Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.33 no.3 Bogotá July/Sept. 2005
Articulo de Investigación
Efectividad de la ketamina para reducir los requerimientos
perioperatorios de opioides: Un ensayo clínico doble ciego,
controlado con placebo1
Luis Enrique Chaparro1, Nelson Darío Giraldo2, Luis Felipe Pabón2,Saida Irlena Agudelo3, Juan Manuel Castillo2, Iván Darío Gómez2
1 Médico Anestesiólogo Sub-especialista en Dolor y Cuidado Paliativo. Profesor Auxiliar de Anestesiología y Medicina del Dolor de la Universidad de Antioquia.
2 Médico Residente de Anestesiología Universidad de Antioquia.
3 Enfermera Jefe. Coordinadora de Cirugía, IPS Universitario.
RESUMEN
Objetivo:
La tolerancia aguda a opioides ha sido reportada con técnicas anestésicas basadas en Remifentanil. Nosotros evaluamos el efecto de la ketamina en el requerimiento de opioides perioperatorios, en pacientes programadas para mamoplastia de aumento, bajo anestesia general sevoflurane/Remifentanil.Métodos: Previa aprobación por Comité de Ética Institucional, se incluyó una muestra de 106 mujeres que fueron llevadas a mamoplastia de aumento, desde abril a diciembre de 2004, en una institución de atención ambulatoria. Las pacientes fueron aleatorizadas en forma ciega a recibir placebo (Grupo RP) o ketamina, 0.5 mg/kg en bolo (preoperatorio) más infusión intraoperatoria a 0.2 mg/kg/hora (Grupo RK). Se evaluó el consumo de Remifentanil intraoperatorio y de Meperidina postoperatoria, el nivel de dolor (escala visual análoga, EVA) y la incidencia de efectos adversos, cada 15 minutos hasta la salida de recuperación.
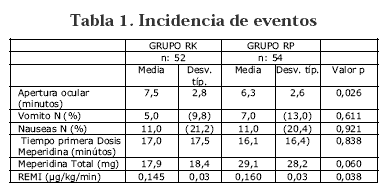
Resultados: El consumo intraoperatorio acumulado de Remifentanil fue menor en el grupo Ketamina/Remifentanil, que en el grupo de Remifentanil/salino (0.14 vs 0.16 ug/kg/min, p=0.038). El consumo de Meperidina postoperatorio fue también menor (17.9 vs 29.1 mg), con una disminución promedio de 38% pero sin alcanzar significancia estadística (p=0.06). El nivel de dolor postoperatorio, fue más bajo en este mismo grupo (2.8 vs 3.9, p=0.03). No hubo significativa estadística en la frecuencia de presentación de efectos adversos. Sin embargo, el tiempo de apertura ocular fue más rápida en el grupo Remifentanil/Salino (7.5 vs 6.3 min, p=0.026).
Conclusiones: Adicionar ketamina a esquemas basados en remifentanil, ayuda a disminuir los requerimientos del mismo, así como los de Meperidina en el postoperatorio con poca relevancia clínica, ya que no hubo diferencia en la frecuencia de presentación de efectos adversos.
Palabras Clave (Fuente, DeCS, BIREME):Analgésicos opioides/Efectos adversos, Hiperalgesia/Prevención & Control, Cetamina/Administración & Dosificación, Dolor Postoperatorio/Prevención & Control, Receptores N-Metil D Aspartato/Antagonistas & Inhibidores.
SUMMARY
Aim of Investigation: Acute opioid tolerance have been reported with remifentanil-based anesthesia techniques. We evaluate the perioperative effect of a racemic ketamine bolus and infusion in perioperative opioid requirements for patients undergoing augmentation mammaplasty with remifentanil/sevorane anesthesia technique.
Methods: After institutional Ethical Committee approval and informed consent, a total of 106 women undergoing augmentation mammaplasty under general anesthesia from April until December 2004, at an ambulatory surgery unit were studied. Patients were randomized in a double blind fashion to receive placebo (Group RP) or ketamine preoperative bolus of 0.5 mg/kg followed by an infusion of 0.20 mg/kg/h (Group RK) plus remifentanil during surgery. Remifentanil (intraoperative) and Meperidine (postoperative) consumption, pain scores (visual analogue scale, VAS), and adverse effects were recorded every 15 min until discharge of surgery.
Results: Cumulative intraoperative consumption of Remifentanil was lower in the ketamine/Remifentanil group (0.14 vs 0.16 ug/kg/min, p=0.038). Cumulative Meperidine consumption was lower too (17.9 vs 29.1 mg) but did not reached statistical significant difference (p=0.06). Pain scores after surgery were significantly lower in the same group (2.8 vs 3.9, p=0.03) but only 15 min after surgery. No significant differences were found in adverse effects. Open eyes was earlier in Remifentanil/Saline group (7.5 vs 6.3 min, p=0.026).
Conclusions: To add racemic ketamine helps to decrease intraoperative and postoperative opioid consumption but didn't reached clinical important differences in patients undergoing augmentation mammaplasty. The same occurred with pain scores.
Keywords (Source, MeSH, NLM): Analgesics, Opioid/adverse effects, Hyperalgesia/chemically induced, Ketamine/administration & dosage
Pain, Postoperative/drug therapy*, Receptors, N-Methyl-D-Aspartate/antagonists & inhibitors
INTRODUCCIÓN
La anestesia basada en analgesia está asociada a una alta incidencia de dolor postoperatorio severo1. El remifentanil, se supone, incrementa el reporte de dolor, de acuerdo a estudios previos1-4. Algunos de estos estudios sugirieron como relación de causalidad, la tolerancia aguda y la hiperalgesia1,2; Como consecuencia de este fenómeno, se ha encontrado clínicamente un mayor consumo de morfina en el postoperatorio inmediato1,5. Estudios, tanto en animales como en humanos, sugieren un papel muy importante de los receptores N-metil-D-Aspartato (NMDA) en este fenómeno, que incluso puede presentarse con el uso de otros opioides como morfina, alfentanil y fentanil6-8. Estímulos dolorosos severos activan los receptores NMDA y producen hiperexcitabilidad de las neuronas del asta dorsal, induciendo sensibilización central, fenómeno de «wind up» y memoria del dolor. También ha sido reportado cómo la activación de los receptores µ de los opioides, llevan a un incremento sostenido de la efectividad sináptica del glutamato, a nivel de los receptores NMDA9,10.
La ketamina -un antagonista de los receptores NMDA- se ha propuesto como modalidad terapéutica, para prevenir la aparición de tales fenómenos como la hiperalgesia y disminuir los requerimientos de analgésicos en el postoperatorio11-13. Esto ha sido ampliamente estudiado en modelos experimentales, con resultados positivos 11,14,15. Contrario a esto, los ensayos clínicos16,17 y las revisiones sistemáticas en humanos, han arrojado resultados no concluyentes18,19.
Nosotros desarrollamos un ensayo clínico aleatorizado, controlado con placebo y doble ciego con el objetivo de demostrar el impacto en el consumo perioperatorio de opioides, mediante la adición de ketamina en bolo preoperatoria más infusión intraoperatoria.
MATERIALES Y MÉTODOS
Previa aprobación por el Comité de Ética de la Institución Universitaria de Atención Ambulatoria y el Comité de Educación de la Sección de Anestesia de la Universidad, se recolectaron pacientes programados para mamoplastia de aumento ASA I, las cuales fueron identificadas en la consulta preanestésica, momento en el cual se explicó el objetivo del estudio y las pacientes firmaron el consentimiento, para el procedimiento anestésico y para participar en la investigación. El día de la cirugía fueron instruidas sobre el manejo de la escala visual análoga (EVA) y de la escala verbal categórica (EVC). Se incluyeron las pacientes que consultaron entre abril y diciembre de 2004.
Aquellas Pacientes con antecedente de enfermedad psiquiátrica, uso crónico de AINES, analgésicos opioides y/o anticonvulsivantes, consumidores de sustancias psicoactivas, y pacientes con incapacidad para comprender el uso de la escala visual análoga, fueron excluídas.
Las pacientes se llevaron a cirugía bajo anestesia general, premedicadas con valdecoxib 40mg. vía oral la noche anterior y 40mg. vía oral, 2 horas antes de la cirugía. Las pacientes fueron monitorizadas con cardiovisoscopio, oximetría de pulso, capnografía, presión arterial no invasiva y analizador de gases.
La aleatorización se realizó en bloques de 4, mediante el lanzamiento de moneda, quedando asignados a recibir la solución 1 ó 2.Se lanzaba la moneda en un primer momento, si caía por la cara se usaba solución 1 y si caía sello, se asignaba solución 2. En un segundo lanzamiento del grupo de 4, se repetia el mismo procedimiento; si en este lanzamiento coincidía nuevamente lo mismo que en el primero, se destinaban las dos siguientes pacientes para recibir la solución no escogida por la moneda. Cada solución tenia 2 cc de solución salina o 2 cc, correspondientes a 100 mg de ketamina, definido por una enfermera profesional entrenada para tal labor, quien tenia orden de mantener discreción hasta después de obtenerse el análisis estadístico final, con lo cual se pudo mantener ciego al paciente, al evaluador y al epidemiólogo. El lanzamiento de la moneda era realizado por una tercera persona, ajena a tomar decisiones intra y postoperatorias de las pacientes (personal de farmacia que comunicaban el resultado a la enfermera profesional para que procediera a la inyección de la solución escogida por la moneda).
La inducción anestésica se estandarizó para ambos grupos, así: Midazolam 0.03 mg/kg de I.V, lidocaína 1.5 mg/kg I.V, propofol 1.5 mg/kg I.V, remifentanil bolo 1 mg/kg I.V. El uso de relajante muscular y el dispositivo para abordar la vía aérea se dejó a decisión del anestesiólogo tratante. Controlada la vía aérea y 5 minutos previos a la inducción, se procedió a aplicar al grupo Remifentanil/Placebo (RP) 0.5 c.c. de solución salina más 1 c.c. de solución salina al remifentanil (2 mg de remifentanil en 250 c.c. de solución salina). El grupo de Remifentanil/Ketamina (RK) recibió 25 mg de Ketamina, más 50 mg adicionados al remifentanil.
El anestesiólogo encargado del caso no era informado del contenido de las soluciones y las evaluaciones postoperatorias eran realizadas por algún miembro del grupo de investigación, quien desconocía, de igual manera, la solución administrada a los pacientes. Se consideró que esta forma de administración era la más indicada, ya que siempre aseguraba un bolo mínimo de al menos 0.25 mg/Kg de Ketamina, para los pacientes que potencialmente la recibieran y que la combinación realizada con remifentanil también aseguraba relevancia clínica, practicidad y concentraciones plasmáticas óptimas20.
La estabilidad de la mezcla fue confirmada por Carlos Andrés Rodríguez, del Departamento de Farmacología de la Universidad de Antioquia (comunicación personal).
El mantenimiento anestésico fue llevado a cabo con oxígeno/aire, sevofluorano a 0.5 MAC y remifentanil a 0.15 µg/kg/mín. De acuerdo a la variación de los parámetros hemodinámicos, presión arterial en un 20% de la basal y frecuencia cardíaca menor de 45 o mayor a 70 latidos por minuto, se ajustó la infusión de remifentanil en un 20%. Al término de la sutura, se suspendió el halogenado más la infusión de remifentanil. En este momento, se realizó la cuantificación de variables del estudio, por un anestesiólogo ciego al grupo al que las pacientes habían sido asignadas.
Se cuantificaron las siguientes variables: Requerimiento de microgramos/kilo/minuto de remifentanil; tiempo (en minutos) para apertura ocular al comando verbal; tiempo (en minutos) para demandar primera dosis de meperidina, requerimiento total de meperidina postoperatoria, Escala de Ramsay21 a los 15, 30, 45 y 60 minutos; cuantificación de intensidad de dolor con EVA a los 15, 30, 45 y salida de la unidad de cirugía ambulatoria y cuantificación de los efectos secundarios (número de episodios de escalofrío, náuseas y vómito).
Durante la estancia postoperatoria en la unidad de cirugía ambulatoria, el manejo de la analgesia se hizo según el siguiente protocolo: Dosis inicial de meperidina 20 mg I.V., utilizada cuando el paciente manifestó dolor en una escala visual análoga mayor o igual a 4, con evaluación subsiguiente cada 5 minutos y si ésta continuaba siendo mayor de 4 se colocaba una nueva dosis de meperidina de 10 mg I.V., hasta que se lograba un nivel de dolor con EVA menor o igual a 3, en cuyo momento se seguía evaluando cada 15 minutos.
Se hizo evaluación de seguridad del uso de opioide, con cuantificación de náuseas (interrogatorio directo), vómito (evidencia de episodios durante la estadía) y nivel de sedación (escala de Ramsay21).
El cálculo del tamaño de muestra se realizó con el software «tamaño de la muestra» de la Universidad Javeriana22. Se estimó el tamaño de muestra para un Poder del 80%, nivel alfa de 5%, una diferencia esperada de 25% en el consumo de Meperidina con una desviación estándar 16%.
Lo que quiere decir que para la diferencia que queríamos detectar (25%), necesitábamos una muestra por grupo de 44 participantes, lo que implicó incluir, con una inclusión por pérdidas del 20%, 52 pacientes por grupo.
Análisis estadístico
Los grupos se compararon utilizando la prueba U de Mann-Whitney, la prueba exacta de Fisher y la prueba Ji2. Se usó la corrección de Bonferroni para las comparaciones de Escala visual análoga, consumo total de meperidina, escala de sedación RAMSAY a los 15, 30, 45, 60 y 120 minutos, por lo que se emplearon valores de p<0.05 para considerar significancia estadística. Los cálculos se realizaron en el programa estadístico SPSS 12.0.
Resultados
En total se aleatorizaron 106 pacientes sometidas a mamoplastia de aumento, bajo anestesia general, 52 para el grupo RK y 54 para el grupo RP (Figura 1).
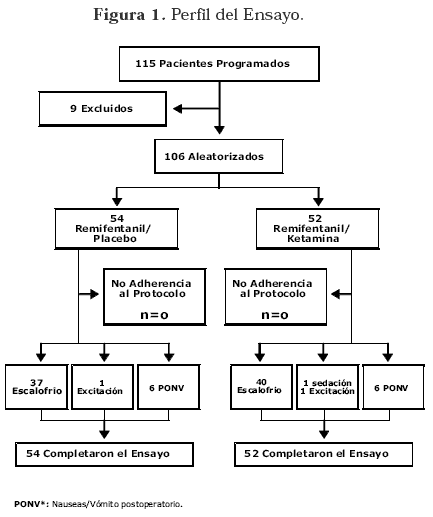
Como era de esperarse el 100% de las participantes fueron mujeres, con una edad media de 30.6 años (desviación estandar 8.0) en el grupo RK y 28.3 años (desviación estandar 7.5) en el grupo RP.
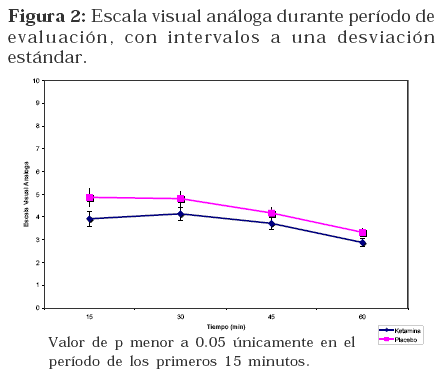
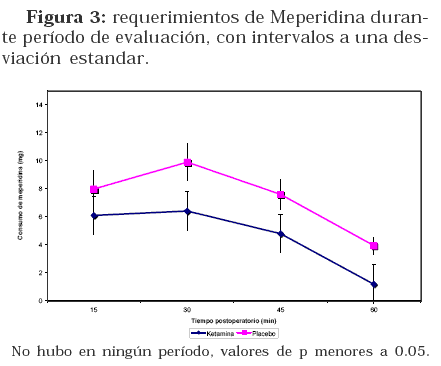
La duración global del procedimiento anestésico fue similar para ambos grupos, siendo 123 minutos para el grupo RK y 134 minutos para el grupo RP. Hubo una diferencia estadísticamente significativa en relación a la apertura ocular, a favor del grupo RP. No se encontraron diferencias significativas en las variables de analgesia y dolor postoperatorio. (Ver Tabla 1) Figura 2 Figura 3.
No se hicieron pruebas estadísticas para demostrar diferencias en sedación, y escalofrío, dados los resultados mostrados en la Figura 1.
DISCUSIÓN
El mecanismo intrínseco responsable de la tolerancia e hiperalgesia inducida por los opioides, es un incremento en la sensibilidad de los receptores NMDA, lo que a nivel molecular se traduce en un flujo de calcio al interior de la célula, llevando a la activación/translocación de la proteína kinasa C (PKC) del citosol a la membrana celular, aumentando la producción intracelular de óxido nítrico y, por lo tanto, a una respuesta disminuida a la estimulación de receptores µ10, 23, 24.
Es reconocido en la literatura el papel preponderante en este fenómeno de los llamados «opioides fuertes y potentes», del remifentanil, alfentanil y sufentanil, pero la verdad desconocemos los mecanismos que generan este hecho, los tiempos mínimos de exposición y la dosis mínima para su desencadenamiento25.
La ketamina podría tener un rol doble en el modelo estudiado: por un lado actuando como «antihiperalgésica», al modular el efecto intracelular de los opioides y por otro, como medicamento con propiedades analgésicas intrínsecas que podrían ajustarse a futuros esquemas de analgesia multimodal26, 27.
Los hallazgos de nuestro trabajo con el uso de la ketamina -en bolo más infusión-, de acuerdo a lo recomendado por la literatura19, nos deja grandes interrogantes acerca de resultados con significancia estadística y su posible relevancia clínica, esta última fundamental para nosotros en términos que el ahorro de consumo de opioide debía verse también reflejado en menos efectos adversos, inducidos por los mismos (náuseas, vómito y sedación)18.
El ahorro de 38% en el consumo de meperidina, de acuerdo a lo expuesto en la tabla 2 desafortunadamente no alcanzó significancia estadística (ni relevancia clínica), principalmente por la gran variabilidad en consumos de meperidina en ambos grupos de estudio, a pesar del manejo estandarizado preoperatorio y postoperatorio. La técnica quirúrgica pudo ser un factor influyente, pero no pudo ser evaluada sistemáticamente.
Hay evidencia, sustentada por múltiples ensayos clínicos controlados16, 17 y meta-análisis18, que la ketamina administrada por vía venosa durante la anestesia general, disminuye la intensidad del dolor en promedio de un punto, lo cual se correlaciona con lo encontrado en nuestro ensayo. Además, disminuye los requerimientos de opioides en un 20% a un 47%18, según el modelo de dolor postquirúrgico investigado, lo cual nos deja satisfechos, ya que nuestros hallazgos están directamente relacionados a lo reportado, incluso muy recientemente18.
Encontrar diferencias estadísticamente, significativas en los consumos de remifentanil, podemos atribuirlo más a un efecto de azar que a un efecto directamente relacionado a la adición de ketamina. Por otra parte, la diferencia si la miramos de forma cuantitativa, no tendría siquiera un impacto económico relevante clínicamente.
El nivel de dolor, según la escala visual análoga, obtuvo una tendencia a favor de usar ketamina, incluso más marcada en la primera evaluación, con tendencia a la homogeneidad en las siguientes valoraciones, que podría relacionarse con un efecto residual postoperatorio de Ketamina.
De acuerdo a reportes previos de significancia clínica en dolor agudo, diferencias como las que pudimos detectar en nuestro trabajo con la escala visual análoga (10 mm), no son relevantes clínicamente28, 29.
CONCLUSIÓN
El uso de ketamina perioperatorio en pacientes sometidas a mamoplastia de aumento, bajo anestesia general basada en remifentanil, tiene un efecto tendiente a disminuir requerimientos de opioides, sin ser clínicamente significativo. Se precisa reproducir este modelo de analgesia, en trabajos donde el dolor postoperatorio esperado sea «homogéneamente» severo y de esa forma alcanzar impacto clínico.
Comentarios
1. Segundo Premio. Concurso Jorge Colmenares. XXVI Congreso Colombiano de Anestesiología, marzo de 2005.
REFERENCIAS BIBLIOGRÁFICAS
1. Guignard B, Bossard AE, Coste C, Sessler DI, Lebrault C, Alfonsi P, Fletcher D, Chauvin M. Acute opioid tolerance: intraoperative remifentanil increases postoperative pain and morphine requirement. Anesthesiology. 2000 Aug;93(2):409-17. [ Links ]
2. Hood DD, Curry R, Eisenach JC. Intravenous remifentanil produces withdrawal hyperalgesia in volunteers with capsaicin-induced hyperalgesia. Anesth Analg. 2003 Sep;97(3):810-5. [ Links ]
3. Koppert W, Angst M, Alsheimer M, Sittl R, Albrecht S, Schuttler J, Schmelz M. Naloxone provokes similar pain facilitation as observed after short-term infusion of remifentanil in humans. Pain. 2003 Nov;106(1-2):91-9. [ Links ]
4. Angst MS, Koppert W, Pahl I, Clark DJ, Schmelz M. Short-term infusion of the mu-opioid agonist remifentanil in humans causes hyperalgesia during withdrawal. Pain. 2003 Nov;106(1-2):49-57. [ Links ]
5. Kochs E, Cote D, Deruyck L, Rauhala V, Puig M, Polati E, Verbist J, Upadhyaya B, Haigh C. Postoperative pain management and recovery after remifentanil-based anaesthesia with isoflurane or propofol for major abdominal surgery. Remifentanil Study Group. Br J Anaesth. 2000 Feb;84(2):169-73. [ Links ]
6. Portenoy RK, Bennett GJ, Katz NP, Payne R, Price DD. Enhancing opioid analgesia with NMDA-receptor antagonists: clarifying the clinical importance. A roundtable discussion. J Pain Symptom Manage. 2000 Jan;19(1 Suppl):S57-64. [ Links ]
7. Price DD, Mayer DJ, Mao J, Caruso FS. NMDA-receptor antagonists and opioid receptor interactions as related to analgesia and tolerance. J Pain Symptom Manage. 2000 Jan;19(1 Suppl):S7-11. [ Links ]
8. Hahnenkamp K, Nollet J, Van Aken HK, Buerkle H, Halene T, Schauerte S, Hahnenkamp A, Hollmann MW, Strumper D, Durieux ME, Hoenemann CW. Remifentanil directly activates human N-methyl-D-aspartate receptors expressed in Xenopus laevis oocytes. Anesthesiology. 2004 Jun;100(6):1531-7. [ Links ]
9. Woolf CJ, Thompson SW. The induction and maintenance of central sensitization is dependent on N-methyl-D-aspartic acid receptor activation; implications for the treatment of post-injury pain hypersensitivity states. Pain. 1991 Mar;44(3):293-9. [ Links ]
10. Mayer DJ, Mao J, Holt J, Price DD. Cellular mechanisms of neuropathic pain, morphine tolerance, and their interactions. Proc Natl Acad Sci U S A. 1999 Jul 6;96(14): 7731-6. [ Links ]
11. Laulin JP, Maurette P, Corcuff JB, Rivat C, Chauvin M, Simonnet G. The role of ketamine in preventing fentanyl-induced hyperalgesia and subsequent acute morphine tolerance. Anesth Analg. 2002 May;94(5):1263-9. [ Links ]
12. Schmid RL, Sandler AN, Katz J. Use and efficacy of low-dose ketamine in the management of acute postoperative pain: a review of current techniques and outcomes. Pain. 1999 Aug;82(2):111-25. [ Links ]
13. Kissin I, Bright CA, Bradley EL Jr. The effect of ketamine on opioid-induced acute tolerance: can it explain reduction of opioid consumption with ketamine-opioid analgesic combinations? Anesth Analg. 2000 Dec;91(6): 1483-8. [ Links ]
14. Celerier E, Rivat C, Jun Y, Laulin JP, Larcher A, Reynier P, Simonnet G. Long-lasting hyperalgesia induced by fentanyl in rats: preventive effect of ketamine. Anesthesiology. 2000 Feb;92(2):465-72. [ Links ]
15. Rivat C, Laulin JP, Corcuff JB, Celerier E, Pain L, Simonnet G. Fentanyl enhancement of carrageenan-induced long-lasting hyperalgesia in rats: prevention by the N-methyl-D-aspartate receptor antagonist ketamine. Anesthesiology. 2002 Feb;96(2):381-91. [ Links ]
16. Chaparro LE, Chavez-vega A, Díaz-cortez JC: Ketamina y analgesia preventiva en artroplastia primaria de cadera. Un estudio aleatorizado doble ciego. Rev. colomb. anestesiol. 2003 31 (2): 85 91. [ Links ]
17. Guillou N, Tanguy M, Seguin P, Branger B, Campion JP, Malledant Y. The effects of small-dose ketamine on morphine consumption in surgical intensive care unit patients after major abdominal surgery. Anesth Analg. 2003 Sep;97(3):843-7. [ Links ]
18. Elia N, Tramer MR. Ketamine and postoperative pain - a quantitative systematic review of randomised trials. Pain. 2005 Jan;113(1-2):61-70. [ Links ]
19. Subramaniam K, Subramaniam B, Steinbrook RA. Ketamine as adjuvant analgesic to opioids: a quantitative and qualitative systematic review. Anesth Analg. 2004 Aug;99(2):482-95. [ Links ]
20. Xie H, Wang X, Liu G, Wang G. Analgesic effects and pharmacokinetics of a low dose of ketamine preoperatively administered epidurally or intravenously. Clin J Pain. 2003 Sep-Oct;19(5):317-22. [ Links ]
21. Ramsay MA, Savege TM, Simpson BR, Goodwin R. Controlled sedation with alphaxalone-alphadolone. Br Med J. 1974 Jun 22;2(920):656-9. [ Links ]
22. Perez A, Rodriguez N, gil JFA, Ramirez GA. Tamaño de la Muestra. Un programa sistematizado para estimar el tamaño de la muestra requerido para diseños de investigación. V 1.1. Registro del Ministerio de Relaciones Exteriores, Dirección Nacional de Derechos de Autor. Libro 13 Tomo 7 Partida 063, Feb 20, 2001. Pontificia Universidad Javeriana. Bogotá, Colombia; 2001. [ Links ]
23. Mao J, Price DD, Mayer DJ. Mechanisms of hyperalgesia and morphine tolerance: a current view of their possible interactions. Pain. 1995 Sep;62(3):259-74. [ Links ]
24. Mayer DJ, Mao J, Price DD. The development of morphine tolerance and dependence is associated with translocation of protein kinase C. Pain. 1995 Jun;61(3): 365-74. [ Links ]
25. Mao J. Opioid-induced abnormal pain sensitivity: implications in clinical opioid therapy. Pain. 2002 Dec;100(3): 213-7. [ Links ]
26. Himmelseher S, Durieux ME. Ketamine for Perioperative Pain Management. Anesthesiology. 2005 Jan;102(1): 211-220. [ Links ]
27. Kohrs R, Durieux ME. Ketamine: teaching an old drug new tricks. Anesth Analg. 1998 Nov;87(5):1186-93. [ Links ]
28. Cepeda MS, Africano JM, Polo R, Alcala R, Carr DB. What decline in pain intensity is meaningful to patients with acute pain? Pain. 2003 Sep;105(1-2):151-7. [ Links ]
29. Farrar JT. What is clinically meaningful: outcome measures in pain clinical trials. Clin J Pain. 2000 Jun;16(2 Suppl):S106-12. [ Links ]
Recibido para publicación: febrero de 2005. Aceptado para publicación: mayo 18 de 2005.













