Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Colombian Journal of Anestesiology
versión impresa ISSN 0120-3347
Rev. colomb. anestesiol. v.35 n.3 Bogotá jul./sep. 2007
Artículo de Revisión
Transfusiones en cirugía cardíaca Parte I
Ximena Palacios Ramos1, Jorge Alberto Castro2, Rafael Meza Jiménez3,Juan Camilo Jaramillo4, Alvaro Quintero Ossa5
1 MD, Residente Anestesiología y Reanimación, Universidad de Antioquia, Medellín. Colombia.
2 MD, Anestesiólogo Cardiovascular, Clínica Cardiovascular Santa María, Medellín. Colombia.
3 MD, Residente Cirugía General, Universidad CES Medellín. Colombia
4 MD, Cirujano Cardiovascular, Clínica Cardiovascular Santa María, Medellín. Colombia.
5 MD, Medico Internista, Clínica Cardiovascular Santa Maria, Medellín, Colombia.
RESUMEN
En este artículo se hace una revisión de los aspectos fisiológicos relacionados con la circulación extracorpórea, de las estrategias de ahorro sanguíneo y de las consecuencias sistémicas de la transfusión de componentes sanguíneos. Y finalmente se trata de identificar las mejores estrategias que conduzcan a una disminución del impacto de la cirugía sobre la coagulación.
Palabras clave: Cirugía cardiaca, sustitutos sanguíneos, circulación extracorpórea
ABSTRACT
This article revises the physiological aspects related to the extracorporeal circulation, the blood savings strategies and the systematical consequences of the transfusion of blood components. Finally, it intends to identify the best strategies which conduct to a decrease on the impact generated by the surgery on blood coagulation.
Key Words: Cardiovascular Surgery, blood substitutes, extracorporeal circulation
INTRODUCCIÓN
La cirugía cardiaca ha evolucionado de manera significativa desde sus comienzos; tal vez en lo único en lo que el progreso ha sido poco, es en encontrar algún mecanismo para realizar la circulación extracorpórea sin que se modifique la cascada de la coagulación.
Esta manipulación de la cascada de la coagulación, asociada al uso de la circulación extracorpórea y a todos los fenómenos implícitos en el contacto de los elementos formes de la sangre con una superficie no endotelizada, produce un desequilibrio entre el sistema anticoagulante y el sistema procoagulante. Dicho desequilibrio se dirigirá hacia la fibrinolísis y la facilitación del sangrado o hacia el fenómeno de coagulación y la aparición de fenómenos trombóticos de diferente magnitud.
Los pacientes sometidos a cirugía cardíaca con circulación extracorpórea, tienen un riesgo asociado de desarrollar sangrado microvascular; dicho sangrado en ocasiones es de tal magnitud que amerita de transfusión sanguínea; si el sangrado es mayor, puede requerir incluso una cirugía de reintervención para explorar el mediastino.
El protocolo de seguimiento en el postoperatorio inmediato es variable, pero el volumen de sangrado no debe exceder los 500cc en 1 hora, 800cc en 2 horas, 900cc en 3 horas, 1.000cc en 4 horas o 1.200cc en 5 horas.
Aproximadamente entre el 5% y el 7% de los pacientes que son sometidos a revascularización coronaria presentan sangrado mayor, definido como más de 2.000ml en las primeras 24 horas1; esto se traduce en un 2% a 6% de reintervenciones, asociado a su vez a un 22% de mortalidad2.
En los Estados Unidos se realizan más de 500.000 cirugías cardíacas al año. Aproximadamente el 20% del total de las transfusiones realizadas en toda USA son efectuadas en esta población1; del total de pacientes operados cerca del 50% son transfundidos3.
FISIOLOGÍA DE LA COAGULACIÓN
La hemostasia adecuada requiere de la interacción de múltiples factores biológicos, que en líneas generales podrían agruparse en cuatro:
- Factores de coagulación. - Función plaquetaria. - Endotelio - Sistema fibrinolítico.
La activación de cualquiera de estos elementos produce reacciones múltiples, las cuales interactúan de tal manera que activan o desactivan de forma controlada la coagulación.
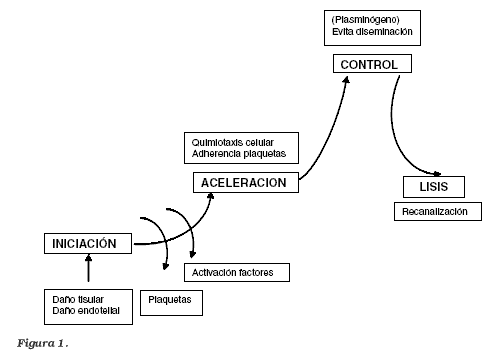
La asociación de lesión/control que produce la activación de la hemostasia, se resume en una secuencia de: Iniciación - Aceleración - Control - Lisis (recanalización). (Figura 1)
Activación por contacto
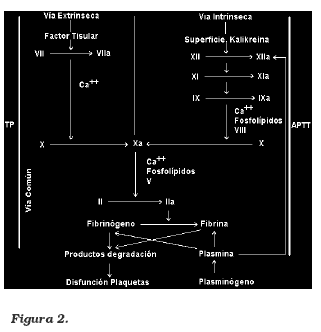
El factor XII, el kinógeno de alto peso molecular (HMWK), prekalikreína (PK), y el factor IX forman el grupo de contacto o superficie.
El factor XII se activa al sufrir un cambio de su configuración en la presencia de una carga eléctrica negativa. Uno de sus posibles mecanismos de activación es la ruptura del endotelio, sin embargo, la activación de las plaquetas también produce la aparición de cargas negativas en la superficie de la membrana, fenómeno que igualmente puede activar el factor XII.
El HMWK se adhiere a otras superficies de activación, a la PK, al factor XI, al endotelio dañado o a las plaquetas activadas. El factor XIIactivado divide el factor XI para formar XIactivado y el PK para formar kalikreina.
Este sistema interactúa con la cascada del complemento y el sistema fibrinolítico. La kalikreína convierte el HMWK en bradikinina la que a su vez activa la cascada del complemento. La kalikreína también puede convertir el plasminógeno en plasmina aunque dicha función es débil y de poca significancia clínica. Inicialmente, el sistema de contacto fue el principal implicado en los trastornos de coagulación asociados a la circulación extracorpórea, esto debido a que el circuito contiene una gran superficie de plástico cargada negativamente. Actualmente se sabe que su papel no es tan importante4.
Sistema intrínseco
La activación intrínseca forma factor XIactivado, producido por la activación del sistema de contacto y la subsecuente producción de trombina. El XIa divide al factor IX para formar el factor IXa, para lo que requiere la presencia de calcio. El factor XIa activa el factor X también con la ayuda de calcio, de un fosfolípido de superficie y un cofactor de glicoproteína, el factor VIIIa. El fosfolípido y el cofactor de glicoproteína están en la superficie de la plaqueta5.
Sistema extrínseco
La activación del factor X se puede producir independientemente del factor XII debido a sustancias extrínsecas a la vasculatura. El factor tisular es altamente regulado por las células endoteliales.
La isquemia, la reperfusión, la sepsis y las citokinas, hacen que la célula endotelial produzca factor tisular por segundo mensajero. Se dice que la gran mayoría de las anormalidades secundarias a la cirugía cardíaca, se deben a la activación del factor tisular más que a la activación de los factores de contacto.
La tromboplastina (factor tisular) dentro de la vasculatura actúa como un cofactor para la iniciación de la activación del factor X por el factor VII.
El factor VII y el X se activan mutuamente con la ayuda del fosfolípido plaquetario y el calcio, produciendo factor Xa. (El factor VIIa también activa el factor IX) uniendo las vías extrínseca e intrínseca 5.
Vía común
Usando fosfolípidos de membrana (fosfotidilserina) como sitio catalítico, el calcio como ligando y el factor Va como cofactor; el factor Xa divide la protrombina (II) y la convierte en trombina (IIa).
La combinación del factor Xa, Va y Ca ++ es llamado el complejo protrombinasa.
La trombina cambia la estructura del fibrinógeno y forma el monómero soluble de fibrina y fragmentos de polipéptidos fibrinopéptido A y B. Los monómeros de fibrina se asocian y forman una matriz soluble de fibrina.
El factor XIII activado por la trombina establece enlace entre los monómeros de fibrina y forma el coágulo insoluble. (Figura 2).
En resumen, la cirugía cardíaca en sí misma produce profundos cambios en la hemostasia que se pueden resumir en los siguientes puntos:
1. Cambios asociados al volumen circulante: el circuito de circulación extracorpórea requiere de un volumen de primado generalmente de cristaloides; este volumen produce sobre la coagulación un estado de dilución, y además altera los volúmenes de distribución.
2. Las características del circuito de circulación extracorpórea difieren de manera importante de las del endotelio vascular, produciendo una gran superficie de contacto de activación para el sistema de coagulación, en cualquiera de sus componentes, especialmente el componente celular (plaquetas).
3. La cirugía cardiaca cambia de manera importante la función endotelial, primero por el traufactor XI para formar XIactivado y el PK para formar kalikreina.
4. La cirugía cardiaca se asocia al uso de aspiración en el campo quirúrgico; el uso del aspirador produce lesión sobre los elementos formes (glóbulos rojos, plaquetas). En ocasiones se asocia al uso del “salvador” de células que puede producir la misma clase de injuria.
5. En la cirugía cardíaca generalmente quedan grandes áreas de superficie de sutura en donde se pueden producir sangrados.
6. El uso de drogas anticoagulantes (heparina) y su efecto residual.
7. La hipotermia, altera el sistema de coagulación.
8. Alteración de la función plaquetaria cuantitativa y cualitativamente (adherencia).
9. Aumento de la actividad fibrinolítica.
MORBILIDAD ASOCIADA A TRANSFUSIÓN
Los derivados sanguíneos son usados, ya sea para prevenir un potencial efecto adverso que afecte el pronóstico o para tratar una situación específica.
Los productos usados se pueden dividir en:
Células Rojas: (Glóbulos rojos empacados, sangre total), usados para mejorar la capacidad transportadora de oxígeno.
Factores de coagulación: Plaquetas, plasma fresco congelado, crioprecipitado.
Transmisión de patógenos
En las décadas de los ochenta y de los noventa, el gran riesgo de la transfusión sanguínea era la transmisión de virus; en esta área se han hecho grandes avances en los bancos de sangre. El virus del VIH y de la hepatitis C prácticamente han sido excluidos gracias a una mejor selección de donantes y a una mejor sensibilidad de las pruebas de laboratorio para detectar dichas patologías.
Recientemente la atención ha sido dirigida a la detección del virus del Oeste del Nilo y a una forma variada de la enfermedad de Creutzfeldt Jacob o enfermedad de las vacas locas, enfermedad diagnosticada debido a transfusión en 2004. El citomegalovirus está presente en aproximadamente el 50% de las unidades transfundidas y el virus de Epstein-Barr en el 34%3. El virus transmitido por transfusión (VTT) el cual está relacionada con el síndrome respiratorio agudo (SARS), está presente en el 52% de las unidades transfundidas6.
Aún hoy alrededor del mundo los riesgos más grandes asociados a transfusión son la transmisión de la malaria y el VIH.
Inflamación
En las unidades de glóbulos rojos almacenadas se han activado células inflamatorias y mediadores humorales. Estos mediadores humorales de inflamación activan el complemento C3a y C5a, aumentan los niveles de citokinas como el factor de necrosis tumoral-∞ (TNF-∞) y de algunas interleukinas (IL-6, IL-9). Los niveles de bradikinina también están aumentados, lo cual podría explicar la hipotensión asociada a transfusión en algunos casos. Todo este incremento en la actividad inflamatoria ha sido encontrado en mayor magnitud cuando se administran plaquetas6.
Inmunomodulación
El principal mecanismo de este fenómeno es la presencia de linfocitos T del donante; están vivos y son trasplantados a la médula ósea del receptor. Estos linfocitos T, al menos por un tiempo, deprimen la capacidad del receptor de responder con la cadena inflamatoria a la infección7.
Estudios aleatorizados de sangre autológa vs. alógenica demostraron que el riesgo de infección podría aumentar entre 1.3 a 3.5 veces respectivamente.
En algunos trabajos como el de Banbury y cols. que incluyó 15.592 procedimientos cardiovasculares, se observó que el número de unidades transfundidas es un factor de riesgo para infección postoperatoria y mayor estancia en UCI8.
Capacidad transportadora de oxígeno
Los glóbulos rojos son transfundidos para incrementar la capacidad transportadora de oxígeno. Hasta el momento la literatura médica es pobre para demostrar la veracidad de dicha información, especialmente en le paciente quirúrgico agudo.
Los glóbulos rojos en el proceso de almacenamiento sufren cambios. El pH es tornado ácido por el citrato usado para quelar el calcio y el magnesio. A los 28 días de almacenamiento el pH es 6.8. Las células rojas dejan salir potasio y hacia el día 28 los niveles de este pueden alcanzar 78 mEq/l. El 30% de las células pueden haber muerto y las que sobreviven lo hacen por glicólisis anaeróbica; esto aumenta los niveles de lactato (30 mg/dl).
La capacidad de la hemoglobina de ligar al oxígeno y de liberarse de él, depende de los niveles intracelulares del 2-3 difosfoglicerato (2-3 DPG). Elnivel del 2-3 DPG disminuye dramáticamente en los primeros días de almacenaje y para el día 28 prácticamente no existe; la ausencia del 2-3 DPG hace que la hemoglobina no libere el oxígeno y que su afinidad por éste se desvíe a la izquierda9.
La hemodilución altera la entrega de oxígeno. En la medida en que la hemodilución se incrementa, el gasto cardíaco aumenta, en respuesta a una disminución en la resistencia vascular periférica. El aumento del gasto cardíaco compensa la disminución en la capacidad transportadora de oxígeno cuyo efecto máximo se alcanza con una hemoglobina de 10gr/dl.
A un hematocrito de 12% tanto los animales como los humanos pasan de metabolismo aeróbico a metabolismo anaeróbico. Transfusiones en pacientes con Hb por debajo de 5gr/dl han sido asociadas a mayor mortalidad en pacientes testigos de Jehová9.
La normalización de la célula transfundida puede tomar de 5 a 24 horas.
PRONÓSTICO Y TRANSFUSIÓN
Hasta el momento lo que se ha logrado demostrar en la literatura es que los pacientes que reciben transfusiones tienen más efectos adversos asociados a una respuesta inflamatoria del tipo de la falla multisistémica, que los no transfundidos.
Número de unidades transfundidas de glóbulos rojos
Leal-Noval y colaboradores10, tomaron 738 pacientes y los clasificaron como aquéllos con infección severa postoperatoria y los que no la tuvieron; se consideraron infecciones severas la neumonía, la mediastinitis, y la sepsis de origen no conocido. 75 pacientes (9.4%), tuvieron infección severa postoperatoria.
Las variables asociadas a infección severa fueron: reintubación, dehiscencia esternal, ventilación mecánica mayor de 48 horas, reintervención, disfunción neurológica, transfusión de más de 4 unidades de glóbulos rojos y la hipotensión sistémica.
En los pacientes transfundidos hubo una mayor mortalidad y mayor tiempo de estancia en la unidad de cuidados intensivos.
Los autores concluyeron que la administración de hemoderivados principalmente de glóbulos rojos, está asociada de una manera dependiente de la dosis con el desarrollo de infecciones severas principalmente la neumonía nosocomial.
Lesión pulmonar asociada a transfusión
Reportada en 1950, es una de las cuatro complicaciones más frecuentes asociadas con la transfusión.
Se caracteriza por un inicio agudo de hipoxemia a pesar de aumentar los niveles de presión positiva al final de la espiración (PEEP) llegando a una saturación de oxígeno < 90%, infiltrados pulmonares en la radiografía de tórax sin evidencia clínica de sobrecarga de líquidos o una presión de cuña pulmonar (PCWP) ≤ 18 mm Hg.
Existen múltiples causas para la generación de lesión pulmonar como la aspiración, la neumonía, las inhalaciones tóxicas, la contusión pulmonar, el ahogamiento, la sepsis, el choque, el trauma, la transfusión masiva, la pancreatitis, la circulación extracorpórea y la sobredosis de psicoactivos.
Para el diagnóstico de lesión pulmonar asociada a transfusión no deben existir otras causas para la aparición del síndrome de injuria pulmonar, y los signos y síntomas se deben presentar dentro de las seis horas de haber hecho la transfusión11.
Esta lesión ha sido asociado a la transfusión de componentes sanguíneos que contengan plasma. Se ha estimado su incidencia así:
1: 5.000 componentes sanguíneos
1: 2.000 componentes que contengan plasma
1: 7.900 plasma fresco congelado
1: 432 plaquetas
La FDA afirma que la lesión pulmonar asociada a transfusión es la principal causa de muerte por transfusión.
Existen dos teorías para su desarrollo10:
- Reacción mediada por anticuerpos, siguiendo a la transfusión de anticuerpos antigranulocíticos en pacientes que tienen leucocitos que expresan este antígeno conocido.
Mediado por una interacción entre mediadores biológicamente activos y el pulmón.
Popovsky y Haley12 en una serie de casos, identificaron anticuerpos en antígenos de leucocitos humanos en 28% y anticuerpos en granulocitos en el 41% de las muestras.
En TRALI es algo más frecuente en receptores de sangre donada por mujeres multíparas.
De todo lo anterior se puede concluir que el TRALI depende de dos factores:
- La condición clínica del paciente (factores predisponentes).
- La transfusión
La leucorreducción no ha disminuido la incidencia TRALI, a mayor tiempo de almacenaje mayor incidencia de neumonía, falla multisistémica y mortalidad.
La mayoría de los pacientes se recuperan en 48 a 96 horas, pero la hipoxemia y la evidencia radiológica pueden persistir por siete días en el 20%; el 70% de los pacientes requieren ventilación mecánica, la mortalidad está entre el 5% y el 10%.
La única estrategia preventiva es evitar las transfusiones13.
MORTALIDAD Y TRANSFUSIÓN
Engoren y cols14 en un estudio realizado en el 2002 en 2000 pacientes de revascularización coronaria analizaron la mortalidad a corto y a largo plazo (60 meses) en pacientes que recibieron transfusión y aquéllos que no la recibieron. Los pacientes que recibieron transfusión tuvieron aproximadamente el doble de mortalidad a los 60 meses.
Existen estudios en los que se ha evaluado la relación entre el hematocrito y el pronóstico, observándose que los bajos hematocritos fueron asociados a mejor pronóstico y menor mortalidad15.
Sehgal y cols16. encontraron que la mortalidad no incrementaba mientras que los niveles de hematocrito en circulación extracorpórea no estaban por debajo del 20%.
Hebert y cols17 han encontrado en sus estudios que en pacientes críticamente enfermos no cardíacos, la transfusión sanguínea se asocia a una mayor incidencia de falla multisistémica e infección.
DeFoe18 en su artículo publicado en Annals Thoracic Surgery en el 2001 afirma que los pacientes transfundidos tienen un peor pronóstico.
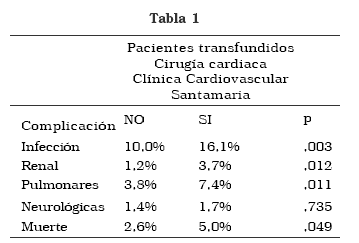
Según los reportes de transfusión en pacientes llevados a cirugía cardiaca en la Clínica Cardiovascular Santa María de Medellín, Colombia entre los años 2001 a 2006 , existe una tendencia a presentar mayor riesgo de morbimortalidad en los pacientes que reciben transfusiones sanguíneas en el intra o en el post operatorio. (Tabla 1).
Nota: La II parte de este trabajo de revisión se publicará en la revista número 4, noviembre de 2007-enero de 2008.













