Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.35 no.4 Bogotá Oct./Dec. 2007
ARTÍCULO DE REVISIÓN
Prevención de la náusea y el vómito postoperatorios*
David A. Rincón1; J. Francisco Valero2.
1. MD Estudiante de postgrado. Email: darinconv@unal.edu.co
2. MD Profesor asociado. Unidad de Anestesiología y Reanimación, Departamento de Cirugía, Facultad de Medicina, Universidad Nacional de Colombia.
RESUMEN
La náusea y el vómito postoperatorio (NVPO) es una complicación frecuente en cirugía. Es un factor que impide la salida temprana en pacientes de cirugía ambulatoria y es una causa de readmisiones inesperadas. Además, existen altos niveles de incomodidad y de insatisfacción asociados con la NVPO. En pacientes de alto riesgo la incidencia de NVPO está entre 70% y 80%. La evidencia sugiere que la profilaxis sistemática para NVPO no es costo-efectiva. Aunque se pretende que en pacientes de alto riesgo se debe hacer profilaxis farmacológica y terapia de rescate en los episodios de NVPO, el abordaje óptimo de tratamiento no es claro para la mayoría de los anestesiólogos. El objetivo de este manuscrito es revisar la prevención farmacológica de la náusea y el vomito postoperatorios.
Palabras clave: Anestesia, prevención, náusea y vómito, incidencia, factores del paciente, factores quirúrgicos.
ABSTRACT
Postoperative nausea and vomiting (PONV) is a common complication of surgery. It is a limiting factor in the early discharge of ambulatory surgery and is cause of unanticipated hospital admission. Equally important are the high levels of patient discomfort and dissatisfaction associated with PONV. Among high-risk patients, the incidence of PONV can be as frequent as 70% to 80%. Evidence suggests that systematic PONV prophylaxis is not cost-effective. Although some advocate prophylactic antiemetic therapy for high-risk patients and rescue antiemetic treatment for episodes of PONV, the optimal approach to management remains unclear to many anaesthesiologists. The objective of this review was to assess the prevention of postoperative nausea and vomiting by drugs.
Keywords: Anaesthesia, prevention, vomiting and nausea, incidence, patient factors, surgical factors.
INTRODUCCIÓN
La náusea y el vómito postoperatorio (NVPO) es una complicación de mucho interés para los anestesiólogos 1. Se estima que entre el 25% y el 30% de los pacientes presentan NVPO, y que alrededor del 0,2% no obtienen mejoría clínica a pesar del uso adecuado de las intervenciones disponibles para la prevención y el tratamiento2. En grupos de pacientes de alto riesgo la incidencia de NVPO puede alcanzar el 70%. Esta complicación anestésica es una causa importante de tránsito lento por la unidad de cuidados post-anestésicos (UCPA) y de disminución en la satisfacción de los pacientes. Esto se presenta a pesar de la introducción de nuevas técnicas quirúrgicas y anestésicas menos inductoras de emesis1. Pero la NVPO no solo genera incomodidad en los pacientes, sino que también induce algunas complicaciones más graves al incrementar la tensión de las suturas, aumentando el sangrado postoperatorio y la dehiscencia del sitio quirúrgico, además eleva el riesgo de aspiración pulmonar, deshidratación y desequilibrios hídricos y electrolíticos2.
FISIOPATOLOGÍA DE LA NÁUSEA Y EL VÓMITO
La coordinación de todo el proceso se realiza en el centro del vómito, ubicado en la formación reticular lateral de la medula oblonga. Este centro está estrechamente relacionado con el núcleo del tracto solitario y el área postrema. Dentro de esta última se encuentra la zona de quimiorreceptores gatillo (ZQG). Estímulos centrales y periféricos pueden afectar directamente al centro del vómito o indirectamente a través de la ZQG. Hay estímulos periféricos provenientes de la faringe, tracto gastrointestinal, mediastino, pelvis renal, peritoneo y genitales, y estímulos centrales desde la corteza cerebral, ZQG, núcleos del tallo cerebral, aparato vestibular del oído interno y del centro visual. La ZQG recibe estímulos químicos a través del flujo sanguíneo del área postrema. El área postrema pertenece al grupo de los órganos circunventriculares y se caracteriza por tener una barrera hematoencefálica incompetente1.
Una gran variedad de receptores para el vómito se encuentran en la ZQG y en el núcleo del trato solitario. La ZQG es rica en receptores de Dopamina tipo 2 (D2), receptores opioides y receptores 5- hidroxitriptamina tipo 3 (5-HT3). El núcleo del tracto solitario tiene una gran cantidad de receptores para encefalina, histaminérgicos y colinérgicos muscarínicos. Estos receptores cuando son estimulados re-envían la señal al centro del vómito, donde se genera el estimulo eferente que es conducido a través de los nervios frénico, vago, y espinales de la musculatura abdominal, para finalmente producir el reflejo del vómito. Esta naturaleza multifactorial del vómito hace necesario un abordaje combinado para la prevención y el tratamiento.
FACTORES DE RIESGO
La etiología de la NVPO es multifactorial, e involucra factores relacionados con el paciente, con la cirugía y con la anestesia3. Los factores relacionados con el paciente están fuera del control del anestesiólogo, pero se deben identificar y evaluar durante la valoración preanestésica. Estos incluyen edad, sexo, historia de vértigo, NVPO e historia de tabaquismo. La obesidad no se considera un factor de riesgo para NVPO. Algunos pacientes tienen condiciones medicas co-existentes como patologías gastrointestinales (hernia hiatal, reflujo gastroesofágico), o metabólicas (diabetes mellitus, uremia, desequilibrios electrolíticos), que los pueden predisponer para presentar NVPO. La gestación y la ansiedad preoperatoria también predisponen a la NVPO. Pacientes con aumento de la presión intracraneana como en el caso de tumores cerebrales, o con sobre-estimulación intestinal como en el abdomen agudo o en la obstrucción intestinal, también tienen mayor riesgo de NVPO. De la misma manera los pacientes sometidos a quimioterapia y/o radioterapia también son más susceptibles para presentar NVPO.
Los factores relacionados con la cirugía tampoco son modificables pero se deben tener en cuenta para el plan de prevención y tratamiento, ya que ciertos tipos de cirugía se relacionan con altas incidencias de NVPO. La cirugía otorrinolaringológica, cirugía dental, mamoplastia de aumento, cirugía de hombro, cirugía laparoscópica, cirugía para el estrabismo y la varicosafenectomía se han asociado a incidencia más alta de NVPO que otros procedimientos 4. Otro factor relacionado con la incidencia de NVPO y el tipo de cirugía es la duración del procedimiento ya que esto aumenta la exposición a fármacos anestésicos potencialmente inductores de emesis.
Los factores relacionados con la anestesia sí se pueden controlar. Dentro de estos factores se cuentan: premedicación, técnica anestésica, fármacos anestésicos, hidratación y manejo del dolor postoperatorio. Una reducción mayor del 35% de la presión arterial sistólica durante la anestesia, y especialmente durante la inducción se ha asociado con un incremento en la incidencia de NVPO5.
PREMEDICACIÓN
El Midazolam se usa frecuentemente como premedicación por su efecto ansiolítico. Pero además de este efecto, el Midazolam probablemente aumenta el efecto inhibitorio del acido gamaamino-butírico (GABA) y disminuye la actividad neuronal dopaminérgica y la liberación de 5- hidroxitriptamina (5-HT)6. El Midazolam también puede disminuir la recaptación de adenosina, disminuyendo la síntesis, liberación y acción postsináptica de la dopamina en la ZQG. El uso de midazolam como premedicación ha mostrado disminuir la incidencia de NVPO7. Igualmente la disminución de los niveles de catecolaminas puede contribuir a la acción antiemética del Midazolam.
TÉCNICA ANESTÉSICA
El uso de anestésicos inhalados es un gran factor de riesgo para el desarrollo de NVPO. Pero este efecto parece estar limitado a las dos primeras horas postoperatorias, y depende de la duración de la exposición8. Al parecer no hay diferencias significativas entre los diferentes anestésicos (enflurano, isoflurano, sevoflurano). El Oxido Nitroso (N2O) estimula directamente el centro del vómito e interactúa con los receptores opioides y con el sistema nervioso simpático. Este causa distensión de los espacios aéreos en el oído medio, estómago e intestinos. Muchos experimentos clínicos han mostrado que el uso de (N2O) aumenta significativamente la incidencia de NVPO en muchos escenarios quirúrgicos. El uso de propofol o la omisión de N2O son intervenciones menos efectivas que el uso de ondansetrón, dexametasona o droperidol, pero su combinación puede reducir significativamente la incidencia de NVPO9. El uso de anestesia regional tiene ventajas sobre la anestesia general, ya que la omisión del uso de anestésicos inhalados, opioides intravenosos y Neostigmina disminuye la incidencia de NVPO. Esto es cierto a pesar del uso de opioides intratecales, e incluso en la población obstétrica el uso de Fentanilo subaracnoideo ha mostrado disminuir la incidencia de vómito intraoperatorio. Pero la hipotensión secundaria al bloqueo simpático de la anestesia neuraxial puede contribuir a la NVPO.
ELECCIÓN DEL FÁRMACO ANESTÉSICO
Existe una fuerte evidencia que sugiere que el uso de anestesia intravenosa total (TIVA) con propofol reduce la incidencia de NVPO cuando se compara con la anestesia inhalatoria10. El propofol puede actuar reduciendo los niveles de 5-HT en el área postrema. El uso de propofol exclusivamente durante la inducción también ha mostrado tener efecto sobre la disminución de NVPO11. Esto desmiente la noción de que la diferencia observada se debe al efecto emetogénico de los anestésicos inhalados y no a efecto antiemético del propofol. El uso de antieméticos controlado por el paciente de protocolos con propofol ha mostrado ser efectiva y además aumenta la satisfacción de los pacientes12.
El uso de neostigmina se ha implicado como un factor de riesgo para NVPO por su acción muscarínica en el tracto gastrointestinal. Sin embargo, análisis recientes han mostrado que las dosis usadas habitualmente no aumentan significativamente la NVPO13. Pero es indudable la gran variabilidad entre los resultados de diferentes estudios. Los hallazgos contradictorios se han relacionado a las diferencias en las edades, tipos de cirugía, uso de diferentes fármacos durante la inducción, diferentes dosis de neostigmina y diferentes agentes anticolinérgicos usados simultáneamente. Además, la atropina a diferencia del glucopirrolato posee propiedades antieméticas ya que puede cruzar la barrera hematoencefálica14. El uso de bloqueadores neuromusculares de duración corta hace menos probable el uso de neostigmina.
MEDICAMENTOS ANTIEMÉTICOS
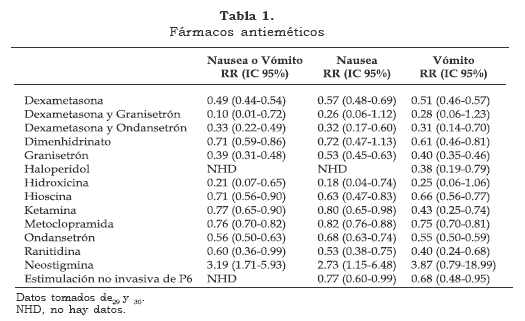
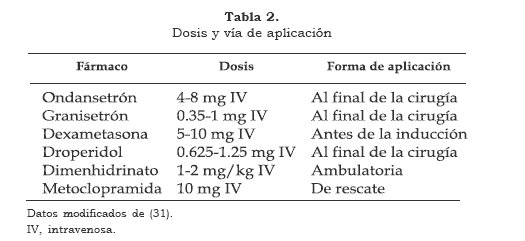
Muchos medicamentos se han usado para la prevención y el tratamiento de la NVPO: anticolinérgicos (atropina), fenotiazinas (prometazina), antihistamínicos (hidroxicina, difenhidramina), butirofenonas (droperidol, haloperidol), benzamidas (metoclopramida) y esteroides (dexametasona) (tablas 1 y 2).
Antagonistas 5ht
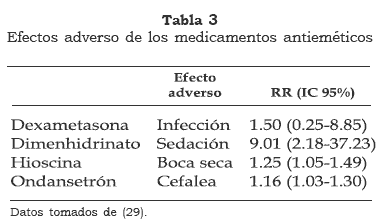
Algunos de esto fármacos se han asociado con efectos adversos como inquietud, boca seca, sedación, hipotensión, extrapiramidalismo y efectos distónicos (tabla 3).
Sin embargo tres grupos farmacológicos siguen siendo útiles para la prevención y el tratamiento de la NVPO: benzamidas, butirofenonas y esteroides.
METOCLOPRAMIDA: Es una benzamida antagonista 5ht, que ha sido usada ampliamente desde hace décadas. Bloquea los receptores D2 centrales (centro del vómito, ZQG) y periféricos (tracto gastrointestinal). Sin embargo ha caído en desuso por su débil efecto antiemético a las dosis que se usan habitualmente. Una revisión sistemática de 66 estudios mostró que la metoclopramida profiláctica no previene la NVPO en las dosis usadas habitualmente en niños (0.25 mg/kg) ni en adultos (10 a 20 mg)15. Sin embargo su eficacia antiemética es indudable, lo que la hace muy útil cuando se administra después de finalizada la cirugía o como terapia de rescate. Además, es posible que su falta de eficacia sea secundaria a una sub-dosificación, pero el uso de dosis mayores no se justifica por la mayor incidencia de síntomas de extrapiramidalismo.
DROPERIDOL: Es una butirofenona que no está disponible en Colombia. Actúa centralmente de forma antagónica sobre los receptores D2. Es más efectivo cuando se administra hacia el final de la cirugía16. Un meta-análisis de 54 estudios mostró que el droperidol tiene una efectividad similar a la del ondansetrón, con efectos centrales similares cuando se administra a dosis mayores de 1.25 mg. Sin embargo la equivalencia de efectividad no es similar en niños, donde el ondansetrón en más efectivo 17. En diciembre de 2001 la FDA en Estados Unidos le aplicó al droperidol una “etiqueta negra” para su uso como antiemético basándose en informes de caso sobre la prolongación del intervalo QTc y episodios de taquicardia ventricular helicoidal concomitantes con su uso. La FDA recomienda que el droperidol no se debe usar como medicamento de primera línea, y que se debe realizar monitorización electrocardiográfica continua antes y de dos a tres horas después de su aplicación. Sin embargo, nunca se ha informado en revistas biomédicas indexadas sobre casos de eventos cardiacos adversos o muertes de origen cardiaco asociadas al uso de droperidol desde su introducción para el manejo de la NVPO18. En Colombia aunque el droperidol no se encuentra disponible, otra butirofenona, el haloperidol también se ha mencionado en la literatura como un fármaco eficaz para la prevención de la NVPO. Desafortunadamente no existe literatura que se ocupe extensamente sobre los efectos clínicos del haloperidol como antiemético.
DEXAMETASONA: Ha demostrado ser efectiva en varios estudios. Su mecanismo de acción esta probablemente relacionado con la inhibición en la síntesis de prostaglandinas y la estimulación en la producción de endorfinas, resultando en una mejoría en el estado de ánimo, sensación de bienestar y estimulación del apetito19,20. Una revisión sistemática que incluye cuatro estudios de adultos y tres en niños mostró la eficacia antiemética de la dexametasona comparada con placebo21. La eficacia es similar en niños y en adultos. La dexametasona tiene un tiempo de latencia de por lo menos dos horas, lo que hace que se deba administrar durante la inducción anestésica como medida profiláctica para la NVPO. La vida media es de 36 a 72 horas, y tiene una duración de la acción clínica hasta de 24 horas. La dosis mínima efectiva de la dexametasona es 5 mg. Es más costo-efectiva que el ondansetrón y tiene una ventaja antiemética adicional en el periodo postoperatorio tardío. Cuando se usa en combinación con el ondansetrón el efecto antiemético se incrementa22. Los efectos de la administración de esteroides incluyen intolerancia a la glucosa, insuficiencia adrenal e infección del sitio quirúrgico. Sin embargo no hay pruebas de que una dosis única de dexametasona incremente la incidencia de infección postoperatoria23. No hay evidencia de trastornos del eje hipotálamo-adenohipofiso- adrenal con el uso de dexametasona como antiemético.
ANTAGONISTAS DEL RECEPTOR 5-HT3: Son los fármacos más efectivos para la prevención y el tratamiento de la NVPO. Los efectos secundarios son menos frecuentes y menos serios que con otros fármacos antieméticos. La cefalea y la disquinesia son los más frecuentes. En Colombia los fármacos más usados de este grupo son el ondansetrón y el granisetrón. El ondansetrón se debe usar hacia el final de la cirugía, ya que tiene una vida media de tres a cuatro horas y es menos efectivo cuando se administra durante la inducción. El Ondansetron a dosis de 0.1 mg/kg hasta 4 mg es más efectivo que el placebo para la prevención de NVPO en pacientes y en cirugías de alto riesgo24. La dosis efectiva de granisetrón es de 40 µg/kg IV, y su vida media permite su administración durante la inducción anestésica25.
OTROS FÁRMACOS: La efedrina es efectiva para prevenir el vómito secundario a la hipotensión inducida por la anestesia neuraxial. Ha mostrado tener una eficacia antiemética similar al droperidol y al propofol26,27. Los agonistas alfa 2-adrenérgicos, especialmente la clonidina, se han estudiado como fármaco de coinducción de la anestesia general, mostrando una reducción significativa de la incidencia de NVPO28. Este efecto puede ser por una reducción del tono simpático, y además, sus propiedades analgésicas pueden reducir los requerimientos de opioides.
TÉCNICAS NO FARMACOLÓGICAS
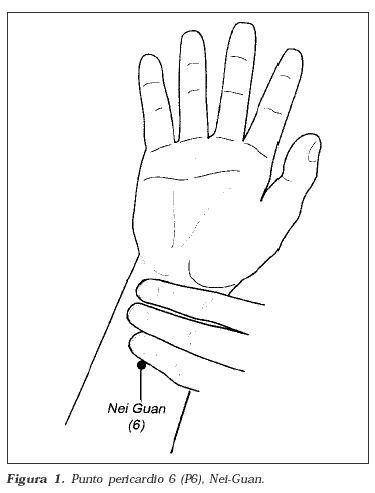
La acupuntura, electroacupuntura, estimulación eléctrica trascutánea del nervio, estímulo trascutáneo de puntos de acupuntura, inyección de puntos de acupuntura y acupresión se han descrito para el tratamiento de la NVPO38. Se cree que el estímulo del punto de acupuntura pericardio 6 - Nei- Guan (P6) se puede asociar a la activación de fibras serotoninérgicas y noradrenérgicas, o a la liberación de endorfinas en el líquido cerebroespinal, reforzando las acciones antieméticas. P6 es el sexto punto en el meridiano pericardial, situado a cinco centímetros proximal en la cara anterior de la muñeca entre los músculos flexores radiales de los carpos y los tendones del palmar largo (figura 1). En una revisión sistemática se concluyó que las técnicas no farmacológicas parecían ser superiores al placebo en la prevención de la NVPO temprana en adultos pero no en niños39.
TERAPIA ADYUVANTE
En un experimento clínico aleatorizado se demostró que en anestesia general la hidratación preoperatoria con 20 ml/kg reduce la incidencia de sed, vértigo y somnolencia hasta 24 horas después de terminada la cirugía32.
La administración suplementaria de oxigeno (O2) también ha demostrado disminuir la incidencia de NVPO. El O2 al 80% administrado durante la cirugía y dos horas después durante la recuperación, cuando se compara con O2 al 30%, reduce significativamente la incidencia de NVPO en pacientes llevados a resección de colon33. Los autores especulan que hay menos distensión intestinal cuando se usan altas concentraciones de O2, y teniendo en cuenta que la distensión intestinal produce 5- HT, que puede inducir la NVPO. Además la isquemia intestinal y la vasoconstricción esplácnicas secundarias a los efectos anestésicos y a la manipulación quirúrgica también pueden aumentar la concentración de 5-HT y otros factores emetogénicos.
Otra terapia usada para el manejo de la NVPO es la aromaterapia. Algunos estudios han mostrado que la inhalación de alcohol isopropílico reduce la severidad de la náusea y el vómito34. El mecanismo por el que este fenómeno ocurre no es claro pero puede estar involucrado un efecto depresor sobre el sistema nervioso central.
TERAPIA COMBINADA
La terapia combinada es superior a la monoterapia para el tratamiento de la NVPO. Nuestra comprensión de la neurofarmacología del centro del vómito, la ZQG y de sus asociaciones con los múltiples receptores eméticos en el cerebro ha proporcionado evidencia de que la etiología de la NVPO es multifactorial y que es lógico pensar en la polifarmacia para abordarla. Muchos estudios han demostrado que los antieméticos dados en combinación son más eficaces que cada antiemético individual37.
FACTORES POSTOPERATORIOS
El dolor postoperatorio, especialmente el dolor visceral se ha implicado en la génesis de NVPO. El dolor puede prolongar el vaciamiento gástrico y puede contribuir al vómito después de la cirugía. El uso de opioides sistémicos, inhibidores de la cicloxigenasa, analgesia controlada por el paciente, bloqueos neuraxiales, bloqueos nerviosos regionales, infiltración local del sitio quirúrgico puede ayudar en el manejo del dolor postoperatorio. Sin embargo el uso de opioides puede aumentar la incidencia de NVPO, por lo tanto el uso de analgesia balanceada o multimodal puede reducir los efectos adversos de cada uno de los métodos mediante un efecto sinérgico.
Los movimientos súbitos o los cambios de posición durante el transporte o la deambulación de los pacientes pueden precipitar NVPO. Esto es particularmente cierto en los pacientes que han recibido opioides.
NÁUSEA Y VÓMITO DESPUÉS DEL ALTA
El tratamiento de la NVPO es olvidado después de la salida de la unidad de cuidados postanestésicos (UCPA). La náusea y el vómito después del alta se presenta en 36% de los pacientes, y de estos el 72% no había presentado ningún síntoma similar durante su estancia en la UCPA35. No existe correlación entre la NVPO antes y después de la alta, y es probable que otros factores como el movimiento, la deambulación temprana o el uso de algunos analgésicos se asocien a las otras causas ya descritas cómo facilitadoras de la NVPO. Una investigación mostró que la administración de ondansetrón oral en tabletas previene el vómito después de la alta36.
CONCLUSIÓN
Los factores de riesgo para la NVPO, los perfiles eméticos, y el riesgo de cada paciente se pueden establecer durante la valoración preanestésica. La profilaxis antiemética rutinaria no se requiere en todos los pacientes. Sin embargo, la profilaxis antiemética mejora la satisfacción en los grupos de alto riesgo. La monoterapia antiemética profiláctica no es aceptable por su pobre eficacia. Ninguno de los fármacos probados hasta el momento se puede considerar el “patrón de oro” para la prevención o el tratamiento de la NVPO. Sin embargo, un abordaje multimodal con el uso de premedicación ansiolítica, evitando técnicas anestésicas inductoras de emesis, combinación de terapia antiemética farmacológica y no farmacológica, pre-hidratación intravenosa adecuada, prevención de la hipotensión, tratamiento adecuado del dolor y una adecuada transferencia del paciente a la UCPA puede llegar a ser efectiva para abordar esta complicación postanestésica. Con respecto al costo beneficio, la decisión para seleccionar el antiemético más rentable para la profilaxis, se debe basar en la incidencia prevista de NVPO, el perfil emético del riesgo del paciente y la eficacia intrínseca de los fármacos antieméticos.
COMENTARIOS
*Esta revisión hace parte del trabajo de investigación “Oxígeno suplementario para la prevención de la náusea y el vómito postoperatorios”, ganador del Concurso “Rafael Sarmiento” de Pósteres de Investigación Original, del Segundo Congreso Colombiano de Estudiantes de Postgrado de Anestesiología, noviembre de 2007.
REFERENCIAS
1. Ho KY, Chiu KW. Multimodal Antiemetic Therapy and Emetic Risk Profiling. Ann Acad Med Singapore. 2005;34:196-205. [ Links ]
2. Watcha MF, White PF. Postoperative náusea and vomiting: its etiology, treatment and prevention. Anesthesiology. 1992;77:162-84. [ Links ]
3. Gan TJ. Risk Factors for Postoperative Náusea and Vomiting. Anesth Analg. 2006;102:1884-98. [ Links ]
4. Sinclair DR, Chung F, Mezei G. Can postoperative náusea and vomiting be predicted? Anesthesiology. 1999;91:109-18. [ Links ]
5. Pusch F, Berger A, Wildling E, Tiefenthaler W, Krafft P. The effects of systolic arterial blood pressure variations on postoperative náusea and vomiting. Anesth Analg. 2002;94:1652-55. [ Links ]
6. Di Florio T. The use of midazolam for persistent postoperative náusea and vomiting. Anaesth Intensive Care. 1992;20:383-86. [ Links ]
7. Splinter WM, MacNeill HB, Rhine EJ, Roberts DJ, Gould MH. Midazolam reduces vomiting after tonsillectomy in children. Can J Anaesth. 1995;42:201-3. [ Links ]
8. Apfel CC, Kranke P, Katz MH, Rauch S. Volatile anaesthetics may be the main cause of early but not delayed postoperative vomiting: a randomized controlled trial of factorial design. Br J Anaesth. 2002;88:659-68. [ Links ]
9. Apfel CC, Korttila K, Abdalla M, Kerger H, Turan A, Vedder I. A factorial trial of six interventions for the prevention of postoperative náusea and vomiting. N Engl J Med. 2004;350:2441-51. [ Links ]
10. Sneyd JR, Carr A, Byrom WD, Bilski AJ. A meta-analysis of náusea and vomiting following maintenance of anaesthesia with propofol or inhalational agents. Eur J Anaesthesiol. 1998;15:433-45. [ Links ]
11. Tramer MR, Moore A, McQuay H. Propofol anaesthesia and postoperative náusea and vomiting: quantitative systematic review of randomized controlled studies. Br J Anaesth. 1997;78:247-55. [ Links ]
12. Gan TJ, El-Molem H, Ray J, Glass PS. Patient-controlled antiemesis: a randomized, double-blind comparison of two doses of propofol versus placebo. Anesthesiology. 1999;90:1570. [ Links ]
13. Cheng CR, Sessler DI, Apfel CC. Does Neostigmine Administration Produce a Clinically Important Increase in Postoperative Náusea and Vomiting? Anesth Analg. 2005;101:1349-55. [ Links ]
14. Dundee JW, Kirwan MK, Clarke RS. Anaesthesia and premedication as factors in postoperative vomiting. Acta Anaesthesiol Scand. 1965;9:223-31. [ Links ]
15. Henzi I, Walder B, Tramer MR. Metoclopramide in the prevention of postoperative náusea and vomiting: a quantitative systematic review of randomized, placebocontrolled studies. Br J Anaesth. 1999;83:761-71. [ Links ]
16. Henzi I, Sonderegger J, Tramer MR. Efficacy, doseresponse, and adverse effects of droperidol for prevention of postoperative náusea and vomiting. Can J Anaesth. 2000;47:537-51. [ Links ]
17. Domino KB, Anderson EA, Polissar NL, Posner KL. Comparative efficacy and safety of ondansetron, droperidol, and metoclopramide for preventing postoperative náusea and vomiting: a meta-analysis. Anesth Analg. 1999;88:1370-1379. [ Links ]
18. Gan TJ. Postoperative náusea and vomiting – can it be eliminated? JAMA. 2002;287:1233-36. [ Links ]
19. Rich WM, Abdulhayoglu G, Di Saia PJ. Methylprednisolone as antiemetic during cancer chemotherapy: a pilot study. Gynecol Oncol. 1980;9:193- 98. [ Links ]
20. Harris AL. Cytotoxic-therapy-induced vomiting mediated via enkephalin pathways. Lancet. 1982;1:714-16. [ Links ]
21. Henzi I, Walder B, Tramer MR. Dexamethasone for the prevention of postoperative náusea and vomiting: a quantitative systematic review. Anesth Analg. 2000;90:186-94. [ Links ]
22. Subramaniam B, Madan R, Sadhasivam S, Sennaraj B, Tamilselvan P, Rajeshwari S. Dexamethasone is a costeffective alternative to ondansetron in preventing PONV after paediatric strabismus repair. Br J Anaesth. 2001;86:84-89. [ Links ]
23. Coloma M, Duffy LL, White PF, Kendall Tongier W, Huber PJ Jr. Dexamethasone facilitates discharge after outpatient anorectal surgery. Anesth Analg. 2001;92:85- 88. [ Links ]
24. Morton NS, Camu F, Dorman T, Knudsen KE, Kvalsvik O, Nellgard P. Ondansetron reduces náusea and vomiting after paediatric adenotonsillectomy. Paediatr Anaesth. 1997;7:37-45. [ Links ]
25. Cieslak GD, Watcha MF, Phillips MB, Pennant JH. The dose-response relation and cost-effectiveness of granisetron for the prophylaxis of pediatric postoperative emesis. Anesthesiology. 1996;85:1076-85. [ Links ]
26. Rothenberg DM, Parnass SM, Litwack K, McCarthy RJ, Newman LM. Efficacy of ephedrine in the prevention of postoperative náusea and vomiting. Anesth Analg. 1991;72:58-61. [ Links ]
27. Naguib K, Osman HA, Al-Khayat HC, Zikri AM. Prevention of postoperative náusea and vomiting following laparoscopic surgery: ephedrine vs propofol. Middle East J Anaesthesiol. 1998;14:219-30. [ Links ]
28. Oddby-Muhrbeck E, Eksborg S, Bergendahl HT, Muhrbeck O, Lonnqvist PA. Effects of clonidine on postoperative náusea and vomiting in breast cancer surgery. Anesthesiology. 2002;96:1109-14. [ Links ]
29. Carlisle JB, Stevenson CA. Drugs for preventing postoperative náusea and vomiting. Cochrane Database Syst Rev. 2006;(3):CD004125. [ Links ]
30. Lee A, Done ML. Stimulation of the wrist acupuncture point P6 for preventing postoperative náusea and vomiting. Cochrane Database Syst Rev. 2004;(3):CD003281. [ Links ]
31. Gan TJ, Meyer T, Apfel CC, Chung F, Davis PJ, Eubanks S, et al. Consensus Guidelines for Managing Postoperative Náusea and Vomiting. Anesthesia Analgesia. 2003;97:62-71. [ Links ]
32. Yogendran S, Asokumar B, Cheng DC, Chung F. A prospective randomized double-blinded study of the effect of intravenous fluid therapy on adverse outcomes on outpatient surgery. Anesth Analg. 1995;80:682-86. [ Links ]
33. Greif R, Laciny S, Rapf B, Hickle RS, Sessler DI. Supplemental oxygen reduces the incidence of postoperative náusea and vomiting. Anesthesiology. 1999;91:1246-52. [ Links ]
34. Wang SM, Hofstadter MB, Kain ZN. An alternative method to alleviate postoperative náusea and vomiting in children. J Clin Anesth. 1999;11:231-34. [ Links ]
35. Carroll NV, Miederhoff P, Cox FM, Hirsch JD. Postoperative náusea and vomiting after discharge from outpatient surgery centers. Anesth Analg. 1995;80:903- 9. [ Links ]
36. Gan TJ, Franiak R, Reeves J. Ondansetron orally disintegrating tablet versus placebo for the prevention of postdischarge náusea and vomiting after ambulatory surgery. Anesth Analg. 2002;94:1199-200. [ Links ]
37. Lopez-Olaondo L, Carrascosa F, Pueyo FJ, Monedero P, Busto N, Saez A. Combination of ondansetron and dexamethasone in the prophylaxis of postoperative náusea and vomiting. Br J Anaesth. 1996;76:835-40. [ Links ]
38. White PF. Are nonpharmacologic techniques useful alternatives to antiemetic drugs for the prevention of náusea and vomiting? Anesth Analg. 1997;84:712-14. [ Links ]
39. Lee A, Done ML. The use of nonpharmacologic techniques to prevent postoperative náusea and vomiting: a metaanalysis. Anesth Analg. 1999;88:1362-69. [ Links ]













