Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.36 no.4 Bogotá Oct./Dec. 2008
ACTUALIZACIONES E INNOVACIONES TECNOLÓGICAS
Análisis matemático de la curva presión-volumen del ventrículo izquierdo
Efraín Riveros Pérez, M.D., M.Sc
Anestesiólogo intensivista; coordinador, Unidad de Cuidado Intensivo, Clínica de los Andes, Tunja; coordinador, Unidad de Fisiología, Universidad del Rosario, Bogotá, D.C., Colombia. Email: efrivero@urosario.edu.co.
RESUMEN
Objetivo. Presentar una aproximación práctica a los factores determinantes de la función cardiaca, basada en los conceptos físicos y matemáticos que subyacen a la curva presión-volumen del ventrículo izquierdo. métodos. Análisis teórico de la curva presión-volumen del ventrículo izquierdo. Conclusiones. La reanimación de los pacientes críticamente enfermos se basa en la obtención de información indirecta de los factores determinantes de la función ventricular, obtenida muy frecuentemente a partir de métodos invasivos. Son evidentes la limitación teórica de la información calculada mediante el catéter en la arteria pulmonar y la necesidad de desarrollar nuevas metodologías que permitan reproducir la curva presión-volumen del ventrículo izquierdo.
Palabras claves: curva presión-volumen, análisis matemático.
SUMMARY
Objective: To present a practical approach to cardiac performance factors based upon physical and mathematical foundations that lie under the left ventricular pressure volume loop. methods: Theoretical analysis of the left ventricular pressure volume loop. Conclusions: The process of reanimation in the critically-ill population depends on indirect measurements of left ventricular performance factors, often derived from invasive maneuvers. Theoretical limitations from pulmonary artery catheter-derived calculations become obvious, and warrant the development of new methods that allow displaying left ventricular pressure-volume loop at the bedside.
Key words: pressure volume loop, mathematical analysis.
INTRODUCCIÓN
Durante los últimos años ha aumentado el interés por el comportamiento de la curva presión-volumen del ventrículo izquierdo, puesto que por medio de ella se encuentran las diferentes relaciones e interacciones de los factores determinantes de la función ventricular1 y es posible hacer una aproximación a cada uno de ellos de manera aislada: precarga, poscarga y contractilidad2,3. Esta aplicación, además de representar un campo fascinante en la investigación fisiológica, es una herramienta útil para la descripción de diferentes procesos fisiopatológicos que afectan el corazón. En este campo, es de particular importancia su eventual aplicación en el área del cuidado de pacientes críticos y con patología cardiaca médica o quirúrgica.
Infortunadamente, en la actualidad los esfuerzos para estimar de manera cuantitativa la precarga, la poscarga y la contractilidad, requieren medios invasivos y parten de postulados erróneos. Por ejemplo, en el caso de la precarga, se hacen mediciones de presiones de llenado, sin tener en cuenta que, por definición, la precarga es el esfuerzo (estrés) que desarrolla la fibra miocárdica antes de iniciar la contracción, es decir, al final de la diástole en el corazón intacto4,5. Este esfuerzo está determinado por la longitud de la fibra, cuya aproximación más cercana es el volumen de fin de diástole, para el cual hay una correspondiente presión de fin de diástole o de llenado predecible, siempre y cuando la distensibilidad del ventrículo izquierdo sea normal. Como es obvio, ningún paciente que necesite la inserción de un catéter en la arteria pulmonar tiene la distensibilidad ventricular izquierda dentro de parámetros normales.
Para la poscarga, la situación no es mejor, pues el parámetro hemodinámico empleado por los clínicos, la resistencia vascular sistémica, asume un fujo constante para poder aplicar la ley de Ohm; esto tampoco es cierto, dado que el fujo sanguíneo es pulsátil y se puede entender únicamente en términos de impedancia (modelo de Windkessel), y eventualmente, de elasticidad arterial, las cuales no se pueden calcular a partir de la información que brinda el catéter de la arteria pulmonar.
Por último, la contractilidad no cuenta con un índice confable de evaluación, puesto que en el momento se considera que las dos mejores aproximaciones a la contractilidad son el trabajo sistólico de precarga reclutable y la elasticidad de fin de sístole, para cuya medición no sirve el catéter de Swan-Ganz.
Ante un panorama tan desalentador, emerge la necesidad de regresar a los conceptos fisiológicos en que se basan los factores determinantes de la función ventricular izquierda6. En ese sentido, la curva presión-volumen es la expresión gráfica más pura para entender los diferentes fenómenos que ocurren durante el ciclo cardiaco. Sin embargo, esta curva sólo se puede desarrollar de manera experimental y bajo condiciones controladas, lo cual limita su uso clínico.
La aproximación matemática que presenta el autor es netamente teórica y parte de los principios físicos y matemáticos que rigen la materia. A este modelo seguirá, en un futuro cercano, la comprobación experimental en sistemas biológicos, con la eventual posibilidad de desarrollar técnicas no invasivas computadorizadas que permitan al clínico analizar de manera directa y no contaminada, la precarga, la poscarga y la contractilidad, para poder llegar fácilmente a la toma de decisiones para la reanimación de pacientes críticos.
FACTORES DETERMINANTES DE LA FUNCIÓN VENTRICULAR EN LA CURVA PRESIÓN-VOLUMEN
En la curva presión-volumen (figura 1) es posible hacer una aproximación a la precarga por medio de la observación del comportamiento del volumen de fin de diástole y su impacto sobre la presión, para así hacer inferencias con respecto a distensibilidad y esfuerzo7, como se explicará más adelante en el modelo matemático. De acuerdo con el comportamiento de los materiales, el tejido miocárdico se mueve en el rango elástico y, como tal, el esfuerzo que se desarrolla en él depende de la elongación de la fibra al final de la diástole (mecanismo de Frank-Starling), por medio de una constante de proporcionalidad, o módulo de elasticidad; para el caso del corazón intacto corresponde a la pendiente de línea recta de la relación presión-volumen de fin de sístole (ESPVR) que, como se muestra en la figura, tiene la intersección en el eje X. Así, la precarga depende tanto del volumen de fin de diástole como del módulo de elasticidad, y ambos son mostrados por la curva presión-volumen8.
En la misma curva, se puede observar que la poscarga es determinada por la elasticidad arterial (figura 1), cuya pendiente es mayor o menor si hay vasoconstricción o vasodilatación sistémica, respectivamente9. Se hace evidente, a partir de la gráfica, que si la elasticidad arterial disminuye, el volumen sistólico o de eyección aumenta, lo cual ocurre clínicamente cuando se administra nitroprusiato de sodio.
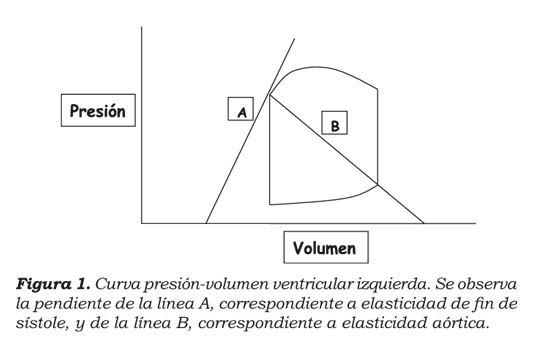
En el caso de la contractilidad, la cual se define como la propiedad intrínseca de la fibra miocárdica, que le permite transformar energía potencial en trabajo mecánico, es determinada por la posición y la pendiente de la elasticidad de fin de sístole ventricular. Naturalmente, si la elasticidad se desplaza hacia la izquierda y hacia arriba (inotropismo positivo), aumentan tanto el volumen de eyección como el trabajo sistólico y, por ende, el consumo de oxígeno miocárdico10 (figura 2).
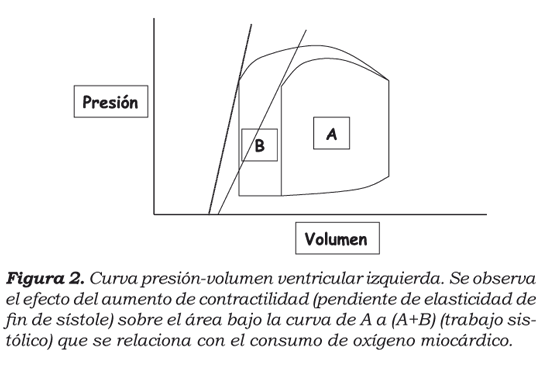
Cuando se habla de la función de bomba del corazón, se entiende que el término eficiencia marca la optimización de su rendimiento. Se define eficiencia ventricular como la producción del máximo volumen de eyección con el menor consumo posible de oxígeno. Dicha eficiencia máxima se obtiene cuando la relación entre elasticidad ventricular y arterial es igual a 2. Si las dos elasticidades son iguales (relación entre elasticidades igual a 1), el volumen de eyección es mayor, pero el costo en términos de demanda metabólica es desproporcionadamente alto. Es de anotar que el primer mecanismo de compensación que el corazón utiliza en cada latido cuando se encuentra al borde de la falla sistólica, es aumentar la pendiente de la elasticidad arterial para cambiar la relación de elasticidades y mantener un adecuado volumen de eyección, pero paga el precio de la isquemia11.
ANÁLISIS MATEMÁTICO DE LA CURVA
En la aproximación teórica que se plantea, se construye un modelo matemático del ventrículo izquierdo como un cilindro con paredes gruesas (figura 3), el cual se contrae durante la sístole. Si se hace un diagrama de cuerpo libre, se encuentra que hay tres fuerzas involucradas en el momento de la eyección: fuerza de cuerpo, es decir, la fuerza por unidad de volumen descrita por Shoucri12 (D), la fuerza representada por la presión (P) y la fuerza representada por componentes elásticos de la pared ventricular (EδV), que no aparece en el diagrama y cuya dirección y sentidos varían según la fase del ciclo cardiaco, puesto que es una magnitud vectorial.
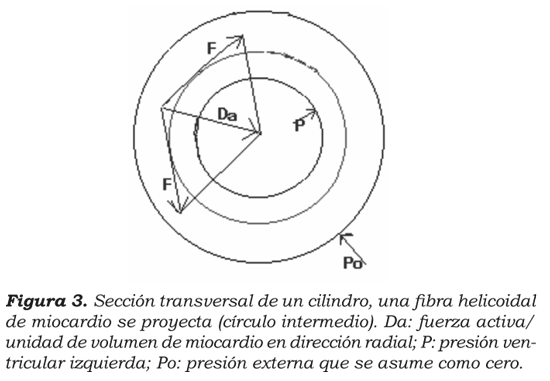
De acuerdo con la segunda ley de Newton, la suma de las tres fuerzas equivale al producto de masa por aceleración, lo cual hace más complejo el análisis. Sin embargo, tras los estudios de Tallarida, se pueden despreciar las fuerzas de la inercia y el sistema se puede asumir como cuasiestático, con lo cual podemos decir que la suma de las fuerzas es igual a 0.

Donde D es la fuerza por unidad de volumen del cilindro, h es el espesor de la pared, P es la presión de la sangre contra la pared del cilindro, A es el área transversal de la cavidad ventricular, E es la elasticidad ventricular o módulo de elasticidad y δV es la diferencia de volumen entre el final de la diástole y el mínimo volumen ventricular posible.
Si se observa la gráfica presión-volumen (figura 1) y acudimos a los análisis de Shoucri, se encuentra que la relación presión-volumen se puede expresar en forma lineal, como se muestra en la figura 4.
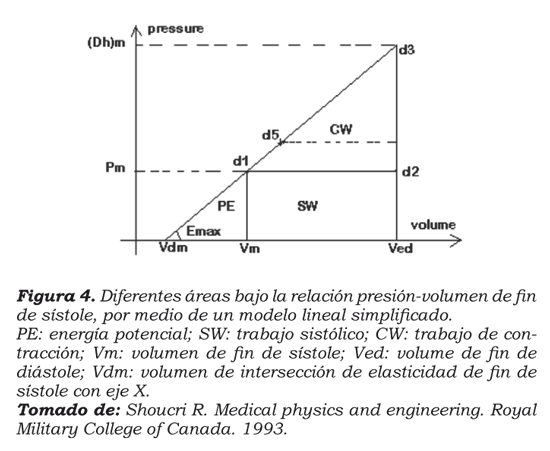
Si analizamos la ecuación 3, encontramos que se trata de la ecuación de una línea recta, cuya forma general es
y=mx+b,
donde m es la pendiente que corresponde en el caso de la curva, a la elasticidad de fin de sístole, y es la presión, y x es el delta de volumen. Es decir, el modelo teórico matemático corresponde con la curva presión-volumen que tradicionalmente se ha descrito. Cabe anotar que para hacer más sencillos los análisis, en las ecuaciones los términos de fuerza se multiplicaron por el área a ambos lados de la igualdad.
Ahora, si se analiza la gráfica de la figura 4, se encuentra que, dado que la pendiente es constante en una línea recta, se pueden obtener dos ecuaciones con la ecuación de la línea recta, sabiendo que
m=(y2-y1)/(x2-x1),
donde m es la pendiente y los delta de x e y representan cambios en volumen y presión, respectivamente.
En la figura 4 se observa que
P=E(V-Vd) (ecuación 4) y
Dh=E(Ved-Vd) (ecuación 5),
donde Ved es el volumen de fin de diástole, Vd es la intersección de la elasticidad en el eje x. Si se restan las dos ecuaciones se obtiene
Dh-P=E(Ved-V).
Esta última es idéntica a la ecuación 3 dividida por el área, con lo cual se comprueba que el modelo matemático postulado es correcto y que se correlaciona con la curva presión-volumen del corazón humano.
APLICACIÓN CLÍNICA
El aporte de este modelo consiste en que, al aplicar la ecuación, se simplifica la aproximación a los factores determinantes de la función ventricular13, puesto que se puede entender que al calcular el módulo de elasticidad se podría hacer una medición de la precarga por medio de ecocardiografía.
En segundo lugar, al expresar en forma lineal la relación presión-volumen, se demarcan claramente unas áreas bajo la elasticidad que son energía potencial que utiliza la célula miocárdica para sus procesos metabólicos basales, y el trabajo sistólico, que se puede entregar a la circulación sistémica. Existe un área que se puede reclutar en caso de insuficiencia cardiaca para aumentar el trabajo sistólico, que corresponde al punto en que las elasticidades arterial y ventricular son iguales. De ese punto en adelante, el trabajo no aumenta más, pero hay un aumento de la demanda metabólica dado por incremento en la energía potencial que no puede ser liberada a la circulación, lo cual, desde el punto de vista del autor, representa un área de isquemia, lo cual se evidencia como empeoramiento clínico de la falla cardiaca sistólica14.
FUTUROS AVANCES
Como producto de los postulados antes tratados, el autor está conduciendo un estudio para medir el módulo de elasticidad en el corazón de cadáver humano, para hacer cálculos en conjunto con la fracción de acortamiento y dar origen a un índice no invasivo de precarga. También lo está haciendo para obtener la curva presión-volumen por medio de la sincronización de señales del ecocardiograma en modo M y la curva de presión arterial femoral, tras la eliminación de las señales de reflexión. Se esperan prontos resultados de estos estudios con la esperanza de tener la curva presión-volumen ventricular al lado del paciente, para evitar las limitaciones del catéter de la arteria pulmonar, del cual se dispone en la actualidad en nuestras unidades de cuidado crítico.
REFERENCIAS
1. Sagawa K. The ventricular pressure-volume diagram revisited, Circ Res. 1978,43.677-87. [ Links ]
2. Suga H. Paul Dudley White international lecture: cardiac performance as viewed through the pressure-volume window. Jpn Heart J. 1993,35:263-80. [ Links ]
3. Shoucri RM. Performance of the left ventricle based on pressure-volume relation. J Biomed Eng. 1990,12:482-8. [ Links ]
4. Riveros E. Análisis de materiales y conceptos de ingeniería aplicados a la precarga ventricular izquierda del corazón humano. Revista Colombiana de Anestesiología. 2004;32:127-9. [ Links ]
5. Riveros E. Shock hemorrágico: expresión del desequilibrio del sistema cardiovascular. Análisis físico. Revista Colombiana de Anestesiología. 2005;33:99-102. [ Links ] [ Links ]
7. Shoucri RM. The pressure volume-relation and the mechanics of left ventricular contraction. Jpn Heart J. 1990;31:713-29. [ Links ]
8. Baan J, Bachman K, Gibson D, editors. Ventricular function and pressure-volume analysis: the role of conductance in cardiology. Eur Heart J. 1992;13(Suppl.E):1-118. [ Links ]
9. Asanoi H, Sasayama S, Kamegama T. Ventriculo-arterial coupling in normal and failing heart in humans. Circ Res. 1989;65:483-93. [ Links ]
10. Kass DA, Maughan WL, Guo ZM, Kono A, Sunagawa W, Sagawa K. Comparative infuence of load versus inotropic states on indexes of ventricular contractility: experimental and theoretical analysis based on pressure-volume relationships. Circulation. 1987;76:1422-36. [ Links ]
11. Elzinga G, Westerhof N. Matching between ventricle and arterial load, an evolutionary process. Circ Res. 1991;68:1495-500. [ Links ]
12. Shoucri RM. The active force of the myocardium. In: Power H, Hart RT, editors. Computer simulations in biomedicine. Southampton and Boston: Computational Mechanics Publications; 1995. p. 19-26. [ Links ]
13. Shoucri RM. Pressure-volume relation in left ventricle. Am J Physiol. 1991;260:H282-91. [ Links ]
14. Shoucri RM. Clinical application of end-systolic pressure-volume relation. Ann Biomed Eng. 1994;22:212-7. [ Links ]













