Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.37 no.1 Bogotá Jan./Mar. 2009
INVESTIGACIÓN CLÍNICA
La metoclopramida no disminuye la incidencia de náusea y vómito postoperatorios cuando se asocia a dexametasona en pacientes ambulatorios llevados a procedimientos otorrinolaringológicos
Eduardo Zárate, MD.*, Edgardo Corrales, MD.*, Juan Marcos Guzmán, MD.**, Ramiro Alcalá, MD.**, Wilmer Fragoso, MD.**, Catalina Soto, MD.**
Primer Premio Concurso Jorge Colmenares, XXVIII Congreso Colombiano de Anestesiología, marzo 2009. Bogotá.
* Profesor Asistente Departamento de Anestesiología, Pontificia Universidad Javeriana, Hospital San Ignacio.edzarate@cable.net.co
** Residente III año Departamento de Anestesiología, Pontificia Universidad Javeriana, Hospital San Ignacio.
Recibido para publicación febrero 18 de 2009. Aceptado para publicación abril 14 de 2009.
RESUMEN
Objetivo: evaluar el efecto profiláctico antiemético de la combinación dexametasona - metoclopramida en pacientes llevados a procedimientos otorrinolaringológicos. Materiales y Métodos: En este estudio doble ciego y placebo controlado, 208 pacientes ambulatorios anestesiados con una técnica anestésica convencional, fueron aleatorizados para recibir dexametasona 8 mg durante la inducción anestésica y metoclopramida, 10 mg al final de la cirugía (Grupo A), dexametasona, 8 mg durante la inducción anestésica y placebo al final de la cirugía (Grupo B), placebo durante la inducción anestésica y metoclopramida, 10 mg al final de la cirugía (Grupo C) o placebo durante la inducción anestésica y al final de la cirugía (Grupo D). La ausencia de vómito y de náusea moderada y no solicitud de administración de medicación antiemética de rescate, se consideraron componentes de la respuesta completa al tratamiento antiemético. Resultados: Durante el período pre-alta del hospital, el número de pacientes que experimentaron respuesta completa al tratamiento profiláctico fue significativamente mayor en los grupos B (90.4%) y A (86.5%) al compararlos con los grupos D (55.8%) y C (75%). A las 24 horas, la proporción de pacientes con una respuesta completa fue significativamente mayor en el grupo A (96.2%) en comparación con los grupo C (67.3%) y D (78.8%) y de igual forma en el grupo B (88%) en comparación con el grupo C (67.3%). Conclusiones: La combinación de dexametasona con metoclopramida no es significativamente más efectiva que la administración de dexametasona sola en la profilaxis de náusea y vómito postoperatorios.
Palabras clave: Dexametasona, Metoclopramida, Náusea, Vómito, NVPO.
SUMMARY
Objective: The aim of this study was to evaluate the prophylactic antiemetic effects of the combination dexamethasone - metoclopramide in patients undergoing ear-nose-throat procedures. Materials and methods: In this placebo-controlled, double-blind study, 208 outpatients under standardized anesthetic were randomized to receive dexamethasone 8 mg before anesthesia induction and metoclopramide, 10 mg at the end of surgery (Group A), dexamethasone 8 mg before anesthesia induction and placebo at the end of surgery (Group B), placebo before anesthesia induction and metoclopramide, 10 mg at the end of surgery (Group C) or placebo before anesthesia induction and at the end of surgery (Group D). Complete response to prophylactic antiemetic medication was defined as no vomiting no sustained moderate nausea and no requesting of antiemetic drug. Results: During predischarge period, the number of patients with complete response to prophylactic antiemetic medication was significantly higher in groups B (90.4%) and A (86.5%) in comparison with groups D (55.8%) and C (75%). At the 24 h follow-up evaluation, complete response was higher in group A (96.2%) in comparison with groups C (67.3%) and D (78.8%). Conclusions: combination dexamethasone-metoclopramide is not more effective than administration of dexamethasone alone in the posoperative profylaxis of nausea and vomiting.
Keywords: Dexamethasone, Metoclopramide, Nausea,Vomiting, PONV.
INTRODUCCIÓN Y OBJETIVOS
La incidencia de náusea y vómito postoperatorios ha permanecido estática durante los últimos veinte años a pesar de la utilización de anestésicos de corta acción y la ejecución de cirugías de mínima invasividad, la mayor parte de estas ejecutadas en un contexto ambulatorio1.
El uso de medicamentos antieméticos profilácticos produce mayor satisfacción en los pacientes que el tratamiento de síntomas de náusea y vómito establecidos en el postoperatorio2,3,4. Sin embargo, se ha generado una gran controversia en relación con el tratamiento antiemético mas costo-efectivo en la profilaxis rutinaria, debido a la introducción de nuevas y más costosas medicaciones antieméticas (antiserotoninérgicos y antagonistas de neurokinina 1)5,6.
Los resultados de estudios de diseño multifactorial sugieren que antieméticos con diferentes mecanismos de acción tienen efectos aditivos en la incidencia de náusea y vómito postoperatorios7. El bajo costo y el excelente perfil de seguridad de la dexametasona la han catalogado como una estrategia altamente costo-efectiva en la prevención de este evento adverso7,8. La metoclopramida es una medicación que se ha utilizado desde hace 40 años en la prevención de emesis postoperatoria9. Es una droga de muy bajo costo, y a dosis de 10 mg IV, posee una reducida incidencia de eventos adversos10. No obstante su escasa relevancia antiemética profiláctica (NNT [número necesario de pacientes a tratar] = 9.1 y 10 para náusea y vómito postoperatorios tempranos respectivamente) es la única medicación autorizada por el Plan Obligatorio de Salud como antiemético profiláctico10,11.
Con el objeto de determinar el verdadero beneficio profiláctico antiemético de utilizar dos medicamentos administrados en diferentes momentos del acto anestésico, se diseñó este estudio clínico en el que se compara la eficacia de la combinación dexametasona-metoclopramida con cada una de estas medicaciones utilizadas individualmente y con placebo, en la prevención de náusea y vómito postoperatorios después de procedimientos quirúrgicos otorrinolaringológicos ambulatorios.
MATERIALES Y MÉTODOS
Después de ser obtenida la aprobación por parte de los Comités de Investigación del Departamento de Anestesiologia y de la Facultad de Medicina de la Pontificia Universidad Javeriana, 208 pacientes firmantes del consentimiento informado, y programados electivamente para procedimientos quirúrgicos otorrinolaringológicos y maxilofaciales ambulatorios fueron enrolados en este experimento clínico aleatorizado, doble ciego y placebo controlado.
Los pacientes en edades entre los 18 y 75 años fueron aleatoriamente asignados a uno de cuatro grupos de tratamiento utilizando una tabla de números aleatorios generada por computador: (A) grupo dexametasona-metoclopramida, quienes recibieron dexametasona antes de la inducción anestésica y metoclopramida 30 minutos antes del final de la cirugía; (B) grupo dexametasona, quienes recibieron dexametasona antes de la inducción anestésica y solución salina 30 minutos antes del final de la cirugía; (C) grupo metoclopramida, quienes recibieron solución salina antes de la inducción anestésica y metoclopramida 30 minutos antes del final de la cirugía y (D) grupo placebo, quienes recibieron solución salina tanto antes de la inducción anestésica, como 30 minutos antes del final de la cirugía.
Se excluyeron del estudio aquellos pacientes que hubiesen recibido cualquier medicación antiemética o que hubiesen experimentado emesis o náuseas durante un período de 24 horas antes de la cirugía, que estuviesen embarazadas, que hubiesen consumido sustancias sicoactivas o alcohol durante las 24 horas previas al acto quirúrgico, que hubiesen recibido esteroides en un período de 6 meses previos a la cirugía y aquellos pacientes con alergia conocida a las drogas estudiadas. También fueron excluidos aquellos pacientes con un estado físico ASA (Sociedad Americana de Anestesiologia) III o mayor, pacientes con un índice de masa corporal (IMC) mayor de 35 y pacientes que sufrieran de cualquier condición que contraindicara la administración de esteroides: hipertensión arterial, enfermedad coronaria, insuficiencia renal, enfermedad ácido péptica, diabetes, enfermedad de Cushing, insuficiencia adrenal, inmunosupresión, tuberculosis reciente y cataratas. De cada paciente se obtuvo su historia clínica detallada así como su información demográfica que incluía edad, talla, peso estado físico ASA, consumo previo de tabaco, alcohol o medicamentos, así como historia anterior de náusea y vómito postoperatorios (NVPO) o vértigo de movimiento. En las mujeres se consignó la fecha de la última menstruación.
Inmediatamente antes de la cirugía, todos los pacientes evaluaron escalas verbales análogas (EVA) para náusea, ansiedad, sedación, vértigo y dolor utilizando una escala de 100 mm (0= nada y 100= máximo). Las medicaciones a estudiar fueron preparadas por la enfermera jefe de salas de cirugía en dos jeringas de 5 ml numeradas, que eran idénticas en apariencia. La primera jeringa (rotulada como Jeringa # 1), contenía dexametasona, 8 mg, o solución salina (en un volumen total de 5 ml), se administró 3 minutos antes de la inducción de la anestesia. La segunda jeringa (rotulada como Jeringa # 2), contenía metoclopramida, 10 mg, o solución salina (en un volumen total de 5 ml) fue administrada 30 minutos antes del final predicho de la cirugía. Los pacientes pertenecientes al GRUPO A recibieron dexametasona, 8 mg, en la Jeringa # 1 y metoclopramida, 10 mg, en la Jeringa # 2. Los pacientes pertenecientes al GRUPO B recibieron dexametasona, 8 mg en la Jeringa # 1 y solución salina en la Jeringa # 2. Los pacientes pertenecientes al GRUPO C recibieron solución salina en la Jeringa # 1 y metoclopramida, 10 mg, en la Jeringa # 2. Los pacientes pertenecientes al GRUPO D recibieron solución salina en la Jeringa # 1 y solución salina en la Jeringa # 2.
En la sala de cirugía, los pacientes fueron monitorizados convencionalmente, y posteriormente recibieron una técnica anestésica estandarizada consistente en tiopental sódico y rocuronio o succinilcolina para la inducción, e isoflurane para el mantenimiento después de la intubación endotraqueal. También se estandarizaron las dosis de analgésicos opioides perioperatorios, y de dipirona como analgésico no opioide. La utilización de relajantes neuromusculares, así como de sus antagonistas se dejaron a criterio del anestesiólogo tratante.
El tiempo del acto anestésico (desde el comienzo de la inducción anestésica hasta la descontinuación del anestésico volátil), el tiempo del acto quirúrgico (desde la infiltración con anestésico local hasta la colocación de vendajes quirúrgicos), y los tiempos de apertura ocular (desde la descontinuación del anestésico volátil hasta la apertura de los ojos), seguimiento de comandos verbales (desde la descontinuación del anestésico volátil hasta levantar la cabeza a la orden verbal) y de orientación (desde la descontinuación del anestésico volátil hasta que fuese capaz de dar el nombre y fecha de nacimiento) fueron registrados en intervalos de 1 minuto. En la unidad de cuidado postanestésico (UCPA), el tiempo de deambulación no asistida (desde la descontinuación del anestésico volátil), cumplimiento de criterios de salida del hospital (desde la descontinuación del anestésico volátil) y salida real del hospital (desde la descontinuación del anestésico volátil) así como la duración de la estancia en la UCPA fueron registrados. Los criterios estandarizados para la salida del hospital incluyeron signos vitales estables, capacidad para deambular sin asistencia, diuresis espontánea y ausencia de dolor o náusea severos.
Uno de los investigadores cegado al grupo de tratamiento antiemético registró todas las variables intraoperatorias y de recuperación, incluyendo la incidencia de náusea y vómito postoperatorios (NVPO) y la necesidad de medicación antiemética de rescate. Un episodio de emesis se definió como vómito o arcada o cualquier combinación de estos eventos que ocurriesen en una secuencia rápida (< 1min entre los eventos). Cuando el intervalo entre los episodios de vómitos o arcadas era > 1 min, se consideraron episodios separados. Si el paciente experimentaba episodios repetidos (dos o más) de emesis, o náusea moderada (> de 40 mm en EVA) sostenida durante 15 min o más, o si solicitaba tratamiento antiemético, se le administraba prometazina, 6.25 mg IV. Si la emesis o náusea persistía por más de 15 min después de la administración de prometazina, se administraba ondansetrón, 4 mg IV. El desenlace primario de eficacia en este estudio fue definido como una respuesta completa a la medicación antiemética profiláctica. Esta a su vez fue definida como ausencia de vómito, ausencia de náusea moderada sostenida durante 15 minutos o más y no solicitud de administración de medicación antiemética de rescate.
En todos los pacientes el dolor postoperatorio se trató con morfina en bolos de 1.5 mg IV cada 10 minutos hasta que el paciente se sintiera confortable (< de 40mm en EVA). La EVA fue utilizada para evaluar náusea, ansiedad, sedación, vértigo y dolor inmediatamente antes de la salida del hospital. Se registraron todos los eventos adversos y medicaciones utilizadas en la UCPA.
Los pacientes fueron contactados a las 24 horas después de la operación por un investigador cegado al grupo de tratamiento antiemético. Se les solicitó que reportaran el número de episodios de vómito y cualquier medicación antiemética tomada desde la salida del hospital. De igual manera, se les pidió que evaluaran la náusea desde que eran dados de alta utilizando una escala verbal de 11 puntos (0 = no náusea a 10 = "la peor náusea imaginable").
ANÁLISIS ESTADÍSTICO
Asumiendo que el 60% de los pacientes llevados a procedimientos otorrinolaringológicos bajo anestesia general desarrollarían NVPO y que la incidencia de este evento adverso en los pacientes tratados profilácticamente con dexametasona es del orden del 45% en estudios previos, se estableció mediante un análisis de poder a priori, que se requerían 52 pacientes por grupo para tener un 80% de oportunidad en detectar una reducción del 25% de NVPO en el grupo A en relación con los grupos B y C y una reducción del 40% en relación con el grupo D con un nivel de significancia P = 0.05.
Series de análisis de varianza de una sola vía se llevaron a cabo para examinar las diferencias entre los cuatro grupos con respecto a variables paramétricas. Si se encontraba una diferencia significativa se utilizó Student´s t -test Bonferroni para detectar las diferencias intergrupales. Las variables categóricas fueron analizadas mediante pruebas de X2 y Fisher. Una P < 0.05 se consideró significativa.
RESULTADOS
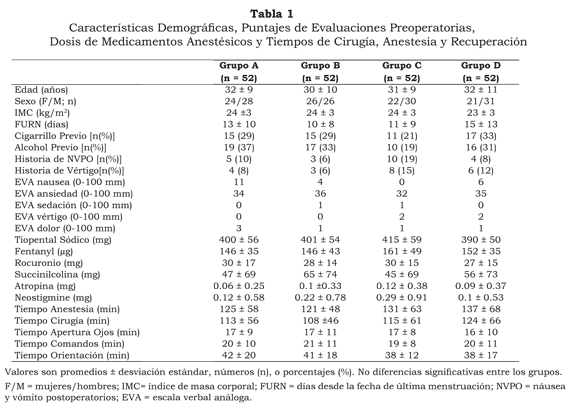
Los cuatro grupos de tratamiento fueron comparables con respecto a sexo, edad, IMC, periodo de ciclo menstrual, consumo previo de cigarrillo y alcohol, e historia de NVPO previos o vértigo de movimiento. No existieron diferencias en las evaluaciones preoperatorias que los pacientes llevaron a cabo en escalas verbales análogas de náusea, ansiedad, sedación, vértigo y dolor. Las dosis de fentanyl, tiopental sódico, rocuronio, succinilcolina, neostigmine y atropina fueron similares en los cuatro grupos, al igual que los tiempos del acto anestésico y quirúrgico, tiempos de apertura ocular, seguimiento de comandos y orientación (tabla 1).
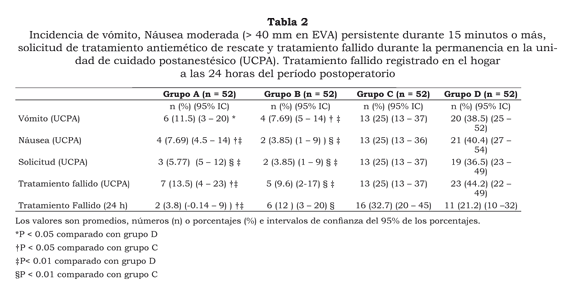
Durante el período pre-alta del hospital, el número de pacientes que experimentaron respuesta completa al tratamiento profiláctico fue significativamente mayor en los grupos dexametasona (B) y dexametasona - metoclopramida (A) al compararlos con los grupos placebo (D) y metoclopramida sola (C). La respuesta completa fue similar entre los pacientes que recibieron dexametasona sola (grupo B) y la combinación dexametasona - metoclopramida (grupo A) y entre los que se les administró metoclopramida sola (grupo C) y placebo (grupo D) (tabla 2). En la tabla 2 se discriminan las incidencias de vómito, náusea persistente durante 15 minutos o más y solicitud de tratamiento antiemético en cada uno de los grupos.
En un análisis a posteriori acerca del uso de analgesia postoperatoria, la dosis de morfina fue significativamente menor en los grupos A [(metoclopramida - dexametasona) 10.4 ± 3.2 mg] y B [(dexametasona) 10.3 ± 3.6 mg] con respecto al grupo D [(placebo) 17.7 mg ± 5.6 mg] (P < 0.05).
Un paciente perteneciente al grupo A fue hospitalizado por dolor intratable. No existieron otras admisiones no planeadas. Las evaluaciones llevadas a cabo con escalas verbales análogas a la salida del hospital no revelaron diferencias en cuanto a ansiedad, vértigo, sedación o dolor. Sin embargo, los puntajes de náusea fueron significativamente mayores en el grupo D en comparación con los grupos A y C. (tabla 3). Los pacientes que recibieron dexametasona - metoclopramida y dexametasona sola tuvieron un menor tiempo de permanencia en la sala de cuidado postanestésico y cumplieron criterios de salida del hospital significativamente más rápido que los pacientes a quienes se administró metoclopramida o placebo. Similares resultados se obtuvieron con el intervalo para lograr el tiempo de salida real, de deambulación no asistida y tolerancia oral a líquidos. En cuanto a estas variables no hubo diferencias entre los grupos metoclopramida - dexametasona y dexametasona sola y entre los grupos metoclopramida y placebo (tabla 3).
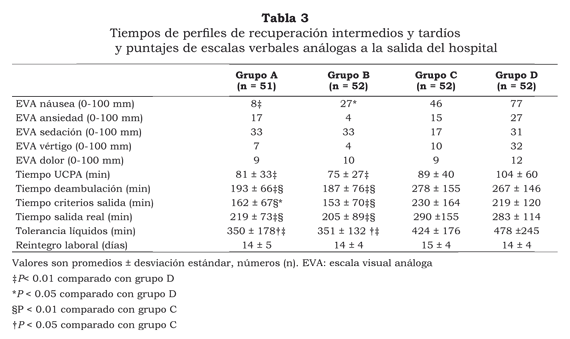
La evaluación llevada a cabo a las 24 horas reveló que la proporción de pacientes con una respuesta completa en este período fue significativamente mayor en el grupo metoclopramida - dexametasona en comparación con los grupos metoclopramida sola y placebo y de igual forma en el grupo dexametasona sola en comparación con el grupo de metoclopramida sola. La proporción de tratamientos fallidos en los grupos metoclopramida y placebo fueron similares. (tabla 2). No existieron diferencias en el tiempo de reintegro laboral (tabla 3). y no se registró evidencia de infección en la herida quirúrgica en ninguno de los 208 pacientes participantes.
DISCUSIÓN
Este estudio demostró que la administración de dexametasona como medicamento único, es igualmente efectiva que la combinación de metoclopramida- dexametasona para prevenir la náusea y el vómito postoperatorios en pacientes ambulatorios llevados a procedimientos otorrinolaringológicos. Esto significa que la adición de metoclopramida no confiere ninguna ventaja adicional en la profilaxis de este evento secundario. También se demuestra que la metoclopramida administrada como agente antiemético único profiláctico, es comparable a placebo.
El presente estudio estableció que la dexametasona administrada antes de la inducción anestésica se asoció a una reducción en la incidencia de tratamiento antiemético profiláctico fallido en un 35% (incidencia de tratamiento fallido basal del 44.2% vs 9.6% en el grupo dexametasona) y de un 31% cuando se adicionó metoclopramida. Esta reducción es superior a la del 26% reportada en un estudio multifactorial que comprendió multiplicidad de factores de riesgo para NVPO y procedimientos quirúrgicos7.
Nuestro estudio también estableció una incidencia de NVPO del 44.2% en el grupo placebo, menor de lo demostrado por Apfel (incidencia del 59%), entre aquellos pacientes que no recibieron tratamiento antiemético profiláctico y en quienes se administró anestésico volátil, óxido nitroso y fentanyl7. Es de anotar que en el mencionado estudio, los procedimientos otorrinolaringológicos tuvieron la mas alta incidencia de NVPO (14.3%)12,13,14. Es por ello que nuestra población estudiada representa un riesgo basal de NVPO clínicamente relevante. Sorprendentemente, nuestra incidencia de náusea en la UCPA fue muy similar a la de emesis, a diferencia de lo usualmente reportado13,15.
La dexametasona ha demostrado ser más efectiva como profiláctico antiemético cuando se administra durante la inducción anestésica8,16,17. Existen varias razones por las que este momento de aplicación parece ser especialmente efectivo para reducir los síntomas emetizantes: se asocia a una reducción pre-incisional de los niveles de 5-hidroxitriptofano en tejido neural mediante la depleción de su precursor triptofano17; las propiedades antiinflamatorias de los corticoides antes de la incisión quirúrgica pueden prevenir la liberación de serotonina en el tracto digestivo18; y es posible que la administración precoz de dexametasona pueda potenciar los efectos de otros antieméticos mediante la sensibilización de receptores farmacológicos19.
Existe evidencia indirecta de que la metoclopramida puede ser más efectiva como profiláctico antiemético cuando se administra al final de la cirugía20. Ferrari y Donlon determinaron que 0.15 mg/kg de metoclopramida administrada al arribo a la UCPA era un antiemético profiláctico efectivo en niños llevados a adenoidectomía21. En contraste, Furst et al no pudieron demostrar eficacia antiemética cuando 0.5 mg/kg de metoclopramida se administraba inmediatamente después de la inducción anestesica22.
El comportamiento de la metoclopramida como profiláctico antiemético en este estudio es concordante con resultados de trabajos previos: a dosis de 10 mg IV no posee efectos antieméticos clínicamente relevantes10. Es muy probable que la dosis utilizada en este estudio (que es la que se utiliza rutinariamente en la práctica clínica) sea baja23. Su efecto sobre receptores 5-HT3 parece ser dosis dependiente y la mínima dosis para bloquear este tipo de receptores es desconocida23. Se requieren por tanto evaluaciones posteriores para determinar la dosis óptima de metoclopramida en combinación con dexametasona para la prevención de NVPO sin que exista bloqueo inadecuado de receptores dopaminérgicos, situación que se asocia a la presentación de los efectos extrapiramidales indeseables.
Este estudio evaluó los resultados del tratamiento en dos diferentes períodos de tiempo. La eficacia a corto plazo tiene un impacto económico principalmente en el área ambulatoria13. Los resultados positivos a largo plazo son los mejores indicadores de la actividad antiemética y del bienestar del paciente24. El presente estudio corrobora la eficacia antiemética temprana y tardía de la dexametasona al compararla con placebo informada en una reciente revisión sistemática cuantitativa8. Sin embargo, hasta el momento no se han reportado resultados acerca de la eficacia de la combinación metoclopramida-dexametasona en la profilaxis de náusea y vómito postoperatorios. Por el contrario, la utilización de esta adición es puramente anecdótica y de hecho ha sido adoptada en protocolos de profilaxis antiemética en varios Departamentos de Anestesiología en nuestro país.
CONCLUSIONES
En conclusión, la combinación de dexametasona con metoclopramida no es significativamente más efectiva que la administración de dexametasona sóla en la profilaxis de NVPO en pacientes llevados a cirugía otorrinolaringológica. Por ello, deberían considerarse otros agentes antieméticos tales como haloperidol y antiserotoninérgicos, adicionados a dexametasona para incrementar su efectividad antiemética profiláctica13,25. La metoclopramida a dosis de 10 mg IV no posee efectos antieméticos profilácticos; el hecho de que esta medicación sea el único antiemético profiláctico aprobado por el Plan Obligatorio de Salud debe ser reconsiderado11.
Agradecimientos
Los autores agradecen a los anestesiólogos y residentes del Departamento de Anestesiología del Hospital Universitario de San Ignacio por su colaboración en el enrolamiento de pacientes y recolección de datos, así como a las enfermeras jefes y auxiliares de la sala de recuperación postanestésica y unidad quirúrgica ambulatoria, por su ayuda en la evaluación de síntomas emetizantes y perfiles de recuperación de los pacientes participantes.
Agradecemos a la Doctora Soledad Cepeda, Profesora titular de Anestesiología y Epidemiología Clínica, por su colaboración en el análisis estadístico del presente estudio.
BIBLIOGRAFÍA
1. White PF, O´Hara JF, Roberson CR, et al. The impact of current antiemetic practices on patient outcomes: a prospective study on high-risk patients. Anesth Analg 2008;107:452-8. [ Links ]
2. White PF, Watcha MF. Postoperative nausea and vomiting: prophylaxis versus treatment. Anesth Analg 1999;89:1337-9. [ Links ]
3. Practice guidelines for postanesthetic care. A report by the American Society of Anesthesiologists Task Force on Postanesthetic Care. Anesthesiology 2002;96:742-52. [ Links ]
4. Gan TJ, Sloan F, Dear Gde, et al. How much are patients willing to pay to avoid postoperative nausea and vomiting? Anesth Analg 2001;92:393-400. [ Links ]
5. Gan TJ, Meyer T, Apfel CC, et al. Consensus guidelines for managing postoperative nausea and vomiting. Anesth Analg 2003;97:62-71. [ Links ]
6. Watcha MF. The cost-effective management of postoperative nausea and vomiting. Anesthesiology 2000;92:931-3. [ Links ]
7. Apfel CC, Korttila K, Abdalla M, et al. A factorial trial of six interventions for the prevention of postoperative nausea and vomiting. N Engl J Med 2004;350:2441-51. [ Links ]
8. Henzi I, Walder B, Tramèr MR. Dexamethasone for the prevention of postoperative nausea and vomiting: a quantitative systematic review. Anesth Analg 2000;90:186-94. [ Links ]
9. Sanger GJ, King FD. From metoclopramida to selective gut motility stimulants and 5-HT3 receptor antagonists. Drug Des Delivery 1988;3:273-95. [ Links ]
10. Henzi I, Walder B, Tramèr MR. Metoclopramide in the prevention of postoperative nausea and vomiting: a quantitative systematic review of randomized, placebo-controlled studies. Br J Anaesth 1999;83:761-71. [ Links ]
11. Medicamentos no POS. http://www.minproteccionsocial.gov.co/vbecontent/News [ Links ]
12. Wu CL, Berenholtz SM, Pronovost PJ, et al. Systematic review and analysis of postdischarge symptoms after outpatient surgery. Anesthesiology 2002;96:994-1003. [ Links ]
13. Gan TJ, Meyer TA, Apfel CC, et al. Society for ambulatory anesthesia guidelines for the management of postoperative nausea and vomiting. Anesth Analg 2007;105:1615-28. [ Links ]
14. Sinclair CR, Chung F, Mezei G. Can postoperative nausea and vomiting be predicted? Anesthesiology 1999;91:109-17. [ Links ]
15. Tramér MR. A rational approach to the control of postoperative nausea and vomiting: evidence from systematic reviews. Part I: efficacy and harm of antiemetic interventions, and methodological issues. Acta Anaesthesiol Scand 2001;45:4-13. [ Links ]
16. Habib AS, Gan TJ. Evidence-based management of postoperative nausea and vomiting: a review. Can J Anesth 2004; 51:326-41. [ Links ]
17. Young S. Mechanismof decline in rat brain 5-hydroytryptamine after induction of liver tryptophan pyrrolaseby hydrocortisone: roles of tryptophane catabolism and kynurenine synthesis. Br J Pharmacol 1981;74:695. [ Links ]
18. Frederikson N, Hursti T, Fürst C. Nausea in cancer chemotherapy is inversely related to urinary cortisol excretion. Br J Cancer 1992;65:779-80. [ Links ]
19. Sagar S. The current role of anti-emetic drugs in oncology: a recent revolution in patient symptom control. Cancer Treat Rev 1991;18:95-135. [ Links ]
20. Bateman DN. Clinical pharmacokinetics of metoclopramide. Clin Pharmacokinet 1983;8:523-9. [ Links ]
21. Ferrari LR, Donlon JV. Metoclopramide reduces the incidence of vomiting after tonsillectomy in children. Anesth Analg 1992;75:351-4. [ Links ]
22. Furst SR, Rodarte A. prophylactic antiemetic treatment with ondansetron in children undergoing tonsillectomy. Anesthesiology 1994;81:799-803. [ Links ]
23. Saller R, Hellenbretch D, Hellstern A, HessH. Improved benefit/risk ratio of higher-dose metoclopramide therapy during cisplatin-induced emesis. Eur J Clin Pharmacol 1985;29:311-12. [ Links ]
24. White PF, Sacan O, Nuangchammong N, et al. The relationship between patient risk factors and early versus late postoperative emetic symptoms. Anesth Analg 2008;107:459-63. [ Links ]
25. Chu CC, Shie JP, Tzeng JI, et al. The prophylactic effect of haloperidol plus dexamethasone on postoperative nausea and vomiting in patients undergoing laparoscopically assisted vaginal hysterectomy. Anesth Analg 2008;106:1402-6. [ Links ]













