Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.37 no.1 Bogotá Jan./Mar. 2009
SERIE DE CASOS
Craneotomia con paciente despierto para resección de tumores cerebrales
Luis Fernando González, MD.*, Fredy Ariza Cadena, MD. MSc.*, Ernest Senz, MD.**, Juan Alfonso Uribe MD.**, Fernando Velázquez, MD.**
* Departamento de Anestesiología, Reanimación y Clínica del Dolor. luisfergonar@gmail.com
** Departamento de Neurocirugía. Fundación Valle del Lili, Cali, Colombia
Recibido para publicación febrero 03 de 2009. Aceptado para publicación abril 14 de 2009.
RESUMEN
La craneotomía realizada bajo bloqueo de los nervios del escalpe junto con sedación conciente, busca mantener las funciones de áreas elocuentes mientras se realiza intervención para resección de masas vecinas o mapeo epileptogénico. Se revisó nuestra base de datos en búsqueda de pacientes llevados a craneotomía en estado de vigilia durante los últimos 10 años. Esta serie de casos pretende comentar la experiencia acumulada, los principales inconvenientes observados durante su implementación y cómo estos fueron solucionados a través del tiempo. Se encontraron 9 pacientes, todos programados para resección de tumores de la glía, quienes fueron previamente instruidos sobre lo que se esperaba durante el intraoperatorio. Las cirugías fueron realizadas sin requerir cambios en la técnica anestésica en tanto que no se presentaron complicaciones mayores.
Palabras Clave: Craneotomía, paciente despierto, tumores cerebrales, técnicas anestésicas, sedación, bloqueo del escalpe.
SUMMARY
Craniotomy with the patient under conscious sedation and blockade of the scalp nerves, aims to preserve functionality of eloquent cortex areas while resection of tumors or epilepsy mapping are achieved. We reviewed our institutional database, looking for patients who underwent to awake craniotomy in the last 10 years. This case report resumes the accumulated experience, main observed problems during its implementation and how these were resolved through time. We found 9 patients, all of them scheduled to glial brain tumor resections, whom where previously instructed in the preanesthetic assessment about the different intraoperative situations. Procedures were doing without changes in the anesthetic technique or major events.
Keywords: Craniotomy, awake pacient, brain tumors, anesthetic techniques, sedation, blockade of the scalp.
INTRODUCCIÓN
La craneotomía con el paciente despierto (CPD) se describe como un procedimiento ideal en aquellos pacientes con lesiones expansivas localizadas cerca de áreas elocuentes cerebrales. Penfield en 1954 describió por primera vez las consideraciones anestésicas durante la craneotomía con paciente despierto usando anestésicos locales y bolos de pentotal sódico, si las condiciones de paciente lo permitían. Recientemente Meyer et al. ha publicado sus resultados con esta técnica que incluye resecciones agresivas de tumores que comprometen áreas elocuentes. El desarrollo de nuevos medicamentos para sedación conciente, el dominio depurado en las técnicas quirúrgicas, al igual que una mayor disponibilidad de métodos avanzados de diagnóstico y monitoria, hacen que esta alternativa sea posible2,3,4. Nuevas técnicas de mapeo del lenguaje denominadas "mapeo negativo" han mostrado excelentes resultados en cuanto a la extensión del área resecada sin necesidad de identificar sitios de lenguaje inducidos por estimulación dentro del campo de exposición5.
Existen dos razones fundamentales para realizar una CPD. La primera radica en la necesidad de realizar evaluaciones funcionales de manera secuencial en el intraoperatorio. La segunda, el deseo por minimizar la interferencia inducida por medicamentos en el registro intraoperatorio del electrocorticograma6. El primer objetivo busca preservar áreas elocuentes cerebrales (sensitivas, motoras o del lenguaje) cuando se realizan resecciones de lesiones en zonas cercanas a estas, mientras que el segundo objetivo se refiere al estudio intraoperatorio de pacientes con epilepsia intratable en quienes la resección quirúrgica del foco epileptogénico es la única solución posible.
En el caso específico de los tumores gliales, existe controversia en cuanto al pronóstico generado por las resecciones parciales versus las realizadas de manera agresiva (radical)7,8. Se discuten ventajas teóricas de la resección total de los tumores que implican disminución en la posibilidad de hipertensión endocraneana, disminución de las tasas de pleomorfismo en aquellos tumores de bajo grado, disminución de la masa tumoral con mejor respuesta a la terapia coadyuvante. Por otro lado se critica de estas, la posibilidad de déficit neurológico permanente que pueda impactar sobre la calidad de vida del paciente a corto y a largo plazo.
PACIENTES Y METODOS
Se revisaron los registros perioperatorios de los pacientes programados para CPD realizados en nuestra institución, durante el periodo comprendido entre el 1 de enero de 1998 y 1 de abril de 2008. Se hizo una búsqueda de los aspectos perioperatorios relevantes que incluyeron la indicación quirúrgica, la técnica de craneotomía utilizada, los tipos de bloqueo realizados, fármacos utilizados durante la sedación conciente y las principales complicaciones presentadas en el intraoperatorio. Los datos fueron tabulados en una hoja electrónica (Microsoft® Office Excel 2007 SP1 MSO, Microsoft Corporation). El análisis incluyó una parte descriptiva inicial que englobaba aspectos técnicos especialmente de las técnicas de bloqueo utilizadas y las técnicas de sedación. Aquellos datos que podían ser analizados como variables categóricas fueron incluidos y analizados en un programa estadístico (STATA SE 9.0., Texas USA) para análisis de frecuencias.
RESULTADOS
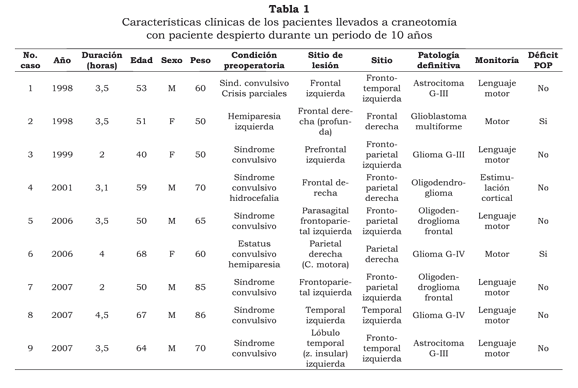
Se recolectó la información de 10 pacientes realizados durante este periodo pero uno fue excluido del análisis por considerar que los datos intraoperatorios fueron anotados de manera incompleta. Todos los pacientes fueron analizados previamente a la cirugía en junta quirúrgica, en donde se decidió la posibilidad de CPD. En su totalidad fueron personas mayores de 18 años, sin discapacidad física que fueron interrogados sobre su posibilidad para cooperar y que dieron su autorización para realizar el procedimiento (Tabla 1).
Consideraciones Quirúrgicas
Para el procedimiento se tuvieron en cuenta aspectos que incluían el aseguramiento del confort por parte del paciente (posición semisentada lo más cómoda posible, protección de los sitios de presión en cuello, espalda y miembros) y la posibilidad de fácil interacción con el equipo quirúrgico para la evaluación del estado de conciencia, lenguaje, actividad motora y permeabilidad de la vía aérea en caso de abordajes de emergencia9,10.
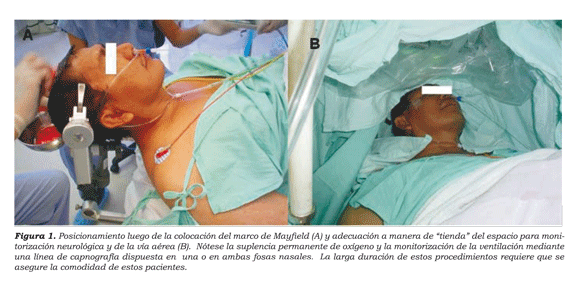
Posterior a los bloqueos de nervios del escalpe (ver más adelante la descripción detallada), la cabeza fue fijada con pines a un sistema de cabezal de Mayfield® para evitar los movimientos durante el intraoperatorio y así maximizar la precisión de la resección (figura 1).
Consideraciones Anestésicas
El proceso inició con una valoración preanestésica exhaustiva en donde se trató de entablar un vínculo basado en la confianza entre el paciente y el anestesiólogo. Allí se evaluó su capacidad para soportar procedimientos prolongados y su examen físico se enfocó principalmente en la verificación de los parámetros de la vía aérea ya que una vía aérea difícil podría contraindicar el procedimiento por su alto riesgo a la hora de perder la ventilación espontánea durante el intraoperatorio.
Ninguno de los pacientes recibió premedicación. El día del procedimiento fueron sometidos a bloqueo anestésico de los nervios del escalpe bajo sedación, utilizando en principio, medicamentos que pudieran ser revertidos en el momento de su evaluación funcional (remifentanilo, fentanilo y midazolam).
Durante el intraoperatorio se tuvo especial consideración de cuatro complicaciones intraoperatorias descritas con esta técnica:
1. Dolor: Especialmente durante el posicionamiento del marco de Mayfield®, y la disección del músculo temporal. La tracción de la duramadre también puede generar dolor si esta no es adecuadamente bloqueada con anestésico local por parte del neurocirujano al momento de la disección de estas estructuras.
2. Obstrucción de la vía aérea: Desencadenada por sedación excesiva cuando la analgesia es inadecuada.
3. Nausea y vómito: Secundaria a manipulación quirúrgica de la duramadre, el lóbulo temporal o la amígdala. Se debe también poner especial atención sobre la inadecuada analgesia y la hipovolemia que también pueden inducirlos.
4. Convulsiones: Pueden suceder durante la estimulación cortical. Siempre habrá que descartar toxicidad relacionada con anestésicos locales.
La monitoria intraoperatoria utilizada incluyó un trazado electrocardiográfico continuo en derivación DII, oximetría de pulso, capnografía continua a través de una cánula nasal de oxigeno (ver figura), una línea arterial radial para evitar las incómodas tomas sucesivas y garantizar la monitoria continua de la presión arterial y la toma de laboratorios intraoperatorios en caso de necesidad. Así mismo a todos los pacientes se les colocó una sonda vesical para evaluación de la diuresis horaria.
La monitoria cortical se realizó con un estimulador de Ojemann, iniciando con estímulos bajos de 3-10 mA, corriente constante de 60 Hz y onda bifásica cuadrada de un segundo de duración. La corteza fue estimulada sobre la anormalidad de la señal de T2 y 2 cms. de corteza adyacente, si un estimulo fue positivo este fue estimulado en dos oportunidades adicionales y la corteza estimulada fue considerada funcional. La corteza con estimulación negativa fue incluida en la resección del tumor11.
La evaluación del lenguaje y las funciones de asociación fueron evaluadas mediante la identificación de figuras, lectura de pequeños párrafos y el conteo de números de dos en dos de adelante y hacia atrás, y viceversa.
TÉCNICA DE BLOQUEO PARA LOS NERVIOS DEL ESCALPE
El bloqueo de los nervios comprendió seis punciones en cada lado, en donde cada sitio a bloquear se infiltró con dos o tres centímetros de bupivacaina al 0,5% con epinefrina. Se tuvo especial énfasis en la detección de síntomas tempranos de toxicidad por anestésicos locales ya que el bloqueo en anillo de los nervios craneales requiere grandes volúmenes12,13.
El bloqueo incluyó los siguientes troncos nerviosos:
a. auriculotemporal: Localizado entre la unión ósea y cartilaginosa de la pared anterior del canal auditivo externo. Se extiende sobre la raíz posterior del zigoma y la parte palpable de la arteria temporal superficial.
b. zigomático-temporal: Localizado en la parte media del trayecto entre el nervio auriculotemporal y el nervio supraorbitario, por encima del cigoma.
c. supraorbitario: Este nervio emerge a través de una escotadura localizada en el borde superior de la órbita. Se puede palpar a nivel del punto medio del arco ciliar.
d. supratroclear: Se encuentra por dentro del borde medial del párpado a nivel de la base de la nariz, inmediatamente por debajo del ángulo supero-medial de la órbita.
e. occipital menor: Este nervio es la primera rama del plexo cervical y emerge del borde posterior del esternocleidomastoideo aproximadamente en el punto medio irradiándose en dirección cefálica y posterior.
f. occipital mayor: Ramo posterior el plexo occipital. Se bloquea en un punto localizado en una línea trazada entre la protuberancia occipital y el proceso mastoideo en su tercio externo. Puede algunas veces ser localizado palpando la arteria occipital porque su trayecto es adyacente a este vaso.
g. bloqueo de las meninges: Este bloqueo es realizado por el neurocirujano en el momento en que realiza la craneotomía y pretende bloquear los nervios que inervan las meninges, los cuales discurren adyacentes a los ramos de la arteria meníngea media.
Los Medicamentos usados para la sedación de estos pacientes incluyeron aquellos considerados de vida media corta, que pudieran ser revertidos con flumazenil o naloxona. Algunos de los pacientes requirieron bolos pequeños de propofol (20-30 mg según respuesta), infusiones de remifentanilo entre 0.05 y 0.1 mcg/kg/min o midazolam en bolo inicial de 2-3 mg y bolos adicionales de 1-2 mg. Todos los pacientes recibieron terapia multimodal para profilaxis de nausea y vomito con dexametasona 4 mgs y ondansetrón (0.1 mg/kg).
COMPLICACIONES
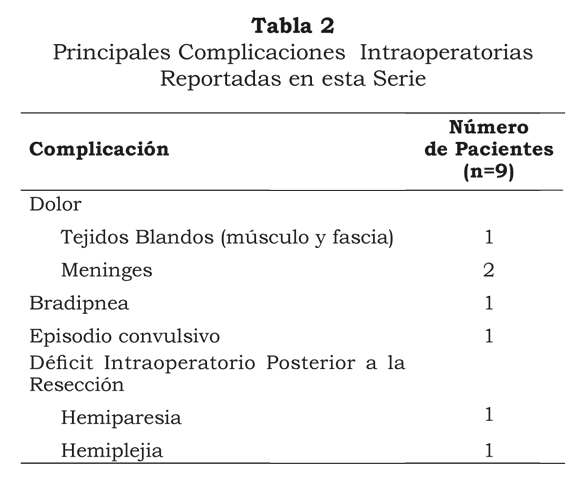
En esta serie de casos no se presentaron muertes perioperatorias. Ninguno de los pacientes presentó dolor al momento de colocación del marco de Mayfield o nausea y/o vómito intraoperatorios.
Un paciente presentó dolor durante la disección del músculo temporal para una craneotomía temporal. Esta complicación fue manejada con infiltración adicional sobre la masa muscular, pudiéndose continuar el procedimiento.
Dos pacientes presentaron dolor durante la realización de la craneotomía, asociado a contacto del craneótomo con las meninges. Esta complicación fue manejada aumentando la analgesia con opioides endovenosos (remifentanilo o fentanilo según fuera el caso) e induciendo sedación transitoria durante esta fase de la disección.
Uno de los pacientes presentó un episodio de bradipnea asociado a opioides que fue manejado adecuadamente con naloxona sin requerir otras medidas avanzadas para el manejo de la vía aérea.
Un paciente presentó un episodio convulsivo asociado a infiltración meníngea con anestésicos locales (lidocaína sin epinefrina), el cual fue manejado adecuadamente con tiopental sódico en dosis de 1mg/kg sin requerir manipulación adicional de la vía aérea ya que se procuró en este caso no abolir la ventilación espontánea.
Dos pacientes evidenciaron déficit motor intraoperatorio luego de la resección. De estos, una mujer de 51 años con una hemiparesia izquierda preoperatoria explicada por compromiso tumoral, presentó empeoramiento de su compromiso motor con hemiplejia ipsilateral. El segundo paciente, también de sexo femenino y 68 años de edad con un síndrome convulsivo de difícil manejo y quien recientemente había sido hospitalizada por un estatus convulsivo secundario a un glioma grado IV, inmediatamente luego de la resección refirió hemiparesia izquierda. Ninguno de los pacientes presentó déficit sensitivo o del lenguaje. (Tabla 2).
La realización de CPD es una importante opción en el manejo quirúrgico de pacientes con tumores localizados en áreas elocuentes cerebrales que plantean el dilema quirúrgico entre la resección amplia con el riesgo implícito de discapacidad importante en el paciente, o una resección incompleta, no muy amplia con un paciente sin discapacidad pero con un gran riesgo de recidiva tumoral. Hemos descrito nuestra experiencia con estos pacientes encontrando que con esta técnica se pueden obtener excelentes condiciones funcionales postoperatorias al tiempo que se han permitido resecciones amplias con bordes libres de tumor.
Las complicaciones descritas en esta serie de casos coinciden con las publicadas por otros grupos14,15 aunque llama la atención que ninguno de los pacientes presentó falla ventilatoria o necesidad de dispositivos para la asistencia ventilatoria, probablemente debido a que la sedación realizada utilizó en mucha menor proporción fármacos como propofol o tiopental de manera secuencial. Esto fue posible, gracias a la importancia que se dio al bloqueo de los nervios del escalpe y a las medidas para garantizar la comodidad de los pacientes, minimizando la exposición a opioides y la necesidad de sedación intensa.
En el caso específico de aparición de dolor durante la craneotomía relacionado con la estimulación de áreas de rica inervación como las meninges, tuvimos una adecuada respuesta mediante el reforzamiento de la analgesia endovenosa con opioides. Es conveniente recordar que en este momento no es posible infiltrar directamente las meninges con anestésico local puesto que no hay espacio disponible para abordar directamente estas estructuras, al tiempo que el bloqueo de los nervios del escalpe no previene la aparición de este dolor de tipo incidental por estimulación directa. Por tanto, el único recurso disponible radica en la analgesia endovenosa. Sin embargo, el riesgo latente de bradipnea/apnea, especialmente con los bolos de opioides hace necesaria la disponibilidad inmediata de antagonistas en la sala de cirugía ante esta eventualidad y en el momento de la evaluación de funciones corticales. Lo mismo es válido en el caso de las benzodiacepinas.
La monitorización de la actividad consciente mediante índice biespectral (BIS) o entropía durante CPD es cada vez más utilizada, con el objeto de titular de manera más exacta la administración de fármacos para analgesia y sedación durante el intraoperatorio. Sinha et al. encontraron una disminución significativa en el consumo de medicamentos y una tendencia menor en la frecuencia de eventos adversos intraoperatorios (depresión respiratoria/sedación profunda) cuando se utilizó monitoría de la conciencia con BIS15. Por otra parte, se han dado importantes avances en el conocimiento de los mecanismos de acción de medicamentos fácilmente titulables como remifentanilo y dexmedetomidina cuando se requieren evaluaciones neurocognitivas sofisticadas o en aras de aumentar la seguridad durante el procedimiento16,17,18.
Las resecciones en el hemisferio dominante próximo a áreas del lenguaje, son particularmente difíciles por el riesgo particular de afasia o síndromes de desconexión. El monitoreo intraoperatorio utilizado para identificar áreas cerebrales funcionales permite la resección de tumores con un índice reducido de morbilidad. Además de la estimulación cortical, la evaluación continua de las funciones cognitivas, motoras y del lenguaje se constituyen en una herramienta valiosa cuando la resección del tumor se profundiza a los tractos de la sustancia blanca donde pudieran existir proyecciones axonales originadas en el área elocuente potencialmente comprometida. Esta evaluación permanente en el intraoperatorio ha demostrado ser de capital importancia para minimizar la posibilidad de afasia cuando estos tumores se localizan especialmente en la corteza insular izquierda dominante.
Con la presentación de esta serie de casos podemos concluir que la craneotomia con paciente despierto para resección de lesiones no solamente relacionadas con focos epileptogénicos es hoy en día un abordaje lógico y real, que permite realizar resecciones amplias y seguras para el paciente, minimizando los riesgos de secuelas neurocognitivas funcionales serias y ofreciendo una calidad de vida postoperatoria cercana a la ideal. Se requiere una coordinación dinámica de todo el equipo quirúrgico en la elección de los individuos aptos para la realización de estos procedimientos, en tanto que existan los mecanismos necesarios para disminuir la posibilidad de eventos serios intraoperatorios. El advenimiento de nuevos abordajes farmacológicos para sedación y analgesia consciente plantean una ayuda invaluable a la hora de manejar estos pacientes, de quienes se requiere la mayor colaboración posible siempre y cuando nuestra intención por garantizar un intraoperatorio confortable y seguro se lleve a cabo con éxito.
BIBLIOGRAFÍA
1. Penfield W, Pasquet A. Combined regional and general Anaesthesia for craniotomy exploration. Anaesth-Analg-1954;33:145-164. [ Links ]
2. Frost EA, Booij LH. Anesthesia in the patient for awake craniotomy. Curr Opin Anaesthesiol. 2007;20(4):331-5. [ Links ]
3. Sato K, Kato M. Intraoperative neurological monitoring in awake craniotomy.J Anesth. 2008;22(4):493-7. [ Links ]
4. Ulu MO, Tanriöver N, Ozlen F, Sanus GZ, Tanriverdi T, Ozkara C, Uzan M. Surgical treatment of lesions involving the supplementary motor area: clinical results of 12 patients. Turk Neurosurg. 2008 Jul;18(3):286-93. [ Links ]
5. Sanai N, Mirzadeh Z, Berger MS. Functional outcome after language mapping for glioma resection. N Engl J Med. 2008 Jan 3;358:18-27. [ Links ]
6. Herrik IA, Gelb A. Awake Craniotomy. En: Whitwam JG, McCloy RF. Principles and practice of sedation. Second Edition; 1998:168-177. [ Links ]
7. Meyer FB, Bates LM, Goerss SJ, Friedman JA, Windschitl WL, Duffy JR, Perkins WJ, O'Neill BP. Awake craniotomy for aggressive resection of primary gliomas located in eloquent brain. Mayo Clin Proc. 2001 Jul;76:677-87. [ Links ]
8. Lanier WL. Brain tumor resection in the awake patient. Mayo Clin Proc. 2001;76:670-2. [ Links ]
9. Girvin JP. Neurosurgical considerations and general methods for craniotomy under local anesthesia. Int Anesthesiol Clin.1986;24:89-114. [ Links ]
10. Manninen P, Contreras J. Anesthetic consideration for craniotomy in awake patients. Int Anesthesiol Clin. 1986;24:157-74. [ Links ]
11. Ojemann GA. Mapping of neuropsychological language parameters at surgery. Int Anesthesiol Clin. 1986;24:115-31. [ Links ]
12. Pinosky ML, Fishman RL, Reeves ST, Harvey SC, Patel S, Palesch Y, Dorman BH. The effect of bupivacaine skull block on the hemodynamic response to craniotomy. Anesth Analg.1996;83:1256-61. [ Links ]
13. Costello TG, Cormack JR. Anaesthesia for awake craniotomy: a modern approach. J Clin Neurosci. 2004;11:16-9. [ Links ]
14. Piccioni F, Fanzio M. Management of anesthesia in awake craniotomy. Minerva Anestesiol. 2008; 74(7-8):393-408. [ Links ]
15. Sinha PK, Koshy T, Gayatri P, Smitha V, Abraham M, Rathod RC. Anesthesia for awake craniotomy: A retrospective study. Neurol India. 2007;55:376-81. [ Links ]
16. Sarang A, Dinsmore J. Anaesthesia for awake craniotomy--evolution of a technique that facilitates awake neurological testing. Br J Anaesth. 2003;90:161-5. [ Links ]
17. Mack PF, Perrine K, Kobylarz E, Schwartz TH, Lien CA. Dexmedetomidine and neurocognitive testing in awake craniotomy. J Neurosurg Anesthesiol. 2004;16:20-5. [ Links ]
18. Frost EA, Booij LH. Anesthesia in the patient for awake craniotomy. Curr Opin Anaesthesiol. 2007;20:331-5. [ Links ]













