Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.37 no.2 Bogotá Apr./June 2009
La variación del volumen celular bajo diferentes concentraciones de solución salina (NaCL)
Cell volume variation under different concentrations of saline solution (NaCl)
Mario J. García*, Angel M. Ardila**
* MD, Anesthesiologist. email: mjgarciam@hotmail.com
** Physics, Phd Physics Department, Faculty of Sciences Universidad Nacional de Colombia, Bogotá, Colombia
Recibido para publicación abril 30 de 2009. Aceptado para publicación julio 6 de 2009.
RESUMEN
Introducción: Dentro de las prácticas clínicas, es de suma importancia conocer la relación volumétrica entre la contracción celular y la concentración de solución salina (NaCl).
Métodos: Muestras de sangre por parte de voluntarios que gozan de buena salud fueron expuestas a diferentes concentraciones de NaCl, las cuales oscilan entre 0.42% a 11.70%, observándose la variación resultante en el hematocrito. Se estudió la variación del volumen celular como función de la correspondiente concentración de NaCl. Se llegó a establecer una ecuación que predice teóricamente el comportamiento observado.
Resultados: Examinamos 53 muestras de sangre provenientes de 12 voluntarios sanos. La relación entre la contracción celular y la concentración de NaCl muestra que la máxima contracción del volumen celular se obtiene cuando el NaCl está en alrededor de 5.85%. Se resume el modelo matemático resultante en la ecuación. ΔV denota la variación celular a la correspondiente concentración de NaCl. Este modelo presenta un coeficiente de regresión lineal de 0.996 y aplicando el Chi-square goodness of fit test [es una prueba estadística] se observa un nivel de confianza superior a 99.5%. Igualmente, es menester mencionar que las concentraciones de NaCl iguales o superiores a 7.02% provoca cierto grado de hemólisis.
Conclusiones: No hay razón para utilizar concentraciones de NaCl superiores a 5.85%. Concentraciones más altas no inducen una mayor contracción del volumen celular, pero sí provocan lesión celular.41CV=Δ.
Palabras clave: Tamaño de la célula, solución salina, hemolisis, células sanguíneas (Fuente: DeCS).
ABSTRACT
Background: It is very important to know the volumetric relation between the cellular contraction and the concentration of saline solution (NaCl) used in clinical practice.
Methods: Blood samples of healthy volunteers were exposed to different concentrations of NaCl ranging from 0.42% to 11.70% and the resultant variation in the hematocrit was observed. The variation of the cellular volume as a function of the corresponding concentration of NaCl was studied. An equation theoretically predicting the observed behavior was obtained.
Results: We studied 53 blood samples of 12 healthy volunteers. The relationship between cellular contraction and the concentration of NaCl shows that the maximum contraction of cellular volume is obtained when NaCl is about 5.85%. The mathematical model derived is summarized in the 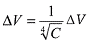 . means the cellular variation to the corresponding NaCl concentration. This model has a linear regression coefficient of 0.996 and applying chi-square goodness of fit test is observed a level of confidence superior to 99.5%. It was also noted that concentrations equal to or higher than 7.02% of NaCl provokes some degree of hemolysis.
. means the cellular variation to the corresponding NaCl concentration. This model has a linear regression coefficient of 0.996 and applying chi-square goodness of fit test is observed a level of confidence superior to 99.5%. It was also noted that concentrations equal to or higher than 7.02% of NaCl provokes some degree of hemolysis.
Conclusions: There is no reason to use concentrations of NaCl higher than 5.85%. Higher concentrations do not induce more contraction of cellular volume, but they do provoke cellular damage.
Key words: Cell volume, saline solution, hemolysis, blood cells (Source: MeSH, NLM).
INTRODUCCIÓN
Es bien conocido que el hematocrito describe la fracción de células dentro una muestra completa de sangre. En solución isotónica-o la solución salina normal-el volumen celular tiende a permanecer constante a pesar de la partícula permanente y el flujo de agua existente entre las áreas intra y extracelulares. En soluciones hipertónicas cierta cantidad de agua fluye de la célula, así disminuyendo el volumen celular hasta que se logra un balance entre las presiones osmóticas extra e intracelulares. Por otra parte, y dentro de las soluciones hipotónicas, la célula recibe un fluido de la región extracelular, causando un aumento en el volumen celular hasta que se equilibran las presiones osmóticas, tal como se observó en el caso anterior 1-3.
Dentro de la práctica clínica, se usan varios tipos de soluciones biocompatibles. 0.9% de NaCl es la solución (NaCl) que más se acerca a la isotónica. Sin embargo, no es inusual utilizar soluciones de NaCl que incluyan concentraciones de nivel hipoosmolar (0.45%) a nivel hiper-osmolar (7.5%). En la literatura médica, existen algunos informes sobre el uso de soluciones NaCl hasta un 23.4%4-6.
El impacto hemodinámico atribuido a soluciones hipotónicas se deriva del rescate de líquido que va del espacio intracelular hacia el espacio intravascular. Esta conclusión clínica esta soportada por múltiples estudios que enfatizan los efectos hemodinámicos de soluciones hipertónicas7-9.
Aunque el uso de soluciones hipertónicas va cada vez en aumento, particularmente en la neurocirugía y el trauma, existe poca investigación acerca del comportamiento volumétrico de las células cuando están sometidas a concentraciones cada vez mayores de NaCl.
En el presente trabajo experimental, las muestras de sangre de personas saludables estuvieron sometidas bajo diferentes concentraciones de NaCl, desde 0.42% hasta 11.7% y el hematocrito fue cuantificado posteriormente en un momento dado. El hematocrito cuantificado -obtenido dentro de las muestras que se mezclaron con las diferentes concentraciones de NaCl- fue comparado con el hematocrito basal (sangre sin mezclar). Luego se determinó el grado de variación resultante de cada concentración de NaCl utilizada.
METODOLOGÍA
El presente proyecto obtuvo la aprobación requerida de parte del ente revisor institucional y se llevó acabo de conformidad con la Declaración de Helsinki. La totalidad de los 12 participantes ofrecieron registrarse voluntariamente en la investigación. Todos firmaron un consentimiento prestado con un conocimiento completo acerca de la naturaleza y objetivo del estudio, incluyendo los riesgos a considerar.
Muestras de 20 cm3 de sangre fueron tomadas de personas para luego ser anti-coaguladas con 1000 unidades de heparina. Por otro lado, se prepararon tubos de ensayo con NaCl de diferentes concentraciones mediante soluciones comerciales de agua destilada, de 0.9% NaCl a 11.7% NaCl. 1 cm3 de sangre completa fue mezclada con 1 cm3 de cada concentración de NaCl preparada. Las muestras fueron entonces colocadas en tubos micro-hematocritos y luego puestas en un centrifugador por 10 minutos a 10.000 RPM.
En cada tubo micro-hematocrito el volumen de la sangre completa y el volumen celular fueron medidos en términos de lo largo en la correspondiente columna. Los resultados fueron tabulados estadísticamente y procesados. Finalmente, establecimos 53 asambleas [conjuntos] de 18 micro-hematocritos, lo cual incluyó los micro-hematocritos base (sangre sin diluir) junto con 17 muestras de micro-hematocritos adicionales diluidas en las diferentes concentraciones de solución salina.
Con base en los datos obtenidos se compararon las muestras de hematocritos -o sea, las que fueron diluidas con diferentes concentraciones de NaCl- con el correspondiente hematocrito base (muestras sin diluir) mediante la relación Hematocrito/ (Basal/2). Fue necesario compararlo contra Basal/2 pues al diluirse la muestra de sangre con NaCl, la relación fue de 1:1. Esto quiere decir que sólo debido a la dilución, el hematocrito cayó a la mitad de su valor real. Cualquier variación adicional obedece al equilibrio osmótico con la solución salina utilizada.
RESULTADOS
Se cuantificó el volumen total (VT) y el volumen globular (VG) de cada muestra. Tal como se afirmó anteriormente, la relación VG/VT (hematocrito) fue comparada con la correspondiente mitad del hematocrito basal mediante la ecuación Hematocrito/ (Basal/2). Vale la pena recalcar que se compara contra la mitad del hematocrito basal debido a que toda concentración diferente de NaCl hace que la concentración celular caiga a la mitad de ello sin considerar los efectos hipotónicos o hipertónicos de la solución. Como se puede esperar, esta ecuación -Hematocrito/( Basal/2)- indicó la variación del volumen celular dada por la tonicidad de la solución NaCl.
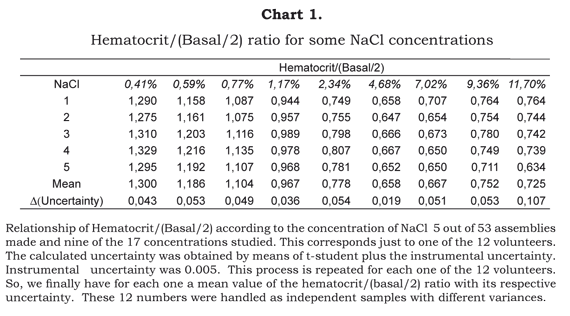
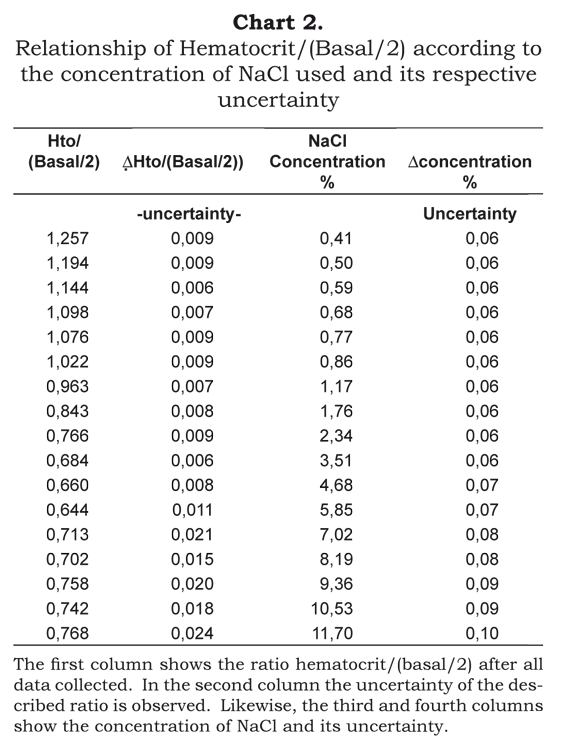
La Tabla 1 muestra el cálculo efectuado con nueve de las 17 concentraciones estudiadas y con cinco de las 53 asambleas. Estas cinco asambleas corresponden a uno de los 12 voluntarios que gozan de buena salud. Por tanto, por cada voluntario saludable, obtuvimos una relación promedio por estudiante de hematocrito/(basal/2) junto con su incertidumbre. Esta incertidumbre incluye la incertidumbre instrumental y la aleatoria. Más tarde, los promedios obtenidos por cada individuo con su respectiva incertidumbre fueron manejados estadísticamente como muestras independientes con diferentes variaciones. A partir de estos datos se elaboró la Tabla 2.
La Ilustración 1 muestra la relación de la ecuación Hematocrito/(Basal/2) versus la concentración de NaCl, una vez procesados los datos. La relación que se observa indica el aumento o disminución en el volumen celular como un índice del volumen base.
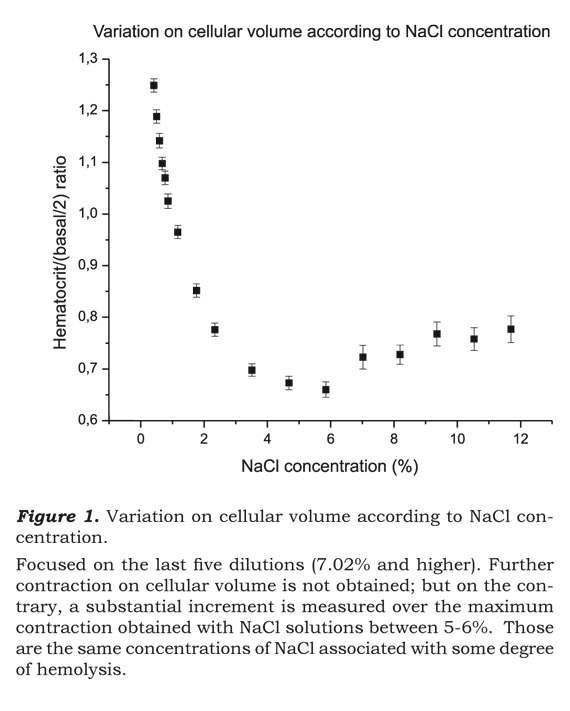
La ilustración 1 es muy notable pues las últimas cinco que se diluyeron -o sea, la correspondiente mezcla de sangre con 7.02%, 8.19%, 9.36%, 10.53 y 11.70% de solución NaCl- presentaron un importante incremento en el volumen celular con respecto al nivel más alto en términos contracción volumétrica obtenida cuando la mezcla de sangre se realizó utilizando concentraciones de NaCl cerca de 5%.
Al inspeccionarse la calidad de plasma en los tubos de micro-hematocrito correspondientes a lo diluido, ello presentó un colorido rojizo derivado my probablemente de la hemoglobina liberada al plasma por medio de los glóbulos rojos. Esto se puede observar claramente en la Ilustración 2.
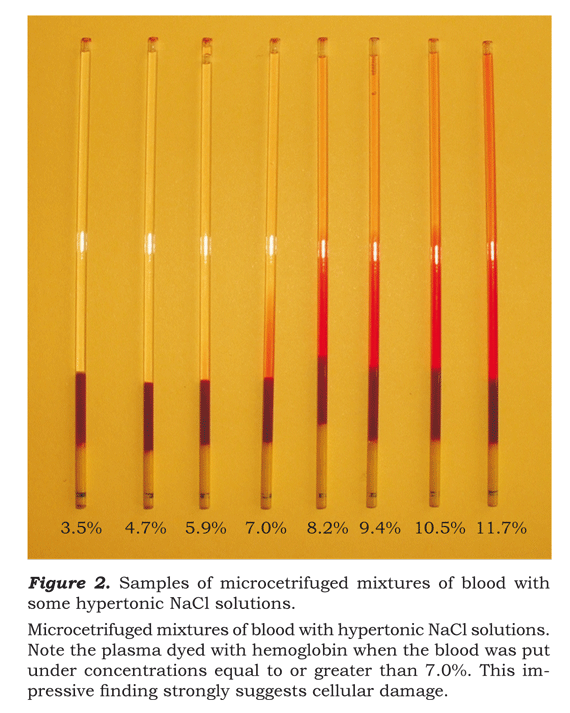
Es evidente que el aumento en la liberación de hemoglobina con soluciones NaCl es igual o mayor a 7.02%. Para algunas de las 53 muestras estudiadas, aun se presentaron puntos pequeños de hemoglobina libre cuando la concentración de NaCl fue de 5.85% pero en ningún caso se demostró este resultado con soluciones hipertónicas de NaCl menos que o igual a 4.68%.
Otro resultado extraordinario que se desprende de la Ilustración 1, es que la curva de contracción volumétrica de las células rojas se torna plana al estar bajo concentraciones cada vez mayores de NaCl, pues se da cuando la solución utilizada llega a niveles entre 5% y 6%. Todo lo cual nos indica que el argumento de rescatar mas volumen del espacio intracelular mediante la colocación de solución hipertónica adicional pierde peso y, por ende, no parece justificarse.
Al tomar en cuenta los resultados que se han descrito, según lo cual la concentración de NaCl de igual o mayor al 7.02% provocará un aumento en el volumen celular (cuando se compara con el efecto observado con soluciones de menor concentración) y una liberación de hemoglobina proveniente de las células rojas, nos permite suponer de manera razonable que este nivel de solución NaCl hipertónica puede causar daños celulares.
Tomando en cuenta que las últimas cinco diluciones mostraron características de lesión celular, nos dimos en la tarea de buscar un modelo matemático de análisis de regresión por el método de mínimos cuadrados (least squares) omitiendo estas últimas cinco diluciones. Este modelo nos permite predecir la variación del volumen celular según la concentración de NaCl en la cual la célula es viable.
Este modelo matemático resuelve la ecuación: 1.
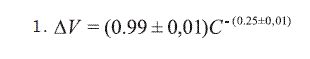
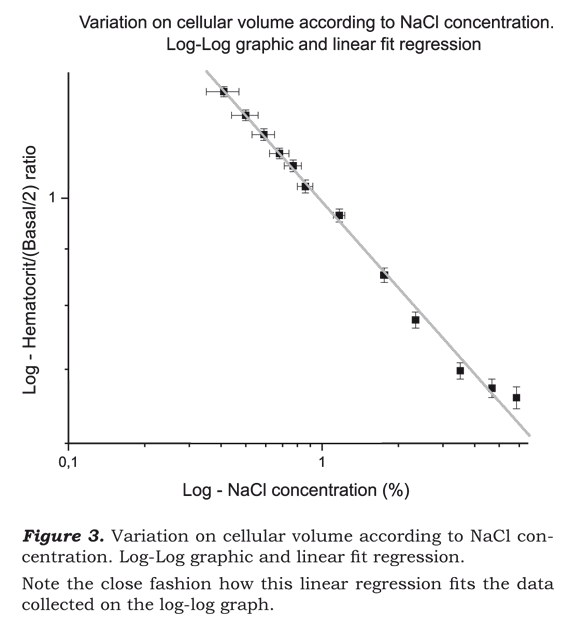
ΔV corresponde a la variación del volumen celular y C a la concentración de NaCl utilizada. Esta función presenta un coeficiente de regresión lineal de 0.996 y un nivel de confianza superior a 99.5% cuando se aplica al Chi-square goodness of fit test10-12. En la Ilustración 3, se puede observar la relación bien estrecha de la regresión lineal al gráfico log-log. Esta función se puede resumir en una sencilla ecuación: 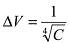 lo cual mantiene el nivel de confianza, según se demostró anteriormente.
lo cual mantiene el nivel de confianza, según se demostró anteriormente.
DISCUSIÓN
Según la literatura médica, el uso de soluciones provenientes de diferentes concentraciones de NaCl usualmente se reporta2-9 y suponiendo que existen estudios farmacológicos que apoyan la solución isotónica ubicada cerca de 0.9%, no encontramos un solo estudio acerca de concentraciones que describa el comportamiento del volumen celular bajo diferentes concentraciones de NaCl.
Por el contrario, sí existen varios estudios en que se administran altas concentraciones de NaClarticularmente en una lesión cerebral traumática, muchos de ellos arrojando resultados diversos y frecuentemente utilizando soluciones salinas de 7.5%13-15.
No es razonable dudar sobre el impacto hemodinámico que se deriva del uso de hipertónicos con soluciones salinas hasta un 7.5%. Varios estudios con animales también confirman incuestionablemente ésta consideración 16-18. Sin embargo, y no obstante los resultados de esta investigación, valdría la pena hacer el esfuerzo y considerar las posibles consecuencias que podrían traer las concentraciones de NaCl en producir no sólo hemólisis sino también la disfunción celular sin un beneficio adicional frente al obtenido con soluciones de cerca de 4.5%.
Por otra parte, la curva volumétrica que se deriva de la relación existente entre la variación en el volumen celular y la concentración de NaCl empleada llega a su máximo nivel (contracción máxima en el volumen celular) cuando la solución de NaCl se acerca al 5%. Por tanto, no es razonable emplear soluciones salinas de mayor concentración que de 5-6%, si el fin es disminuir el volumen intracelular o en rescatar liquido del espacio intracelular e intersticial.
La contracción celular más alta observada en este estudio fue alrededor de 35%, o sea que el volumen celular declinó fuertemente para ubicarse en el 65% frente a su volumen base. Esto sucedió cuando el 5.85% de NaCl fue utilizada. Sin embargo, se observaron algunos puntos de hemoglobina en plasma en algunas asambleas diferentes a las que emplearon esta solución. Esto no ocurrió en ninguna de las 53 asambleas hechas con NaCl hasta un 4.68%.
Es razonable suponer que en vivo nunca utilizaríamos tal cantidad de NaCl hipertónico, ya que podríamos inducir una dilución de 1:1 (al evaluar in vitro). Sin embargo, el equilibrio osmótico se da muy rápidamente, pues solo toma milisegundos y pequeñas cantidades de NaCl hipertónicas para causar una lesión celular. No existen estudios sobre la medición de los niveles de hemoglobina en plasma, luego de administrarse importantes cantidades de salina hipertónica.
En resumen, se definió el comportamiento del volumen celular bajo diferentes concentracioines de NaCl. Este experimento demostró un importante grado de hemólisis al someter las muestras de sangre ante concentraciones de NaCl igual o mayores a 7.02%. No se presentó este efecto en soluciones salinas entre el 0.41% y 4.68%.
Se encontró que la ecuación 1 permite la predicción teórica sobre la variación en el volumen celular, como función de la concentración NaCl en ese dominio de la función, y que no muestra lesión celular.
Finalmente, es importante comentar que esta es una prueba experimental. No es possible pretender que se apliquen estos resultados en las prácticas clínicas sin tomar consideraciones adicionales.
REFERENCES
1. Guyton AC, Hall JE. Textbook of medical physiology. Eleventh Edition. Philadelphia, Pennsylvania: Elsevier Saunders, 2006. [ Links ]
2. Marino PL. The ICU book. Second Edition. Baltimore, Maryland: Lippincott Williams & Wilkins, 1998. [ Links ]
3. Groeneveld A. Hypovolemic Shock. In: Parrillo J, Dellinger P. eds. Critical Care Medicine, Second edition. St Louis, Missouri; Mosby 2001: 465-500. [ Links ]
4. Marrón B, Ruiz E, Fernandez C, Almeida P, Horcajada C, Navarro F, Caramelo C. Systemic and renal effects of preventing contrast nephrotoxicity with isotonic (0.9%) and hypotonic (0.45%) saline. Rev Esp Cardiol. 2007;60:1018-25. [ Links ]
5. Bentsen G, Breivik H, Lundar T, Stubhaug A. Hypertonic saline (7.2%) in 6% hydroxyethyl starch reduces intracranial pressure and improves hemodynamic in a placebo-controlled study involving sChart patients with subarachnoid hemorrhage. Crit Care Med 2006; 34:3037-9. [ Links ]
6. Ware ML, Nemani VM, Meeker M, Lee C, Morabito DJ, Manley GT. Effects of 23.4% sodium chloride solution in reducing intracranial pressure in patients with traumatic brain injury: a preliminary study Neurosurgery 2005; 57:727-36. [ Links ]
7. Brod VI, Krausz MM, Hirsh M, Adir Y, Bitterman H. Hemodynamic effects of combined treatment with oxygen and hypertonic saline in hemorrhagic shock. Crit Care Med 2006;34:2784-91. [ Links ]
8. Bentsen G, Breivik H, Lundar T, Stubhaug A. PredicChart reduction of intracranial hypertension with hypertonic saline hydroxyethyl starch: a prospective clinical trial in critically ill patients with subarachnoid haemorrhage. Acta Anaesthesiol Scand 2004;48:1089-95. [ Links ]
9. Watters JM, Tieu BH, Differding JA, Muller PJ, Schreiber MA. A single bolus of 3% hypertonic saline with 6% dextran provides optimal initial resuscitation after uncontrolled hemorrhagic shock. J Trauma 2006;61:75-81. [ Links ]
10. Hogg RV, McKean JW, Craig AT. Introduction to mathematical statistics. Sixth Edition. Upper Saddle River, NJ: Pearson Prentice Hall, 2005. [ Links ]
11. Dawson-Saunders B, Trapp RG. Bioestadística médica. Segunda Edición. Mexico DF, Mexico: El Manual Moderno, 1997. [ Links ]
12. Ferrán M. SPSS para Windows, programación y análisis estadístico. Primera Edición. Madrid, España: McGraw-Hill, 1996. [ Links ]
13. Kolsen-Petersen JA, Rasmussen TB, Krog J, Hokland M, Tonnesen EK. Infusion of hypertonic saline (7.5%) does not change neutrophil oxidative burst or expression of endothelial adhesion molecules after abdominal hysterectomy. J Trauma 2006;61:1100-6. [ Links ]
14. Battison C, Andrews PJ, Graham C, Petty T. Randomized, controlled trial on the effect of a 20% mannitol solution and a 7.5% saline/6% dextran solution on increased intracranial pressure after brain injury. Crit Care Med 2005;33:196- 202. [ Links ]
15. Cooper DJ, Myles PS, McDermott FT, Murray LJ, Laidlaw J, Cooper G, Tremayne AB, Bernard SS, Ponsford J; HTS Study Investigators. Pre-hospital hypertonic saline resuscitation of patients with hypotension and severe traumatic brain injury: a randomized controlled trial. JAMA 2004;291:1350-7. [ Links ]
16. Toung TJ, Nyquist P, Mirski MA. Effect of hypertonic saline concentration on cerebral and visceral organ water in an uninjured rodent model. Crit Care Med 2008;36:256-61. [ Links ]
17. Rivera-Chavez FA, Huerta S, Brown R, York GB, Minei JP. Resuscitation from hemorrhagic shock comparing standard hemoglobin-based oxygen carrier (HBOC)-201 versus 7.5% hypertonic HBOC-201. J Trauma 2007;63:1113-9. [ Links ]
18. Deree J, de Campos T, Shenvi E, Loomis WH, Hoyt DB, Coimbra R. Hypertonic saline and pentoxifylline attenuates gut injury after hemorrhagic shock: the kinder, gentler resuscitation. J Trauma 2007;62:818-27. [ Links ]











 text in
text in