Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Colombian Journal of Anestesiology
versão impressa ISSN 0120-3347
Rev. colomb. anestesiol. v.37 n.3 Bogotá jul./set. 2009
INVESTIGACIÓN CIENTÍFICA Y TECNOLÓGICA
Añadir haloperidol a la morfina para la analgesia controlada por el paciente (PCA) reduce náusea y vómito tras una cirugía de corta estancia en el hospital: un ensayo clínico aleatorio, controlado
Adding haloperidol to morphine for patient-controlled analgesia (PCA) reduces nausea and vomiting after short stay surgery: randomized, controlled
Luis E. Chaparro*, Catalina M. Martínez*, Julián A. Jaramillo**, Héctor Manrique***, Andrés Castaño****, Alejandro R. Jadad*****
Segundo puesto. Concurso Juan Marín. XXVIII Congreso Colombiano de Anestesiología, marzo 2009. Bogotá.
* MD. Department of Anaesthesia, University of Antioquia, Medellin, Colombia. Email: luisdr74@yahoo.com
** MD. Department of Anaesthesia, Pontificia Bolivariana University, Medellin, Colombia.
*** MD. Department of Anaesthesia, Clinica Las Americas, Medellin, Colombia.
**** MD. School of Medicine, University of Antioquia, Medellin, Colombia.
***** MD. Departments of Health Policy, Management and Evaluation; and Anaesthesia; and Dalla Lana School of Public Health; University Health Network and University of Toronto. Toronto, Canada
Recibido: febrero 18/2009 - Aceptado: julio 24/2009
RESUMEN
Antecedentes: La morfina analgesia controlada por el paciente (PCA) aumenta la frecuencia de náuseas y vómitos postoperatorios (PONV); además, la efectividad de añadir haloperidol es desconocida.
Métodos: 145 mujeres programadas para someterse a una cirugía de corta estancia, bajo anestesia general, fueron asignadas aleatoriamente en dos grupos: un grupo recibió 2 mg i.v. de haloperidol 30 minutos antes del final de la cirugía, junto con 2 mg mezclados con 50 mg de morfina para ser administrados vía PCA (Grupo H); el otro grupo recibió el mismo esquema analgésico para el tratamiento del dolor empleando dos bolos i.v. comparables de solución salina (Grupo P). Además, ambos grupos recibieron 4 mg de dexametasona durante la inducción de anestesia. Se utilizó ondansetrón (4 mg i.v) en lo atinente al rescate antiemético. Los participantes y evaluadores de los resultados quedaron bajo el esquema de "doble mascara" (double-blinded scheme) durante la asignación de grupos. La incidencia de náuseas, vómitos y los requisitos antieméticos durante las primeras 24 horas posteriores a la cirugía se constituyeron en los objetivos principales. Entre los objetivos secundarios está la sedación y el requerimiento de morfina.
Resultados: Los datos acumulados a las 24 horas mostraron que el grupo H tuvo menos náuseas (71,2% vs 20,6%; RR 0,29 [95% CI: 0.17-0.46]) y vómitos (47% vs 11,8%; RR 0,25; [95 % CI: 0.12-0.49]), y requiere menos ondansetrón (66,7% vs 17,7%), pero experimentó una mayor incidencia de sedación (NNH: 3.5, 95% CI, 2,3-6,7). El NNT para la respuesta total (sin náuseas, ni vómitos /intentos de vómitos) fue de 2,5 (0-2 horas) y de 2 (2-24 horas).
Conclusión: Un bolo de 2 mg de haloperidol antes de finalizar la cirugía seguido por 2 mg mezclados con 50 mg de morfina para la administración de PCA puede reducir significativamente la frecuencia de PONV, pero la sedación aumenta.
Palabras claves: analgesia controlada por el paciente, naúsea y vómito postoperatorio, ensayo clínico controlado aleatorio (fuente: DeCS, Bireme)
SUMMARY
Background: Morphine Patient-Controlled Analgesia (PCA) increases the frequency of postoperative nausea and vomiting (PONV) and the effectiveness adding haloperidol is unknown.
Methods: 145 women scheduled to undergo short-stay surgery under general anaesthesia were randomly assigned in two groups: One group received 2 mg i.v. of haloperidol 30 minutes before the end of surgery plus 2 mg mixed with 50 mg of morphine for administration via PCA (Group H); the other group received the same analgesic scheme for pain management using two comparable i.v. boluses of saline (Group P). Furthermore, both groups received dexamethasone 4 mg during anaesthesia induction. Ondansetron (4 mg i.v.) was used for antiemetic rescue. Participants and outcomes assessors were blinded to group assignment. The primary endpoints were incidence of nausea, vomiting and antiemetic requirements during the first 24 hours after surgery. Secondary endpoints included sedation and morphine requirement.
Results: Cumulative data at 24 hours showed that the group H had less nausea (71.2% vs. 20.6%; RR 0.29 [95% CI: 0.17-0.46]) and vomiting (47% vs. 11.8%; RR 0.25; [95% CI: 0.12-0.49]), and required less ondansetron (66.7% vs. 17.7%), but had an increased incidence of sedation (NNH: 3.5; 95% CI, 2.3-6.7). The NNT for Total response (no nausea, no vomiting/retching) was 2.5 (0-2 hours) and 2 (2-24 hours).
Conclusion: A bolus of haloperidol 2 mg prior to the end of surgery followed by 2 mg mixed with 50 mg of Morphine for PCA administration can significantly reduce the frequency of PONV but at a cost of increased sedation.
Key words: haloperidol, analgesia, patient-controlled, postoperative nausea and vomiting, randomized controlled trial (source: MeSH, NLM).
INTRODUCCIÓN
La administración de opioides mediante analgesia controlada por el paciente (PCA) es una forma efectiva de controlar el dolor postoperatorio; sin embargo, ello se asocia con una incidencia significativamente mayor de náusea y vómito postoperatorios (PONV), que puede llegar hasta un 50% (1).
Combinar estrategias de antieméticos es la regla de oro para la prevención de PONV con pacientes entre moderado y alto riesgo(2), pero la efectividad de este enfoque se desconoce en poblaciones con analgesia basada en PCA. Droperidol como antiemético único ha demostrado ser útil en la profilaxis de PONV con aquellos pacientes que recibieron analgesia morfina PCA(3). Sin embargo, droperidol no demostró tener efecto significativo en la población de alto riesgo(4). Haloperidol ha demostrado su efecto profiláctico cuando se utiliza durante el período intraoperatorio(5,6), pero se desconoce su beneficio al coadministrarse con dexametasona durante la operación y posteriormente al mezclarse con morfina en PCA. Se permitió el uso de ondansetrón para el rescate antiemético con el fin de aumentar la validez externa e introducir el concepto del enfoque pragmático en esta prueba.
MATERIALES Y MÉTODOS
Al recibir la aprobación de la Junta de Revisión de Ética, realizamos una prueba clínica aleatoria en un sólo centro (Clínica Las Américas en Medellín, Colombia), en forma paralela, bajo el esquema de "doble mascara" (double-blinded)(participantes y evaluadores), y controlada con placebo.
Población: Se incluyeron las mujeres ASA I-II (18-50 años), que se sometieron a intervención quirúrgica bajo anestesia general, con una duración de más de una hora bajo una estancia de corta duración (1-2 días) en el hospital. Igualmente, dentro de los criterios de inclusión se dio una explicación previa, junto con comprensión sobre la prueba clínica y cómo utilizar el PCA.
Se excluyeron pacientes que recibieron haloperidol a 6 meses o menos de la cirugía, o casos de alergia al haloperidol, a los esteroides, a 5-HT3 antagonists, al SNAIDs o a los antihistamínicos. También fueron excluidos pacientes con antecedentes de enfermedad cardiovascular, cerebral, pulmonar, renal, tiroides o hepática.
Procedimientos: Los participantes del estudio fueron asignados a uno de los dos grupos (Grupo H, haloperidol; Grupo P, placebo) a través de una secuencia aleatoria generada por computador. La asignación a los grupos se mantuvo oculta en sobres opacos numerados que se fueron abriendo en forma consecutiva por el anestesiólogo a cargo, sólo después de que el formulario de consentimiento fuera leído y firmado por los pacientes. El esquema i.v. de anestesia incluyó midazolam 3 mg, propofol 1,5 mg kg-1, fentanilo 100-200 mcg i.v., dexametasona 4 mg y relajante muscular i.v. (cisatracúrio o rocuronio ad libutum) fueron utilizados vía intravenosa.
Se mantuvo la anestesia con remifentanilo (0,10 a 0,25 mcg kg-1), junto con sevoflurano (1,5 - 3%); no se permitió óxido nitroso(7).
Aproximadamente treinta minutos antes de terminarse la cirugía, el grupo H recibió haloperidol 2 mg i.v. (2 ml de una solución de 1mg ml-1), y el grupo P recibió solución salina i.v. 2 ml por vía intravenosa. Para la analgesia, ambos grupos recibieron bolo i.v. de 0,05 mg kg-1 de morfina. Reversión del bloqueo neuromuscular fue administrada según la necesidad.
En la unidad de cuidados post-anestesia (PACU) los participantes fueron recibidos por uno de los evaluadores de resultados. Estos participantes fueron monitoreados por oximetría de pulso, ECG y presión arterial no invasiva, y recibieron bolos intravenosos de 3 mg de morfina cada 10 minutos para las intensidades de dolor ¡Ý 4 en una escala de clasificación numérica de 0-10. Si el dolor persistía después de 3 bolos, los pacientes recibieron metamizol (dipirona) 2 gramos i.v. o diclofenaco 75 mg i.v, según lo requerido, lo cual se mantuvo según la necesidad durante la gestión hospitalaria. La Morfina PCA fue preparada por el anestesista encargado realizando una mezcla de 93 ml de solución salina con 50 mg de Morfina (5 ml; concentración: 0,5 mg ml-1) y añadiendo 2 mg de haloperidol (20 µg ml-1) para Grupo H ó 2 ml de salina para el grupo P. Apoyado por una revisión sistemática anterior(8), los dispositivos PCA fueron programados con una dosis de demanda de 2 ml (morfina 1 mg) y un período de "espera forzosa entre dosis" (lockout period) de 10 minutos, sin infusión de fondo. Para mantener el esquema de "doble mascara" con los evaluadores, se le dio sólo un código numérico a la bolsa PCA.
En lo referente a vómitos/intentos de vómito o rescate de náuseas, se permitió administrar 4 mg de ondansetrón i.v. Los participantes que requirieron de rescate antiemético no fueron excluidos de análisis adicional.
La dosis de haloperidol fue elegida sobre la base de dos pruebas anteriores: Lamond et al(9) observó que droperidol 100 µg mg-1 de morfina (es decir, 5 mg de droperidol por cada 50 mg de morfina) brindó la adecuada efectividad y el equilibrio seguro. Adicionalmente, en un estudio reciente, encontramos que 1.5 mg de haloperidol no protegía de las náusea durante el período postoperatorio, aunque si fue efectivo con respecto a los vómito(10) por lo que decidimos aplicar una estrategia combinada al utilizar un sólo bolo de 2 mg antes de finalizar la cirugía y otros 2 mg mezclado con la morfina PCA.
Anestesistas de nómina no participaron en la evaluación o proceso de recolección de datos. La dosis de los antiinflamatorios se basó en la eficacia de estos medicamentos con pruebas aleatorias anteriores y una revisión sistemática(11,12).
RESULTADOS DE LAS MEDICIONES
Uno de los investigadores (JAJ, CMM, y AC) efectuó el registro de datos del primer día postquirúrgico. Los resultados primarios arrojaron lo siguiente: incidencia de náusea, vómito o intentos de vómito, y los requisitos antieméticos a las 2 y 24 horas después de la cirugía, según lo recomendado por una revisión previa(13). Además, recolectamos los resultados de la respuesta total, la cual se define como la ausencia de náusea y vómito/intentos de vómito durante todo el período de 24 horas que fue analizado de acuerdo con la intensidad del dolor. Los resultados secundarios incluyeron: requisito acumulativo de morfina, rescate anti-inflamatorio, intensidad del dolor 0-10, y la sedación evaluada por la rubrica de Ramsay (1 = ansioso y agitado o inquieto, o ambos, 2 = cooperativo, orientado y tranquilo, 3 = responde sólo a órdenes verbales, 4 = muestra respuesta enérgica al ligero golpe sobre el entrecejo o al fuerte estímulo auditivo, 5 = muestra una respuesta lenta al golpe ligero sobre el entrecejo o estímulo auditivo fuerte, 6 = no exhibe respuesta). Acatisia o síntomas relacionados (como nerviosismo, agitación, incapacidad para permanecer sentado o de pie) fueron evaluados para detectar el desarrollo potencial de un síndrome extra-piramidal y/o movimientos anormales(14) y se trataron con una sola dosis de midazolam(15).
Cálculo del tamaño de la muestra
De acuerdo con una revisión anterior(13) y con base en una frecuencia esperada de 50% en el grupo placebo y una reducción potencial del 25% en el grupo haloperidol, estimamos que 66 pacientes que presentarían un poder del 80% para obtener una diferencia estadística significativa en el valor de p <0,05 entre los grupos. Siete pacientes fueron agregados por grupo para compensar la deserción potencial. No se programó un análisis interino.
ESTADÍSTICAS
Se aplicaron estadísticas descriptivas para resumir el número de pacientes que experimentaron náusea, vómito, o que requirieron antieméticos en cada grupo y en diferentes puntos del tiempo. Se utilizó el Chi cuadrado para comparar los datos categóricos, mientras que una prueba-t fue aplicada a los resultados continuos. Un valor de p de menos de 0,05 fue considerado estadísticamente significativo en todos los casos. Los riesgos relativos (RR) y los intervalos de confianza de 95% (95% CI), también se calcularon y se consideraron estadísticamente significativos cuando los intervalos de confianza no cruzaron la unidad. Los datos fueron analizados mediante el SPSS 14 y Statxact 8,0 (Cytel Inc., EE.UU.). Los datos dicotómicos se analizaron aplicando el inverso de la diferencia de riesgo absoluta, el número necesario para tratar (NNT) la efectividad y el número necesario para dañar (NNH) en lo relacionado con sedación, junto también con su correspondiente 95% CI (16).
RESULTADOS
145/187 pacientes se registraron entre febrero de 2007 y junio de 2008 (véase el diagrama de flujo. Figura 1) y 134 finalmente fueron analizados para efecto de los resultados primarios.
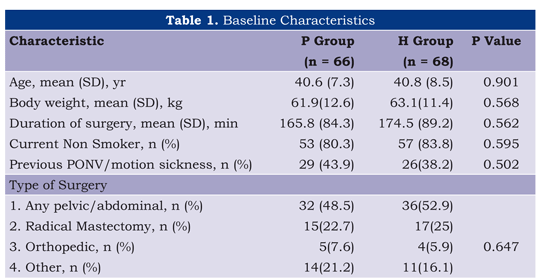
Los grupos fueron similares en edad, peso, duración de la operación así como los principales factores de riesgo relacionados con las náusea y los vómitos (Tabla 1). Se requirió reversión del bloqueo neuromuscular en el 45,6% de los casos del grupo haloperidol y 43,9% en el grupo de control.
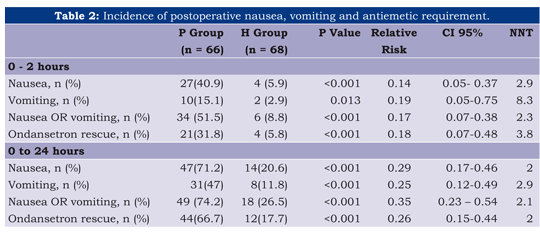
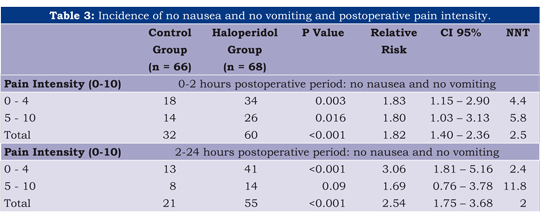
La incidencia acumulativa de náusea, vómito o intentos de náusea, junto el requerimiento antiemético a las 2 y 24 horas (Tabla 2) fue menor con el grupo haloperidol. La respuesta total, definida como ausencia de náusea, y vómito/intentos de vómito, fue estadísticamente más alta para el grupo haloperidol. Curiosamente, encontramos en esta población de que el haloperidol tendió a reportar una mayor incidencia de dolor desde lo moderado a lo grave (véase Tabla 3).
No se encontraron diferencias significativas en la solicitud de morfina acumulada entre los grupos; a las 24 horas, 25,5 mg (SD = 14.4, rango: 6 mg a 76 mg) en el grupo placebo, y 22,0 mg (SD = 12.0, rango: 6 mg a 72 mg) en el grupo haloperidol (p = 0,12). Además, el grupo haloperidol presentó una menor incidencia en el rescate anti-inflamatorio (en 2 horas: 54,5% vs 32,3%; en 2-24 horas: 43,9% vs 22% en el grupo placebo versus el de haloperidol, respectivamente).
No hubo casos de sedación inaceptable de acuerdo con la medición de Ramsay, ¡Ý4 en todo tiempo, o calificación de 3 en los intervalos de 6 a 24 horas. Sin embargo, encontramos una mayor incidencia de sedación (Ramsay 3 únicamente) durante las primeras seis horas en el grupo haloperidol, con un NNH de 3,5.
Tres casos en el grupo de control desarrollaron agitación y un caso en el grupo haloperidol desarrolló acatisia, lo cual se resolvió rápidamente al aplicarse una dosis única de 1 mg de midazolam. Uno de los participantes se negó a continuar en el estudio al desarrollarse prurito intenso.
DISCUSIÓN
Con base en los resultados NNT de 100 pacientes que reciben este tratamiento, 50 no desarrollarán náuseas y 35 no van a presentar vómito en el transcurso de 24 horas, los cuales lo hubieran tenido al recibir todos morfina vía PCA sin haloperidol.
Se podría argumentar que en vez de un estudio sobre los efectos anti-eméticos del haloperidol en una población de alto riesgo, lo nuestro fue mas bien una evaluación sobre la bondad de añadir haloperidol en la combinación de ondansetrón y dexametasona como estrategia de rescate antiemética. Este enfoque redujo la validez interna de la prueba, pero añade una validez externa significativa (la práctica clínica rutinaria)(17).
Aunque la interacción entre estos tres medicamentos antieméticos no puede ser excluida y el efecto " "absoluto" antiemético del haloperidol no se puede cuantificar, es razonable atribuir las diferencias entre los grupos al valor adicional de haloperidol. Una revisión sistemática reciente(18) resaltó la falta de efectividad de la dexametasona para tratar náusea y vómito inducidos por el PCA en dosis menores a 5 mg, según nuestro estudio. Además, a pesar de la evidencia contradictoria que apoya la efectividad de ondansetrón en la profilaxis de PONV inducida por Morfina PCA(19-21), la efectividad del tratamiento de PONV está bien soportada(22).
Un hallazgo interesante que también merece mayor análisis se relaciona con la disminución significativa en el consumo de NSAID entre pacientes que recibieron haloperidol, lo cual puede obedecer a un potencial efecto analgésico desconocido de la droga o que está asociado con su efecto sedante. Otra explicación podría ser el hecho de que los participantes en esta prueba clínica leen un formulario de consentimiento, que establece la posibilidad de náusea y vómito con el uso de morfina PCA y voluntariamente eligen NSAID para el rescate de analgesia, lo que puede explicar las diferencias de este resultado. Nosotros explicamos la ausencia de diferencias significativas en los requerimientos de morfina bajo la conjetura de que los participantes fueron alertados en el formulario de consentimiento sobre el potencial efecto emético de la morfina, lo que significó que ellos profirieron el uso del anti-inflamatorio en vez de recurrir a la morfina PCA. Una incidencia más alta y no significativa ace de la intensidad del dolor, o sea, > 4 en el grupo haloperidol apoya también esta hipótesis. Dado nuestro enfoque pragmático, se decidió no excluir a los participantes que requirieron de rescate antiemético con ondansetrón. En teoría, este enfoque reduciría la diferencia entre el grupo placebo y el de haloperidol, pero la incidencia más baja como sostenida de náuseas y vómitos, así como la disminución de antieméticos requeridos en un periodo de 2-24 horas demostró en forma sostenida el beneficio del haloperidol (Tabla 2).
Una de las limitantes de la prueba está relaciona con el hecho de que el tamaño de la muestra se calculó con base en efectividad y no en seguridad. Por lo tanto, no es posible determinar si el riesgo del efecto adverso cardiovascular es clínicamente importante. Además, el diseño no permite la evaluación de la relación dosis-efecto o el valor relativo del haloperidol al comparase con otros antieméticos (en particular la dexametasona). Aun más, no fue posible determinar si el efecto antiemético obedeció principalmente al bolo intraoperatorio o a la dosis añadida al dispositivo PCA, o a ambos.
Todos estos temas deben considerarse prioritarios en futuras investigaciones. Mientras tanto, este estudio ofrece una alternativa efectiva al droperidol, lo que disminuye la frecuencia de náuseas, vómitos y los requisitos antieméticos en pacientes que califican para la gestión de morfina PCA.
En conclusión, este estudio sugiere que el haloperidol 2 mg antes de concluirse la cirugía, seguido por la misma dosis mezclada en el dispositivo de solución morfina PCA, se asocia con una disminución significativa de NVPO, con sólo un leve aumento en sedación como "multa."
AGRADECIMIENTOS
Queremos agradecer a los miembros del Departamento de Anestesia de la Clínica Las Américas (Medellín, Colombia), así como los Departamentos de Epidemiología de la Universidad de Antioquia y de la Universidad Pontificia Bolivariana. Por último, un agradecimiento especial a los miembros del Comprehensive Pain Program del Toronto Western Hospital por todo el apoyo con las correcciones de estilo.
REFERENCIAS
1. Tramer MR, Walder B: Efficacy and adverse effects of prophylactic antiemetics during patient-controlled analgesia therapy: a quantitative systematic review. Anesth Analg 1999; 88: 1354-61. [ Links ]
2. Apfel CC, Korttila K, Abdalla M, Kerger H, Turan A, Vedder I, Zernak C, Danner K, Jokela R, Pocock SJ, Trenkler S, Kredel M, Biedler A, Sessler DI, Roewer N: A factorial trial of six interventions for the prevention of postoperative nausea and vomiting. N Engl J Med 2004; 350: 2441-51. [ Links ]
3. Culebras X, Corpataux JB, Gaggero G, Tramer MR: The antiemetic efficacy of droperidol added to morphine patient-controlled analgesia: a randomized, controlled, multicenter dose-finding study. Anesth Analg 2003; 97: 816-21. [ Links ]
4. Sanchez-Ledesma MJ, Lopez-Olaondo L, Pueyo FJ, Carrascosa F, Ortega A: A comparison of three antiemetic combinations for the prevention of postoperative nausea and vomiting. Anesth Analg 2002; 95: 1590-5, table of contents. [ Links ]
5. Rosow CE, Haspel KL, Smith SE, Grecu L, Bittner EA: Haloperidol versus ondansetron for prophylaxis of postoperative nausea and vomiting. Anesth Analg 2008; 106: 1407-9, table of contents. [ Links ]
6. Yang YL, Lai HY, Wang JJ, Wang PK, Chen TY, Chu CC, Lee Y: The timing of haloperidol administration does not affect its prophylactic antiemetic efficacy. Can J Anaesth 2008; 55: 270-5. [ Links ]
7. Myles PS, Leslie K, Chan MT, Forbes A, Paech MJ, Peyton P, Silbert BS, Pascoe E: Avoidance of nitrous oxide for patients undergoing major surgery: a randomized controlled trial. Anesthesiology 2007; 107: 221-31. [ Links ]
8. Walder B, Schafer M, Henzi I, Tramer MR: Efficacy and safety of patient-controlled opioid analgesia for acute postoperative pain. A quantitative systematic review. Acta Anaesthesiol Scand 2001; 45: 795-804. [ Links ]
9. Lamond CT, Robinson DL, Boyd JD, Cashman JN: Addition of droperidol to morphine administered by the patient-controlled analgesia method: what is the optimal dose? Eur J Anaesthesiol 1998; 15: 304-9. [ Links ]
10. Chaparro L, Gallo T, Gonzalez N, Rivera M, Peng P: Effectiveness of combined haloperidol and dexamethasone versus dexamethasone only for postoperative nausea and vomiting in high-risk day surgery patients: a randomized blinded trial. Eur J Anaesthesiol 2009; In Press: In press. [ Links ]
11. Fredman B, Olsfanger D, Jedeikin R: A comparative study of ketorolac and diclofenac on post-laparoscopic cholecystectomy pain. Eur J Anaesthesiol 1995; 12: 501-4. [ Links ]
12. Edwards JE, Meseguer F, Faura CC, Moore RA, McQuay HJ: Singledose dipyrone for acute postoperative pain. Cochrane Database Syst Rev 2001: CD003227. [ Links ]
13. Apfel CC, Roewer N, Korttila K: How to study postoperative nausea and vomiting. Acta Anaesthesiol Scand 2002; 46: 921-8. [ Links ]
14. Van Putten T, May PR, Marder SR: Akathisia with haloperidol and thiothixene. Arch Gen Psychiatry 1984; 41: 1036-9. [ Links ]
15. Parlak I, Erdur B, Parlak M, Ergin A, Ayrik C, Tomruk O, Turkcuer I, Ergin N: Midazolam vs. diphenhydramine for the treatment of metoclopramide-induced akathisia: a randomized controlled trial. Acad Emerg Med 2007; 14: 715-21. [ Links ]
16. Cook RJ, Sackett DL: The number needed to treat: a clinically useful measure of treatment effect. Bmj 1995; 310: 452-4. [ Links ]
17. Merckx P, Paugam-Burtz C, Boudinet S, Bonnet A, Mantz J: Explanatory versus pragmatic trials? The methods make the difference. Anesthesiology 2008; 108: 542-3; author reply 543-4. [ Links ]
18. Karanicolas PJ, Smith SE, Kanbur B, Davies E, Guyatt GH: The impact of prophylactic dexamethasone on nausea and vomiting after laparoscopic cholecystectomy: a systematic review and meta-analysis. Ann Surg 2008; 248: 751-62. [ Links ]
19. Boonmak P, Boonmak S, Bunsaengjaroen P, Srichaipanha S, Poomsawat S, Nonlhaopol D: Antiemetic effect of ondansetron 0.2 mg ml-1 in PCA morphine solution. Eur J Anaesthesiol 2007; 24: 664-7. [ Links ]
20. Jellish WS, Leonetti JP, Sawicki K, Anderson D, Origitano TC: Morphine/ondansetron PCA for postopeConflicto de intereses: ninguno declarado.rative pain, nausea, and vomiting after skull base surgery. Otolaryngol Head Neck Surg 2006; 135: 175-81. [ Links ]
21. Millo J, Siddons M, Innes R, Laurie PS: Randomised double-blind comparison of ondansetron and droperidol to prevent postoperative nausea and vomiting associated with patient-controlled analgesia. Anaesthesia 2001; 56: 60-5. [ Links ]
22. Kazemi-Kjellberg F, Henzi I, Tramer MR: Treatment of established postoperative nausea and vomiting: a quantitative systematic review. BMC Anesthesiol 2001; 1: 2. [ Links ]
Conflicto de intereses: ninguno declarado.











 texto em
texto em