Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.37 no.4 Bogotá Oct./Dec. 2009
Editorial
Primeras experiencias en anestesia para transplante hepático 1965-1980
Early experiences of anesthesia for liver transplantation 1965-1980
J. Antonio Aldrete*, Jesús Ernesto Rojas**
* MD. Anestesiólogo. Profesor emérito del Departamento de Anestesiología. Universidad de Alabama, Birmingham. Arachnoiditis Foundation, Inc., Birmingham, AL. E-mail: aldrete@arachnoiditis.com
** MD. Anestesiólogo. Colombia
Recibido: diciembre 15/2009. Aceptado: diciembre 22/2009
Algunas veces las oportunidades golpean nuestra puerta y raras veces pasamos por ellas. Esta fue mi experiencia con los transplantes. Los primeros dos transplantes de hígado en humanos se hicieron en 1963 cuando Yo era un residente de cirugía rotando por el Hospital de Veteranos de Denver, Colorado; ya que mucho de mi tiempo lo pasaba aplicando la nueva forma desarrollada de Reanimación Cardiopulmonar, decidí entrar a anestesia. Me uní al grupo de transplantes en 1965 al regresar de mi entrenamiento en Anestesia en Cleveland, no por alguna aptitud especial sino porque en ocasiones otros colegas eran renuentes a participar en cirugías tan prolongadas y complicadas. Fui designado al hospital National Jewish donde solamente se hacía un procedimiento torácico o cardiovascular diariamente, y así con el tiempo en mis manos, entré en un programa de Maestría en Farmacología Anestésica y comencé a trabajar en algunos estudios de transplantología en el laboratorio y algunos otros proyectos propios.
Por algunas extrañas conexiones, pero más por casualidad, conocí que Thomas E. Starzl (figura 1), director del programa de transplantes, estaba interesado en reclutar un anestesiólogo que trabajara con el grupo. Me ofrecí voluntariamente para ese trabajo. Mi rango académico cambió de fellow a instructor.
Los dos primeros transplantes ortotópicos (TOT) se llevaron a cabo en 1963(1), eran dos niños afectados de atresia biliar terminal quienes murieron en la sala de cirugía por hemorragia incontrolable, a pesar del puente venoso fémoro-axilar (figura 2). El grupo regresó al laboratorio y en 1965 se reinició el trabajo con los pacientes.
La experiencia en el laboratorio nos dio solamente una visión parcial de las tantas alteraciones hemodinámicas, metabólicas e inmunológicas que ocurren en estas intervenciones. Hasta entonces en los humanos la interrupción simultánea del flujo sanguíneo en la vena porta y de la vena cava inferior se consideraba letal. La extensión y la severidad de la coagulopatía se había predicho, pero no estaba claramente entendida; tampoco no se apreciaban completamente los mecanismos de los cambios súbitos en los electrolitos plasmáticos y las causas de la acidosis metabólica. Pero más que eso, era desconocido el impacto de los agentes anestésicos, los relajantes musculares y las transfusiones masivas de sangre en la condición general de los pacientes con un hígado muy enfermo, que por un corto tiempo estaría sin él y finalmente los cambios funcionales que ocurrirían en el órgano recientemente transplantado. Poco conocía que mi anterior experiencia con los puentes porto-cava, la cirugía de corazón abierto y los pacientes con trauma múltiple, aunque útiles, no podrían compararse con el transplante hepático, cuyas indicaciones para esa época se muestran en la tabla 1.
CAMBIOS EN LA GLICEMIA
El TOT # 3 sobrevivió cerca de 24 horas después de la operación y el TOT # 4, vivió varios días después del transplante. En el TOT # 5, mientras se transfería el paciente de las salas de cirugía a la Unidad de Cuidado Intensivo Pediátrico, apreciamos en el ascensor que un paciente que respondía, súbitamente se convirtió en un paciente que no respondía e hipotenso; las muestras sanguíneas tomadas al arribo de la unidad revelaron un nivel de glicemia de 38 mg%; despertó cuando recibió 4 c. c. de dextrosa al 10%2. A partir de este momento, monitorizábamos la glicemia por lo menos cada dos horas durante y después de la cirugía.
MONITORÍA CLINÍCA
Cuando empezamos, monitorizábamos con un fonendoscopio esofágico, un tensiómetro aneroide y un monitor electrocardiográfico de tres derivaciones1. Inicialmente teníamos un residente y algunos profesores renuentes. Cuando los demás anestesiólogos estaban ocupados en las urgencias frecuentemente venía y los reemplazaba, en algunas ocasiones tenía que hacer los casos por mi mismo. Gradualmente residentes y fellows se fueron interesando y luego otros miembros del grupo docente y fellows fueron específicamente designados para la anestesia de transplantes. Muchos de ellos vinieron de otros países y aprendieron el manejo de estos casos.
HIPOTENSIÓN ARTERIAL
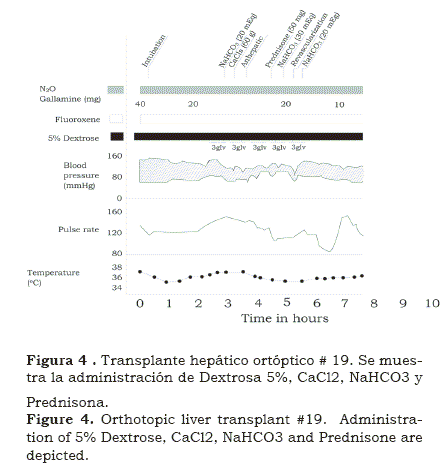
Al comienzo de la operación, las caídas de la presión arterial ocurrían por el sangrado excesivo cuando los cirujanos abrían el abdomen e iban a través de los abundantes vasos colaterales. Ya en la cavidad peritoneal ante la exposición del hígado (figura 3), con el fin de disecar alrededor de la vena cava, la reducción del retorno venoso eventualmente producía caídas severas de la presión arterial2. Como no usábamos puente durante el período anhepático, y mientras la vena cava y la vena porta estaban clampeadas, una marcada hipotensión se desarrollaba. La principal manera de manejar la hipotensión era infundir sangre y líquidos tan rápido como fuera posible. Muy pronto aprendimos que la ausencia del hígado, el citrato y el anticoagulante contenido en la sangre del banco, disminuían la contractilidad miocárdica, la contrarrestamos con cloruro de calcio4 (figuras 3 y 4).
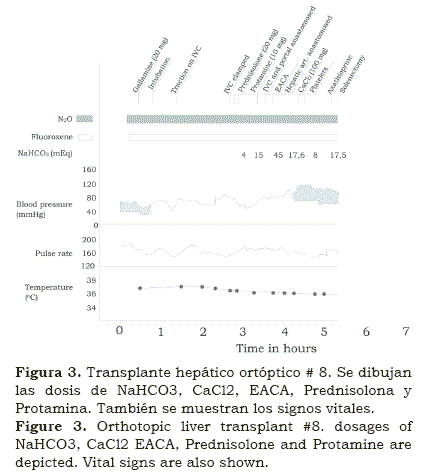
Eventualmente a finales de 1967 y después de varios intentos, con los sobrevivientes de días y luego semanas, en el TOT # 8 (figura 3), pudimos canular la arteria radial en un paciente de 2 años extremadamente enfermo con cirrosis biliar y hepatoma; ella tuvo un período anhepático muy corto en que fuimos capaces de monitorear los gases arteriales y corregir la acidosis metabólica. También monitorizando la presión arterial continuamente usando un manómetro aneroide, fuimos capaces de compensar la pérdida de líquidos y sangre con una guía más objetiva2 (figura 4).
CAMBIOS METABOLICOS Y DE ELECTROLITOS PLASMATICOS
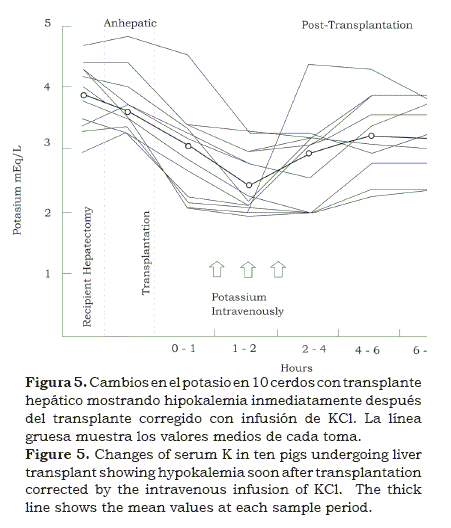
En el laboratorio y la sala de cirugía, pudimos establecer la severidad y el momento en que ocurría la acidosis metabólica antes, durante y después del período anhepático y la intención de corregirlo con Na HCO3(4, 5). Ocasionalmente ocurría hipernatremia y en estos casos se utilizó Tham para su corrección2, 3. Con el director del laboratorio Jerry Aikawa se encontró otra alteración metabólica; en algunos pacientes, inmediatamente después de soltar los clamps al final de la fase anhepática, presentaron arritmias junto a hipokalemia (figura 5). De nuevo regresamos al laboratorio y con la ayuda de George Abouna, encontramos que en los cerdos esto era debido a la baja concentración de potasio en los líquidos que se usaban para perfundir al remover el órgano(5).
Teniendo la oportunidad de usar una preparación extraordinaria y única (en el período anhepático), medimos en el hígado enfermo del recipiente la habilidad de metabolizar lidocaína y de nuevo cuando el órgano nuevo transplantado se vascularizó habiendo encontrado que un órgano bien preservado, comienza a tener por lo menos algunas de sus capacidades para metabolizar algunas drogas, muy rápidamente inmediatamente después que la irrigación se ha restaurado(6).
ESCOGENCIA DEL ANESTÉSICO
Frecuentemente debatimos la búsqueda del anestésico, la explosividad y la toxicidad fue algo que nos preocupaba. De los agentes halogenados con que contábamos, seleccionamos el flurexeno, ya que el consenso fue que este agente anestésico no se metabolizaba en organismo. Al final de esta década encontramos que el metoxiflurano, el flurexeno, y el enflurano se metabolizaban. Estos hallazgos sorprendentes coincidieron con la popularidad inicial de las grandes dosis de morfina como anestésico en la cirugía de corazón; por esta época el fentanilo, el droperidol y el butorfanol se hicieron gradualmente más populares y así de esta forma se inició su uso3. En ocasiones, durante la fase anhepática, cuando la presión arterial se hacia casi imperceptible, el agente anestésico se cerraba. Ya que nuestros equipos de monitoría eran muy limitados, pocos minutos posteriormente les pedíamos a los pacientes que abrieran los ojos; la mayoría del tiempo estaban con capacidad de hacerlo; eso nos confirmaba que el paciente estaba neurológicamente íntegro. Afortunadamente ninguno de ellos tuvieron recuerdos, pero alguien llegó a insinuar que Yo “podría mantener viva una piedra”. Esa reputación errada o no, la he continuado a través de mi carrera(7).
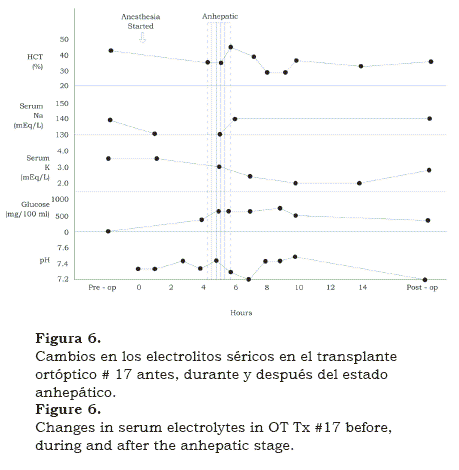
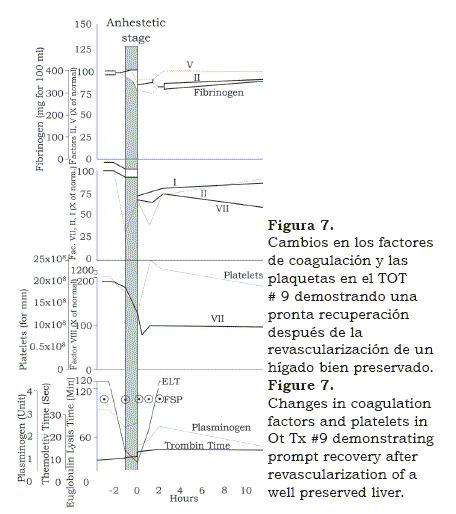
En la medida que trabajábamos en el laboratorio este ayudó a resolver los problemas encontrados en las salas de cirugía. Este primer suceso de largo plazo inicial, reavivó el programa y muy pronto estábamos en el TOT #17, para ese entonces medíamos y corregíamos los cambios en los electrolitos plasmáticos(8) (figura 6). También tuvimos un visitante experto en coagulación, Kurt Van Kulla de Alemania, quien encontró que un injerto implantado bien preservado, rápidamente comenzaba a producir factores de coagulación (figura 7).
Además diagnosticó la fibrinolisis después de muchas transfusiones y aconsejó como tratarlas con ácido aminocapróico y plasma fresco. Las transfusiones de plaquetas también se administraron cuando el conteo era inferior a 100.000.
PRESERVACIÓN DEL HÍGADO DONADO
Con el fin de encontrar la óptima, un gran número de experimentos se hicieron en el laboratorio buscando la solución de perfusión. También se trató la hipotermia media y la profunda. Con la ayuda de un brillante cirujano naval, Larry Brettschneider, quien tenía experiencia con la medicina hiperbárica, se intentó preservar y transportar el hígado donado en una cámara hiperbárica, no es necesario decir que toda la preservación era de tamaño exagerado y complicada. Hubo éxitos inconsistentes con esta cámara; en un cambio irónico el asistente de laboratorio Paul Taylor, se imaginó que podría transportar el hígado del donador, del hospital General de Denver donde la mayoría de los donadores se localizaban al Hospital Universitario en una nevera de picnic. Esta manera simple es usada actualmente. In mediatamente después de un año de la cirugía, encontramos tristemente que el hepatoma de Julie Rodríguez recurrió e hizo metástasis. Sentimos grandemente la muerte de esta valiente niña de Pueblo, Colorado.
OTROS TRANSPLANTES DE ÓRGANOS
Hoy hay diferentes especialidades para los transplantes de corazón, hígado, riñón, páncreas, pulmón y médula ósea. En su tiempo, el mismo grupo también llevaba a cabo todos los otros transplantes de órganos; alrededor de 1970, el grupo de la Universidad de Colorado llevó a cabo 1.000 transplantes de riñón(9); de los cuales cerca de la mitad eran de parientes en quienes no ocurrían complicaciones anestésicas serias(10). Los estudios llevados a cabo determinaron que los agentes anestésicos eran aceptables y que los relajantes musculares que dependían de la eliminación renal se debían evitar. Encontramos que la hiperkalemia y la hipermagnesemia típicas de los pacientes con insuficiencia renal, se podían evitar si la diálisis se llevaba a cabo el día antes de la operación(11).
También llevamos a cabo 11 transplantes hepáticos auxiliares, implicando que un nuevo hígado debería ser implantado dejando un lugar en el hígado enfermo. Estas operaciones no fueron solamente difíciles técnicamente, si no también los intentos de cerrar la cavidad peritoneal que contenía hypotherdos hígados, era en ocasiones insuperable a pesar de las grandes cantidades de relajante muscular. “Aquellos eran los días” cuando el grupo de transplantes seleccionaba el paciente receptor y donados, hacía la tipificación de los tejidos, desarrollaba todo el trabajo químico y sanguíneo, determinaba los signos de rechazo y prescribía de acuerdo a lo que había, los agentes inmunosupresores (especialmente corticosteroides y aziotropina). También mirábamos minuto a minuto los pacientes que se recuperaban en cualquier UCI que se colocaran.
TRANSPLANTE SIMULTÁNEO DE OTROS ORGANOS
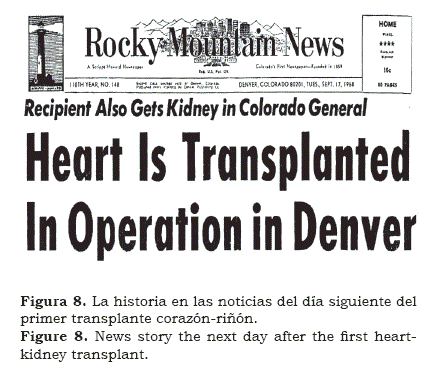
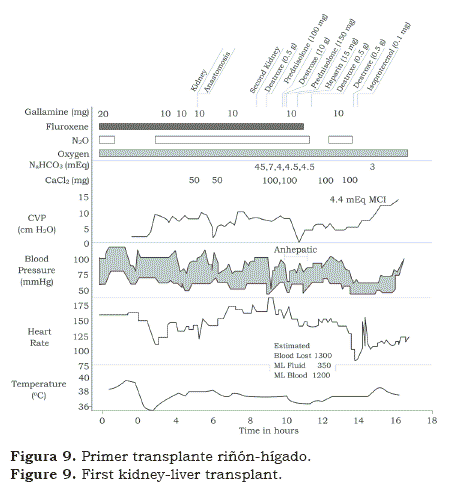
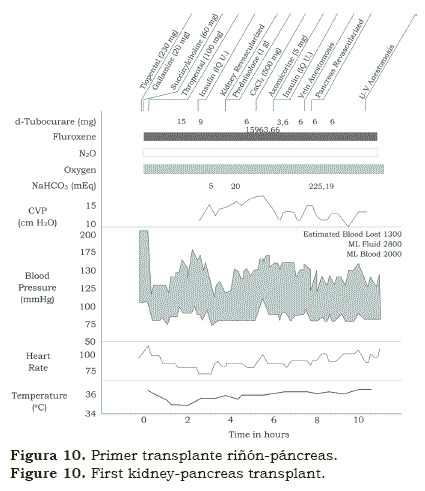
Encontramos muy peculiar que después de pasar 6 meses con Norm Shumway en Stanford, Christian Barnard pasó dos meses en Denver aprendiendo inmunosupresión y de ahí regresó a Surafrica. En meses, en 1988, Chris llevó a cabo el primer transplante de corazón en el mundo. No es necesario decirlo lo “impactante” que fue que un cirujano joven y desconocido haya llevado a cabo lo que otros habían preparado durante años y que no se habían atrevido a hacer en humanos. Como cientos de otros grupos, comenzamos a preparar nuestro propio transplante cardíaco(12); cuando el potencial recipiente se identificó, también se avisó que tenía algún grado de falla renal. Llevamos a cabo el transplante cardíaco seguido en la misma sesión del transplante de riñón (figura 8); el paciente sobrevivió algunas semanas. Algunas semanas después llevamos a cabo un transplante de hígado y riñón (figura 9) y después, se siguió con un transplante de riñón y uno de páncreas en un paciente con una diabetes mellitas avanzada y en insuficiencia renal (figura 10). Los pacientes vivieron algunas semanas; aunque era obvio que las operaciones se podían hacer simultáneamente; sin embargo los rechazos permanecían como un problema.
RESCATE DEL ORGANO Y PROTECCIÓN DEL DONADOR
En algún momento en 1967, llegó a ser evidente que teníamos que definir cuando y como debía ser declarada la muerte cerebral en los donantes cadavéricos; junto con los cirujanos y los neurólogos se delineó un criterio simplificado13 y de allí en adelante, se usó como una guía hasta que apareció impreso, un año después, el criterio de Harvard. Es muy interesante ver que ambos eran similares, aunque con énfasis en diferentes puntos. Es lógico que para mejorar los resultados finales, la preservación homeostática de los donantes cadavéricos fue esencial para los riñones, pero aún más para los hígados. Era obvio que dentro de las guías, los órganos, mientras estaban en el donador, tenían que ser protegidos y preservados apropiadamente durante la extracción, exactamente antes y durante el período avascular. En la mayoría de los donantes la lesión cerebral producía alguna espasticidad y casi todos tenían cierto grado de hipotermia con la cual presentaban escalofrío, frecuentemente resultando en rigidez muscular; a veces, este problema hacía que a los cirujanos les fuera imposible entrar a la cavidad abdominal. Aunque nos preocupaba decidimos dar relajantes musculares para facilitar la remoción del órgano. De la misma forma la administración de vasoconstrictores para mantener la presión arterial podría ser peligrosa por la posible isquemia (no había dopamina en ese entonces); se tomó la decisión de administrar abundantes volúmenes de cristaloides, se controlaba la bradicardia con dosis repetidas de atropina y para mejorar la contractilidad se administraban dosis cuidadosas de cloruro de calcio intravenoso.
El criterio para declaración de muerte cerebral se empleó en el Dr. Andrés Zahler en septiembre de 1968, un residente de anestesiología quien participó en varios transplantes de riñón e hígado y fue fatalmente herido en un accidente automoviliario. Después de varios días, cuando llegó a ser evidente que no era recuperable, sus padres lo propusieron como un posible donante. Pocos eventos pueden ser tan dramáticos y generosos como el gesto de la familia de este joven Doctor, quien solamente pocos días antes cuidaba por alguno de estos pacientes(14). En medio de la tragedia, las operaciones de transplante que siguieron fueron dramáticas.
LA ESCOGENCIA DEL ANESTÉSICO
Siempre estuvimos debatiendo cuales eran los mejores anestésicos para estas operaciones; al comienzo nos inclinábamos por la anestesia inhalatoria específicamente con flurexeno(2,3), porque se suponía no tenía metabolismo; pero en la medida que supimos de la liberación de fluoruros a partir del metabolismo hepático del metoxiflurano, del flurexeno y del enflurano, esta indicación cambió. Al final de la década de los años sesenta, estos hallazgos coincidieron con el entusiasmo de la anestesia con morfina para la cirugía cardiovascular, así como la aparición del fentanilo, el droperidol, el butorfanol y otros agentes hipnóticos tales como el diazepam y el ácido gamma-aminobutírico, lo cual nos dio más alternativas. Gradualmente comenzamos a usarlos, primero combinado con los agentes inhalatorios, y posteriormente la mayoría con anestesia intravenosa total. Sin embargo, el consenso fue que los anestésicos inhalatorios no tenían más efecto deletéreo en el hígado enfermo que se iba a remover. Usualmente debido a la inestabilidad hemodinámica, la concentración del agente inhalado se redujo considerablemente en el período post-revascularización.
INMUNOSUPRESIÓN
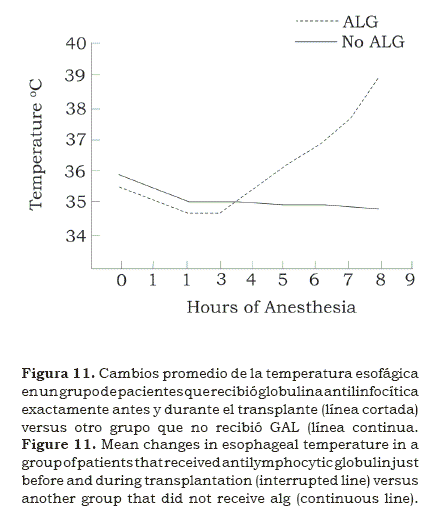
Aunque los métodos inmunosupresores se limitaban a los corticosteroides y la aziotropina otros fueron explorados; la globulina antilinfocítica (GAL) se usó extensivamente en los receptores de riñón e hígado; como en efecto sucedía se inyectaba antes de la cirugía, y en algunos casos se repetía tres horas después. Vimos que en más de una ocasión la temperatura esofágica se elevaba15 durante la cirugía (figura 11); por esta época se iniciaba el estudio de la hipertermia maligna, así que se temió fuera el caso en varios pacientes, sin embargo con solo parar los líquidos calientes que se administraban se controló la subida de la temperatura. No se tenía la ciclosporina en ese tiempo.
Otro método fue el drenaje del conducto linfático que debía ser hecho al tiempo del transplante, frecuentemente prolongando la operación en una o dos horas más. Eventualmente las proteínas plasmáticas tenían que ser reemplazadas usando grandes volúmenes de albúmina, indudablemente una modalidad muy costosa.
CONCLUSIONES Y PROTAGONISTAS
En 1969 se publicó el primer tratado en “La Experiencia en Transplante Hepático”17. El capítulo relacionado con la anestesia y el cuidado intraoperatorio en dicho tratado3 y otras pubñlicaciones( 2, 5, 6, 8) llegaron a ser las guías para otros colegas comenzando empresas similares. Fui promovido a Profesor Asociado en la Universidad de Colorado. Casi simultáneamente un cirujano experimentado, R. Y. Calne, comenzó un programa de transplante hepático en la Universidad de Cambridge, en el Reino Unido. Tuvieron resultados similares; el anestesiólogo de este grupo era J. V. Farman; reportó su experiencia posteriormente(18).
Respecto a muchos cirujanos de transplantes con quienes tuve el placer de trabajar en el laboratorio y en las salas de cirugía se incluyen a Carl Groth (Suiza), John Homatas (Grecia), George Abuna (Egipto), George Pappas (USA), Tom Marchioro (USA), Bernard Serrou (Francia), Al Couburg (Alemania), Charlie Putman (USA), Charlie Halgrimson y otros. La mayoría de ellos, si no todos, fueron a otras universidades a desarrollar su propio programa de transplante. Un docente senior de Bristol, Reino Unido, Jack O’Higgins permaneció dos años trabajando activa y productivamente con nosotros, repentinamente de no tener alguien quien me relevara para un descanso durante los casos, vinieron anestesiólogos de varias universidades y de diferentes países a trabajar con nuestro grupo.
En momentos críticos Paul Taylor estuvo para ayudarnos, no lo hubiéramos podido hacer sin él. Permaneció con el grupo, llegó a ser un miembro en los setentas y un Coordinador de Transplantes posteriormente; el es el típico ejemplo de que en los Estados Unidos de Norteamérica, el trabajo duro, una buena disposición y la sabiduría común hace llegar a los individuos a lugares altos. El lo merecía.
COROLARIO
La tenacidad de Tom Starzl, su técnica quirúrgica extraordinaria, su mente brillante y su incansable capacidad de trabajo hicieron que este logro fuera posible, sus contribuciones a los transplantes, la cirugía hepática, y la inmunosupresión han sido numerosas y de gran importancia. Después de más de 4 décadas del primer transplante hepático en el hombre, la operación es rutina en muchos hospitales en todo el mundo. Cada paso individual ha sido mejorado y la sobrevivencia de estos pacientes es más grande cada día. Ha reemplazado otras cirugías paliativas como la hepatectomía, la ligadura de la arteria hepática, las segmentectomías y los puentes porto-cava, entre otros.
Mi participación dentro del grupo de transplante (figura 12), nos permitió resolver en conjunto, algunas de las complejidades de estas operaciones, usualmente llevadas a cabo en pacientes moribundos. Hay muchas más anécdotas acerca de lo épico que se deben decir. El asunto es ¿por qué ahora? Como muchos otros avances quirúrgicos, la anestesia jugó un papel importante en el éxito del transplante hepático; sin duda, el mayor protagonista fue Tom Starzl, una personalidad importante en el mundo médico de la segunda mitad del siglo 20. Como muchas otras innovaciones en medicina, el desarrollo del transplante hepático no fue fácil; agregado a lo técnico, la tipificación de los tejidos, los problemas metabólicos y el rechazo, hubo muchos colegas que se oponían con vehemencia por varias razones. Algunos alegaban que era antiético, otros sentían que era demasiado costoso, o que los casos eran demasiado largos y que los recursos que se empleaban eran tomados de otros proyectos. Otros lo que tenían era completa envidia al ver nuestras fallas y sucesos. Y teniendo mayor éxito, Tom Starzl no solamente mostró que se podía hacer, sino que la perseverancia y los estándares de alta calidad casi siempre llevan a buenos hechos y triunfos. Mi participación en este maravillosa saga fue un evento afortunado(19, 20) que me dio una oportunidad en la vida. Hace poco encontré copias de los informes de anestesia de la mayoría de estos procedimientos; indudablemente una fuente invaluable y un tesoro que lo he mantenido en mis archivos por más de tres décadas. Un recorte de periódico de la época decía que la operación sería eventualmente un suceso (figura 13). Hemos mostrado como entramos en un camino que nunca se había transitado antes y juntos aprendimos que pasa cuando una nueva cirugía se introduce para salvar vidas. Así fue como en los años sesentas enfrentamos este reto.
REFERENCIAS
1. Starzl TE: The puzzle people: Memoirs 1. of a transplant surgeon. University of Pittsburgh Press. Pittsburgh and London. 1987, PP. 172, 187, 218. [ Links ]
2. Aldrete JA, Levine DS, and Gingrich TF: Experiences in anesthesia for liver transplantation. Anesth Analg 48: 802-814, 1969. [ Links ]
3. Aldrete JA: Anesthesia and Intraoperative Care. In: Experience in Hepatic Transplantation. Ed.: Starzl TE. WB Saunders Co., Philadelphia, 1969, Chapter VII, pp. 83-111. [ Links ]
4. Serrou B, Coburg AJ, Abouna GM, Aldrete JA: Hemodynamic and metabolic stability after total hepatectomy in the dog. Int Surg 55: 235-242, 1971. [ Links ]
5. Abouna GM, Aldrete JA, Starzl TE: Changes in serum potassium and pH during clinical and experimental liver transplantation. Surgery 69: 418-426, 1971. [ Links ]
6. Aldrete JA, Homatas J, Boyes RN, et al: Effectes of hepatectomy on the disappearance of lidocaine from the blood of dog and man. Anesth Analg 49:687-690, 1970. [ Links ]
7. MacMartin-Klobuchar C; Pioneering anesthesiologist continues to shape his field. Anesthesiology News Jan 2005:25. [ Links ]
8. Aldrete JA, O`Higgins JW, Pearson JR et al: Serum magnesium changes during organ transplantation. In 1st Int Symposium on magnesium Deficits in Human Pathology. Soc Gen Des Eaux Minerales de Vittel. 1973:431-433. [ Links ]
9. Aldrete JA, Daniel W, O`Higgins JW, et al.: Analysis of anesthetic-related morbidity in human recipients of renal homografts. Anesth Analg 50: 321-329, 1971. [ Links ]
10. Aldrete JA, Swanson JT, Penn I, et al.: Anesthesia experience with living renal transplant donors. Anesth Analg 50: 169-174, 1971. [ Links ]
11. Aldrete JA, O`Higgins JW, Starzl TE: Changes of serum potassium during renal homotransplantation. Arch Surg 101 82-84, 1970. [ Links ]
12. Aldrete JA, Pappas G: Anesthetic implications for simultaneous cardiorenal transplant. Anesth Analg 48: 928-932, 1969. [ Links ]
13. Aldrete JA, Swanson JT, Penn I et al: Anesthesia experience with living renal transplant donors. Anesth Analg 50:169-174, 1971. 13. Available upon request, JAA [ Links ]
14. Aldrete JA, Zahler A, Aikawa JK: Prevention of succynilcholine- induced hyperkalemia by magnesium sulfate. Canad Anawesth Soc J 1970:17:477-484. [ Links ]
15. Aldrete JA, Clapp HW, Starzl TE: Body temperature changes during organ transplantation. Anesth Analg 49: 384-388, 1970. [ Links ]
16. Aldrete JA, Padfield A, Solomons CC et al: Possible predictive tests for malignant hyperthermia during anesthesia. JAMA 215: 1465-1469. 1971. [ Links ]
17. Starzl TE: Experience in hepatic transplantation. W.B. Saunders Co. Philadelphia 1969. [ Links ]
18. Farman JV, Mason SA, Samule JR: Anaesthetic and metabolic problems of liver transplantation. Communication. Annual meeting of the Association of Anaesthetists of GB and Ireland, London, 1970. [ Links ]
19. Aldrete JA: Those patients in the transplant Unit. In The Human Factor. J. A. Aldrete (ed). Edit. Alfil, Mexico. 2004:pp. 121-124. [ Links ]
20. Aldrete JA: Walking unknown paths toward a milestone. In the Human Factor, J A. Aldrete (ed) Edit. Alfil, Mexico. 2004:pp. 131-134. [ Links ]











 text in
text in