Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.37 no.4 Bogotá Oct./Dec. 2009
Artículo de Revisión
Anestesia para trasplante hepático en hepatitis fulminante
Anaesthesia for Liver Transplantation in Fulminant Hepatic Failure A practical approach
Joel Avancini Rocha Filho, MD,* Ricardo Souza Nani, MD,* Maria José Carvalho Carmona, MD,* Mauricio Vanegas Ballesteros, MD,** Luiz Augusto Carneiro D’Albuquerque, MD.**
* Departamento de Anestesiología, Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo – Brasil E-mail: joelrocha@me.com
** Departamento de Trasplante y Cirugía de Hígado, Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo – Brasil
Recibido: septiembre 18/2009. Aceptado: diciembre 11/2009
RESUMEN
La falla hepática fulminante (FHF) es definida como el comienzo súbito de encefalopatía, coagulopatía e ictericia en un individuo que se encontraba en condiciones normales de salud. La falla hepática fulminante termina en un deterioro progresivo de múltiples órganos con un impacto dramático en el cerebro.
El edema cerebral severo es un hallazgo frecuente que, finalmente, conlleva a hipertensión intracraneal y a la muerte. El manejo de pacientes con FHF apunta principalmente a prevenir o reversar el incremento de la presión intracraneal, asociada con el tratamiento de soporte para la falla de otros órganos. El tratamiento definitivo para pacientes con FHF es el trasplante de hígado. Este artículo tiene como objetivo presentar una aproximación práctica al cuidado anestésico e intraoperativo para el manejo de pacientes con FHF.
Palabras Clave: Fallo hepático agudo, insuficiencia hepática, hipertensión intracraneal, trasplante de higado, anestesia (Fuente: DeCS, BIREME)
SUMMARY
Fulminant hepatic failure (FHF) is defined by sudden onset of encephalopathy, coagulopathy and jaundice in an otherwise normal individual. Fulminant hepatic failure results in progressive multi-organ failure with a dramatic impact in the brain. Severe cerebral edema is a frequent finding that ultimately lead to intracranial hypertension and death. The management of patients with FHF is aimed mainly in prevent or reversing increased intracranial pressure associated with support treatment for other failing organs. The definitive treatment for patients with FHF is liver transplantation. This article aims to present a practical approach to anesthesia care and intraoperative management of patients with FHF.
Key Words: Fulminant Hepatic failure, Liver failure, Intracranial Hypertension, Liver Transplantation, Anesthesia (Source: MeSH, NLM)
INTRODUCCIÓN
La Hepatitis Fulminante (HF) es una afección grave caracterizada por el desarrollo de encefalopatía y coagulopatía dentro de las 8 semanas después de la aparición de ictericia, en un paciente sin compromiso hepático previo. La causa más común es una hepatitis viral (VHB en la mayoría de los casos), seguida por la hepatitis medicamentosa (paracetamol, halotano, isoniazida, rifampicina, AINES, sulfonamidas, flutamida, ácido valproico, carbamazepina, “éxtasis”, etc.) e intoxicación exógena (tricloroetileno, tetracloroetano, hongos [Amanita phaloides]. La recuperación espontánea de la función hepática se da en el 70% de los grados de encefalopatía hepática I y II, y en menos del 20% en los grados III y IV. La mortalidad se aproxima al 80% sin trasplante hepático y su indicación está basada en los criterios del King’s College Hospital. (Tabla 1) (1)
La Hipertensión endocraneana (HIC), mayor causa de mortalidad en estos pacientes (responsable del 50 a 80% de las muertes), y secundaria a edema cerebral, que es el núcleo del proceso responsable por la encefalopatía hepática. Una manifestación clínica de la encefalopatía hepática(2-4) varía de confusión a coma y mantiene relación directa con la intensidad del edema cerebral y con la evolución de la gravedad de la HF. Al tiempo y de forma también rápida evolucionan las manifestaciones extra hepáticas, caracterizadas por un hiperdinamismo circulatorio con dependencia creciente de soporte farmacológico α−adrenérgico, IRA, coagulopatía e hipoglicemia, con progresión sin el trasplante, hacia el deterioro e hipoperfusión cerebral y falla multiorgánica.
En cuanto los trastornos de las funciones de síntesis del hígado enfermo pueden hasta cierto punto ser eludidas con la infusión de plasma fresco congelado, mientras que la insuficiencia de las funciones metabólicas (remover, metabolizar y detoxificar toxinas) responsables del edema cerebral y las manifestaciones extra hepáticas de la falla hepática aguda, aún no tienen medidas de soporte satisfactorio. Las perspectivas tecnológicas para el soporte y el tratamiento de la insuficiencia hepática aguda están en constante desarrollo y van desde sistemas de diálisis hepática (biológicas y no-biológicas) al xenotrasplante (trasplante entre individuos de especies diferentes); pero actualmente la precocidad en la realización de trasplante ortotópico de hígado es la única opción terapéutica definitiva para estos pacientes.(1,5)
EL PACIENTE.
Cardiovascular.
El hiperdinamismo circulatorio es una alteración cardiovascular característica de la insuficiencia hepática aguda. Este perfil hemodinámico es directamente proporcional al grado de disfunción hepática, estando constituido por disminución de la resistencia vascular sistémica, aumento del índice cardíaco, hipotensión arterial y aumento de la frecuencia cardíaca. La patogenia de la alteración circulatoria es posiblemente debido a un exceso de sustancias vasoactivas (principalmente vasodilatadoras) que no son debidamente depuradas de la circulación por la afección hepática, entre ellas el óxido nítrico, c GMP, Glucagón, ferritina y el VIP.(6,7)
En la Insuficiencia hepática aguda este predominio de vasodilatación arteriolar es acompañada de elevación de la actividad simpática y de activación del sistema renina-angiotensina-aldosterona, proporcionando aumento del volumen sanguíneo total, pero debido a su mala distribución, la volemia central se encuentra frecuentemente disminuida. La vasodilatación aumenta el shunt arterio-venoso periférico, elevando así el contenido y la saturación de oxígeno de la sangre venosa mixta con la consecuente disminución de la diferencia arterio-venosa de oxígeno. Pulmonar.
La hiperemia (PaO2<70 mph al aire ambiente) es un signo frecuente, debido al shunte intrapulmonar por arteriolas pulmonares anormalmente vasodilatadas y del compromiso de vasoconstricción pulmonar hipóxica. El control de los niveles de CO2 y la protección de la vía aérea constituyen las principales indicaciones de intubación traqueal de estos pacientes.(8)
Coagulación.
El hígado es el mayor sitio de síntesis de pro coagulantes y anticoagulantes del cuerpo (excepto el factor VIII, o activador tisular del plasminógeno [t- PA] y un inhibidor del activador del plasminógeno), y es también el mayor sitio de depuración de factores de coagulación activados, del t-PA y productos de degradación de la fibrina (PDFs).(9) La coagulopatía en la enfermedad hepática avanzada es debida a la disminución de la síntesis y función de los factores de coagulación asociada a disminución del número de plaquetas y de la agregación plaquetaria. La trombocitopenia en la Insuficiencia hepática aguda es frecuente con o sin presencia de CID, y se relaciona directamente con el sangrado. El tiempo de protrombina (o INR) es un marcador independiente de gravedad y pronóstico de la afección hepática.
Renal.
La primera manifestación del compromiso renal es la disminución del flujo sanguíneo renal, secundaria a estimulación neuro-humoral debido al aumento de la actividad simpática y de la activación del sistema renina-angiotensina-aldosterona. La etiología de la afección renal en la Insuficiencia hepática aguda es una combinación de insuficiencia renal aguda (IRA) hepato-renal y necrosis tubular aguda (NTA), y hasta el 75% de estos pacientes necesitan de terapia dialítica. La hemofiltración continua es preferida a la intermitente debido a su menor compromiso sobre la hemodinamia sistémica y la presión intracraneana (PIC).(8)
El síndrome Hepato-Renal (SHR) es un cuadro de IRA funcional caracterizada por una intensa vasoconstricción renal sin lesión morfológica significativa, particularmente frecuente en la enfermedad hepática crónica, mas también ocurre en la aguda. La patogénesis incluye la hipovolemia central con disminución del retorno venoso debido a la vasodilatación esplácnica, manifestándose con oliguria (<500 ml/día), Creatinina sérica >1.5 mg/dL (clearance <40 mL/min) y sodio urinario bajo (<10 mEq/L).(10) . El diagnóstico diferencial incluye IRA pre renal (que responde a expansión volémica) y la NTA (que presenta sodio urinario >10 mEq/L).(10). El SHR es un cuadro grave, potencialmente reversible con el trasplante de hígado y exige un mantenimiento de la volemia para prevenir la lesión pre renal en estos riñones ya comprometidos.(11)
Sistema Nervioso Central.
La encefalopatía hepática es un síndrome neuropsiquiátrico característico de la insuficiencia hepática aguda. La progresión de la de la encefalopatía en la insuficiencia hepática aguda implica un agravamiento del pronóstico y sus manifestaciones clínicas son, de un modo general, potencialmente revertidas con el restablecimiento de la función hepática o con un trasplante de hígado.
El edema cerebral es el centro del proceso responsable por la encefalopatía hepática(3,4). En la insuficiencia hepática el amonio deja de ser convertido en urea por el hígado con la consecuente hiperamonemia y baja urea sérica. En el caso de la hiperamonemia el cerebro detoxifica en el astrocito, el amonio en glutamina, aminoácido con potente efecto osmótico, generando edema glial y alteración de la comunicación interneural, potencializando inclusive la neuro-inhibición γ−aminobutírica (GABA).(12)
La repercusión clínica depende de la velocidad de aumento de la amonemia y de la capacidad adaptativa del SNC, con manifestaciones clínicas directamente proporcionales a la intensidad del edema cerebral, que van desde confusión mental hasta decorticación, decerebración y anisocoria (Tabla 2). Así que se debe evitar maniobras y/o fármacos que aumenten la presión intracraneana en todos los pacientes con encefalopatía, independientemente del grado.
En los pacientes con Hipertensión intracraneana refractaria mayor de 50 mmHg asociada a presión de perfusión cerebral menor de 40 mmHg por más de 2 horas el trasplante hepático puede no ser mas una opción terapéutica.(1,13)
EL INTRAOPERATORIO.
Anestesia.
La inducción anestésica es normalmente realizada después de la monitorización no invasiva convencional, excepto en los pacientes con encefalopatía grado III/IV o con uso de drogas vasoactivas.
En la inducción el riesgo siempre presente de aspiración pulmonar indica intubación con secuencia rápida de drogas y maniobra de Sellick, después de la administración de propofol o barbitúrico asociado a opioide y bloqueo neuromuscular con succinilcolina. En el mantenimiento de la anestesia se debe evitar el uso de anestésicos inhalatorios, principalmente en los pacientes con disminución de la compliance cerebral y en aquellos dependientes de soporte farmacológico hemodinámico α−adrenérgico. La anestesia es complementada con opioides y bloqueadores neuromusculares (BNM) de farmacocinética menos comprometida para la afección hepática terminal, como fentanil o sufentanil, asociada a atracurium ó, preferencialmente, cisatracurium por su menor liberación de histamina, ambos BNM de eliminación órgano-independiente.
En los pacientes con encefalopatía hepática por hepatitis fulminante, todo el esfuerzo debe ser concentrado en el mantenimiento de la presión de perfusión cerebral (PPC=PAM-PIC) mayor de 50 mmHg para evitar hipoperfusión cerebral y menor de 65 mmHg para evitar hiperemia cerebral.(14). En los pacientes en encefalopatía grado III, la intubación orotraqueal debe ser prontamente realizada en el pre operatorio para protección de la vía aérea y para que se pueda disponer precozmente de hiperventilación como parte del arsenal terapéutico. En aquellos que evolucionan a grado IV debe ser considerada la colocación de catéter de monitorización de PIC, fundamental en el manejo de estos pacientes.(15)
En el intraoperatorio, los pacientes en encefalopatía grados III y IV son considerados los de mayor riesgo para isquemia cerebral. Con respecto a las alteraciones extra hepáticas, de un modo general, mejoran inmediatamente con el explante del órgano nativo, el edema cerebral tiene resolución más lenta y picos de HIC pueden ocurrir aún después de la reperfusión del injerto y en el post operatorio inmediato, a pesar del buen funcionamiento del injerto.(16). Los períodos que más frecuentemente cursan con aumento de PIC y disminución de la perfusión cerebral son la fase I y la de reperfusión del injerto.( 16,17) Posición semi-fowler (20°) durante todo el procedimiento y el uso intermitente de manitol (20% - 0.5 a 1.0 g/kg en 20 minutos), tiopental (125 mg en bolos) e hiperventilación toda vez que la PIC pase de 25 mmHg, hacen parte de la estrategia protectora cerebral recomendada.( 8)
En los pacientes con HIC refractaria a la terapia convencional, la hipotermia moderada (33.5 °C) previene el aumento de la PIC durante el trasplante hepático.(17,18). Sus efectos protectores parecen potencializados por la disminución de la producción y de la respuesta en órganos blanco de los productos tóxicos liberados por el hígado necrótico.(18). El riesgo aumentado de depresión cardíaca, arritmias, hipocoagulación sanguínea y disminución de la función renal deben ser considerados frente a su efecto neuroproductor.
Monitoria y equipamiento.
El trasplante hepático es un procedimiento de alta complejidad, en que los resultados demostrarán estar en dependencia de avances tecnológicos para evitar la inestabilidad hemodinámica multifactorial y las alteraciones metabólicas que caracterizan el procedimiento. Una monitoria invasiva debe incluir, al menos, una línea arterial y dos accesos venosos de mayor calibre que 8 Fr (uno par colocación de catéter de Swan-Ganz). Tabla 3
La monitoria de la presión intracraneana (PIC) proporciona información esencial en el peri operatorio de trasplante de hígado en pacientes con hepatitis fulminante. En estos pacientes, para reducir el riesgo de hemorragia intracraneana, la colocación del catéter de monitorización de la PIC debe ser hecha después de la corrección de las alteraciones de la coagulación (INR<1.5 y plaquetas >50000 cel./mm3) y preferiblemente localizado en posición intraventricular.
Los equipos de soporte deben estar disponibles inmediatamente y sobre constante supervisión, pudiendo ser clasificados en cuatro grupos, conforme se describen en la tabla 4.
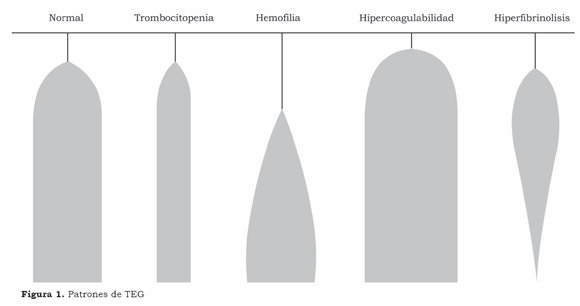
La monitorización de coagulación es realizada de rutina durante el trasplante hepático para disminuir el sangrado y la cantidad administrada de hemocomponentes, que en trasplante de hígado está asociado a aumento de morbimortalidad perioperatoria( 19,20). Por medio de los test de coagulación tradicionales (tiempo de protrombina, INR, tiempo de tromboplastina activado, tiempo de trombina, fibrinógeno, Dímero D) o por la tromboelastografía (TEG) y el recuento plaquetario, la monitoría debe indicar si existe coagulopatía, identificar la causa y la terapia adecuada de forma rápida, optimizando el uso de hemocomponentes. La dificultad de valoración y el tiempo de realización de la batería de exámenes convencionales de coagulación dificultan su implementación intraoperatoria y favorecen la incorporación del TEG, que de hecho es el único test que a través de un único análisis sanguíneo proporciona informaciones con respecto al balance entre coagulación y fibrinólisis, con agilidad y facilidad de realización e interpretación, permitiendo inclusive un análisis in vitro de la terapéutica.(21) El perfil global de coagulación puede ser cualitativa y cuantitativamente interpretado en términos de estado hipo, normal o hipercoagulabilidad y permite también un análisis del grado de lisis (Figura 1). Nuestra estrategia intraoperatoria está basada en el TEG junto al recuento del número de plaquetas. La coagulación sanguínea, de esta forma, es monitorizada por la clínica y orientada laboratorialmente y el uso de componentes sanguíneos está limitado a tratar aquellos disturbios de la coagulación que son clínicamente importantes, particularmente cuando estos tienen confirmación laboratorial.
Trasplante.
La cirugía para fines didácticos, comprende tres fases. La fase I o fase pre-anhepática se inicia con la inducción anestésica e incluye la hepatectomía, por lo tanto finaliza con la exclusión vascular hepática y retiro del órgano nativo. La fase II o fase anhepática se extiende desde la exclusión vascular hepática hasta la revascularización del injerto. La fase III o fase neo-hepática se inicia con la reperfusión hepática y con el restablecimiento del retorno venoso al corazón y finaliza con el cierre de la pared abdominal.
Pre-Anhepática.
La fase I es en general, la fase más laboriosa de la cirugía siendo la intercurrencia más común de sangrado con todas sus consecuencias – hipovolemia, hipocalcemia, hipotermia y transfusiones. Nuestro protocolo de reposición volémica intra operatoria a mantener un hematocrito entre 25 y 30% durante todas las fases del trasplante.
La hipocalcemia (calcio ionizado <1.13 mmol/L) ocurre con frecuencia en esta fase principalmente durante la administración de hemocomponentes. El citrato, presente en los hemocomponentes, que es rápidamente metabolizado por el hígado normal, en la enfermedad hepática tiene su depuración circulatoria disminuida, haciendo a estos pacientes particularmente sensibles a la intoxicación por citrato. Típicamente la hipocalcemia se manifiesta con depresión miocárdica (hipotensión arterial, aumento de las presiones de llenado) y en el electrocardioscopio puede ser detectado un alargamiento del intervalo QT. El tratamiento consiste en la administración de Cloruro de calcio (10 mg/Kg) o gluconato de calcio (30 mg/Kg).
El magnesio iónico también tiene sus niveles séricos disminuidos por la tasa de infusión de citrato y la hipomagnasemia está asociada a depresión miocárdica y arritmias cardíacas. (22) A pesar de no ser frecuente la aplicación intraoperatoria, cuadros de depresión miocárdica y arritmias, después de politransfusión y de la reperfusión, refractarios a terapéutica convencional, principalmente en aquellos pacientes con hipomagnasemia preoperatoria, indican la reposición de magnesio.
El riesgo de hipoglicemia está siempre presente en la insuficiencia hepática por disminución de los depósitos de glicógeno hepático, compromiso de la gliconeogénesis y disminución de la depuración de insulina por el hígado enfermo en la insuficiencia hepática aguda; monitoria intensiva debe ser realizada en las fases I y II del trasplante.(23,24)
La hipopotasemia es común en la hepatitis fulminante independiente del compromiso renal, pero se deben evitar correcciones agresivas anticipando al período hipercalémico que acompaña la reperfusión hepática. En los pacientes oligúricos con hiperpotasemia la diálisis intraoperatoria debe ser considerada precozmente en cirugía.
Anhepática.
Las alteraciones hemodinámicas más significativas del trasplante hepático ocurren al inicio y al final de esta fase, que de un modo general duran cerca de 60 minutos. A pesar del hiperdinamismo circulatorio puede mejorar con el retiro del órgano nativo, las alteraciones del retorno venos secundarias a la hepatectomía al inicio de esta fase, junto con las alteraciones hemodinámicas de reperfusión al final de la misma, hace de este período el de perfil hemodinámico mas agitado de la cirugía.
Esta fase se inicia con el pinzamiento de la vena porta (flujo: 1300 mL/min) y, dependiendo de la técnica operatoria, también con una interrupción del flujo sanguíneo de la vena cava inferior, siendo hemodinámicamente caracterizada por disminución del índice cardíaco, aumento de la resistencia vascular periférica y bajas presiones de llenado cardíaco.
La hepatectomía puede ser realizada por dos técnicas quirúrgicas, por la técnica convencional o por la técnica de piggyback, que se diferencian por el pinzamiento o no de la vena cava inferior y, por lo tanto por el grado de compromiso del retorno venoso cardíaco durante toda la fase anhepática. Una técnica convencional requiere pinzamiento total de la vena cava inferior para la extracción hepática, con reducción de hasta el 50% del débito cardíaco. En la técnica de piggyback la vena cava permanece intacta durante el implante del injerto, proporcionando mejor estabilidad hemodinámica en este período.
La elección de una técnica u otra depende tanto de la preferencia del equipo quirúrgico como la presencia de dificultades técnicas presentadas durante la hepatectomía.
En la fase II, con la ausencia total de la función hepática, la hipocalcemia, la hipomagnasemia, la hipotermia y la hipoglicemia suceden más intenso y más frecuentemente. La fibrinólisis puede tener su cuadro agravado en esta fase por ausencia de depuración hepática de t-PA. Los pacientes con afección hepática avanzada, con fase II prolongada, son los que más comúnmente hiperfibrinolisis en los exámenes de laboratorio con importante manifestación clínica; en ellos, la terapia debe ser realizada con ácido aminocaproico a dosis de 50 mg/ Kg o ácido tranexámico a dosis de 10 mg/Kg para el control clínico de la hiperfibrinolisis hasta que el injerto funcione.
El objetivo principal de la fase anhepática es preparar al paciente para la reperfusión hepática, considerado el momento del trasplante donde las alteraciones hemodinámicas ocurren con mayor frecuencia e intensidad, recomendándose, cinco minutos antes de la reperfusión aumentar la fracción inspirada de O2 para 1.0.
Neo hepática – Reperfusión.
La reperfusión hepática, o sea, la restauración del flujo sanguíneo hepático, es un momento crítico del trasplante de hígado y el período más frecuente de inestabilidad hemodinámica,(25-28), aumento de la PIC y gran riesgo de isquemia cerebral en los pacientes con hepatitis fulminante.(16,17)
La respuesta hemodinámica ocurre por la súbita liberación en la circulación de sangre acidótica, hiperpotasémica, rica en sustancias vasoactivas y agentes tóxicos liberados tanto por el injerto en el proceso de isquemia y reperfusión hepática como por los acumulados en la circulación esplácnica durante el pinzamiento de la vena porta.(29)
Desde el punto de vista hemodinámico este período se caracteriza por caída de la presión arterial y de la resistencia vascular sistémica con aumento del índice cardíaco, que generalmente persiste por una o dos horas.(27)
El síndrome post reperfusión es un fenómeno hemodinámico agudo y transitorio de colapso cardiovascular que sucede con la revascularización, ocurriendo disminución de la presión arterial, de la resistencia vascular sistémica y de la contractilidad miocárdica acompañada de aumento de las presiones de llenamiento, de la resistencia vascular pulmonar (manifestada por aumento de las presiones de la arteria pulmonar media y en cuña) (30) y bradicardia(31), pudiendo evolucionar súbitamente a paro cardíaco(32) . El síndrome post reperfusión ocurre en cerca del 30% de los trasplantes hepáticos y clásicamente tiene un patrón hemodinámico caracterizado por caída de la presión arterial media de más del 30% de los valores pre reperfusión, con duración mayor de un minuto, ocurriendo en los primeros cinco minutos de la reperfusión. (27) Otros grupos definen el síndrome como una caída de la presión arterial media a valores inferiores a 60 mmHg en adultos y 50 mmHg en los niños en los primeros minutos de la reperfusión.(26) Donadores e injertos marginales (alto grado de esteatosis, historia de paro cardíaco, dependientes de elevado soporte farmacológico α−adrenérgico, hipotensos y con edad mayor de 50 años) y tiempo de isquemia prolongado constituyen factores de riesgo para el desarrollo del síndrome de reperfusión e de (7,33) El síndrome tiende a ser más grave en el primer minuto de reperfusión y de manera general deja de ser crítico después del 5° minuto, presión arterial media menor de 60 mmHg es preferencialmente tratada con adrenalina en bolos de 50 μg y con una infusión de líquidos orientada por las presiones venosas, la necesidad de soporte continuo adrenérgico es decidida por la evolución de los datos hemodinámicos.
Actualmente en el intraoperatorio, la profilaxis es la única forma de atenuar los efectos hemodinámicos de la reperfusión y tiene como base un riguroso control hemodinámico por medio de la monitoria invasiva asociado al control metabólico y hidroelectrolítico en los períodos que anteceden a la reperfusión.
La hiperpotasemia es la alteración electrolítica de consecuencias más graves en la reperfusión, tornando obligatorio las medidas profilácticas para mantenimiento del potasio sérico en niveles inferiores a 4.0 mEq/L durante la fase anhepática. Un nivel de potasio mayor de 5.0 mEq/L en la fase anhepática constituye un factor de riesgo para el desarrollo de hiperpotasemia en a reperfusión(34) y debe ser y debe ser tratado de forma agresiva antes de ella.(23,35) Electrocardioscópicamente la hiperpotasemia se manifiesta por ondas T picudas y simétricas y en los casos más graves con alargamiento del complejo QRS, pudiendo evolucionar a taquicardia ventricular o FV, siendo la administración de calcio y bicarbonato de sodio las medidas más eficaces para llevar el potasio al medio intracelular con rapidez suficiente para tratar la hiperpotasemia de reperfusión.
La coagulopatía en la fase neo hepática es debida a un aumento exacerbado y transitorio de la actividad de t-PA, de la actividad proteolítica, de la liberación de heparina o factores heparinoides del injerto, hipotermia y acidosis, resultando en un cuadro de hiperfibrinolisis e hipocoagulación. (36-38) La coagulopatía, si el hígado implantado funciona adecuadamente, se restringe a la primera hora de reperfusión y no requiere intervención.
La necesidad creciente de soporte farmacológico hemodinámico, hiperfibrinolisis grave y prolongada, hipocalcemia, acidosis metabólica persistente, hipotermia refractaria, hipoglicemia y oliguria son signos clásicos de disfunción del injerto.
Típicamente caracteriza un buen funcionamiento del injerto el hecho de que las alteraciones hemodinámicas, metabólicas, de coagulación, electrolíticas y acido-básicas de reperfusión se autolimiten. (Tabla 5)
REFERENCIAS
1. Punch JD. Bridges to transplantation. Anesthesiol Clin North America. 2004 Dec;22(4):863-9. [ Links ]
2. Vaquero J, Chung C, Cahill ME, Blei AT. Pathogenesis of hepatic encephalopathy in acute liver failure. Semin Liver Dis. 2003 Aug;23(3):259-69. [ Links ]
3. Donovan JP, Schafer DF, Shaw BW, Jr., Sorrell MF. Cerebral oedema and increased intracranial pressure in chronic liver disease. Lancet. 1998 Mar 7;351(9104):719-21. [ Links ]
4. Haussinger D, Kircheis G, Fischer R, Schliess F, vom Dahl S. Hepatic encephalopathy in chronic liver disease: a clinical manifestation of astrocyte swelling and low-grade cerebral edema? J Hepatol. 2000 Jun;32(6):1035-8. [ Links ]
5. Bacher A, Zimpfer M. Hot topics in liver intensive care. Transplant Proc. 2008 May;40(4):1179-82. [ Links ]
6. Debray D, Yousef N, Durand P. New management options for end-stage chronic liver disease and acute liver failure: potential for pediatric patients. Paediatr Drugs. 2006;8(1):1-13. [ Links ]
7. Han MK, Hyzy R. Advances in critical care management of hepatic failure and insufficiency. Crit Care Med. 2006 Sep;34(9 Suppl):S225-31. [ Links ]
8. Ekser B, Gridelli B, Tector AJ, Cooper DK. Pig liver xenotransplantation as a bridge to allotransplantation: which patients might benefit? Transplantation. 2009 Nov 15;88(9):1041-9. [ Links ]
9. Galvao FH, Pompeu E, de Mello ES, da Costa Lino Costa A, Mory E, Dos Santos RM, et al. Experimental multivisceral xenotransplantation. Xenotransplantation. 2008 May;15(3):184-90. [ Links ]
10. Mitzner SR, Stange J, Klammt S, Koball S, Hickstein H, Reisinger EC. Albumin dialysis MARS: knowledge from 10 years of clinical investigation. ASAIO J. 2009 Sep-Oct;55(5):498-502. [ Links ]
11. Mushlin PS, Gelman S. Anesthesia and the Liver, em: Barash PG, Cullen BF, Stoelting RK - Clinical Anesthesia, 4ª edição, Filadélfia, Lippincott Williams & Wilkins, 2001;1067-101. [ Links ]
12. Steadman RH. Anesthesia for liver transplant surgery. Anesthesiol Clin North America. 2004 Dec;22(4):687- 711. [ Links ]
13. Krowka MJ, Porayko MK, Plevak DJ, Pappas SC, Steers JL, Krom RA, et al. Hepatopulmonary syndrome with progressive hypoxemia as an indication for liver transplantation: case reports and literature review. Mayo Clin Proc. 1997 Jan;72(1):44-53. [ Links ]
14. Lai WK, Murphy N. Management of acute liver failure. Continuing Education in Anaesthesia, Critical Care & Pain. 2004;4(2):40-3. [ Links ]
15. Kang Y, Lewis JH, Navalgund A, Russell MW, Bontempo FA, Niren LS, et al. Epsilon-aminocaproic acid for treatment of fibrinolysis during liver transplantation. Anesthesiology. 1987 Jun;66(6):766-73. [ Links ]
16. Petrovich CT. An approach to the patient who may have a bleeding disorder. ASA Refresher Courses in Anesthesiology. 2004;32(236):1-5. [ Links ]
17. Moller S, Bendtsen F, Henriksen JH. Pathophysiological basis of pharmacotherapy in the hepatorenal syndrome. Scand J Gastroenterol. 2005;40:491- 500. [ Links ]
18. Iwatsuki S, Popovtzer MM, Corman JL, Ishikawa M, Putnam CW, Katz FH, et al. Recovery from "hepatorenal syndrome" after orthotopic liver transplantation. N Engl J Med. 1973 Nov 29;289(22):1155-9. [ Links ]
19. Clemmesen JO, Larsen FS, Kondrup J, Hansen BA, Ott P. Cerebral herniation in patients with acute liver failure is correlated with arterial ammonia concentration. Hepatology. 1999 Mar;29(3):648-53. [ Links ]
20. Mukherjee KK, Chhabra R, Khosla VK. Raised intracranial pressure in hepatic encephalopathy. Indian J Gastroenterol. 2003 Dec;22 Suppl 2:S62-5. [ Links ]
21. Rocha Filho JA, Rocha JPS, Nani RS. Anestesia para transplante hepático. In: Cangiani LM, Posso IP, Poterio GMB, editors. Tratado de Anestesiologia. São Paulo: Atheneu; 2006. p. 1899-909. [ Links ]
22. Jalan R. Intracranial hypertension in acute liver failure: pathophysiological basis of rational management. Semin Liver Dis. 2003 Aug;23(3):271-82. [ Links ]
23. Ellis A, Wendon J. Circulatory, respiratory, cerebral, and renal derangements in acute liver failure: pathophysiology and management. Semin Liver Dis. 1996 Nov;16(4):379-88. [ Links ]
24. Wendon J, Lee W. Encephalopathy and cerebral edema in the setting of acute liver failure: pathogenesis and management. Neurocrit Care. 2008;9(1):97- 102. [ Links ]
25. Rabadan AT, Spaho N, Hernandez D, Gadano A, de Santibanes E. Intraparenchymal intracranial pressure monitoring in patients with acute liver failure. Arq Neuropsiquiatr. 2008 Jun;66(2B):374-7. [ Links ]
26. Detry O, Arkadopoulos N, Ting P, Kahaku E, Margulies J, Arnaout W, et al. Intracranial pressure during liver transplantation for fulminant hepatic failure. Transplantation. 1999 Mar 15;67(5):767-70. [ Links ]
27. Jalan R, Davies NA, Damink SW. Hypothermia for the management of intracranial hypertension in acute liver failure. Metab Brain Dis. 2002 Dec;17(4):437-44. [ Links ]
28. Filho JA, Machado MA, Nani RS, Rocha JP, Figueira ER, Bacchella T, et al. Hypertonic saline solution increases cerebral perfusion pressure during clinical orthotopic liver transplantation for fulminant hepatic [ Links ]











 text in
text in