Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Colombian Journal of Anestesiology
versión impresa ISSN 0120-3347
Rev. colomb. anestesiol. v.38 n.1 Bogotá ene./mar. 2010
Artículo de Reflexión
Fentanilo PK/PD, un medicamento vigente
Luis Alberto Tafur*, Ana Milena Serna**, Eduardo Lema***
* Médico anestesiólogo, Universidad del Valle, Hospital Universitario del Valle; Clínica Visual y Auditiva, Instituto para Niños Ciegos y Sordos del Valle del Cauca, Cali, Colombia
** Médica anestesióloga, Universidad del Valle, Hospital Universitario del Valle, Cali, Colombia
*** Médico anestesiólogo, Universidad del Valle, Hospital Universitario del Valle; Clínica Visual y Auditiva, Instituto para Niños Ciegos y Sordos del Valle del Cauca; docente, Departamento de Anestesiología, Universidad del Valle, Cali, Colombia
Recibido: noviembre 8 de 2009. Enviado para modificaciones: diciembre 1 de 2009. Aceptado: febrero 16 de 2010.
RESUMEN
Con la aparición de nuevos medicamentos opioides en el mercado de los fármacos anestésicos, podríamos pensar que disponemos de moléculas capaces de reemplazar al legendario fentanilo. Sin embargo, el estudio de sus propiedades farmacocinéticas y farmacodinámicas, nos permite utilizarlo de una manera adecuada, aprovechando su potencia, su excelente analgesia y su seguridad, comparable esta última con los demás opioides cuando se administra con la guía de modelos farmacocinéticos.
Para esto, es necesario tener en cuenta que varios de los medicamentos utilizados con frecuencia durante el acto anestésico (midazolam, dexametasona, prednisolona, ketamina, etc.), pueden influenciar su metabolismo por la enzima citocromo P4503A4.
El conocimiento y la aplicación juiciosa de los modelos farmacocinéticos nos permiten estimar las concentraciones plasmáticas, de modo que nos brinde las mejores condiciones analgésicas, asociadas a un destacado sinergismo con los hipnóticos de uso frecuente, como el propofol y el desfluorano. Su aprovechamiento es máximo cuando se utiliza con una indicación específica, como en cirugía prolongada (mayor de 120 minutos) o que represente un estímulo de percepción del dolor importante para el paciente.
Palabras clave: fentanilo, farmacocinética, farmacología, nomogramas, anestesia intravenosa (Fuente: DeCS, Bireme)
INTRODUCCIÓN
El opio fue llamado así por Hipócrates hacia el año 400 a.C. y significa jugo. Los opioides son un grupo de fármacos, derivados o no del opio, con una afinidad selectiva por los receptores opioides, es decir, poseen actividad del tipo de la morfina. El término opiáceo se utiliza para nombrar toda sustancia derivada del opio que tenga o no actividad similar a la morfina (1). La evolución de la anestesia ha ocurrido a la par con el desarrollo de nuevos medicamentos con propiedades excepcionales. Sin embargo, el conocimiento juicioso de la farmacocinética y farmacodinámica de sus predecesores, nos permiten continuar contando con ellos de manera segura y eficiente.
OBJETIVO
Revisar las propiedades farmacocinéticas y farmacodinámicas del fentanilo que proporcionen al lector herramientas de juicio en la selección del mismo como un medicamento vigente.
Se realizó una búsqueda en el PubMed de artículos sobre la farmacocinética y farmacodinámica de los opioides, seleccionando aquellos relevantes para incluirlos en la revisión.
Los opioides pueden dividirse en tres grupos. El primero son los alcaloides naturales del opio, al cual pertenecen los derivados del fenantreno (morfina y codeína) y los derivados de la benzilisoquinolina (papaverina y tebaína).
El segundo son los opioides semisintéticos, entre los que se encuentran los derivados de la morfina (oximorfona e hidromorfona), los derivados de la tebaína (bupremorfina e hidromorfona) y los derivados de la codeína (tramadol).
El tercer grupo corresponde a los opioides sintéticos, al cual pertenecen los morfinanos (levorfanol, nalbufina, naloxona y naltrexona), las fenilheptilaminas (metadona, propoxifeno) y las fenilpiperidinas (meperidina, fentanilo, sufentanilo, alfentanilo y remifentanilo).
La potencia de los opioides en orden ascendente, sigue este acróstico "MEMO ALFERESU´ el menos potente es la meperidina y los más potentes son morfina, alfentanilo, fentanilo, remifentanilo y sufentanilo. El fentanilo es, en promedio, 100 veces más potente que la morfina y el remifentanilo, cuatro veces más que el fentanilo (2)
El 8 % del fentanilo es eliminado sin sufrir ningún cambio y 6 % se excreta por orina y 2 % por materia fecal. Más de 80 % del fentanilo que ingresa al organismo es metabolizado por la citocromo P4503A4, presente en el hígado y en el intestino. El 99 % de los metabolitos del fentanilo corresponde al norfentanilo (metabolito inactivo), el cual es excretado 76 % por orina y 8 % por materia fecal (2,3,4).
Cuando administramos fentanilo, debemos tener presente los medicamentos que inhiben la citocromo P4503A4, ya que esto implicaría menor producción de norfentanilo y mayor disponibilidad de fentanilo, lo que altera completamente la farmacocinética y farmacodinámica de este medicamento (5)
Labroo et al. (6) demostraron que el midazolam disminuía la producción de norfentanilo casi en 95 %, tanto en el hígado como en la luz intestinal. Otros medicamentos que afectan esta enzima y que manejamos a diario son: la dexametasona, la prednisolona, la ketamina, los antidepresivos y el alfentanilo, entre otros.
Hacia los años 80, con el uso masivo del fentanilo, empezaron a reportarse casos de depresión respiratoria en las unidades de cuidado posanestésico. Una de las posibles explicaciones era la reabsorción del fentanilo en la luz intestinal después de su excreción en el estómago (7). Los estudios que sustentaban esta hipótesis se llevaron a cabo en animales, pero no existen reportes en la literatura que documenten concentraciones elevadas de fentanilo en la luz intestinal en humanos.
Los casos documentados de depresión respiratoria en la literatura, muestran que la forma de utilización del fentanilo fue en bolos y asociado a otros medicamentos con farmacocinética poco conocida (8,9)
Con el desarrollo de nuevos agentes anestésicos con propiedades farmacocinéticas y farmacodinámicas bien establecidas y con el conocimiento de los modelos farmacocinéticos del fentanilo (10,11,12), estos casos de depresión respiratoria en las unidades de cuidado posanestésico, prácticamente han desaparecido según la literatura.
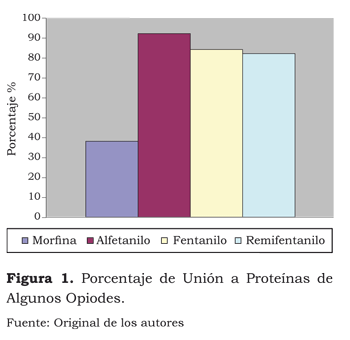
La unión a proteínas del fentanilo es de 84 %, muy similar a la del alfentanilo y el remifentanilo (figura 1).
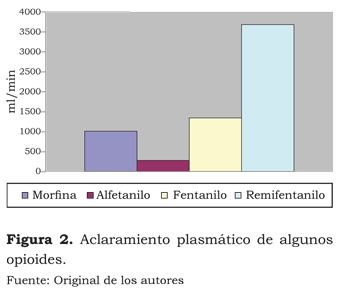
Su volumen de distribución de 300 a 350 litros se explica por su gran liposolubilidad y su bajo peso molecular. El aclaramiento de 1 400 ml por minuto es superado por el del remifentanilo (3 700 ml por minuto) y muy superior al del alfentanilo (300 ml por minuto) (figura 2).
El fentanilo parece ofrecer mayor seguridad que el alfentanilo si tenemos en cuenta que, dada la mayor potencia del primero, la masa requerida para anestesia es menor que la del segundo y que, además, el aclaramiento del fentanilo es mayor que el del alfentanilo (13,14,15).
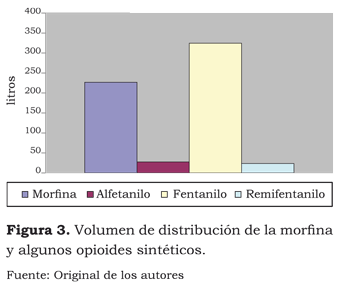
El fentanilo tiene el pKa más alto de todos los opioides (8,4) Es así como, a un pH de 7,4, el porcentaje de la forma no ionizada no supera el 10 %. Por lo tanto, su inicio de acción depende de su volumen de distribución (figura 3).
El tiempo medio de KeO, definido como el tiempo que tarda el fármaco en el compartimiento efector en alcanzar la mitad de la concentración plasmática, determina el tiempo de inicio de efecto del medicamento.
La KeO del fentanilo es de 0,10 minutos y su tiempo medio de KeO es de 6,6 minutos. Esto se explica por su elevado pKa (8,4) que, a diferencia del alfentanilo y el remifentanilo (pKa de 6,4 y de 7,1), manejan tiempos medios de KeO de 0,6 y 0,9 minutos, respectivamente(7).
Para administrar el fentanilo de una manera farmacocinética (8,16) se dispone de varios modelos. Los más utilizados son el de Shafer (17,18)y el de Scott (19) La gran diferencia entre estos dos radica en los mayores volúmenes de distribución utilizados por el segundo. Estos modelos están basados en poblaciones con un índice de masa corporal normal, es decir, fueron diseñados para poblaciones con un peso promedio entre 65 y 70 kg.
El error promedio de desempeño absoluto varía entre 21 % y 32 % para el modelo de Shafer y entre 21 % y 33 % para el de Scott. El cuadrado del error medio del primero varía entre 34 % y 49 % y el del segundo, entre 27 % y 70 %.
A pesar de que el modelo de Shafer tiene el menor porcentaje de error, éste puede considerarse muy alto, razón por la cual, cuando manejamos estos modelos, es mejor tener precisión que exactitud. Por lo tanto, no importa cuál modelo escojamos siempre y cuando utilicemos el mismo en todos los pacientes. Además, cuando estemos leyendo sobre las concentraciones plasmáticas del fentanilo, debemos tener presente cuál fue el modelo aplicado en ese estudio para no hacer interpretaciones erradas y planear infusiones inadecuadas.
Si a un hombre de 25 años con 65 kg de peso y 1,65 m de estatura, le aplicamos 3 µg/kg de fentanilo, alcanzará un pico plasmático de 27 ng/ml, según Shafer, y de 13 ng/ml, según Scott. La concentración en el sitio de efecto a los cinco minutos será de 3,4 ng/ml y de 2,4 ng/ml, respectivamente (figuras 4 y 5).
En nuestro caso, preferimos el modelo de Scott por tres razones. La primera es que los textos guía, como Barash, describen concentraciones plasmáticas basadas en este modelo. La segunda es que la probabilidad de falta de respuesta al estímulo quirúrgico en 50 % de los pacientes, cuando se usa propofol a una concentración plasmática de 3,7 µg/ml, se alcanza con fentanilo a una concentración plasmática de 1,1 ng/ml para cirugías de 300 minutos, según el modelo de Scott. La tercera es que la correlación para administrar fentanilo en pacientes obesos, de acuerdo con el nomograma diseñado por Shibutani(20) y la administración haciendo el ajuste del 20 % de más sobre el peso ideal, se aproxima más al modelo de Scott (figura 6).
Cuando se administra solo, la concentración plasmática de propofol requerida para que 50 % de los pacientes no respondan al estímulo durante la incisión quirúrgica, es de 15,2 µg/ml(21) Cuando tenemos una concentración de fentanilo de 1 ng/ml, se disminuye la necesidad de propofol a concentraciones de 5 µg/ml y, a concentraciones de fentanilo de 2 ng/ml, a 2,5 µg/ml; a concentraciones de 3 ng/ml de fentanilo se dismunuye a 1,3 µg/ml y, a concentraciones de 4 ng/ml, a 1.2 µg/ml de propofol. La mayor reducción en la concentración de propofol se obtiene con concentraciones de fentanilo entre 2 y 3 ng/ml (65 % a 80 %, respectivamente) (22). Por encima de estas concentraciones de fentanilo, el beneficio es mínimo y se nota claramente un efecto techo del opioide cuando se combina con un hipnótico.
Con base en lo anterior, podemos deducir que la concentración plasmática óptima de fentanilo para intubar a un paciente, cuando se acompaña de un hipnótico, se encuentra entre 2 y 3 ng/ml en el sitio de efecto. Esto se alcanza con dosis de fentanilo entre 3 y 4 µg/kg de peso. Después de 30 minutos de haber colocado estas dosis, la concentración en el sitio de efecto es de 0,9 ng/ml y 1,2 ng/ml y a los 40 minutos es de 0,7 ng/ml y 0,9 ng/ml, respectivamente. El riesgo de depresión respiratoria está presente a concentraciones por encima de 1 ng/ml (23,24).
La concentración de fentanilo requerida durante el mantenimiento anestésico depende del tiempo y el tipo de cirugía (1,2). Procedimientos que duren 1 a 5 horas requieren una concentración de fentanilo entre 1,3 y 1,1 ng/ml y de propofol entre 3,4 y 3,7 µg/ml, respectivamente. El tiempo de despertar después de finalizada la infusión varía entre 12 y 20 minutos.
El tiempo de despertar cuando administramos fentanilo con propofol, no depende de las concentraciones del primero (3,4). Así, con concentraciones de propofol de 1,7 µg/ml en el sitio de efecto, el despertar ocurre independientemente de si tenemos concentraciones de fentanilo de 0,8, 1,0, 1,4, 2,0 o 3,0 ng/ml. Lastimosamente, el propofol carece de efecto analgésico, lo cual lo hace insuficiente para el mantenimiento de la analgesia durante el transoperatorio.
En nuestro concepto, el mejor hipnótico para la administración del fentanilo es el desfluorano o el sevofluorano (5), ya que por su bajo coeficiente sangre/gas brinda un despertar rápido. Además, por su efecto analgésico, permiten controlar los estímulos dolorosos durante el transoperatorio (30).
Las cirugías con mejor indicación para uso de fentanilo serían aquéllas con duración superior a dos horas y las que presenten mayor estímulo doloroso (columna, ortopedia, bypassi y de tórax, entre otras) y con un tiempo quirúrgico estimado conocido.
El midazolám, a dosis de 30 µg/kg antes de la inducción, con dosis de fentanilo entre 3 y 4 µg/kg, 3 a 5 minutos antes de la intubación y dosis de 5 mg/kg de tiopental sódico (fragmentada en dos, las dos terceras partes iniciales y la tercera parte un minuto antes de la intubación), con 2 ED95 de cualquier relajante muscular, provee condiciones de intubación excelentes sin necesidad de abrir el vaporizador. Después de la inducción, si ajustamos la tasa de infusión para una concentración plasmática de fentanilo entre 1,2 y 1,4 ng/ml con 0,8 a 1 MAC de desfluorano a 0,4 litros, es suficiente para mantener unas condiciones anestésicas adecuadas en cirugías como las de bypassi y columna. El consumo promedio de desfluorano con fentanilo en estas cirugías es de 12 ml por hora, mientras que el consumo con remifentanilo es de 8 ml por hora. En la era de los costos, parece ser muy atractiva esta combinación, con la ventaja de una mejor analgesia posoperatoria y un rápido despertar.
Para administrar el fentanilo de una forma farmacocinética, lo podemos hacer por medio de un sistema de infusión computadorizado (target controlled infusion) o con base en nomogramas. Para mantener una concentración plasmática entre 1,1 y 1,2 ng/ml, por ejemplo, debemos iniciar con una infusión de 8 µg/kg por hora durante, por lo menos, quince minutos y, luego, realizar los ajustes pertinentes de acuerdo con el nomograma, según el tiempo, para mantener la concentración plasmática (figura 7). Es necesario aclarar que aun alcanzando este nivel, no obtendríamos la concentración plasmática requerida para la intubación (2 ng/ml). Necesitaríamos entonces una infusión adicional o una dosis de carga de fentanilo.
Una dosis de fentanilo entre 3 y 4 µg/kg, 3 a 5 minutos antes de la intubación, y continuando con una infusión de 2,2 µg/kg por hora desde el momento mismo de aplicada la dosis inicial, provee las condiciones necesarias tanto para la intubación como para el inicio de la cirugía de manera rápida, dado que, de esta forma, obtenemos 2 ng/ml y aseguramos la concentración plasmática elegida, 1,1 a 1,2 ng/ml, para este caso, desde el inicio de la cirugía. Después de iniciada la infusión, se realizan ajustes cada 30 minutos, a 1,8, 1,5, 1,3, 1,2, 1,1 y 1,0 µg/kg por hora para mantener el mismo nivel plasmático (figura 8).
Para cirugía ambulatoria menor de dos horas es preferible usar un bolo de fentanilo así: cirugías con duración entre 15 y 20 minutos, 2 µg/kg; entre 30 y 40 minutos, 3 µg/kg; de 60 minutos, 4 µg/kg; de 90 minutos, 5 µg/kg y de 120 minutos, 6 µg/kg. La concentración en el sitio de efecto después del tiempo establecido para cada dosis es menor de 0,8 ng/ml.
El midazolam, a dosis de 30 µg/kg antes de la inducción, un bolo de fentanilo de acuerdo con la duración de la cirugía (diluido y lento) 3 a 5 minutos antes de la intubación, dosis de 2 a 3 mg/kg de propofol y 1 a 2 ED(95) de rocuronio, proveen condiciones de intubación excelentes sin necesitad de abrir el vaporizador. Después de la inducción, si mantenemos 0,8 a 1 CAM (Concentración Alveolar Mínima) de sevofluorano a 0,8 litros, es suficiente para unas condiciones anestésicas adecuadas. El despertar del paciente ocurre cuando tenemos 0,1 CAM de sevofluorano. En cirugías de otorrinolaringología, el CAM de sevofluorano con fentanilo a estas dosis es de 0,8 a 1, mientras que el CAM con remifentanilo es de 0,5 a 0,6.
La incidencia de náusea y vómito posoperatorios durante una técnica de inducción con fentanilo y propofol, no es diferente a la de remifentanilo con sevofluorano (7). Diferentes estudios han determinado la incidencia de náuseas y vómito posoperatorios comparando el remifentanilo con opioides tales como el alfentanilo y el fentanilo (8,9,10,11,12,13,14,15,16). La conclusión de la mayoría de ellos, es que la incidencia de náusea y vómito posoperatorios no cambia significativamente con los diferentes opioides.
Rama-Maceiras et al. (17), en el 2005 y en un ensayo clínico controlado, demostraron que la incidencia de náusea y vómito fue mayor con fentanilo cuando se comparó con remifentanilo, en pacientes a quienes se les practicó cirugía plástica utilizando un hipnótico como el propofol. Lastimosamente, en el protocolo de este trabajo no se administró el fentanilo de una forma farmacocinética y se desconoce la concentración plasmática asociada a este evento. Además, los criterios para administrar fentanilo fueron los mismos que para el remifentanilo, sin tener en cuenta la farmacocinética tan diferente entre ambos medicamentos. El tiempo promedio de cirugía fue 129±79 min (53 a 325) y el consumo de fentanilo fue de 630±420 µg (13 a 1 920 µg). En el análisis de los datos no se aclara si la incidencia de náusea y vómito posoperatorios fue mayor en aquellos pacientes que requirieron mayor dosis de fentanilo.
El interrogante continúa, pero los estudios disponibles por el momento parecieran no mostrar diferencias entre fentanilo y remifentanilo en cuanto a náusea y vómito posoperatorios.
Otro de los efectos adversos del fentanilo, al igual que de los otros opioides(18), principalmente cuando se administran altas dosis o bolos rápidos, es el tórax leñoso o la rigidez muscular(19). El espectro clínico puede ir desde la rigidez muscular leve, pasando por movimientos tipo escalofrío, hasta presentar episodios similares a los de una convulsión tónica-clónica generalizada(20,21,22). Asociada a estos episodios, se ha documentado una tensión sobre los músculos de la laringe, especialmente en las cuerdas vocales, similar a un laringoespasmo que se revierte con la naloxona (22) o con dosis de relajante muscular plena, 2 a 3 ED(95).
La incidencia de este síndrome, mayor en edades extremas de la vida (36,24), se presenta a concentraciones en el sitio de efecto superiores a 10 ng/ml de fentanilo33 y se postula que su génesis está relacionada con la modulación de la vía del ácido gamma-aminobutírico en el cordón espinal y en los ganglios basales por medio de la unión de los receptores opioides µ y ?(36). Los estudios en animales también sugieren que la estimulación de los receptores opioides en los ganglios basales induce la rigidez muscular. Otros autores han documentado, en ratas (25), que los receptores de adenosina A1 y A2 en el cordón espinal pueden ser más importantes que aquéllos del sistema nervioso central, para explicar la rigidez muscular.
CONCLUSIÓN
El fentanilo es un opioide con unas características farmacocinéticas y farmacodinámicas que lo hacen ideal en cirugía prolongada con una gran necesidad de analgesia. El uso concomitante de medicamentos que afectan la CP450, como la dexametasona, el midazolam y los antidepresivos, entre otros, disminuye la producción de norfentanilo (metabolito inactivo). Una dosis para intubación entre 3 y 4 µg/kg, después de 30 minutos, alcanza una concentración plasmática por debajo de 1 ng/ml (límite de apnea). El fentanilo administrado de acuerdo con un modelo farmacocinético, ajustando una concentración plasmática entre 1,2 y 1,4 ng/ml, provee una adecuado nivel de analgesia, disminuyendo los efectos adversos como depresión respiratoria. El hipnótico ideal para administrar el fentanilo en infusión continua, en cirugías mayores de dos horas, es el desfluorano o el sevofluorano a concentraciones entre 0,8 y 1 CAM.
REFERENCIAS
1. Gutstein HB, Akil H. Opioid Analgesics. En Goodman & Gilman`s. The Pharmacological Basis of Therapeutics. 11th Ed. New York. McGraw Hill; 2006. p. 547-90. [ Links ]
2. Coda B. Opioids. En Barash PG. Clinical Anesthesia. Fifth edition. Philadelphia: Lippincott Williams and Wilkins; 2006. p. 353-83. [ Links ]
3. Wang H, Li EY, Xu GW, Wang CS, Gong YL, Li P. Intravenous fentanyl is exhaled and the concentration fluctuates with time. J Int Med Res. 2009;37(4):1158-66. [ Links ]
4. Coral IS, Moore AR, Strunin L. Plasma concentrations of fentanyl in normal surgical patients with severe renal failure. Br J Anaesth. 1980; 52:101. [ Links ]
5. Fine, P, Portenoy, RK. Opioid analgesia, 2nd Edition. McGraw Hill, New York 2007. [ Links ]
6. Labroo RB, Paine MF, Thummel KE, Kharasch ED. Fentanyl metabolism by human hepatic and intestinal cytochrome P450 3A4: implications for interindividual variability in disposition, efficacy, and drug interactions. Drug Metab Dispos. 1997;25(9):1072-80. [ Links ]
7. Stoeckel H, Hengstmann JH, Schüttler J. Pharmacokinetics of fentanyl as a possible explanation for recurrence of respiratory depression. Br J Anaesth. 1979; 51(8): 741-5. [ Links ]
8. Adams A, Pybus D. Delayed respiratory depression after use of fentanyl during anaesthesia. Br Med J. 1978; 1(6108): 278-9. [ Links ]
9. Williams JH. Delayed respiratory depression after use of fentanyl. Br Medical J. 1978; 1:441. [ Links ]
10. Shafer S, Varvel J. Pharmacokinetics, Pharmacodynamics, and Rational Opioid Selection. Anesthesiology. 1991; 74 (1): 53-63. [ Links ]
11. Yassen A, Olofsen E, Romberg R, Sarton E, Teppema L, Danhof M et al. Mechanism-based PK/PD modeling of the respiratory depressant effect of buprenorphine and fentanyl in healthy volunteers. Clin Pharmacol Ther. 2007; 81(1):50-8. [ Links ]
12. Magosso E, Ursino M, van Oostrom JH. Opioid-induced respiratory depression: a mathematical model for fentanyl. IEEE Trans Biomed Eng. 2004;51(7):1115-28. [ Links ]
13. Sternlo JE, Sandin RH. Recurrent respiratory depression after total intravenous anaesthesia with propofol and alfentanil. Anaesthesia. 1998;53(4):378-81. [ Links ]
14. Krane BD, Kreutz JM, Johnson DL, Mazuzan JE Jr. Alfentanil and delayed respiratory depression: case studies and review. Anesth Analg. 1990;70(5):557-61. [ Links ]
15. Scholz J, Steinfath M, Schulz M. Clinical pharmacokinetics of alfentanil, fentanyl and sufentanil. An update. Clin Pharmacokinet. 1996;31(4):275-92. [ Links ]
16. Glass P, Jacobs J, Smith R, Ginsberg B, Quill T, Bai S et al. Pharmacokinetic Model-driven Infusion of Fentanyl: Assesment of Accuracy. Anesthesiology. 1990; 73 (6): 1082-90. [ Links ]
17. Shafer S, Varvel J, Aziz N, Scott J. Pharmacokinetics of Fentanyl Administered by Computer - controlled Infusion Pump. Anesthesiology. 1990; 73 (6): 1091-1102. [ Links ]
18. Youngs E, Shafer S. Pharmacokinetic Parameters Relevant to Recovery from Opioids. Anesthesiology 1994; 81 (4): 833-42. [ Links ]
19. Scott JC, Stanski DR. Decreased fentanyl and alfentanil dose requirements with age. A simultaneous pharmacokinetic and pharmacodynamic evaluation. J Pharmacol Exp Ther. 1987;240(1):159-66. [ Links ]
20. Shibutani K, Inchiosa M, Sawada K, Bairamian M. Accuracy of Pharmacokinetic Models for Predicting Plasma Fentanyl Concentrations in Lean and Obese Surgical Patients. Derivation of Dosing Weight ("Pharmacokinetic Mass"). Anesthesiology. 2004; 101(3): 603-13. [ Links ]
21. Vuyk J, Mertens M, Olofsen E, Burm A, Bovill J. Propofol Anesthesia and Rational Opioid Selection: Determination of Optimal EC sub 50 -EC sub 95 Propofol-Opioid Concentrations that Assure Adequate Anesthesia and a Rapid Return of Consciousness. Anesthesiology. 1997; 87 (6): 1549-62. [ Links ]
22. Smith C, McEwan A, Jhaveri R, Wilkinson M, Goodman D, Smith R et al. The Interaction of Fentanyl onthe Cp50 of Propofol for Loss of Conciousness and Skin Incision. Anethesiology, 1994; 81(4):820-8. [ Links ]
23. Mildh LH, Scheinin H, Kirvelä OA. The concentration-effect relationship of the respiratory depressant effects of alfentanil and fentanyl. Anesth Analg. 2001;93(4):939-46. [ Links ]
24. Cartwright P, Prys-Roberts C, Gill K, Dye A, Stafford M, Gray A. Ventilatory depression related to plasma fentanyl concentrations during and after anesthesia in humans. Anesth Analg. 1983;62(11):966-74. [ Links ]
25. Kaneda K, Han TH. Comparative population pharmacokinetics of fentanyl using non-linear mixed effect modeling: burns vs. non-burns. Burns. 2009;35(6):790-7. [ Links ]
26. Koehntop DE, Rodman JH. Fentanyl pharmacokinetics in patients undergoing renal transplantation. Pharmacotherapy 1997; 17:746-52. [ Links ]
27. Han T, Kim D, Kil H, Inagaki Y. The effects of plasma fentanyl concentrations on propofol requirement, emergence from anesthesia, and postoperative analgesia in propofol-nitrous oxide anesthesia. Anesth Analg. 2000;90(6):1365-71. [ Links ]
28. Iwakiri H, Nagata O, Matsukawa T, Ozaki M, Sessler D. Effect-Site Concentration of Propofol for Recovery of Consciousness Is Virtually Independent of Fentanyl Effect-Site Concentration. Anesth Analg 2003;96:1651-55. [ Links ]
29. Ledowski T, Manopas A, Lauer S. Bronchial mucus transport velocity in patients receiving desflurane and fentanyl vs. sevoflurane and fentanyl. Eur J Anaesthesiol. 2008;25(9):752-5. [ Links ]
30. Feld J, Hoffman W, Paisansathan C, Park H, Ananda RC. Autonomic activity during dexmedetomidine or fentanyl infusion with desflurane anesthesia. J Clin Anesth 2007; 19(1): 30-6. [ Links ]
31. Watcha M, White P. Postoperative Nausea and Vomiting Its Etiology, Treatment and Prevention. Anesthesiology 1992; 77 (1):162-84. [ Links ]
32. Yang H, Choi P, McChesney, Buckley N. Induction with sevoflurane-remifentanil is comparable to propofol-fentanyl-rocuronium in PONV after laparoscopic surgery. Can J Anesth 2004; 51(7): 660-7. [ Links ]
33. Phitayakorn P, Melnick BM, Vicine AF 3rd. Comparison of sufentanil and fentanyl infusions for outpatient anaesthesia. Can J Anaesth. 1987; 34: 242-5. [ Links ]
34. Flacke JW, Bloor BC, Kripke BJ,Flacke WE, Warneck CM, Van Etten AP, Comparison of morphine, meperidine, fentanyl and sufentanil in balanced anesthesia: a double blind study. Anesth Analg. 1985; 64: 897-910. [ Links ]
35. Schuttler J, Albrecht S, Breivik H, Osnes S, Prys-Roberts C, Holder K, A comparison of remifentanil and alfentanil in patients undergoing major abdominal surgery. Anaesthesia. 1997; 52: 307-17. [ Links ]
36. Jellish WS, Leonetti JP, Avramov A, Fluder E, Murdoch J. Remifentanil-based anesthesia versus a propofol technique for otologic surgical procedure. Otolaryngol Head Neck Surg. 2000; 122: 222-7. [ Links ]
37. Michalowski P, DershwitzM, Rosow CE, Conlay LA, Chang YC. Total intravenous anesthesia with remifentanil or alfentanil in ambulatory orthopedic surgery carries minimal risk of postoperative nausea and vomiting. Anesthesiology. 1998; 89 (3A): A34. [ Links ]
38. Davis PJ, Finkel JC, Orr RJ. Fazi L, Mulroy JJ, Woelfel SK. A randomised, doble-blind study of remifentanil versus fentanyl for tonsillectomy and adenoidectomy surgery in pediatric ambulatory surgical patients. Anesth Analg 2000; 90: 863-71. [ Links ]
39. Gaszynski T, Strzelczyk J, Gaszynski W. Post-anesthesia Recovery after Infusion of Propofol with Remifentanil or Alfentanil or Fentanyl in Morbidly Obese Patients. Obes Surg. 2004; 14: 498-504. [ Links ]
40. Langevin S, Lessard MR, Trépanier CA, Baribault JP. Alfentanil causes less postoperative nausea and vomiting than equipotent doses of fentanyl or sufentanil in outpatients. Anesthesiology. 1999;91(6):1666-73. [ Links ]
41. Bloomfield EL. The incidence of postoperative nausea and vomiting: a retrospective comparison of alfentanil versus sufentanil. Mil Med. 1992;157(2):59-61. [ Links ]
42. Rama-Maceiras P, Ferreira T, Molins N, Sanduende Y, Bautista A, Rey T. Less postoperative nausea and vomiting after propofol + remifentanil versus propofol + fentanyl anaesthesia during plastic surgery. Acta Anaesthesiol Scand. 2005; 49: 305-11. [ Links ]
43. Bowdle A. Adverse Effects of Opioid Agonists and Agonist-Antagonists in Anaesthesia. Drug Saf. 1998; 19 (3): 173-89. [ Links ]
44. Streisand J, Bailey P, LeMaire L, Ashburn M, Tarver S, Varvel J et al. Fentanyl-induced rigidity and Unconsciousness in Human Volunteers. Incidence, Duration and Plasma Concentrations. Anesthesiology 1993; 78(4): 629-34. [ Links ]
45. Bowdle T, Rooke G. Postoperative Myoclonus and Rigidity After Anesthesia with Opioids. Anesth Analg 1994;78:783-6. [ Links ]
46. Roy S, Fortier L. Fentanyl-induced rigidity during emergence from general anesthesia potentiated by venlafexine La rigidité induite par le fentanyl, pendant le retour à la conscience qui suit l´anesthésie générale, est potentialisée par la venlafexine.Can J Anesth. 2003; 50(1): 32-5. [ Links ]
47. Smith NT, Benthuysen JL, Bickford RG, Sanford TJ, Blasco T, Duke PC, Seizures during opioid anesthetic induction-are they opioid-induced rigidity? Anesthesiology 1989;71:85242. [ Links ]
48. Fahnenstich H, Steffan J, Kau N, Bartmann P. Fentanyl-induced chest wall rigidity and laryngospasm in preterm and term infants. Crit Care Med. 2000; 28 (3): 836-9. [ Links ]
49. Bailey P, Wilbrink J, Zwanikken P, Pace N, Stanley T. Anesthetic Induction with Fentanyl. Anesth Analg. 1985; 64: 48-53. [ Links ]
50. Lui PW. Involvement of spinal adenosine A1 and A2 receptors in fentanyl-induced muscular rigidity in the rat. Neurosci Lett. 1997; 224(3): 189-92. [ Links ]











 texto en
texto en