Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.38 no.1 Bogotá Jan./Mar. 2010
Reporte de Casos
Técnica de hipotermia profunda y paro circulatorio total para clipaje de aneurismas cerebrales gigantes
Hernán Castro*, Juan Jaramillo**, Carlos Pardo***, Julio Chávez***, Pablo Isaza****, María Robledo ****†
* Anestesiólogo cardiovascular y torácico, Hospital Santa Sofía, ESE, Manizales, Clínica Medellín, Medellín. E_mail: hernan_castro@epm.net.co
** Cirujano cardiovascular, Hospital Santa Sofia, ESE, Manizales, Clínica Medellín, Medellín
*** Neurocirujano, Hospital Santa Sofia, ESE, Manizales
****† Residente 3er año Anestesiología, Universisdad de Caldas, Manizales.
Recibido: octubre 19 de 2009. Enviado para modificaciones: diciembre 17 de 2009. Aceptado: febrero 16 de 2010.
RESUMEN
La hipotermia profunda con paro circulatorio total para facilitar el clipaje de aneurismas cerebrales complejos de circulación posterior no es una técnica nueva, pero en el Hospital Santa Sofía de Manizales (Caldas) este caso es el primero que se realiza en la Institución y en el eje cafetero.
Se presenta el caso de una paciente con aneurisma gigante de la circulación cerebral posterior, la cual fue intervenida neuroquirurgicamente con bypass cardiopulmonar fémoro-femoral con tórax cerrado, paro circulatorio total, hipotermia profunda y anticoagulación con heparina. El tiempo de paro circulatorio total fue de 15 minutos. La paciente no requirió conversión a esternotomía. Durante el paro circulatorio se logró exanguinar y evacuar el aneurisma, lo que permitió un fácil clipaje. No se presentaron complicaciones intraoperatorias como fibrilación ventricular, dilatación ventricular, ni hemorragias importantes, y la paciente se transladó intubada a la Unidad de Cuidados Intensivos.
Palabras clave: Encéfalo, agentes protectores, puente cardiopulmonar, aneurisma intracraneal (Fuente: DeCS, BIREME)
INTRODUCCIÓN
Recientes avances en circulación extracorpórea, técnicas anestésicas y neuroquirúrgicas han permitido mejorar el pronóstico de pacientes con aneurismas cerebrales complejos y de difícil abordaje, en los cuales las técnicas convencionales incrementan la morbi-mortalidad. La utilización del paro circulatorio total con hipotermia profunda en pacientes bien seleccionados con aneurismas cerebrales complejos, no candidatos a técnicas endovasculares, le ofrece al paciente un perfil más favorable frente a la historia natural de los aneurismas cerebrales complejos sin tratamiento quirúrgico, o al tratamiento quirúrgico sin esta alternativa (1-3).
Los aneurismas intracraneanos de la circulación cerebral posterior presentan características anatómicas que limitan la técnica quirúrgica convencional. Estos aneurismas, a pesar de los avances en la técnica neuroquirúrgica de los últimos 50 años, pueden romperse en el intraoperatorio por dificultades en su control circulatorio y en la oclusión quirúrgica, ocasionando gran morbimortalidad y deficientes resultados posoperatorios. La disección y clipaje de estas lesiones complejas es riesgosa debido a su amplio cuello. Además, se exige como prerrequisito al clipaje una exsanguinación previa. La hipotermia profunda con paro circulatorio puede hacer posible la cirugía de estos aneurismas complejos. Este procedimiento quirúrgico requiere un equipo multidisciplinario de neurocirujanos, cirujano cardiovascular, anestesiólogo cardiovascular o neuroanestesiólogo con entrenamiento en esta técnica, cardiólogos, intensivistas, perfusionista y enfermeras. Además, son necesarios los correspondientes equipos de anestesia, máquina de circulación extracorpórea, ecocardiografía intraoperatoria y microscopio neuroquirúrgico (4-10).
REPORTE DE CASO
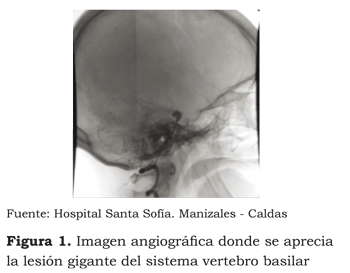
Se reporta el caso de una paciente de sexo femenino, de 53 años, quién tres semanas antes había sido remitida de un hospital de primer nivel por presentar cefalea intensa súbita, acompañada de fotofobia y trastorno de la conciencia. La paciente ingresó al servicio de urgencias de la institución con un Glasgow de 12/15 y un Hunt y Hess de III. Se le realizó una tomografía cerebral que reportó hemorragia subaracnoidea drenada a tercero y cuarto ventrículos cerebrales, con una escala de Fischer II. Además, se le realizó una angiografía cerebral de cuatro vasos, en la cual se evidenció un aneurisma de la bifurcación de la arteria cerebral media derecha de 5 mm, acompañado de vasoespasmo de la arteria cerebral anterior. La arteria basilar tenía un aneurisma en la punta de 10 mm, con cuello de 5 mm, vasoespasmo de las arterias cerebrales posteriores y basilar. La arteria vertebral izquierda era hipoplásica en su porción intracraneana y terminaba en pica. La carótida izquierda mostraba patrón fetal de circulación y un infundíbulo de 3 mm en el origen de la comunicante posterior (ver figura 1). Los senos venosos no mostraban patología. Se inició manejo médico con nimodipino 60 mg cada cuatro horas, vía oral, y fenitoina de 300 mg/día.
Antecedentes médicoquirúrgicos: hipertensión arterial crónica manejada irregularmente con captopril; la paciente fuma un paquete de cigarrillos al día.
Evaluación preoperatoria
Paciente en buenas condiciones generales: oeso: 53 Kg; talla: 1,64 m; presión arterial: 130/80; frecuencia cardíaca: 76 por minuto, regular; frecuencia respiratoria: 12 por minuto. Clase funcional de NYHA I, consciente, orientada, colaboradora, parálisis de VI par derecho, sin signos meníngeos, motilidad y sensibilidad conservadas, Glasgow 15/15. Conjuntivas rosadas, escleras anictéricas, edéntula, cuello sin ingurgitación yugular, corazón rítmico, sin soplos, pulmones se auscultan hipoventilados, sin ruidos sobreagregados, abdomen blando, sin megalias, extremidades sin edemas, pulsos periféricos presentes.
Electrocardiograma: ritmo sinusal, regular, frecuencia de 76 por minuto.
Ecocardiograma transtorácico: ventrículo izquierdo de tamaño normal; fracción de expulsión: 50 %, sin trastornos segmentarios de contractilidad. Transtorno de relajación, sin aumento de las presiones de fin de diástole. Ventrículo derecho de tamaño y función normales. Septum interauricular e interventricular íntegros. Válvulas cardíacas estructural y funcionalmente normales. No hay signos indirectos de hipertensión pulmonar. Aurículas normales. Arco aórtico normal.
Radiografía de tórax: silueta cardíaca en límites normales; pulmones con aumento de la radiolucidez; congestión parahiliar bilateral.
Clasificación Hemoleucograma: O Rh-Hb: 13,3 g/dL; Hto: 43 %; leucocitos: 7 400 mm3; plaquetas 122 000 mm3; TP: 12,8 segundos; TPT: 30,7 segundos; creatinina: 0,73 mg/dL; Na+: 143 mEq/L; K+: 3,7 mEq/L; Ca++: 1,16 mmol/L; densidad urinaria: 1 010; Glicemia en ayunas: 78 mg/dL.
Se reservaron 10 U de concentrado globular, 10 U de plasma, 10 U de plaquetas y 10 U de crioprecipitado.
Se premedicó con lorazepam 1 mg vía oral la noche anterior a la cirugía y 1 mg vía oral 45 minutos antes de la misma.
Manejo anestésico intraoperatorio
Ingreso al quirófano: buenas condiciones generales, Glasgow 15/15 sin déficit motor ni sensitivo, con estrabismo excéntrico de ojo derecho, presión arterial 130/80, FC 75 por minuto, temperatura oral de 36,5 ºC, Mallampati I y Cormack I.
Inducción anestésica: paciente en decúbito supino; cabecera elevada 30°; monitorizada con monitoreo no invasivo: cardioscopio con derivación II, V5, analizador electrónico de segmento ST, oximetría de pulso, presión arterial electrónica con brazalete en brazo izquierdo, capnografía y medición de concentración de gases inspirados y espirados. Se inicia inducción con preoxigenación 02 100 %. Por vena periférica de antebrazo derecho se aplica midazolam 15mg IV, fentanyl 150 mcg IV, lidocaína 60 mg/IV, bromuro de pancuronio 8mg IV. Se obtiene un adecuado plano anestésico para la intubación cinco minutos después, y se entuba con tubo corrugado No. 9, sin cambios significativos hemodinánicos. Posteriormente, se administra: ácido tranexámico, 3 gramos IV; ranitidina, 50 mg IV; y cefalosporina, 2gr IV. Se fija el tubo orotraqueal y se realiza protección ocular. Se instala ventilación mecánica protectora con 02 al 50 %, aire al 50 % e isofluorane al 1 Vol %.
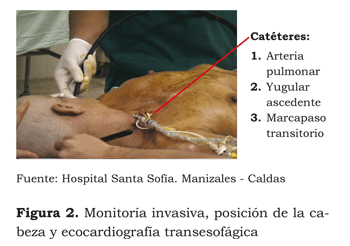
Monitoreo invasivo: se canaliza línea arterial radial izquierda. Se canaliza vena yugular interna derecha con introductor de Swan Ganz, marcapasos temporal, catéter yugular ascendente. Se instala cateter vesical de Foley, sonda nasogástrica, termómetro rectal, termómetro nasofaríngeo, ecocardiograma transesofágico y electrodos cutáneos para desfibrilador externo. La hemodinamia inicial muestra: gasto cardíaco: 2,86 L/min; índice cardíaco: 1,97 L/min/M2; resistencia vascular sistémica: 1 788 dynas/seg/cm5; resistencia vascular pulmonar: 279 dynas/seg/cm5; PVC: 11 mmHg; PCP: 12 mmHg.
Posteriormente, la paciente es posicionada en decúbito supino, cabeza elevada 30° y rotada a la izquierda, preparada para para permitir el acceso quirúrgico del cráneo, así como de ambas regiones inguinales y el tórax para estereotomía media, en caso de necesidad (ver figura 2).
Mantenimiento anestésico: 02 50 %; aire 50 %; isofluorane entre 0,8 - 1 Vol %; infusión de propofol entre 50 y 200 mcg/kg/min y una nueva dosis de 4mg de bromuro de pancuronio.
Se aplican 150 cc IV de manitol 20 %, 500 mg de hidrocortisona IV y Hartman 1 000 cc IV.
La cabeza es rapada, y previo lavado, asepsia y antisepsia, se fija y se infiltra con bupivacaina al 0,5 %. Después de 80 minutos de la inducción anestésica se practica craneotomía frontotemporal con resección del arco zigomático, apertura de la duramadre y disección hasta la cisterna quiasmática. Bajo magnificación con microscópica del Valle Silviano se identifica la carótida interna. En bifurcación de la arteria cerebral media M1 M2 se encuentra aneurisma dirigido hacia abajo, y se ocluye con clip de 7 mm recto. Se canula el ventrículo cerebral, y el cerebro se relaja. Se continúa con abordaje pterional subtemporal hasta llegar a la lesión en el techo de la arteria basilar. Se encuentra un aneurisma fusiforme, sin cuello aparente. Hasta este instante se completan cinco horas y media de cirugía con circulación espontánea.
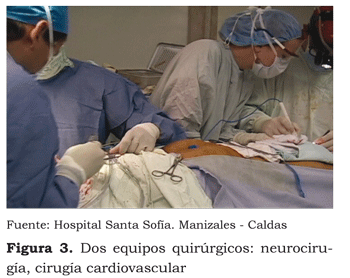
Mientras los neurocirujanos llegan a la cisterna quiasmática, el cirujano cardiovascular inicia el procedimiento de canulación fémoro-femoral con tórax cerrado. Antes de la canulación se aplican 300U/kg de heparina vía línea venosa central. A los cinco minutos se toma ACT, que reporta 542 segundos. Se realiza control de gases y electrolitos: Na+: 137 mEq/L; K+: 3,9 mEq/L; Ca++: 1,22; Hb: 13 gr/dL; Hto: 37 %; T: 35,2 °C; PH: 7,47; PC02: 29,6 mmHg; P02: 125 mmHg; HC03: 22 mEq/L; BE: -2 S02 arterial 99 % (ver figura 3).
La arteria y la vena femorales izquierdas se disecan y canulan con kit Medtronic® Minneapolis, USA, y la posición de la cánula venosa a nivel de la aurícula derecha es confirmada con ecocardiograma transesofágico realizado por el anestesiólogo cardiovacular. Se inicia bypass cardiopulmonar con centrífuga, con cánula arterial # 17 y venosa # 21, volumen de primado compuesto por SSN al 0,9 %, albúmina 20 cc, manitol 50 cc, con oxigenador marca Affinity Medtronics® Minneapolis, USA y estrategia de manejo metabólico Alfa Stat, temperatura de 34,6 ºC nasofaríngea, flujo de 3,7 L/m, y presión arterial media de 52mm de Hg. Los reportes de laboratorio muestran, iniciada la circulación extracorpórea: Na+: 140 mEq/L; K+: 4 mEq/L; Ca++: 0,97 mmol/L; Hb: 9gr/dL; Hto: 25 %; PH: 7,48; PC02: 31,6 mm de Hg; P02: 83 mm Hg; HC03: 24 mEq/L; BE: 0; S02: 98 % arterial. Se induce hipotermia sistémica por enfriamiento de la sangre arterial a través del intercambiador de calor de la máquina de circulación extracorpórea. La temperatura baja gradualmente, y a los 23 minutos de iniciada la hipotermia se alcanzan los 18,2 °C de temperatura nasofaríngea. El corazón entra en asistolia espontáneamente. No resulta necesario aplicar bolo de potasio IV. Se administra thiopental sódico 30 mg/kg/IV. Hay paro circulatorio total, y se drena la sangre a través de la cánula venosa hasta que la vasculatura cerebral queda exangüe. Los neurocirujanos realizan disección y oclusión del aneurisma de la basilar con dos clips de 7 mm, uno recto y otro curvo, respetando el tronco de la basilar y las perforantes bilateralmente. Luego realizan hemostasia y lavado de cisternas. El procedimiento tarda 15 minutos. Cuando los neurocirujanos logran el clipaje óptimo, se inicia el recalentamiento y se reinicia el bypass cardiopulmonar. En este momento los reportes de laboratorio muestran: Na+: 138 Meq/L; K+: 4,4 Meq/L; Ca++: 1,15 mmol/L; PH: 7,44; PC02: 30,5 mmHg; P02: 340 mmhg; Hb 7 gm/dL; Hto: 22 %; glicemia: 107 mg/dL. Se transfunden 2 U de concentrado globular.
Los neurocirujanos continúan con el cierre de la duramadre, reposición del colgajo óseo y reconstrucción del arco zigomático. El ritmo cardíaco espontáneo aparece a los 24 °C, apoyado por bolo de Milrinone 2 mg y fenilefrina 400 mcg. Se continúa el calentamiento hasta llegar a los 37 ºC, y allí se separa el bypass cardiopulmonar del paciente, sin complicaciones; se revierte la heparina con 325 mg de sulfato de protamina intravenosa; y se aplica un refuerzo de cefalosporina, gluconato de calcio 2 gramos IV, dipirona 2 gramos IV. El tiempo de bypass es de 95 minutos y el de paro circulatorio total de 15 minutos.
Los exámenes de laboratorio muestran: Na+: 137 Meq/L; K+: 4,3 Meq/L; Ca++: 1,12; Hb: 8gr/dL; Hto: 24; PH: 7,52; PC02: 26,1 mmHg; P02: 284 mmHg; HC03: 23 mEq/L; BE: -1; S02 arterial 100 %; ACT: 115 segundos. Se transfunden 2 U adicionales de concentrado globular, 4 U de plasma, 12 U de plaquetas y 5 U de crioprecipitado.
Diuresis: prebomba 375 cc, bomba: 100cc, postbomba: 200 cc.
Con la paciente estable hemodinámicamente, y luego del cierre de la craneotomía, se retira la canulación fémoro-femoral. Luego de seis horas y media de cirugía, la paciente está lista para pasar intubada a la Unidad de Cuidados Intensivos. Los exámenes de laboratorio de salida son: Na+: 140 Meq/L; K+: 4,0 Meq/L; Ca++: 1,15 mmol/L; Hb 9 gr/dL; Hto: 25 %; PH: 7,48; PC02: 31,6; mmHg; P02: 83 mmHg; T: 34,6 °C; HC03: 24 mEq/L; BE: 0 S02 arterial 98 %; gasto cardíaco: 4,28 L/min; IC: 3,95 L/min/M2 RVS 1232 dynas/seg/cm5 RVP 205 dynas/seg/cm5; PVC: 14 mmHg; PCP: 30 mmHg. En la evaluación neurológica final de la paciente se encuentra la pupila derecha midriática, con reacción muy lenta a la luz, y pupila izquierda de 4 mm normo-reactiva. La paciente es trasladada a la Unidad de Cuidados Intensivos con monitoreo de transporte de presión arterial invasiva y pulsoximetría con ventilación de presión positiva con sistema Jackson y bajo sedación con propofol a 10 mcg/k/min.
DISCUSIÓN
La hipotermia profunda con paro circulatorio total para facilitar el clipaje de aneurismas cerebrales complejos de circulación posterior no es una técnica nueva, pero en el Hospital Santa Sofía de Manizales (Caldas), como antes se dijo, este caso es el primero que se realiza en la Institución y en el eje cafetero.
Históricamente, el concepto de hipotermia en cirugía cardíaca se introdujo en 1950 por Bigelow mediante enfriamiento superficial. Boterell, en 1958, fue el pionero en hipotermia para cirugía de aneurisma intracraneano. En 1959, Drew utiliza la hipotermia profunda a 15 °C a tórax abierto en cirugía cardíaca, a través de máquina de circulación extracorpórea e intercambiador de calor. El paro circulatorio fue de 46 minutos sin complicaciones neurológicas. En 1960, Woodhall y colaboradores, utilizando la técnica de canulación femoro-femoral con tórax cerrado, reportaron el primer caso de hipotermia profunda en neurocirugía para tumor cerebral. El entusiasmo inicial disminuyó por los deficientes resultados quirúrgicos relacionados con complicaciones de la circulación extracorpórea y coagulopatías.
Los avances en la tecnología de perfusión y de la hipotermia profunda han hecho que se obtengan mejores resultados, permitiendo la reparación de cardiopatías congénitas complejas, aneurismas del arco aórtico y transplante de corazón. El interés por su utilización en aneurismas cerebrales complejos se renovó a partir de 1980 (11-14).
La hipotermia profunda se refiere a temperaturas menores de 20 ºC, para lo cual se requiere un flujo aceptable por la circulación extracorpórea de 1 L/min/M2. El rango de 20 a 30 ºC se considera hipotermia moderada con flujo aceptable de 1,6 L/min/M2, y la hipotermia leve está entre los 30 y 34 ºC, con un flujo aceptable de 2 L/min/M2. El Q10 hace referencia al concepto fisiológico en el cual, por cada 10 ºC de descenso en la temperatura corporal, se disminuye la tasa metabólica cerebral en un 50 %. El tiempo donde la técnica de paro circulatorio con hipotermia profunda a 18 ºC es segura, oscila entre 30 y 45 minutos. Se ha encontrado que a los 60 minutos de paro total e hipotermia profunda, hasta un 10 % de los pacientes pueden tener lesiones neurológicas, algunas de ellas reversibles. En orden de frecuencia, los órganos más susceptibles a la isquemia son: cerebro, corazón, riñones e hígado. Una adecuada protección neurológica puede requerir, aparte de la hipotermia, el uso de agentes como propofol o tiopental sódico en infusión para disminuir el consumo metabólico de oxígeno, esteroides para disminuir el edema, y en algunos centros la utilización de perfusión selectiva de arterias cerebrales o perfusión retrograda de venas cerebrales (15).
Los aneurismas de circulación posterior son sólo el 8 % de los aneurismas intracraneales. Se originan de las bifurcaciones y curvaturas de las arterias del polígono de Willis y son más comunes en los vasos hipoplásicos o con orígen anómalo (patrón de circulación fetal). El exámen histológico reporta adelgazamiento de la capa media muscular arterial y disminución del colágeno tipo III en la capa elástica. Desde el punto de vista de la patología, los aneurismas son saculares (mal llamados congénitos, que son los más frecuentes) y fusiformes o ateroscleróticos. Estos últimos afectan generalmente la arteria basilar y se asocian a deficientes resultados quirúrgicos (especialmente si están rotos). Su historia natural nos indica que tienen mayor probabilidad de ruptura y alta tendencia a resangrado después de la primera hemorragia, y con alta mortalidad (16).
La ruptura de los aneurismas intracraneanos se produce en el vértice del saco aneurismático, con extravasación de sangre al espacio subaracnoideo o parénquima cerebral, o ambos. La posibilidad de ruptura aumenta con el tamaño de la lesión y generalmente coincide con aumento de la PIC (tos, esfuerzo, defecación). Entre el 25 y el 50 % de los pacientes mueren como consecuencia de la primera ruptura; la mayoría sobreviven y recobran la consciencia en unos minutos. La primera consecuencia de la hemorragia subaracnoidea es el vasoespasmo cerebral con lesión isquémica adicional. En las necropsias se observan entre 20 y 30 % de casos de aneurismas múltiples (6).
Sin tratamiento, el pronóstico de los aneurismas intracerebrales es sombrío: Peeless y colaboradores reportan 68 % de mortalidad en los primeros dos años y 85 % a los cinco años. Los sobrevivientes quedan con graves secuelas neurológicas. Otras complicaciones frecuentes son el tromboembolismo distal y la oclusión de los vasos de la pared (17-19).
El manejo quirúrgico de los aneurismas debe individualizarse, e idealmente debe realizarse en instituciones que puedan ofrecer microcirugía con clipaje y terapia endovascular. El clipaje es el gold standard para el manejo de los aneurismas intracraneales. La primera craneotomía con clipaje la realizó Walter Dandy en 1937 (5).
Los aneurismas de cuello amplio, de saco tenso, son difíciles de ocluir mientras se mantiene la circulación permeable. Además, sus ramas adyacentes carecen de una adecuada demarcación en la pared del aneurisma. Las paredes, a veces calcificadas, complican la movilización del saco durante la disección, con probabilidad de ruptura y resultados desastrosos. Cuando se encuentran estas características el paro circulatorio ofrece una enorme ventaja al cambiar un aneurisma duro, pulsatil y lleno, en un saco suave y colapsable, fácil de manipular y con menores riesgos de ruptura (20-22).
Drake, de 174 casos de aneurismas complejos, reporta buenos resultados quirúrgicos en el 71,5 % de los pacientes, pobres resultados en el 13 % y resultados fatales en el 15,5 %. El pronóstico es peor para aneurismas de la circulación posterior.
Otros factores que afectan el pronóstico son el estado neurológico del paciente al ingreso (buen estado: 88 % de buen pronóstico; mal estado: sólo el 43 % tienen un buen pronóstico), su edad (<45 años, 90 % de buen pronóstico) y la experiencia del cirujano (12).
Spetzler y colaboradores, en clipaje de ocho aneurismas complejos, con cirujanos experimentados, hipotermia profunda y paro circulatorio, reportaron un tiempo promedio de paro circulatorio para el clipaje de 11 minutos, y el rango fue de siete a 53 minutos (15).
La utilización de hipotermia profunda con paro circulatorio en pacientes seleccionados ofrece un razonable riesgo-beneficio para el manejo de aneurismas cerebrales, comparada con la historia natural de los aneurismas no tratados.
Para tratar de limitar el daño hecho al paciente con microcirugía y clipaje (craneotomía, retracción del cerebro expuesto al aneurisma, retracción de nervios craneanos, oclusión de arterias perforantes con el clipaje, tiempo de hospitalización, eventos isquémicos), se ideó la técnica de oclusión endovascular con coils o espirales, de buenos resultados en aneurismas pequeños con cuello corto, pero que no ofrece una solución definitiva en todos los pacientes con aneurismas complejos (40 %), quedando con cuello residual el 39 %, con recanalización los aneurismas gigantes en el 87-90 % de los casos, los cuales pueden dar lugar a enfermedad cerebrovascular (por embolización del espiral a vaso distal, prolapso del espiral fuera del aneurisma, recurrencia del aneurisma, ruptura del aneurisma a largo plazo) o morbilidad neurológica (ceguera, afasia, parálisis, coma, muerte) (21).
La hipotermia profunda con paro circulatorio se utilizó exitosamente en el caso de la paciente aquí reportado, en donde las técnicas quirúrgicas convencionales y las técnicas endovasculares no eran la mejor alternativa, y en donde el concurso de un grupo multidisciplinario fue esencial para poder brindar atención y solución a la patología de la paciente.
REFERENCIAS
1. Mack WJ, Ducruet AF, Angevine PD, Komotar RJ, Shrebnick DB, Edwards NM, Smith CR, Heyer EJ, Monyero L, Connolly ES Jr, Solomon RA. Deep hypothermia and Circulatory Arrest for Surgery of Complex Intracranial Aneurysms: Lassons Learned. Neurosurgery. 2008; 62( Suppl 3):1311-23. [ Links ]
2. Young WL et al. Anesthetic Management of Deep Hypothermic Circulatory Arrest for Cerebral Aneurysm Clipping. Anesthesiology. 2002; 96: 497-503. [ Links ]
3. Massad MG et al. Closed Chest Hypothermic Circulatory Arrest for Complex Intracranial Aneurysms. Society of Thoracic Surgeons. 2001; 71: 1900-4. [ Links ]
4. Dewitte TC III. Endovascular Treatment of Cerebral Aneurysms Will Replace Clipping. Journal of Neurosurgical Anesthesiology. 2003; 15: 58-60. [ Links ]
5. Chicoine MR. Microsurgery and Clipping: The gold standard for Treatment of Intracranial Aneurysms. Journal of Neurosurgical Anesthesiology. 2003; 15: 61-3. [ Links ]
6. Morita KI, Inenaga C, Ito Y, Fujii Y et al. An Autopsy Case Of Gigant Aneurism of vertebrobasilar artery treated endovascular surgery. Acta Neurochirúrgica. 2003; 145: 723-5. [ Links ]
7. Spetzler RF et al. Giant Aneurisms. Neurosurgery. 2002; 49: 902-8. [ Links ]
8. Rhoton AL Jr. Aneurysms. Neurosurgery. 2002; 51: 121-58. [ Links ]
9. Le Roux P et al. Blood Transfusion During Aneurysm Surgery. Neurosurgery. 2001; 49: 1068-75. [ Links ]
10. Aebert H et al. Deep hypothermia and Circulatory Arrest for Surgery of Complex Intracranial Aneurysms. Cardio-Thoracic Surgery. 1998; 13; 223-9. [ Links ]
11. Hacein-Bey L, Connolly ES Jr, Mayer SA et al. Complex intracranial aneurysms: combined operative and endovascular approaches. Neurosurgery. 1998; 43:1304-12. [ Links ]
12. Drake CG, Barr HWK, Coles JC et al. The use of extracorporeal circulation and profound hypothermia in the treatment of ruptured intracranial aneurysm. J Neurosurg. 1964; 21:575-81. [ Links ]
13. Baumgartner WA, Silverberg GD, Ream AK et al. Reappraisal of cardiopulmonary bypass with deep hypothermia and circulatory arrest for complex neurosurgical operations. Surgery. 1983; 94:242-9. [ Links ]
14. Thomas AN, Anderton JM, Harper NJ. Anaesthesia for the treatment of a giant cerebral aneurysm under hypothermic circulatory arrest. 1990; Anaesthesia.45:383-5. [ Links ]
15. Spetzler RF, Hadley MN, Rigamonti D et al. Aneurysms of the basilar artery treated with circulatory arrest, hypothermia, and barbiturate cerebral protection. J Neurosurg. 1988; 68:868-79. [ Links ]
16. Young WL, Lawton MT, Gupta DK, et al. Anesthetic management of deep hypothermic circulatory arrest for cerebral aneurysm clipping. Anesthesiology. 2002; 96:497-503. [ Links ]
17. Nussmeier NA, Arlund C, Slogoff S. Neuropsychiatric complications after cardiopulmonary bypass: cerebral protection by a barbiturate. Anesthesiology. 1986; 64:165-70. [ Links ]
18. Kahveci FS, Kahveci N, Alkan T et al. Propofol versus isoflurane anesthesia under hypothermic conditions: effects on intracranial pressure and local cerebral blood flow after diffuse traumatic Brain injury in the rat. Surg Neurol. 2001; 56:206-14. [ Links ]
19. Hindman BJ, Todd MM, Gelb AW et al. Mild hypothermia as a protective therapy during intracranial aneurysm surgery: a randomized prospective pilot trial. Neurosurgery. 1999; 44:23-32. [ Links ]
20. Clifton GL. Systemic hypothermia in treatment of severe Brain injury. J Neurosurg Anesthesiol. 1995;7:152-6. [ Links ]
21. Johnston SC, Wilson CB, Halbach VV et al. Endovascular and surgical treatment of unruptured cerebral aneurysms: comparison of risks. Ann Neurol. 2000; 48:11-9. [ Links ]
22. Lai YC, Manninen PH. Anesthesia for cerebral aneurysms: a comparison between interventional neuroradiology and surgery. Can J Anaesth. 2001;48: 391-5. [ Links ]











 text in
text in