Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.38 no.4 Bogotá Oct./Dec. 2010
Artículo de Revisión
Coagulopatía temprana en trauma: ¿Llegan los pacientes coagulopáticos a la sala de cirugía?
Early Coagulopathy in Trauma: Do Coagulopathic Patients Reach the Operating Room?
Juan Carlos Jiménez B.*, Jairo de La Peña L.**, Rubén Teherán M.***, Andrés Orozco****
* MD Especialista en Anestesiología, Universidad de Cartagena. Anestesiólogo Hospital
Universitario del Caribe, Cartagena, Colombia. juanjim170@hotmail.com
** Residente de I año Cirugía General, Universidad de Cartagena, Cartagena, Colombia.
*** MD. Anestesiólogo director UCI Hospital Universitario del Caribe, Cartagena, Colombia.
**** Médico de Planta, UCI Hospital Universitario del Caribe, Cartagena, Colombia.
Recibido: enero 25 de 2010. Enviado para modificaciones: enero 28 de 2010. Aceptado: julio 26 de 2010.
RESUMEN
Introducción. De la coagulopatía aguda en el trauma, resultan múltiples complicaciones como la necesidad de administración de hemoderivados, mayor incidencia de disfunción orgánica, aumento de estancia en unidad de cuidados intensivos y mayor mortalidad. Con el conocimiento actual de la fisiopatología del trauma y la vía celular de la coagulación es ahora posible mejorar el dignóstico y tratamiento de la coagulopatía inicial y conseguir mejores resultados en nuestros centros.
Métodos. Este artículo examina la fisiología básica de la coagulación, la etiología, el diagnóstico y el tratamiento de la coagulopatía temprana en trauma. La búsqueda se realizó con términos Mesh y no Mesh con conectores AND: Anesthesia-coagulophaty, postinjury and trauma thromboelastography, transfusion and trauma, shock-Mechanism and trauma review.
Resultados. La coagulopatía aguda o temprana en trauma está directamente asociada al estado de shock y se caracteriza por anticoagulación e hiperfibrinolisis sistémica; hay evidencia de la implicación de la proteína C en este proceso. Se ha establecido que seis mecanismos fisiopatológicos multifactoriales pueden perpetuar la coagulopatía en los pacientes traumatizados; éstos son: inflamación, acidosis, hipotermia, shock, trauma tisular y hemodilución. El diagnóstico se realiza con las diferentes pruebas (TP, TPT, plaquetas) ya conocidas desde hace mucho tiempo, pero con limitaciones que reducen su utilidad clínica. Ahora la tromboelastografía nos puede ayudar a guiar la transfusión, con el concepto actual de transfusión temprana de glóbulos rojos, plasma y plaquetas, utilizando la mejor proporción según la evidencia disponible.
Conclusiones. Contamos, con algún conocimiento sobre la fisiopatología de la coagulopatía asociada con trauma pero son necesarias más investigaciones, en este campo. El diagnóstico rápido y una intervención directa inmediata son importantes para mejorar el desenlace de nuestros pacientes.
Palabras claves: Coagulopatía, trauma, hemorragia, transfusión, tromboelastografía (Fuente: DeCS, BIREME)
SUMMARY
Introduction. Acute coagulopathy in trauma results in multiple complications such as the need for blood products, higher rates of organ dysfunction, longer stay in the ICU and higher mortality. With the current knowledge of the pathophysiology of trauma and of the cellular coagulation pathway it is now possible to improve diagnosis and treatment of the initial coagulopathy and achieve better outcomes in our trauma centers.
Methods. This paper looks into the basic physiology of coagulation, and the etiology, diagnosis and treatment of early coagulopathy in trauma. The search was done using Mesh and non-Mesh terms with AND connectors: Anesthesia-coagulopathy, postinjury and trauma thromboelastography, transfusion and trauma, shock-Mechanism and trauma review.
Results. Acute or early coagulopathy in trauma is directly associated with a state of shock and is characterized by anticoagulation and systemic hyperfibrinolysis; protein C is known to be implicated in this process. It has also been determined that six multi-factorial pathophysiological mechanisms may perpetuate coagulopathy in trauma patients, namely, inflammation, acidosis, hypothermia, shock, tissue trauma and hemodilution. Diagnosis is made using the different tests (PT, PPT, platelets) that have been in use for a long time; however, these tests have drawbacks that limit their clinical usefulness. Thromboelastography can now help guide early transfusion using the best proportion of red blood cells, plasma and platelets on the basis of the best available evidence.
Conclusions. We have some knowledge about the pathophysiology coagulopathy associated with trauma but more research in this field is needed. Rapid diagnosis and immediate intervention are important to improve the outcomes with our patients.
Keywords: Coagulopathy, trauma, hemorrhage, transfusion, thromboelastography (Source: MeSH, BIREME)
INTRODUCCIÓN
La mortalidad en los pacientes con trauma de cualquier etiología; está directamente relacionada con trastornos de la vía de la coagulación. La coagulación forma parte integral de los estados inflamatorios y su activación puede resultar en mayor susceptibilidad para el inicio de la sepsis (1-3). Recientemente se ha establecido que la coagulopatía en trauma se presenta en uno de cada cuatro pacientes admitidos a las salas de trauma, lo cual cuadriplica la mortalidad asociada con este (4,5). El trauma asociado con hemorragia masiva tiene una alta mortalidad, más del 50 % de los pacientes que la presentan, mueren (6). La hemorragia es la primera causa de muerte en los pacientes con trauma y hasta el 40 % de éstos, presentan complicaciones como la coagulopatía que reporta desenlaces fatales. En un estudio llevado a cabo en Miami, Florida (7) en un centro de trauma, encontraron una tasa de anormalidades en el perfil de la coagulación del 28 %; de los pacientes admitidos con trauma, y la coagulopatía temprana se asoció con pobre supervivencia. Brohi y colaboradores (8), demostraron que las anormalidades tempranas en el TP y TPT en los pacientes con trauma es un factor independiente asociado con mortalidad. Tradicionalmente, se ha pensado que la coagulopatía temprana en los pacientes con trauma es producida por el consumo de los factores de la coagulación, dilución de éstos por los líquidos intravenosos administrados, hipotermia y acidosis metabólica asociada. Recientemente se ha podido demostrar que ninguno de estos factores es responsable de la coagulopatía asociada con trauma en los minutos iniciales, si no posteriormente. Actualmente se sabe que la lesión por hipotensión e hipoperfusión tisular; pueden activar la vía de la trombomodulina-proteína C, como resultado, desencadena el proceso de coagulopatía y fibrinólisis (9-11). La evidencia actual sugiere que el adecuado y rápido manejo de la coagulopatía en trauma, conduce a reducción en la mortalidad y en la severidad de complicaciones observadas posteriormente (12). El objetivo de dicha revisión es resaltar la importancia sobre estos nuevos conceptos de coagulopatía temprana y trauma, la cascada de la coagulación, el diagnóstico y el tratamiento inicial y su aplicación en nuestras salas de cirugía y servicios de emergencia.
MECANISMO BÁSICO DE LA COAGULACIÓN
El clásico modelo de la coagulación, presentado en 1964, como “cascada de la coagulación” (figura 1), ha sido reemplazado por un modelo celular en el cual se enfatiza en la interacción de las proteínas de la coagulación con la superficie celular de las plaquetas y el endotelio (12-14).
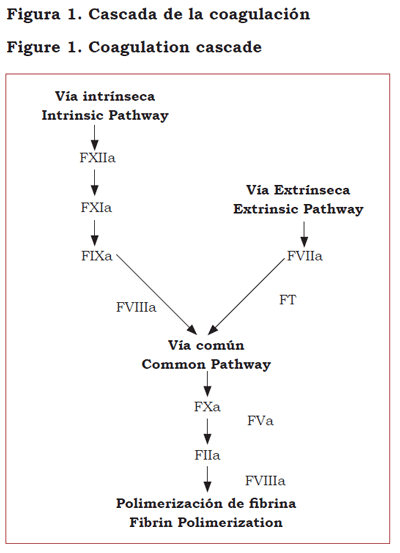
De acuerdo con esto, la hemostasia inicia con la formación de un complejo entre el factor tisular (FT) (expresado en los fibroblastos del subendotelio como resultado del daño en la pared del vaso sanguíneo) y el factor VII activado, presente normalmente en la sangre circulante en baja concentración. El complejo FT-factor VIIa convierte el factor X a factor X activado, éste activa la protrombina a trombina. Hay dos inhibidores de esta fase inicial:
1. El inhibidor de la vía del factor tisular (IVFT), que neutraliza el FXa cuando está como complejo unido FT-FVIIa.
2. La antitrombina III que circula en altas concentraciones (150 mcg/ml) en la sangre y neutraliza el FXa y la trombina.
La trombina activa los factores VIII, V, XI y las plaquetas; estas últimas cambian su forma como consecuencia de la exposición a la carga negativa de los fosfolípidos, que sirven de molde para la formación de fibrina desde el fibrinógeno por medio de la trombina. Los factores VIIIa y Va sirven como cofactores al FIXa y el FXa respectivamente. Este proceso se puede dividir en tres pasos: iniciación, propagación y amplificación (figura 2). El endotelio intacto tiene múltiples funciones anticoagulantes, entre éstas, la liberación de óxido nítrico, de prostaciclina y de ADPasa, que atenúan la actividad plaquetaria. El IVFT es liberado por el endotelio rápidamente después de la administración de heparina, lo cual disminuye la acción de FT-FVIIa. La trombomodulina es otra proteína que se une a la célula endotelial con función anticoagulante y antiinflamatoria.
En respuesta a un estímulo procoagulante se libera el activador tisular del plasminógeno (TPA) para promover la fibrinólisis. Los factores de la coagulación se consumen a una tasa basal en ausencia de trauma, al igual que hay una producción basal de trombina (14). La respuesta hemostática está limitada al sitio del trauma por activación local de plaquetas adheridas, los factores activados son rápidamente neutralizados así: El FT-FVIIa-FXa por el IVFT Y FXa y la trombina por la antitrombina. La trombomodulina y trombina se unen a la célula endotelial, lo cual genera la activación del anticoagulante natural, la proteína C (PC); ésta, inhibe los cofactores VIIIa y Va y estimula la liberación de TPA por la célula endotelial, la función de la PC es ayudada por la proteína S; a la PC se le han atribuido además efectos citoprotector y antiinflamatorios. La liberación continua de FXa, fibrina y trombina conduce a la activación del sistema fibrinolítico (figura 2).
MECANISMO DE LA COAGULOPATÍA AGUDA EN EL TRAUMA
Clásicamente se ha descrito que la coagulopatía en el trauma es inducida por la dilución, hipotermia y acidemia asociado al consumo o disfunción de los factores de la coagulación. Como vemos las causas son de origen multifactorial, pero existen mecanismos que son predominantes, a otros propios del estado clínico del paciente, como el trauma tisular, el estado de shock, la hemodilución, la hipotermia, la academia y la inflamación (15); siendo esta ultima responsable, junto con la activación de la coagulación, en el incremento, de la susceptibilidad, a presentar sepsis posteriormente.
Clínicamente la severidad del trauma está asociada con el grado de coagulopatía (16), Basados en las nuevas teorías sobre la fisiología de la coagulación,podemos analizar, que cuando se expone el colágeno tipo III ocurre la agregación plaquetaria y la activación del factor VII como iniciador del proceso de coagulación (17). Actualmente se ha establecido que el shock inicial puede ser el desencadenante de coagulopatía, y es un factor independiente asociado con mortalidad en trauma (18). La hemodilución desempeña un papel fundamental en la coagulopatía asociada con trauma (19,20). El efecto de los líquidos sobre la coagulación se ha demostrado ampliamente en modelos matemáticos y animales (21,22). El tipo de líquidos que se utilizan, para la resucitación, puede influenciar en los trastornos de la coagulación en el peritrauma; sabemos cómo diferentes coloides pueden interferir en la formación del coágulo y su estabilidad. La hipotermia inhibe la funcionabilidad de los factores de la coagulación y de las plaquetas (23,24); de esta manera, se conoce que el factor VII conserva su actividad sólo en un 50 % a 28 °C (25,26). Las plaquetas son las más susceptibles a la disminución de la temperatura corporal con ausencia de adhesividad a temperaturas inferiores a 30 °C (27). La mortalidad está aumentada en pacientes con trauma y temperaturas inferiores a los 32 °C (28,29). La acidemia observada en pacientes de trauma, pudo haber sido producida por el estado de shock y la utilización de cloruro de sodio en la reanimación; la actividad de los factores de la coagulación está marcadamente disminuida, sobre todo FXa/Va debido a esta acidemia, la cual a su vez incrementa la degradación del fibrinógeno (30).
El PH tiene efectos deletéreos, sobre las proteasas, cuando está por debajo de 7,2; se puede corregir con soluciones buffer, mas no así la coagulopatía (1).
Por último, no debemos olvidar la relación que tienen los factores de la coagulación con la inducción del sistema inmunitario y la inflamación, al activar las células endoteliales. La inflamación conduce a alteración en la coagulación (31,32) consistente en aumento del sangrado inicial y posterior estado de hipercoagulabilidad.
Todos estos factores están implicados en la coagulopatía asociada con trauma como coagulopatía sistémica adquirida, pero analizaremos cómo en los primeros minutos puede empezar dicho proceso: Brohi y colaboradores (11) realizaron un estudio prospectivo en un solo centro de trauma, con 208 pacientes, a quienes se les tomaron muestras sanguíneas dentro de los primeros 10 minutos a la llegada al servicio de urgencias, para medirles TP, TPT, dímero D, fibrinógeno, trombomodulina, proteína C, inhibidor del activador tisular del plasminógeno y gases arteriales para ver exceso déficit de base EB.
La prolongación de TP y TPT fue observada solamente en pacientes con niveles altos de EB, y en éstos; encontró niveles elevados de trombomodulina, dímero D y niveles bajos de proteína C y de inhibidor de activador tisular del plasminógeno, lo cual nos hace pensar en un estado hiperfibrinolítico. Además, los niveles altos de trombomodulina y bajos de proteína C se asociaron con alta mortalidad, necesidad de transfusión y mayores días de ventilación mecánica. Cohen y colaboradores en su trabajo sobre coagulopatía y trauma craneoencefálico de 39 pacientes concluyeron que en los pacientes con trauma craneoencefálico la coagulopatía no se produce por la sola liberación del factor tisular por el tejido cerebral, sino que está implicado el mecanismo de la hipoperfusión severa y la activación de la proteína C como iniciador.
Brohi y colaboradores (10) en un estudio posterior confirman que la coagulopatía aguda en trauma puede estar directamente asociada con hipoperfusión tisular, y es caracterizada por anticoagulación e hiperfibrinolisis. La proteína C es activada con la trombomodulina y el receptor endotelial para la proteína C (Figura 3). Una vez la proteína C es activada ejerce un efecto anticoagulante e inhibe irreversiblemente los cofactores VIIIa y Va. Para esta reacción es necesario el cofactor proteína S; la proteína C tiene un efecto directo sobre la inhibición de la formación de fibrina al bloquear el inhibidor del activador tisular del plasminógeno -1, con la consiguiente liberación de la conversión de plasminógeno en plasmina, lo cual lleva al paciente a un estado hiperfibrinolítico que se puede detectar ahora con tromboelastografia (33).
Más recientemente, Chesebro y colaboradores (32) en un modelo animal en ratas con inducción de trauma y hemorragia, publicó resultados a favor del mecanismo de la proteína C y el estado inicial de shock como desencadenantes de la coagulopatía temprana en trauma.
DIAGNÓSTICO DE LA COAGULOPATÍA EN TRAUMA
En la mayoría; de nuestros centros de atención inicial, las pruebas de laboratorio utilizadas en urgencias están limitadas a tiempo de protrombina (TP), tiempo de tromplastina parcial activado (TPT), con bastantes limitaciones en cuanto a tiempo (de 20 a 60 minutos para el resultado), y evaluación de la funcionabilidad plaquetaria. Dichas pruebas están basadas en el modelo anterior de la cascada de la coagulación (vía intrínseca y extrínseca); por tanto no proporciona ninguna información de la interacción de los factores de la coagulación con las plaquetas (14) y tampoco brinda información sobre la estabilidad del trombo pues estas pruebas son terminadas antes de que ocurra la estabilidad del coágulo por el FXIIIa.
En contraste con TP y TPT, la tromboelastografía permite valorar la actividad funcional del sistema fibrinolítico y factor XIII. En los pacientes con trauma el TPT parece ser más específico para predecir resultados que el TP (1). En el estudio de Brohi (11) el TPT se correlacionó más con los niveles bajos de proteína C, por el efecto que ésta tiene; sobre los cofactores V y VIII. La tromboelastografía fue evaluada en un estudio de 90 pacientes con trauma, y sirve para detectar rápidamente alteraciones en la coagulación (33). La demora en obtener los resultados en las pruebas de coagulación, puede ser un iniciador, para aplicar el protocolo de transfusión en emergencias (34).
Las pruebas con las que contamos en nuestros servicios dejan por fuera aspectos fisiopatológicos de la coagulación en los pacientes traumatizados. Teniendo en cuenta la posible causa de iniciación de la coagulopatía aguda en trauma se hace necesario valorar con gases arteriales y venosos. Es necesario, además, medir; de forma seriada, la saturación venosa mixta de oxígeno; y el valor de EB y lactato sérico como medida de hipoperfusión (35,36). El EB durante la reanimación se correlaciona bien con los requerimientos de transfusión, la estancia en unidad de cuidados intensivos y el nivel de lactato sérico.
TRATAMIENTO DE LA COAGULOPATÍA EN EL TRAUMA
En trauma, la mayoría de los pacientes que consultan a las salas de urgencias tienen componentes multifactoriales asociados (36). En dicho evento, mientras se realiza la reanimación, el manejo debe ser enfocado a la causalidad de la lesión, por lo tanto, el principal factor es el control de la hemorragia como generador de shock (37). Los mejores desenlaces se obtienen cuando nos guiamos por objetivos y evaluamos continuamente cada intervención que realizamos; es aquí cuando podemos utilizar como objetivos tempranos los determinados por el Dr. Rivers en su estudio para pacientes con choque séptico, extrapolados perfectamente para pacientes con choque hipovolémico hemorrágico, sin descuidar algo tan fundamental como es el control del sangrado que constituye el pilar inicial para la reanimación. Basados en el perfil hemodinámico del ingreso debemos considerar la reanimación retardada, hasta tener control vascular del sitio de sangrado, con identificación temprana de los signos y síntomas de hipoperfusión o shock.
Según el Colegio Americano de Cirugía (38) cabe el uso o manejo con hemoderivados como elementos de primera elección en la recuperación del control hemostático: glóbulos rojos empaquetados (GRE), plaquetas, plasma fresco congelado. La medición de niveles de fibrinógeno con valores por debajo de 100 mg/dl indica el uso de crioprecipitado, donde podemos indicar hasta 10 U para la corrección de éste. En este punto la tromboelastografía puede ayudarnos a guiar la transfusión (39).
Aspectos importantes, como el uso exclusivo de GRE, se puede asociar con hemodilución por falta de los factores de coagulación, en relación con el volumen sanguíneo, por lo cual se hace imprescindible la asociación de plasma fresco y reposición de plaquetas con relación uno a uno.
La instauración de la coagulopatía puede ser reversible, una vez realizado el control hemostático y recuperado el estado hemodinámico. Debemos tener metas tempranas en la reanimación (37) (Tabla 1). Es importante resaltar que existen múltiples causas de sangrado en el paciente traumatizado y crítico (40,41):

1. Coagulopatía dilucional por reposición de fluídos y dilución de factores de la coagulación.
2. Transfusiones masivas de glóbulos rojos sin reposición de plaquetas y factores.
3. Trauma per se.
4. Enfermedades médicas preexistentes.
5. Coagulopatías adquiridas (acidosis, hipotermia e hipocalcemia).
Una vez realizado el control hemostático y vascular del paciente, se deben fijar las metas de control térmico y mantenimiento de la perfusión con corrección de la acidosis (Tabla 2).

Como ha sido sustentado a lo largo de toda la revisión que se ha hecho del evento fisiopatológico de la hemostasia y sus diferentes componentes, una inadecuada reanimación, pobre control del sangrado, persistencia de la hipoperfusión e inadecuada protección de la hipotermia en el manejo temprano nos deja a las puertas de la tríada mortal como disparador del desenlace fatal de estos pacientes. La experiencia descrita por muchos autores ha dejado ver con gran descontento que el evento de coagulopatía en el paciente con trauma se ha instaurado aun cuando se realizan las reposiciones con hemoderivados de modo temprano y se compensa la hipoperfusión, hay una gran brecha en el manejo de este tipo de problemas y la necesidad de un elemento corrector del estado coagulopático luego de la instauración debido a la estimulación de sustancias procoagulantes endógenas.
En el escenario actual tenemos el rol de un medicamento que, para muchos, ha referido un resultado milagroso en el control de la coagulopatía, siendo este: el factor VII recombinante activado o NovoSeven, Novo Nordisk, Bagsvaerd, Denmark (rFVIIa).
Desde la década de los años ochenta, del siglo anterior, cuando se inició su uso; como terapéutica para pacientes con hemofilia, le valió su aprobación en Europa y la Administracion de Alimentos y Fármacos (FDA, por sus siglas en inglés Food and Drug Administration) en Norteamérica, para esta última indicación.
Encontramos ahora un gran número de publicaciones acerca del uso de este tipo de sustancia en el manejo de la coagulopatía, podemos observar como en casos aislados ha servido; para reversar coagulopatias en pacientes en tratamiento con warfarina (41), por lo cual vale la pena recordar la acción del rFVIIa en la cascada de la coagulación: el factor VII, como dependiente de factor tisular (FT), posterior a la activación de éste en el subendotelio, y generar una gran producción de trombina. El debut del rfVIIa es de crucial importancia, porque promueve la coagulación en el sitio del trauma y no a escala sistémica; al mismo tiempo se ha demostrado que genera aumento de la densidad del coagulo haciéndolo resistente a la fibrinólisis y además puede reducir la cantidad de unidades de globulos rojos a transfundir (42). Respecto a las dosis, para el uso del rfVIIa, no hay consensos que dicten las dosis adecuadas, se recomiendan, rangos entre 40 y 90 ug/kg (43). Además tampoco contamos con unas guías de manejo que nos permitan definir las indicaciones precisas en este tipo de pacientes y sus contraindicaciones, podemos ayudar la terapia con la tromboelastometría (44).
Los concentrados de complejos protrombínicos (CCP) son altamente purificados con actividad hemostática y se preparan a partir de plasma. Contienen factores llamados vitamina K- dependientes (II,VII,IX y X) indicados para la reversión de anticoagulación por anticoagulantes orales, en ocasiones utilizado para manejo de coagulopatías por déficit de FII o FX (45). En algunos países de Europa se utilizan para manejo de sangrados masivos perioperatorios y postoperatorios (46). Los CCP deben tener un nivel mínimo de potencia de FIX, FII y FX cercanas a la del FIX y potencia menor de FVII (47). La concentración de factores de coagulación es mucho más alta que la del plasma. La principal indicación para la utilización de éstos, es la deficiencia de factores vitamina K dependientes o en deficiencias congénitas de factor II y X, aunque sólo deben utilizarse con sangrados que amenazan la vida y se debe administrar concomitantemente vitamina K (48).
La única contraindicación absoluta para su utilización es la coagulación intravascular diseminada (CDI) y debe utilizarse con precaución en los pacientes con trombocitopenia inducida por heparinas tipo II o que tengan complicaciones trombóticas mediada por heparina.
CONCLUSIONES
El enfoque del paciente con trauma severo debe ir encaminado a un adecuado y oportuno manejo inicial en la sala de urgencias, con adecuada reanimación, protección de la hipotermia y mantenimiento de la perfusión, basados en los nuevos conceptos fisiopatológicos, la decisión de aplicar hemoderivados de manera temprana es importante, también, el mantenimiento de las metas pre y poscontrol vascular en la reanimación. Además tenemos que evaluar cuantitativamente las diferentes intervenciones, hasta lograr los objetivos. No debemos olvidar que el trauma induce una respuesta inflamatoria, y esta también puede ser iniciada, por las proteasas de la coagulación (49), llevando posteriormente al paciente a un estado protrombotico, similar al observado en la sepsis severa (50).
Las pruebas diagnósticas con las que contamos en nuestros servicios de urgencia presentan limitaciones. La tromboelastografía se perfila como herramienta diagnóstica y puede guíar la terapia.
El rFVIIa como tratamiento en el trauma promete buenos resultados con uso adecuado, en el momento correcto sin tener aún parámetros protocolizados en relación con indicaciones precisas o contraindicaciones; cabe anotar, que el uso del mismo, es importante una vez se ha hecho control vascular del sangrado, asociado a la corrección de la acidosis e hipotermia, como factores perpetuantes.
Referencias
1. Brohi K, Mitchell J, Cohenb, Ross A, Davenporta. Acute coagulopathy of trauma: mechanism, identification and effect. Curr Opin Crit Care. 2007;13:680-685. [ Links ]
2. Charles A, Shaikh AA, Walters M, Huehl S, Pomerantz R. Bloodtransfusion is an independent predictor of mortality after blunttrauma. Am Surg. 2007;73:1-5. [ Links ]
3. Kheirabadi BS, Crissey JM, Deguzman R, Holcomb JB. In vivobleeding time and in vitro thrombelastography measurements are better indicators of dilutional hypothermic coagulopathy thanprothrombin time.J rauma.2007;62:1352-1359 [ Links ]
4. Rugeri L, Levrat A, David JS, et al. Diagnosis of early coagulation abnormalities in trauma patients by rotation thrombelastography.JThrombHaemost. 2007;5:289 -295. [ Links ]
5. Borgman MA, Spinella PC, Perkins JG, et al. The ratio of bloodproducts transfused affects mortality in patients receiving massive transfusions at a combat support hospital. J Trauma. 2007;63:805- 813. [ Links ]
6. Sauaia A, Moore FA, Moore EE, et al. Epidemiology of trauma deaths: a Reassessment. J Trauma. 1995; 38(2):185-193. [ Links ]
7. MacLeod JB, Lynn M, McKenney M, Cohn S, Murtha M. Early coagulopathy predicts mortality in trauma. J Trauma. 2003; 55(1):39-44. [ Links ]
8. Brohi K, Singh J, Heron M, Coats T. Acute traumatic coagulopathy. J.Trauma.2003;54(6):1127-1130. [ Links ]
9. Stahel PF,Moore EE,Schreier SL, Flierl MA,Kashuk JL. Transfusion Strategies in Posinjury Coagulophaty. Curr Opin Anesth. 2009;22:289-298. [ Links ]
10. Brohi K, Cohen MJ, Ganter MT, et al. Acute coagulopathy of trauma: hypoperfusion induces systemic anticoagulation and hyperfibrinolysis. J Trauma.2008; 64:1211-1217. [ Links ]
11. Brohi K, Cohen MJ, Ganter MT, et al. Acute traumatic coagulopathy: initiated by hypoperfusion: modulated through the protein C pathway? Ann Surg.2007; 245:812-81. [ Links ]
12. Torres JC, Torres MU, Benjumea MA. Manejo de hemorragia digestiva profusa secundaria a hemangioma intestinal con factorVIIa recombinante [Reporte de caso y revisión de la literatura]. Act Colom de Cuid Inten. 2008; 8(4): 322-329. [ Links ]
13. Tanaka, kenichi A, Keil NS, Levy, Jerrold H. Blood Coagulation: Hemostasis and Thrombin Regulation. Anesth. & Analg. 2009 May 108(5) :1433-1446. [ Links ]
14. John RH, Brohi K, Richard PD,Carl JH, John BH , Kluger Y,Mackway K, Par M, , Rizoli SB , Yukioka T , Hoyt DB, Bouillon B. The Coagulopathy of Trauma: A Review of Mechanisms. J Trauma. 2008;65:748 -754. [ Links ]
15. Esmon CT. The interactions between inflammation and coagulation.Bj J Haematol.2005;131:417-430. [ Links ]
16. Mann KG. Biochemistry and physiology of blood coagulation.Thromb Haemost. 1999;82:165-174. [ Links ]
17. Siegel JH, Rivkind AI, Dalal S, et al. Early physiologic predictors of injur Severity and death in blunt multiple trauma. Arch Surg 1990; 125:498-508. [ Links ]
18. Brummel ZK, Whelihan MF, Ziedins EG, Mann KG. Theresuscitative fluid you choose may potentiate bleeding. J Trauma. 2006;61:1350 -1358. [ Links ]
19. Ho AM, Karmakar MK, Dion PW. Are we giving enough coagulation factors during major trauma resuscitation?. Am J Surg 2005;190:479-484. [ Links ]
20. Hirshberg A, Dugas M, Banez EI, Scott BG, Wall MJ, Mattox KL. Minimizing dilutional coagulopathy in exsanguinating hemorrhage: a computer simulation. J Trauma 2003;54:454-463. [ Links ]
21. Brazil EV, Coats TJ. Sonoclot coagulation analysis of in-vitro haemodilution with resuscitation solutions. J R Soc Med 2000;93:507-510. [ Links ]
22. Vincent JL, Rossaint R, Riou B, Ozier Y, Zideman D, Spahn DR. Recommendations on the use of rFVIIa as an adjunctive treatment for massive bleeding -a European perspective. Critical Care 2006; 10: R120. [ Links ]
23. Reed RL II, Bracey AW, Jr., Hudson JD, Miller TA, Fischer RP.Hypothermia and blood coagulation: dissociation between enzyme activity and clotting factor levels. Circ Shock. 1990;32:141-152. [ Links ]
24. Wolberg AS, Meng ZH, Monroe DM III, Hoffman M. A systematic evaluation of the effect of temperature on coagulation enzyme activity and platelet function. J Trauma. 2004;56:1221-1228. [ Links ]
25. Meng ZH, Wolberg AS, Monroe DM III, Hoffman M. The effect oftemperature and pH on the activity of factor VIIa: implications forthe efficacy of high-dose factor VIIa in hypothermic and acidoticpatients. J Trauma. 2003;55:886-891. [ Links ]
26. Wolberg AS, Meng ZH, Monroe DM, Hoffman MA. systematic evaluation ofthe effect of temperature on coagulation enzyme activity and platelet function.J Trauma 2004; 56:1221-1228. [ Links ]
27. Martini WZ, Pusateri AE, Uscilowicz JM, DelgadoAV, HolcombJB. Independent contributions of hypothermia and acidosis tocoagulopathy in swine. J Trauma. [discussion] 2005;58:1009-1010. [ Links ]
28. Cosgriff N, Moore EE, Sauaia A,Moynihan K, Burch JM,Galloway B. Predicting life-threatening coagulopathy in the massively transfused trauma patient: hypothermia and acidoses revisited. J Trauma. [discussion] 1997;42:857- 861. [ Links ]
29. Martini WZ, Dubick MA, Wade CE,Holcomb JB. Evaluation of tris-hydroxymethyl aminomethane on reversing coagulation abnormalities caused by acidosis in pigs. Crit Care Med. 2007;35:1568 -1574. [ Links ]
30. Levi M, van der Poll T, ten Cate H, van Deventer SJ. The cytokine mediated imbalance between coagulant and anticoagulant mechanisms in sepsis and endotoxaemia. Eur J Clin Invest. 1997;27:3-9. [ Links ]
31. Shebuski RJ, Kilgore KS. Role of inflammatory mediators in thrombogenesis. J Pharmacol Exp Ther. 2002;300:729 -735. [ Links ]
32. Chesebro BB, Rahn P, Carles M,Esmon C, Jun X, Brohi K, Frith D, Pittet J-P, Cohen M. Shock. Increase in activated protein c mediates acute traumatic coagulopathy in mice. 2009 Dec ; 32 6:659-665. [ Links ]
33. Rugeri L, Levrat A, David JS, et al. Diagnosis of early coagulation abnormalitiesin trauma patients by rotation thrombelastography. J Thromb Haemost 2007; 5:289-295. [ Links ]
34. Devenport RA, Brohi K. Coagulophaty in trauma patients : Importance of thrombocyte function?.Curr Opin Anesth.2009;22:261-266. [ Links ]
35. Oliver M. Theusinger D R, Ganter M. Transfusion in trauma: why and how should we change our current practice? Curr Opn Anaesth 2009,22:000-000 [ Links ]
36. Feliciano DV, Mattox K, Moore E. Trauma, 6th Edition: McGraw-Hill ;2008. [ Links ]
37. Dutton RP. Current Concepts in Hemorrhagic Shock. Anesth Clinics 2007 March 1; 25 :23-34. [ Links ]
38. American College of Surgeons Committee on Trauma: Advanced Trauma Life Support(ATLS)Course for Physicians,edn 7.Chicago:American College of Surgeons;2008. [ Links ]
39. Sorensen B, Ingerslev J. Tailoring haemostatic treatment to patient requirements - an update on monitoring haemostatic response using thrombelastography. (Suppl) Haemophilia 2005 11; 1:1-6. [ Links ]
40. Brown RB, Klar J, Teres D, Lemeshow S, Sands M. Prospective study of clinical bleeding in intensive care unit patients. Crit Care Med. 1988 Dec 16(12):1171-6. [ Links ]
41. Stein D, Dutton R, Kramer M, Scalea T. Reversal of Coagulopathy in Critically Ill Patients With Traumatic Brain Injury: recombinant Factor VIIa is More Cost-Effective Than Plasma. J Trauma 2009;66: 63-75. [ Links ]
42. Galvan DA,Fink MP. Recombinant factor VIIa in severe trauma: Further study needed. Crit care 2006 10:308. [ Links ]
43. Martinowitz U, Holcomb JB, Pusateri AE, et al. Intravenous rFVIIa administered for hemorrhage control in hypothermic coagulopathic swine ith grade V liver injuries. J Trauma 2001; 50:721-729. [ Links ]
44. Bartal C, Yitzha A. The role of thromboelastometry and recombinant factor VIIa in trauma, Curr Opin Anaesthesiol 2009 Apr; 22(2):281-288 [ Links ]
45. Hellstern P, Halbmayer WM, Kohler M et al. Prothrombin complex concentrates: indications, contraindications, and risks: a task force summary. Thromb Res 1999; 95:S3-S6. [ Links ]
46. Blauhut B. Indications for prothrombin complex concentrates in massive transfusions. Thromb Res 1999; 95:S63-S69. [ Links ]
47. Schulman S, Bijsterveld NR. Anticoagulants and their reversal. Transfusion Medicine Reviews 2007; 21: 37-48. [ Links ]
48. Van Veen SQ, Strengers PF. Use of prothrombin complex concentrates in anticoagulation. Am J Hematol 2008; 83:344-345. [ Links ]
49. Esmon CT. Crosstalk between inflammation and thrombosis.Maturitas. 2004;47:305-314. [ Links ]
50. Rigby AC, Grant MA. Protein S: a conduit between anticoagulation and inflammation. Crit Care Med. 2004;32:S336 -S341 [ Links ]











 text in
text in 

