Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.39 no.1 Bogotá Jan./Mar. 2011
https://doi.org/10.5554/rca.v39i1.160
http://dx.doi.org/10.5554/rca.v39i1.160
Artículo de Revisión
Toxicidad por anestésicos locales: revisión de la literatura
Rafael Enrico Valencia Gómez*, Hans Fred Garcia Araque**
* Médico, Residente II Ano de Anestesiología, Hospital Militar Central, Bogotá, Colombia, rafael_valencia@hotmail.com
** Médico y Anestesiólogo. Coordinador del Posgrado en Anestesiología, Universidad Militar Central. Comité de Reanimación Sociedad Colombiana de Anestesiología y Reanimación. Coordinador servicio anestesiología, docente pregrado y posgrado U. Militar Nueva Granada, Hospital Militar Central, Bogotá, Colombia, hafregar@gmail.com
Recibido: febrero12 de 2010. Enviado para modificaciones: abril 27 de 2010. Aceptado: agosto 28 de 2010.
RESUMEN
Los anestésicos locales (AL) son medicamentos muy empleados en la práctica anestésica, con baja presentación de efectos adversos y, en el caso de toxicidad, una alta mortalidad. Actualmente las tasas de toxicidad sistémica han disminuido, del 0,2 % al 0,01 %, por el uso de medidas preventivas y desarrollo de medicamentos más seguros. Dado el riesgo de mortalidad latente, los estudios en humanos no son factibles, siendo la fuente de información disponible la extrapolación de estudios animales o reportes de caso.
Las manifestaciones de toxicidad severa por AL, se dan principalmente con la administración intravascular más que por la absorción tisular; siendo así la bupivacaína el AL con mayor riesgo. Clínicamente se observa alteración del estado de conciencia y convulsiones tónico-clónicas seguidas de compromiso cardiovascular, dado por bloqueos de la conducción y colapso cardiovascular de difícil manejo.
En cuanto al manejo, la prevención es la base de éste seguido de una técnica anestésica adecuada; rápido reconocimiento y diagnostico e inicio temprano de medidas de rescate según el ACLS y más recientemente el uso concomitante de emulsiones lipídicas al 20 %, soportado en reportes de caso con resucitación exitosa.
Palabras claves: Anestésicos Locales, Toxicidad, Cardiotoxinas, Síndromes de Neurotoxicidad, Emulsiones Grasas Intravenosas. (Fuente: DeCS, BIREME).
INTRODUCCIÓN
Los anestésicos locales (AL) son medicamentos muy utilizados en la práctica anestésica, en especial en centros que manejan procedimientos bajo técnicas regionales; una herramienta en el tratamiento o prevención del dolor agudo o crónico y en el manejo de dolor con fines diagnósticos o para establecer pronóstico (1).
A pesar que la presentación de efectos adversos por AL no es frecuente; es de gran importancia su estudio, pues la severidad de la toxicidad debido al riesgo por su administración inadecuada (dosis altas, ubicaciones no apropiadas, entre otras) se asocia a una alta mortalidad (2).
De su modificación molecular se generan propiedades de unión a proteínas plasmáticas, solubilidad en lípidos (potencia), duración de acción, toxicidad e ionización (1). Igualmente, tienen la propiedad de tener isómeros con diferentes propiedades a su molécula racémica (potencia, afinidad por receptores, efectos tóxicos, entre otros) (3).
Incidencia
Los datos existentes hasta la fecha, se encuentran soportados en estudios con bajo grado de evidencia, dado que éticamente no es permitida la realización de trabajos con exposición a altos niveles de toxicidad en humanos, por obvias razones. Por ello, la mayoría de información proviene de extrapolar resultados de estudios en modelos animales (4,5). La incidencia descrita por Mulroy para procedimientos regionales es de 200/100.000 casos para bloqueo del plexo braquial y de 12/100.000 para anestesia epidural (4).
Las tasas de toxicidad sistémica por AL han disminuido significativamente en las últimas tres décadas, de un 0,2 % a un 0,01 %, debido a la aplicación de medidas preventivas, como la aspiración previa a la inoculación, el uso de las dosis de prueba y el establecimiento de dosis máximas, entre otras. Las mayores tasas de toxicidad han sido reportadas como secundarias al bloqueo de nervio periférico (7,5/10.000 casos). Con una tasa de mortalidad de 0,023 casos/100.000 (6). La incidencia de convulsiones asociadas con la anestesia regional fue de 1 a 4/1.000 casos con una mayor incidencia asociada con técnicas caudal > braquial (supraclavicular - interescalénico > axilar) > epidural; con respecto a los AL, la bupivacaína fue el AL con mayor incidencia de complicaciones (7-10). (Tabla 1).
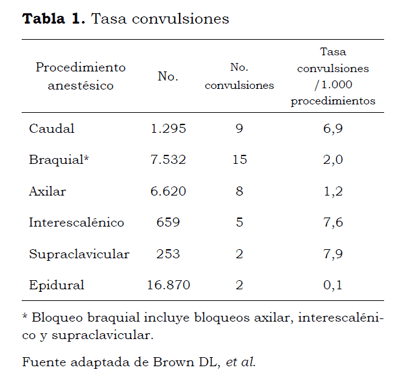
En el estudio de Barrington y cols (11), se encontró una incidencia de toxicidad por AL de 0,98/1.000 bloqueos; siendo las complicaciones mayores convulsiones tónico-clónicas, perdida del estado de conciencia y taquicardia; y complicaciones menores de agitación y signos de compromiso de SNC leves. No se observaron eventos de colapso cardiovascular. Según el tipo de AL, se observo mayor incidencia con ropivacaína y en un caso asociado al uso de lidocaína.
FARMACODINAMIA Y FARMACOCINÉTICA
El bloqueo de los canales de sodio voltaje dependientes con mayor afinidad por los canales abiertos, es la forma como realiza su efecto axonal lo que genera bloqueo sensitivo y motor; se ha descrito actividad sobre otro tipo de canales iónicos (Ca++ y K+), evidenciado por su efecto en el ensanchamiento, retraso en la repolarización y modificación del potencial de membrana generando así un mayor efecto sobre el bloqueo de los canales de Na+ (12). La presencia de estos en los espacios central, cardíaco y periférico explican la sintomatología de la toxicidad por AL (12,13).
Diversos factores influyen en la farmacocinética de los AL, son reconocidas la potencia (lipofilici-dad), dosis, velocidad de administración, vascularización del sitio de aplicación en la absorción sistémica de estos (intravenosa > traqueal > intercostal > paracervical > epidural > plexo bra-quial > ciático > subcutáneo), metabolismo, uso de sustancias que disminuyen la velocidad de absorción (epinefrina, bicarbonato, hialuronida-sas, entre otras) (1,4). Igualmente, se ha descrito el pulmón como órgano protector del efecto tóxico de los AL, por la atenuación de las concentraciones sanguíneas (20 %), independiente de la dosis (6).
MÁXIMAS DOSIS RECOMENDADAS
La información existente sobre dosificación de los AL en su gran mayoría no está basada en evidencia; usualmente, se presenta en dosis máxima total con el fin de prevenir la administración excesiva y, por ende, la toxicidad (14). (Tabla 2).
La recomendación en este caso, es individualizar la dosificación de acuerdo con sus características (edad, comorbilidades), procedimiento por realizar, tipo de AL (farmacocinética, farmacodinamia), entre otros (14,15). En el caso de los AL amino-esteres, estos se metabolizan por esterasas plasmáticas, disminuyendo el riesgo de toxicidad aguda; pero por el contrario, sus metabólitos son responsables de reacciones anafilácticas (5).
Dentro de los usos clínicos de los AL, las técnicas tumescentes utilizadas en cirugía plástica en el contexto de la liposucción (16), se emplean dosis máximas aceptadas de lidocaína con epinefrina hasta de 35 mg/kg y reportadas hasta 55 mg/kg, sin alcanzar niveles séricos superiores a 5 ug/mL. En todo caso, es importante tener en cuenta la posibilidad de presentación de toxicidad por AL independiente de la dosis o relacionada con interacciones medicamentosas.
TOXICIDAD POR ANESTÉSICOS LOCALES
Descrita inicialmente en 1928 por Mayer, quien publico 40 casos de fatalidades secundarias al empleo de técnicas anestésicas locales (17); recientemente, el doctor Albright reportó el riesgo por los nuevos AL en 1979 (17). Posteriormente, se ha dado mayor importancia a la descripción fisiopatológica y terapéutica de la toxicidad aguda por los AL.
Las reacciones sistémicas por los AL son raras, se presentan con tendencia hacia la disminución de su incidencia por el efecto positivo de la instauración de procedimientos y la presencia de AL más seguros. A pesar de su baja incidencia, su desenlace puede ser fatal. Generalmente, cursan con manifestaciones leves en la mayoría de los casos, y suelen pasar inadvertidas generando un posible subregistro de dichos eventos (6).
Los efectos tóxicos agudos posterior a la administración intravascular de los AL tienden a ser más severos y de corta duración que aquellos secundarios a la absorción sistémica lenta por administración perineural; lo anterior, debido al sobrepaso de los sistemas de aclaramiento corporal (1). Suele presentarse como consecuencia de inyección inadvertida intravascular o intra-tecal, o secundario a altas dosis. Con presencia de compromiso, principalmente, de SNC inicialmente (mayor susceptibilidad) y posterior colapso CV (3,4). Puede clasificarse en tres categorías de acuerdo con el tipo de reacción (Tabla 3).

Los AL de larga duración, a pesar de la disponibilidad actual de isómeros desarrollados (le-vobupivacaína, ropivacaína), con el fin de disminuir los efectos tóxicos de la bupivacaína, continúan siendo de especial importancia, debido a la presencia de eventos de toxicidad aguda severos (18-21).
TOXICIDAD LOCAL
Miotoxicidad: Los AL pueden producir necrosis tisular en el sitio de administración, no excluyendo dentro de las causas de esta complicación, el trauma y la hemorragia, generado por la administración. En estudios de laboratorio, se ha descrito mayor riesgo de toxicidad tisular con el uso de bupivacaína > procaína > tetracaína > ropivacaí-na (22). Recientemente, se ha descrito experimentalmente el efecto condrotóxico con la administración intraarticular de la bupivacaína (23).
Neurotoxicidad: En modelos de laboratorio se ha demostrado con altas concentraciones; sin embargo, no se puede atribuir solamente a los AL la presentación de neurotoxicidad, si no que debe considerarse la presencia de otro tipo de sustancias como los preservantes (22). Igualmente, se han descrito síntomas neurológicos transitorios (disestesias, parestesias, disminución o pérdida temporal de la función motora, incontinencia, síndrome de la cola de caballo, entre otras), con resolución de estos en una a cuatro semanas, no siendo permanentes (23).
Estudios experimentales han demostrado mayor tendencia de la lidocaína para producir neuro-toxicidad en el contexto de la anestesia espinal (2 a 5 % más que otros AL) (22).
TOXICIDAD SISTÉMICA
Toxicidad de sistema nervioso central: Con el incremento progresivo de la concentración sérica de los AL posterior a su administración, se aumenta el riesgo de la toxicidad a nivel central, debido a su mayor sensibilidad. Inicialmente, se observa efecto depresor sobre las vías inhibitorias mediadas por receptores GABA (22), y efecto estimulante sobre receptores NMDA (22), clínicamente dado por agitación, mareo, mioclonías, nistagmos, disartria, contracturas musculares, parestesias periorales, alteración de la percepción de sabores (sabor metálico), sonidos (tinnitus), falta de respuesta a órdenes verbales, trastornos del habla y por último, convulsiones tónico-clónicas (22,23). Con concentraciones séricas mayores, el efecto depresor en las vías inhibitorias continúa, y bloquea las vías excitatorias, produciendo depresión respiratoria (hipoxia, acidosis) y coma (22,23).
Toxicidad cardiovascular: Los cambios hemodinámicos agudos son la resultante de la respuesta sistémica a la toxicidad aguda, lo que genera cambios entre los sistemas cardiovascular (efecto directo) y sistema nervioso central (efecto indirecto, mediado por estímulo al sistema nervioso autónomo) (6). La toxicidad cardiaca se observa por dos mecanismos; el primero, asociado con disfunción de ganglio autonómico y el segundo como efecto sobre los sistemas de conducción miocárdicos. La presencia de arritmias ventriculares no son frecuentes, excepto con la bupivacaína, con la que se ha observado taquicardia y fibrilación ventricular (24).
En estudios realizados sobre modelos animales (25-29), se ha determinado el efecto directo de los AL sobre la célula cardíaca, que se evidencia en el ensanchamiento del QRS, alteración en la contractilidad y arritmias malignas con la posterior falla cardíaca; dado por la alteración de la modulación mediada por proteínas G de canales iónicos (Ca++ y K+), metabolismo mitocondrial y producción de ATP (30). De los diferentes AL, y sobre modelos animales la bupivacaína ha demostrado mayor cardiotoxicidad, debido a la fuerte atracción y disociación de los canales de sodio, así como por los efectos sobre los canales lentos de calcio (10).
Las concentraciones séricas requeridas para la presentación de toxicidad severa por AL (excepto bupivacaína) en el corazón, exceden aquellas necesarias para producir convulsiones tónico-clónicas; clínicamente cursa con taquicardia, hipertensión (inicialmente), hipotensión y bradicardia (toxicidad severa), depresión miocárdica y bajo gasto asociados con arritmias (retraso en la conducción, bloqueos de rama, prolongación PR, ectopias ventriculares, taquicardia ventricular, fibrilación ventricular, torsade de pointes, paro sinusal, asistolia) (22,30,31). Asi mismo, la enfermedad cardiaca isquémica y los trastornos en la conducción favorecen la presentación de toxicidad por AL (17). En la Tabla 4, se muestra las concentraciones séricas de diversos AL en el momento del colapso cardiovascular, de acuerdo con un estudio realizado sobre modelo animal.
ABORDAJE TERAPÉUTICO
Debe aclararse que todo procedimiento con técnicas regionales debería ser practicado bajo condiciones adecuadas, previniendo la presentación de complicaciones; por ello, debe ser realizado con monitoria básica no invasiva (oximetría de pulso, monitoreo electrocardiográfico continuo y presión arterial no invasiva; teniendo en consideración las complicaciones cardiovasculares y la necesidad de identificarlas tempranamente para iniciar maniobras correctivas); igualmente, realizar acciones tendiente a prevenir la sobre-dosificación, aspiración previa a la infiltración, dosis de prueba y fraccionamiento de la dosis. Medidas todas que han llevado a la disminución de la presentación de este tipo de eventos adversos en las últimas décadas (7-9).
Prevención de sobredosificación: Es claro que disponer de los insumos necesarios para responder ante un evento de toxicidad aguda por AL, podría mejorar el efecto en la atención de la misma (17). Bajo este contexto se debe contar con elementos para manejo adecuado de la vía aérea; seleccionar el AL, dosis y concentraciones óptimas (22), seleccionar la técnica más favorable y el abordaje anatómico adecuado. Igualmente, debe considerarse que el uso de bupivacaína presenta un mayor efecto depresor de la conducción cardiaca, principalmente en el espacio ventricular; igualmente, asociación bupivacaína-lidocaína está relacionada con un mayor incremento en los trastornos de conducción cardiaca dado por el efecto aditivo de la lidocaína (24, 27-29).
Pretratamiento: El uso de benzodiacepinas en modelos animales (17), disminuye la probabilidad de presentar convulsiones por toxicidad en el SNC; aunque la sedación retrasaría el diagnóstico temprano de un evento de toxicidad aguda por AL.
Dosis de prueba: Su objetivo es la identificación temprana de inyección intravascular (17), teniendo en cuenta algunos factores que pueden modificar su resultado (edad, gestación, uso de medicamentos como benzodiacepinas, b-bloqueadores, opiáceos, clonidina, anestesia general) (17,32,33).
El efecto secundario a la administración de 15 mcg de epinefrina (incremento FC > 10 x/min, PAS > 15 mmHg o disminución del 25 % amplitud de onda T en DII) (17); el bajo gasto puede alterar este resultado.
Fraccionamiento de dosis: El fraccionamiento de la dosis administrada (dosis lenta 5 mL, con aspiraciones frecuentes y monitoreo no invasivo (34)), reduciría la concentración arterial máxima, aunque hasta el momento sin evidencia experimental de efecto en el resultado; detección temprana de efectos tóxicos y así detener la administración del AL ante síntomas sugestivos, aunque, no es una acción suficiente para evitar una intoxicación aguda por AL (6). Así mismo, da el tiempo necesario para la reducción en las concentraciones sanguíneas lo que permite su distribución y eliminación (6).
Respuesta temprana: El abordaje temprano ante la detección de síntomas leves de toxicidad incrementa la probabilidad de éxito en el tratamiento (30,31); ante la presencia de sintomatología sugestiva, se debe dar inicio a las maniobras terapéuticas necesarias (asegurar vía aérea y ventilación adecuada, realizar maniobras de reanimación según protocolos ACLS, prevención y tratamiento temprano de convulsiones, corrección de arritmias y depresión miocárdica) (30,31).
La administración de altas dosis de epinefrina (modelos animales) durante maniobras de reanimación junto con las Emulsiones Lipídicas (EL) para el manejo de la toxicidad cardiovascular por bupivacaína, no mostro beneficios en la recuperación; sugiriendo que dicha asociación evitaría la reversión de la toxicidad por bupivacaína (35). Hiller y cols (36), mostraron el efecto de dosis altas de epinefrina sobre el uso concomitante de EL posiblemente secundario al incremento de la acidosis por aumento del lactato; mostrando mejores efectos a dosis menores a 10 mcg/Kg (36).
Igualmente, se debe considerar la posibilidad de bypass cardiopulmonar o el uso de EL (18), ante el evento de toxicidad refractaria al tratamiento (30,31). Cabe resaltar que el propofol no reemplaza este tipo de medicamentos por su contenido lipídico bajo y efecto cardiodepresor.
USO DE EMULSIONES LIPÍDICAS
Existen diversas teorías sobre el mecanismo de acción de la administración intravenosa de las EL; entre las más aceptadas se encuentra la extracción del suero de los AL a través de una in-terfaz lipídica, otras tratan el efecto metabólico por medio del restablecimiento de la entrega de ácidos grasos a nivel mitocondrial, para recuperar la producción energética; igualmente, se ha demostrado la activación de los canales de calcio y potasio, así como la disminución de la acidosis tisular y disminución de la producción de CO2 durante episodios de isquemia asociados con colapso cardiovascular (10).
La solubilidad de los AL de larga duración en las EL y su alta capacidad de unión a éstas, explica probablemente su eficacia clínica en el manejo de la toxicidad por los primeros. Dentro de este tipo de EL, los triglicéridos de cadena larga son más eficaces que los de cadena media, demostrado por Mazoit y cols (17); igualmente, las propiedades farmacocinética de los AL (hidrofobicidad), favorece este efecto; por el contrario, la acidosis disminuye el efecto de unión a estas. Zausig y cols. (37), sugieren que los efectos de las EL sobre la toxicidad cardiovascular (paro cardiaco) inducida por los AL, se encuentra fuertemente dependiente en la lipofilicidad de cada tipo de anestésico, teniendo mejores efectos la toxicidad inducida por bupivacaína. Aunque con respecto a estos hallazgos, se requieren más estudios para validar estos resultados.
La aceptación global de las EL como posible antídoto para el tratamiento de la toxicidad por AL (38), ha generado interés por parte de asociaciones médicas para su inclusión en guías (39), protocolos y recomendaciones en diferentes publicaciones escritas y por medios electrónicos (31); (http://www.lipidrescue.org, http://www.asahq.org/clinical/Anesthesiology-CentricACLS.pdf, http://www.resus.org.uk/pages/caLocalA.htm); en las que las EL, aparentemente presentan un perfil de seguridad aceptable en las dosis recomendadas por la AAGBI (Association of Anesthetists of Great Britain and Ireland) (31). Igualmente, hacia el 2008, el Comité de Medicina de Cuidado Critico de la ASA, así como el Consejo en Resucitación del Reino Unido realizaron publicaciones en línea de protocolos para el manejo de la toxicidad por AL.
Cave y cols (40) realizaron un estudio evaluando las guías de manejo de la toxicidad por AL publicadas por la AAGBI con el fin de valorar su eficacia; con este protocolo encontraron una tendencia hacia la recuperación espontanea de la circulación más rápida frente al grupo control; aunque estos hallazgos son positivos, se requiere aun mayor evidencia experimental para su soporte.
En general, se han mostrado efectivas en los reportes de caso publicados, al emplear EL al 20 % (41,42), en un variado contexto de presentación de pacientes encontrando reportes de uso exitoso en pacientes obstétricas (analgesia obstétrica con bupivacaína por vía peridural) (43); pacientes pediátricos (anestesia caudal con bupivacaí-na) (44); y en otros en los que se recomienda su uso para disminuir la progresión de la toxicidad aguda una vez que los síntomas (leves), están presentes (17,42,45-51). Igualmente, es una herramienta útil en la reversión de la toxicidad por AL, en el contexto de uso previo de medidas de soporte vital cardiovascular avanzado con poca respuesta a dichas maniobras (52).
EFECTOS ADVERSOS
Los más comunes, a pesar de dosis seguras y adecuadamente toleradas según los reportes previos, se encuentran relacionados con la administración del mismo; las alteraciones en la respuesta inflamatoria sistémica, reacciones alérgicas, anafilácticas, cefalea, somnolencia, mareo, diaforesis, disnea, nauseas, vomito, hi-pertermia e hipercoagulabilidad (10).
Efectos tardíos, la trombocitopena, ictericia, sobrecarga de volumen, aumento de transaminasas, leucopenia, resistencia a la warfarina (unión a proteínas), interferencia con circuitos de oxigenación de membrana, hepato-esplenomegalia, pancreatitis (53), embolismo graso (partículas > 5 u), embolismo pulmonar, estos últimos asociados a la dosis y tasa de infusión; incremento de la presión intracraneana posterior a trauma cra-neoencefálico severo (54); riesgo de recurrencia de la toxicidad posterior a su administración y predisposición a convulsiones en niños (55).
CONTRAINDICACIONES
Presencia de desordenes lipídicos, alergias al huevo, infarto agudo de miocardio y dentro de las recomendaciones debe ser empleada precaución en los casos de anemia, enfermedad hepática severa, coagulopatías, enfermedad pulmonar y pacientes en riesgo de embolismo graso (10).
La realización de investigación en toxicidad aguda por AL en humanos, éticamente no es posible. Los estudios (entendimiento de mecanismos farmacológicos, patofisiológicos y terapéuticos) realizados hasta el momento se basan en modelos animales con posterior aplicación y extrapolación a seres humanos. Dada la naturaleza poco ética de la realización de estudios en humanos para la determinación de las dosis ideales de las EL en el tratamiento de la toxicidad por AL, estas permanecen aún por determinar.
CONCLUSIONES
La toxicidad por los AL a pesar de ser un evento infrecuente debe ser considerada de manera importante dadas las connotaciones de mortalidad ante la presencia de reacciones severas como el colapso cardiovascular, ante lo cual, se hace necesaria su temprana identificación basada en la clínica y en un alto índice de sospecha; así como, en la continua aplicación de las diferentes medidas preventivas tendientes a disminuir el riesgo de su presentación.
Igualmente, considerar dentro del posible manejo de reanimación basados en los protocolos de la ACLS el uso concomitante de las EL basados en recomendaciones soportadas por reportes de caso con éxito en su uso.
REFERENCES
1. Heavner JE. Local Anesthetics, Curr Opin Anesthesiol, 2007, 20336-342. [ Links ]
2. Veering BT. Complications and local anaesthetic toxicity in regional anaesthesia. Curr Opin Anaesth, 2003;16:455-9. [ Links ]
3. Leone S, Di Cianni S, Casati A, et al. Pharmacology, toxicology and clinical use of new long acting local anesthetics, ropivacaine and levobupivacaine. Acta Biomed, 2008;79:92-105. [ Links ]
4. Mulroy MF. Sistemic toxicity and cardiotoxicity from local anesthetics: incidence and preventive measures. Regional Anesthesia and Pain Medicine, 2002;27(6):556-561 [ Links ]
5. Reynolds F. Maximum Recommended Doses of Local Anesthetics: A Constant Cause of Confusion. To the editor. Regional Anesthesia and Pain Medicine. 2005; 30(3):314-6. [ Links ]
6. Mather LE, Copeland SE, Ladd LA. Acute Toxicity of Local Anesthetics: Underlying Pharmacokinetic and Pharmacodynamic Concepts. Reg Anesth Pain Med 2005;30:553-66. [ Links ]
7. Brown DL, Ransom DM, Hall JA, et al. Regional Anesthesia and Local Anesthetic-Induced Systemic Toxicity: Seizure Frequency and Accompanying Cardiovascular Change. Anesth Analg 1995;81:321-8. [ Links ]
8. Cox B, Duriex ME, Marcus MA. Toxicity of local anaesthetics. Best Pract Res Clin Anaesthesiol. 2003 Mar;17(1):111-36 [ Links ]
9. Faccenda KA, Finucane BT. Complications of regional anaesthesia, incidence and prevention. Drug Saf. 2001;24(6):413-4. [ Links ]
10. Felice KL, Schumann HM. Intravenous Lipid Emulsion for Local Anesthetic Toxicity: A Review of the Literature. J Med Toxicol, 2008;4(3):184-91. [ Links ]
11. Barrington MJ, Watts SA, Gledhill SR, et al. Preliminary Results of the Australasian Regional Anaesthesia Collaboration A Prospective Audit of More Than 7000 Peripheral Nerve and Plexus Blocks for Neurologic and Other Complications. Reg Anesth Pain Med 2009;34:534-41. [ Links ]
12. Kindler CH, Yost CE. Two-pore domain potassium channels: new sites of local anesthetic action and toxicity. Reg Anesth Pain Med 2005;30:260-274. [ Links ]
13. Hollmann MW, Herroeder S, Kurz KS, et al. Time-dependent inhibition of G-protein coupled receptor signaling by local anesthetics. Anesthesiology. 2004; 100:852-860. [ Links ]
14. Rosenberg PH, Veering BT, Urmey WF. Maximum recommended doses of local anesthetics: A multi-factorial concept. Reg Anesth Pain Med 2004;29:564-575. [ Links ]
15. Niesel HC. Local anesthetics maximum recommended doses. Anaesthesiol Reanim. 1997;22(3):60-2. [ Links ]
16. Kucera IJ, Lambert TJ, Klein JA, et al. Liposuction: contemporary issues for the anesthesiologist. Journal of Clinical Anesthesia 2006;18:379-87. [ Links ]
17. Weinberg GL. Lipid Infusion Therapy: Translation to Clinical Practice, Anesth Analg 2008;106:5 1340-42. [ Links ]
18. Mazoit J, Le Guen R, Beloeil H, et al. Binding of Long-lasting Local Anesthetics to Lipid Emulsions, Anesthesiology 2009; 110:380-6. [ Links ]
19. Foxall G, McCahon R, Lamb J, et al. Levobupivacaine-induced seizures and cardiovascular collapse treated with Intralipid. Anaesthesia. 2007;62:516-518. [ Links ]
20. Chazalon P, Tourtier JP, Villevielle T, et al. Ropiva-caine-induced Cardiac Arrest after Peripheral Nerve Block: Successful Resuscitation. Anesthesiology 2003; 99:1449-51. [ Links ]
21. Huet O, Eyrolle LJ, Mazoit JX, et al. Cardiac Arrest after Injection of Ropivacaine for Posterior Lumbar Plexus Blockade Anesthesiology 2003; 99:1451-3. [ Links ]
22. Tasch MD, Butterworth JF. Toxicity of local anesthetics, ASA REFRESHING COURSE, 2006. [ Links ]
23. Zink W, Graf BM. The toxicity of local anesthetics: the place of ropivacaine and levobupivacaine. Current Opinion in Anaesthesiology. 2008;21:645-650. [ Links ]
24. Harmatz A. Local Anesthetics: Uses and Toxicities. Surg Clin N Am 2009;89:587-98. [ Links ]
25. Heavner JE. Cardiac toxicity of local anesthetics in the intact isolated heart model: a review. Reg Anesth Pain Med 2002;27:545-555. [ Links ]
26. Liu P, Feldmahn S, Covino BM, et al. Acute cardiovascular toxicity of intravenous amide local anesthetics in anesthetized ventilated dogs. Anesth Analg 1982;61:317-22. [ Links ]
27. Simon L, Kariya N, Pelle-Lancien E, et al. Bupivacaine-Induced QRS Prolongation is Enhanced by Lidocaine and by Phenytoin in Rabbit Hearts. Anesth Analg 2002;94:203-7. [ Links ]
28. Mets B, Janicki PK, James MF, et al. Lidocaine and Bupivacaine Cardiorespiratory Toxicity Is Additive: A Study in Rats. Anesth Analg 1992;75:611-4. [ Links ]
29. Thomas RD, Behbehani MM, Coyle DE, et al. Cardiovascular Toxicity of Local Anesthetics: An Alternative Hypothesis. Anesth Analg 1986;65:444-50. [ Links ]
30. Weinberg GL. Current Concepts in Resuscitation of Patients With Local Anesthetic Cardiac Toxicity. Reg Anesth Pain Med. 2002; 27(6): 568-75. [ Links ]
31. The Association of Anaesthetists of Great Britain & Ireland 2007. Guidelines for the Management of Severe Local Anaesthetic Toxicity. http://www.aagbi.org/publications/guidelines/docs/latoxicity07.pdf. 2007. [ Links ]
32. Copeland SE, Ladd LA, Gu X, et al. The Effects of General Anesthesia on Whole Body and Regional Pharmacokinetics of Local Anesthetics at Toxic Doses. Anesth Analg 2008;106:1440-9. [ Links ]
33. Copeland SE, Ladd LA, Gu X, et al. The Effects of General Anesthesia on the Central Nervous and Cardiovascular System Toxicity of Local Anesthetics. Anesth Analg 2008;106:1429-39. [ Links ]
34. Corcoran W, Butterworth J, Weller RS, et al. Local Anesthetic-Induced Cardiac Toxicity: A Survey of Contemporary Practice Strategies Among Academic Anesthesiology Departments. Anesth Analg 2006;103:1322-26. [ Links ]
35. Hicks SD, Salcido DD, Logue ES, et al. Lipid emulsion combined with epinephrine and vasopressin does not improve survival in a swine model of bupivacai-neinduced cardiac arrest. Anesthesiology 2009;111:138-46. [ Links ]
36. Hiller DB, Di Gregorio G, Ripper R, et al. Epinephrine Impairs Lipid Resuscitation from Bupivacaine Overdose A Threshold Effect. Anesthesiology 2009;111:498-505. [ Links ]
37. Zausig YA, Zink W, Keil M, et al. Lipid Emulsion Improves Recovery from Bupivacaine-Induced Cardiac Arrest, but Not from Ropivacaine- or Mepivacaine-Induced Cardiac Arrest. Anesth Analg 2009;109:1323-6. [ Links ]
38. Picard J, Ward SC, Zumpe R, et al. Guidelines and the adoption of "lipid rescue" therapy for local anaesthetic toxicity. Anaesthesia 2009; 64:122-125. [ Links ]
39. Picard J, Harrop-Griffiths W. Lipid emulsion to treat drug overdose: past, present and future. Anaesthesia 2009; 64:119-121. [ Links ]
40. Cave G, Harvey MG, Winterbottom T. Evaluation of the Association of Anaesthetists of Great Britain and Ireland lipid infusion protocol in bupivacaine induced cardiac arrest in rabbits. Anesthesia. 2009;64(7):732-7. [ Links ]
41. Leskiw U , Weinberg GL. Lipid resuscitation for local anesthetic toxicity: is it really lifesaving?. Curr Opin Anaesthesio. 2009;22:667-71. [ Links ]
42. Weinberg G. Lipid infusion resuscitation for local anesthetic toxicity: Proof of clinical efficacy. Anesthesiology 2006; 105:7-8. [ Links ]
43. Spence A. Lipid reversal of central nervous system symptoms of bupivacaine toxicity. Anesthesiology 2007; 107:516-517. [ Links ]
44. Shah S, Gopalakrishnan S, Apuya J, et al. Use of Intralipid in an infant with impending cardiovascular collapse due to local anesthetic toxicity Anesth 2009:23:439-41. [ Links ]
45. Rosenblatt MA, Abel M, Fischer GW, et al. Successful Use of a 20% Lipid Emulsion to Resuscitate a Patient after a Presumed Bupivacaine-related Cardiac Arrest. Anesthesiology 2006;105:217-8. [ Links ]
46. Ludot H, Tharin JY, Belouadah M, et al. Successful Resuscitation After Ropivacaine and Lidocaine-Induced Ventricular Arrhythmia Following Posterior Lumbar Plexus Block in a Child. Anesth Analg 2008;106:1572-4. [ Links ]
47. Warren JA, Thoma RB, Georgescu A, et al. Intravenous Lipid Infusion in the Successful Resuscitation of Local Anesthetic-Induced Cardiovascular Collapse After Supraclavicular Brachial Plexus Block. Anesth Analg 2008;106:1578-80. [ Links ]
48. Gregorio GD, Schawartz D, Ripper R, et al. Lipid emulsion is superior to vasopressin in a rodent model of resuscitation from toxin-induced cardiac arrest. Crit Care Med 2009; 37:993-999. [ Links ]
49. Picard J, Ward SC, Zumpe R, et al. Guidelines and the adoption of 'lipid rescue' therapy for local anaesthetic toxicity. Anaesthesia. 2009 Feb;64(2):122-5. [ Links ]
50. Litz RJ, Popp M, Stehr SN, Koch T. Successful resuscitation of a patient with ropivacaine-induced asystole after axillary plexus block using lipid infusion. Anaesthesia 2006;61:800-1. [ Links ]
51. Litz R, Roessel T, Heller AR, et al. Reversal of Central Nervous System and Cardiac Toxicity After Local Anesthetic Intoxication by Lipid Emulsion Injection. Anesth Analg 2008;106:1575-7. [ Links ]
52. Corman SL, Skledar SJ. Use of Lipid Emulsion to Reverse Local Anesthetic-Induced Toxicity Corman and Skledar. Ann Pharmacother 2007;41:1873-7. [ Links ]
53. Weinberg GL. Limits to Lipid in the Literature and Lab: What We Know, What We Don't Know. Anesth Analg 2009;108(4):1062-4. [ Links ]
54. Brull SJ. Lipid Emulsion for the Treatment of Local Anesthetic Toxicity: Patient Safety Implications. Anesth Analg. 2008;106:1337-8. [ Links ]
55. Marwick PC, Levin AI, Coetzee AR. Recurrence of Cardiotoxicity After Lipid Rescue from Bupivacaine-Induced Cardiac Arrest. Anesth Analg 2009;108: 1344-6. [ Links ]
Conflicto de intereses: ninguno declarado











 text in
text in 

