Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.39 no.1 Bogotá Jan./Mar. 2011
https://doi.org/10.5554/rca.v39i1.76
http://dx.doi.org/10.5554/rca.v39i1.76
Artículo de Revisión
Manejo perioperatorio del niño diabético
Ana Sofía Del Castillo*, Troy Holder**, Norma Sardi***
* Médico Anestesiólogo, Hospital Santo Tomás. Funcionario del Hospital del Niño, Ciudad de Panamá, Panamá, anasofia113@gmail.com.
** Médico Anestesiólogo, Hospital Santo Tomás. Funcionario del Hospital del Niño, Ciudad de Panamá, Panamá.
*** Médico. Funcionario en Patología Clínica, Hospital Santo Tomás. Profesor titular de Patología Humana en la Universidad Latina de Panamá, Ciudad de Panamá, Panamá.
Recibido: noviembre 27 de 2009. Enviado para modificaciones: enero 28 de 2010. Aceptado: octubre 13 de 2010.
RESUMEN
Pacientes pediátricos con diabetes mellitus son manejados durante el periodo perioperatorio por anestesiólogos pediátricos, quienes monitorean muy cuidadosamente no solo los niveles de glicemia, sino también el tipo de cirugía a realizarse y la fisiopatología de la enfermedad. Este artículo presenta una guía práctica; un algoritmo para el manejo de pacientes pediátricos con diabetes mellitus sometidos a un acto quirúrgico, ya sea con anestesia general o regional.
Palabras claves: Diabetes Mellitus, Pacientes, Periodo Postoperatorio, Pediatría. (Fuente: DeCS, BIREME).
INTRODUCCIÓN
La diabetes mellitus es una enfermedad meta-bólica conocida hace siglos. Las primeras descripciones de sus características clínicas aparecieron en el año 1550 a.C. Aunque actualmente la mayoría de los pacientes jóvenes con diabetes mellitus tienen vidas alegres y productivas, hace tan solo 80 años los niños y adultos con esta enfermedad poseían una esperanza de vida limitada, ya que solían morir dentro de los dos primeros años luego del diagnóstico (1).
De manera general, se puede definir a la diabetes mellitus como un síndrome clínico que se produce por la utilización inadecuada de la glucosa y una alteración del metabolismo; puede ser secundaria a una alteración en la secreción de insulina o a la reducción de su efectividad biológica (2).
La incidencia de diabetes mellitus en niños, tanto de la tipo 1 como de la tipo 2, ha ido aumentado en los últimos años (3) convirtiéndose en un verdadero reto para el anestesiólogo por la complejidad de su manejo, el cual implica no solo considerar la fisiopatología de la enfermedad, sino también el régimen específico de tratamiento del niño, el control glicémico, el tipo de cirugía, su duración, y las expectativas para el control postoperatorio.
En base a lo antes expuesto, así como a la variedad y complejidad en el tratamiento actual de la diabetes, el plan perioperatorio del niño diabético debe hacerse siempre en consulta con el endocrinólogo pediatra.
La finalidad de este artículo consiste en plasmar, de manera práctica, esquemas para el manejo perioperatorio del niño diabético; un subgrupo de pacientes dentro de la población pediátrica con consideraciones especiales.
La metodología seguida para realizar el siguiente artículo consistió en una revisión sistemática de la literatura disponible sobre el manejo perioperatorio de niño diabético en las siguientes bases de datos: Pubmed, MEDLINE, Ovid, Cochrane. Se encontró el inconveniente de que las mismas no son muy amplias, así como que las pocas revisiones con que se cuenta sobre este tema poseen más de cinco años de antigüedad (4-9).
El advenimiento de nuevos análogos de la insulina, de sistemas de administración de insulina de manera continua, así como el crecimiento en el número de niños con diabetes tipo 2 debido al aumento de la obesidad infantil, son factores que contribuyen a que el manejo perioperatorio del nivel de glicemia sanguínea en el paciente pediátrico sea un reto más exigente para el anestesiólogo.
CLASIFICACIÓN Y ETOLOGÍA DE LA DIABETES MELLITUS
La diabetes mellitus suele dividirse en dos grandes grupos (10-12):
Tipo 1, causada por la destrucción de las células Beta (β) del páncreas, usualmente relacionada con respuesta inmune asociada a antígenos leucocitarios humanos clase 2.
Virus como el Coxsackie B y algunas toxinas han sido sugeridos como potenciales agentes causales en ciertos pacientes. Toda esta fisiopatología trae como resultado una deficiencia absoluta de insulina.
Tipo 2, cuya etiología es una combinación de una resistencia de los tejidos periféricos a la insulina con una deficiencia relativa de la misma. Inicialmente este tipo de diabetes estaba asociado principalmente a adultos, pero, con el aumento de la obesidad infantil, cada vez son más los niños diagnosticados con el mismo.
Se debe recordar que existen otras formas de diabetes más raras, las cuales estan resumidas en la Tabla 1 (8):

La incidencia global de diabetes tipo 1 es altamente variable (13), pero parece ser que tiende a aumentar en todas las poblaciones del mundo (14). El aumento en los casos de obesidad en niños norteamericanos ha contribuido al incremento progresivo de la incidencia y prevalencia de diabetes tipo 2 en este grupo de la población (15).
Tomando en cuenta esta situación, es aceptable extrapolar esta información a la realidad latinoamericana. Según las cifras del "Nacional Health and Nutrition Examination Survey III" (1988-1994), aproximadamente 100 000 adolescentes norteamericanos entre las edades de 12 a 19 años tenían diabetes, y de éstos, un 31 % tenían diabetes tipo 2 (16).
OPCIONES DE MANEJO PARA LA DIABETES MELLITUS EN NIÑOS
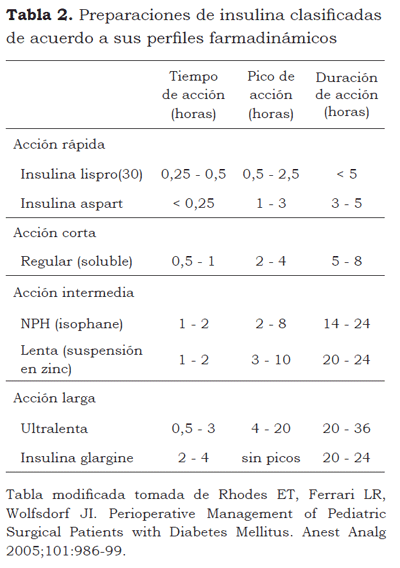
La diabetes tipo 1 siempre requerirá tratamiento con insulina. Existen en el mercado un número cada vez más creciente de preparaciones de insulina (Tabla 2). Una nueva insulina, glargina (insulina glargine; Sanofi-Aventis, Bridgewater, NJ) (17), es una preparación de larga acción que provee un nivel basal relativamente constante de insulina circulante sin un pico pronunciado (18). Otra opción terapéutica es la bomba de insulina, un dispositivo que administra una infusión subcutánea continua de insulina (típicamente una de acción rápida) a una tasa basal constante, y que es suplementada con bolos adicionales de insulina antes de las comidas y meriendas para corregir la hiperglicemia. Esta modalidad, en pacientes cuidadosamente escogidos, ha demostrado ser superior al régimen de administrar inyecciones (19,20).
Por otro lado, en la diabetes tipo 2 la mayoría de los pacientes pediátricos son manejados con insulina y/o metformina (21), siendo esta última la única droga aprobada por la FDA para uso en niños (22). Su mecanismo de acción consiste en disminuir la producción hepática de glucosa y aumentar la sensibilidad de la insulina en los tejidos periféricos (23,24). En adolescentes mayores pueden utilizarse otras drogas como sulfonilureas (25), que promueven la secreción de insulina, y las tiazolidinedionas (26,27), que aumentan la sensibilidad de la insulina en el músculo y el tejido adiposo.
En cuanto al nuevo grupo de drogas para el manejo de la diabetes tipo 2, cuyo mecanismo de acción es inhibir a la dipeptidil peptidasa (DDP-4) y aumentar los niveles de hormonas increti-nas activas (28), y siendo la sitagliptina la molécula con la cual contamos en Latinoamérica, no se recomienda su uso en pacientes menores de 18 años por falta de estudios sobre su seguridad y eficacia en población pediátrica (29).
LA RESPUESTA METABÓLICA A LA CIRUGÍA Y A LA ANESTESIA
La insulina es la principal hormona anabólica y su función consiste en promover la recaptura de glucosa por los tejidos muscular y adiposo, así como suprimir las rutas metabólicas que promueven la producción de glucosa por el hígado (glucogenólisis y glucogénesis). Las hormonas contrarreguladoras tienen el efecto contrario, que incluye el aumento de los niveles de glice-mia sanguínea por estímulo de la glucogenólisis y glucogénesis, aumentando la lipólisis y la cetogénesis. Dentro de este grupo de hormonas se encuentran la epinefrina, el glucagón, el cortisol y la hormona del crecimiento (31).
El trauma y cualquier estímulo quirúrgico desencadenan una respuesta neuroendocrina compleja al estrés, lo cual incluye la supresión de la producción de insulina y el aumento de las hormonas contrarreguladoras, especialmente el cortisol y las catecolaminas (32). El resultado inal es un estado catabólico, con aumento de la producción hepática de glucosa y ruptura de moléculas de proteínas y grasas (33). Todos estos cambios en el paciente diabético traen como consecuencia un estado de marcada hiperglice-mia y una posible cetoacidosis diabética (34).
CONSECUENCIAS ADVERSAS DE LA HIPERGLICEMIA
Aunque los estudios clínicos no han demostrado una relación consistente entre el control glicémi-co perioperatorio y el riesgo a corto plazo de infección y morbilidad (35), muchos de ellos brindan soporte a la recomendación aceptada sobre los niveles de glicemia sanguínea cercanos a lo normal que deben formar parte del cuidado estándar en el manejo del paciente con diabetes (36-38).
La hiperglicemia afecta la cicatrización de heridas al alterar la producción de colágeno, dando como resultado la disminución de la fuerza ten-sil de las heridas quirúrgicas (39). Además, tiene efectos adversos en la función de los neutróilos, disminuyendo la quimiotaxis, la fagocitosis y la capacidad bactericida (40).
No existe evidencia alguna que respalde el uso de un anestésico inhalado en particular, pues todos comprometen la liberación de insulina. La inducción debe realizarse tomando en cuenta el retardo del vaciamiento gástrico y la neuropatía cardíaca autonómica que sufren estos niños, lo cual se puede manifestar por la disminución de la respuesta a la atropina y a la efedrina, y puede generar cuadros de hipotensión exagerada, bradicardia o taquicardia (41).
La anestesia regional, peridural o espinal, disminuye la respuesta hiperglicémica normal, porque el bloqueo simpático afecta la producción de las hormonas contrarreguladoras. No obstante, la administración de grandes dosis de anestésicos locales ha sido asociada a la depresión miocárdica y siempre debe descartarse la neuropatía periférica al momento de escoger la técnica regional (42).
EVALUACIÓN PREOPERATORIA
Es importante recordar que los niños diabéticos raramente tienen las complicaciones vasculares, neurológicas y renales comúnmente asociadas a los adultos diabéticos; por tal razón, es pertinente que el manejo de los niños se enfoque al control de la homeostasis de la glicemia (43).
Dicho manejo puede esquematizarse de la siguiente manera:
1. Identificar enfermedades relacionadas o co-existentes.
2. Corregir cualquier desorden del tipo ácido-base, hidroelectrolítico o volémico antes de la cirugía.
3. Lograr un satisfactorio control de la glice-mia sanguínea.
4. Evitar la hipoglicemia.
5. De ser necesario, proveer insulina para inhibir un estado catabólico (proteólisis, lipó-lisis y cetogénesis) (44).
En caso de cirugía electiva, la misma debe ser pospuesta hasta que un adecuado control me-tabólico sea logrado. De manera práctica, esto significa (8):
No tener cetonuria.
Presentar electrolitos séricos normales.
Mostrar la hemoglobina glicosilada en niveles cercanos al rango ideal:
- Menores de 5 años, del 7 al 9 %
- De 5 a 13 años, del 6 al 8,5 %
- Mayores de 13 años, del 6 al 8 %
Se debe realizar la consulta preoperatoria por lo menos 10 días antes del procedimiento para asegurar un adecuado control metabólico, y debe también existir una relación conjunta entre los servicios de Anestesiología y Endocrinología. Es importante, además, programar a estos pacientes en los primeros turnos del programa quirúrgico para evitar un ayuno prolongado, como también para que los regímenes de tratamiento de la diabetes puedan ser más fácilmente ajustados.
En los casos de cirugías de urgencia (trauma o patología aguda quirúrgica), también debe existir un manejo conjunto entre los servicios de Endocrinología y Anestesiología. Aquí, la cirugía no puede ser omitida aunque el control metabólico sea inadecuado, pero el paciente debe ser estudiado clínica y bioquímicamente, y toda descompensación metabólica debe ser corregida, excepto que la indicación quirúrgica sea inmediata.
Estos pacientes generalmente están deshidratados, por tal razón, el pilar básico de su tratamiento consiste en la rehidratación y la administración de insulina, utilizándose para esta última una infusión continua endovenosa.
MANEJO PREOPERATORIO
El manejo del paciente pediátrico diabético antes, durante y después del procedimiento quirúrgico o diagnóstico, busca mantener normoglicemia; esto significa conservar los niveles plasmáticos de glucosa entre 100 y 200 mg/dL. La meta es permanecer entre estos niveles de glicemia, ya que en este rango se reduce el riesgo de diuresis osmótica, deshidratación, desequilibrio hi-droelectrolítico, acidosis metabólica, infección e hipoglicemia.
El niño diabético programado para cirugías menores puede admitirse el mismo día de la cirugía, mientras que el programado para cirugías mayores debe admitirse el día antes de la misma.
En la mañana de la cirugía, ninguna insulina de acción corta o rápida debe ser administrada, a menos de que los niveles de glicemia sean superiores a 250 mg/dL. Dado el caso de que sean superiores a esta cifra, una dosis de insulina rápida o corta debe ser administrada utilizando un "factor de corrección". Dicho factor de corrección de insulina corresponde a la disminución esperada de la concentración de glucosa sanguínea luego de administrar 1 U de insulina. Este se calcula utilizando la "regla del 1.500", que consiste dividir 1.500 entre la dosis total usual de insulina que utiliza el niño. Por ejemplo, si el niño típicamente utiliza 50 U de insulina, el factor de corrección será 1.500 ÷ 50 = 30, lo que significa que, en este paciente, 1U de insulina deberá disminuir la concentración plasmática de glucosa en 30 mg/dL. Es necesario aclarar que, si bien existen otros factores de corrección para la insulina regular y la insulina lispro (45), la regla de corrección de los "1.500" ofrece una forma segura y práctica de corregir la hiperglicemia durante el preoperatorio en pacientes que se encuentren recibiendo insulina rápida o regular de manera subcutánea, o en aquellos que serán manejados durante el procedimiento quirúrgico con una infusión de insulina.
Para aquellos pacientes con diabetes tipo 2 que no fueran tratados previamente con insulina, se utiliza una dosis subcutánea rápida de 0,1 U/kg para niveles de glicemia superiores a 250 mg/dL; pero se debe recordar siempre que es necesario individualizar a cada niño de acuerdo con su tratamiento de base.
Para esquematizar el manejo transoperatorio es conveniente dividirlo en cuatro grandes grupos:
Niños en tratamiento con hipoglicemiantes orales.
Procedimientos menores ambulatorios.
Procedimientos menores e intermedios hospitalizados.
Procedimientos mayores.
Niños en tratamiento con hipoglicemiantes orales
Si el niño utiliza metformina, esta debe descontinuarse 24 horas antes del procedimiento para evitar el riesgo de acidosis láctica, deshidratación, hipoxemia y pobre perfusión tisular (46,47).
Si el niño utiliza otras drogas como sulfonilureas y tiazolidinedionas, estas deben descontinuarse la mañana de la cirugía.
PROCEDIMIENTOS MENORES AMBULATORIOS
Para estos casos, la insulina puede seguir siendo administrada con inyecciones subcutáneas o con bolos de insulina endovenosa. Aunque existen estudios que recomiendan infusiones de insulina incluso en procedimientos menores ambulatorios en niños (4), se debe recordar que los mismos fueron realizados antes de contar con la disponibilidad de insulinas de acción rápida con efectos reproducibles a la colocación endovenosa, luego de la administración subcutánea.
A pesar de que aún no hay estudios sobre el uso de las insulinas de acción rápida en niños, si existe evidencia probada en adultos con diabetes tipo 2, la cual muestra que con estas se presenta una efectividad comparable a la del uso de una infusión continua (48).
PROCEDIMIENTOS MENORES E INTERMEDIOS HOSPITALIZADOS
Dentro de este grupo, el manejo dependerá del régimen de base del niño:
Combinación de insulina rápida y lenta:
- En estos pacientes, se debe aplicar el día de la cirugía el 50 % de la dosis usual de insulina intermedia o lenta de la mañana.
Uso de insulina glargina
- Si el niño utiliza la insulina glargina en la tarde, no se debe administar esta insulina en la mañana de la cirugía.
- Si el niño utiliza la insulina glargina en la mañana, toda la dosis debe administrarse en la mañana de la cirugía para prevenir cetosis.
Uso de bombas de insulina subcutánea
- En procedimientos menores de 2 horas se puede utilizar la bomba a su tasa basal en ese momento del día.
- En procedimientos mayores de 2 horas, o en servicios de anestesiología no familiarizados con estos sistemas, se recomienda la transición a una infusión endovenosa de insulina.
PROCEDIMIENTOS MAYORES
Recordemos que la estimulación del sistema nervioso simpático puede tener efecto directo sobre la homeostasis de la glucosa. La epinefrina circulante estimula los receptores Alfa (α) 2, con disminución de la liberación de insulina por el páncreas y aumento de la gluconeogénesis. Por tal razón, especialmente en este grupo, debe existir una adecuada analgesia durante la cirugía para minimizar la estimulación simpática (49).
Definimos procedimientos mayores como aquellos para los cuales se anticipa una duración mayor de 2 horas o que conllevan riesgo potencial de sangrado. Bajo estas circunstancias, existen estudios tanto en niños (7) como en adultos (49) que demuestran la superioridad de las infusiones de insulina sobre las inyecciones subcutáneas para el óptimo control glicémico.
El manejo sugerido es el siguiente:
Los pacientes deben recibir su dosis usual de insulina el día anterior al procedimiento.
En la mañana de la cirugía, es iniciada una infusión endovenosa de dextrosa al 10 % en solución salina media normal, como dosis de mantenimiento, junto con una infusión endovenosa de insulina que se administra simultáneamente para mantener los niveles de glucosa sanguínea entre 100-200 mg/dL.
- El mantenimiento de fluidos endovenosos depende del tamaño del niño y puede calcularse utilizando el peso corporal (4 mL/Kg los primeros 10 kg, 2 mL/kg de los 11-20 kg, y 1 mL/kg por cada kilogramo superior a los 20 kg) como también la superficie corporal (1,5 L/m2/d).
Debido a que los niños antes de la pubertad son más sensibles a la insulina (50), la dosis a administrar de esta depende de su edad:
- Para niños prepuberales (menores de 12 años), los requerimientos de insulina son típicamente del 0,6 a 0,8 U/kg/día.
- Los adolescentes requerirán dosis de 1,0 a 1,5 U/kg/día.
- Los pacientes con diabetes tipo 2, debido a su resistencia a la insulina, tendrán requerimientos mayores. En niños menores de 12 años se utiliza 1U de insulina por 5 g de dextrosa; en mayores de 12 años se utiliza 1 U de insulina por 3 g de dextrosa.
MANEJO POSTOPERATORIO
Debe existir una monitorización estricta de la glicemia, la presencia de cetonas en sangre y orina, la función renal y los niveles de electrolitos, recordando que el trauma quirúrgico, la inactividad, el dolor, las náuseas, los vómitos y la pobre ingesta oral, pueden alterar significativemente la homeostasis de la glucosa.
Una vez que el paciente pueda reasumir la ingesta oral, el régimen usual de tratamiento del paciente debe reiniciarse, incluyendo tanto la insulina como los hipoglicemiantes orales. La infusión de líquidos debe interrumpirse.
En aquellos pacientes a quienes no se les ha podido reiniciar la vía oral, se deben continuar aplicando las soluciones de dextrosa y electrolitos, y manteniendo los niveles de glicemia entre 100-200 mg/dL, ya sea con bolos endovenosos o subcutáneos de insulina.
CONCLUSIONES
El paciente pediátrico diabético debe ser manejado de manera integral entre los servicios de Anestesiología y Endocrinología, tomando en cuenta no solo su régimen de tratamiento de base, sino también su edad, peso, presencia de la pubertad y procedimiento quirúrgico. En base a estos factores, el anestesiólogo deberá establecer un plan de trabajo para el manejo perioperatorio de estos pacientes, en función de la complejidad propia de una enfermedad como la diabetes.
REFERENCES
1. Kelnar CJH. The historic background. En: Kelnar CJH, editor.Childhood and Adolescent Diabetes. London: Chapman and Hall; 1995:123. [ Links ]
2. Jaramillo J, Reyes G, Gómez J. Consideraciones generales y anestésicas de algunas enfermedades endocrinas en niños. En: Anestesiología Pediátrica. Publicación oficial de la SCARE; 2003:684-99. [ Links ]
3. Onkamo P, Vaananem S, Karvonen M, Tuomilehto J. Worldwide increase in incidence of type I diabetes. The analysis of the data on published incidence trends. Diabetología 1999;42:1395-403. [ Links ]
4. McAunulty GR, Robertshaw HJ, May GM. Anaesthetic manegement of patients with diabetes mellitus. Br J Anaesth 2000;85:80. [ Links ]
5. Chadwick V, Wilkinson KA. Diabetes mellitus and the pediactic anesthetist. Pediatr Anaesth 2004;14: 716-23. [ Links ]
6. Kirschner RM. Diabetes in pediatric ambulatory surgical patients. J Post Anesth Nurs 1993; 8:322-6. [ Links ]
7. Holvey SM. Surgery in the child with diabetes. Pediatr Clin North Am 1969;16:671-9. [ Links ]
8. Kaufman FR, Devgan S, Roe TF, Costil G. Perioper-atve manegement with prolonged intravenous insulin infusion versus subcutaneous insulin in children with type I diabetes mellitus. J Diabetes complications 1996;10:6-11. [ Links ]
9. Rhodes ET, Ferrari LR, Wolfsdorf JI. Perioperative Management of Pediatric Surgical Patients with Diabetes Mellitus. Anest Analg 2005;101:986-99. [ Links ]
10. American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care 2004;27:Supl1;5-10. [ Links ]
11. Stoelting, MD, Dierdorf, ST. Handbook for Anesthesia an Co-Exisiting Disease. En: Endocrine Diseases. Estados Unidos: Churchill Livingstone; 2002:301-32. [ Links ]
12. Nicolino M, Chatelain P. Diabetes mellitus infantil: clasificación, diagnóstico, epidemiología y etiología. En: Pombo M. Tratado de Endocrinología Pediátrica. 2002;64:1122-31. [ Links ]
13. Karvonen M, Viik-Kajander M, Moltchanova E, Libman I, LaPorte R, Tuomilehto J. Incidence of childhood type 1 diabetes worldwide: Diabetes Mondiale (DiaMond) Project Group. Diabetes Care 2000;23:1516-26. [ Links ]
14. Fagot-Campagna A, Pettitt DJ, Englelgau MM, Burrows NR, Geiss LS, Valdez R, et al. Type 2 diabetes among North American children and adolescents: an epidemiologic review and a public health perspective. J Pediatr 2000;136:664-72. [ Links ]
15. Fagot-Campagna A, Saaddine JB, Flegal KM, Beckles GL. Diabetes, impared fasting glucose, and elevated HbA1c in U.S. adolescents: the Third National Health and Nutrition Examination Survey. Diabetes Care 2001;24:834-7. [ Links ]
16. Tomado de la ficha técnica del medicamento. Disponible en la página web de Sanafi-Aventis: URL: http://www.facmed.unam.mx/bmnd/plm_2k8/src/prods/35539.htm. [ Links ]
17. Murphy NP, Keane SM, Ong KK, Ford M, Edge JA, Acerini CL, et al. Randomized cross-over trial of insulin glargine plus lispro or NPH insulin plus regular human insulin in adolescents with type 1 diabetes on intensive insuline regimens. Diabetes Care 2003;26:799-804. [ Links ]
18. Weintrob N, Benzaquen H, Galatzer A, Shalitin S, Lazar L, Fayman G, et al. Comparison of continuos subcutaneous insulin infusión and multiple daily injection regimens in children with type 1 diabetes: a randomized open crossover trial. Pediactrics 2003;112:559-64. [ Links ]
19. Willi SM, Planton J, Egede L, Schwarz S. Benefits of continuous subcutaneous insulin infusion in children with type 1 diabetes. J Pediatr 2003;143:796-801. [ Links ]
20. Codner E, Meriq V, Román R, Hrlic I, Martínez A, Unanue N, et al. Nuevos esquemas de tratamiento con insulina en niños y adolescentes con diabetes mellitus tipo 1 en un hospital público. Rev chil pediatr 2004;75(6):520-529 [ Links ]
21. Gahagan S, Silverstein J. Prevention and treatment of type 2 diabetes mellitus in children, with special emphasis on American Indian and Alaska native children: American Academy of Pediatrics Committee on Native American Child Health. Pediatrics 2003;112:e328. [ Links ]
22. Rapaprt R, Silverstein JH, Garzarella L, Rosenbloom AL. Type 1 and type 2 diabetes mellitus in childhood in the United States: practice patterns by pediatric en-docrinologists. J Pediatr Endocrinol Metab 2004;17:871-7. [ Links ]
23. Velazquez O, Lara A, Tapia R. Metformina y síndrome metabólico. Manual de uso. Secretaría de Salud. México, (DF). 2001. [ Links ]
24. Contreras F, Romero B, Suárez N, González M, Fouillioux C, Guevara E, Betancourt MC, Torres D, and Velasco M. Receptores Sur y Sulfonilureas en el tratamiento de la Diabetes Mellitus Tipo 2. AVFT. 2002 Jul; 21(2):148-5. [ Links ]
25. Hernández-Jiménez S, Aguilar-Salinas C, Gómez-Pérez F. Tiazolidinedionas. Beneficios y riesgos reales. Rev Edocrinol Nutr. 2002 Apr-Jun;10(2):69-76. [ Links ]
26. Yki-Jarvinen H. Thiazolidinediones. N Engl J Med. 2004 Sep 9;351(11):1106-18. [ Links ]
27. Brubaker P. Incretin-based therapies: mimetics versus protease inhibitors. Trends in Endocrinology and Metabolism. 2007;18(6):240-5. [ Links ]
28. Tomada de la ficha técnica del medicamento. Disponible en la página web de la Agencia Europea del Medicamento (EMEA): URL: http://www.emea.europa.eu/. [ Links ]
29. Holleman F, Hoekstra JBL: Insulin Lispro. N Engl J Med 1997;183:176-183. [ Links ]
30. Allison SP, Tomlin PJ, Chamberlain MJ. Some effects of anesthesia and surgery carbohydrate and fat metabolism. Br J Anesth 1969;41:588-93. [ Links ]
31. Halter JB, Plug AF. Relationship of impares insulin secretion during surgical stress to anesthesia and catecholamine release. J Clin Endocrinol Metaol 1980;51:1093-8. [ Links ]
32. Hirsh BR, Shamoon H: Defective epinephrine and growth hormone responses in type I diabetes ara stimulus specifica. Diabetes 1987;36:20-26. [ Links ]
33. Hirsch IB, MacGill JB. Role of insulin in the manege-ment of surgical patients with diabetes mellitus. Diabetes Care 1990;13:980-91. [ Links ]
34. MacKenzie CR, Charlson ME. Assesment of perioperative risk in the patient with diabetes mellitus. Surg Gynecol Obstet 1988;167:293-9. [ Links ]
35. Glister BC, Vigersky RA. Perioperative management of type 1 diabetes mellitus. Endocrinol Metab Clin North Am 2003;32:411-36. [ Links ]
36. Van den Berghe G, Wouters P, Weekers F, Verwaest C, Bruyninckx F, Schetz M, et al. Intensive insulin theraphy in the critically ill patients. N Engl J Med 2001;345:1359-67. [ Links ]
37. Krinsley JS. Effect of an intensive glucose management protocol on the mortality of critically ill adult patient. Mayo Clin Proc 2004;79:992-1000. [ Links ]
38. Rosenberg CS. Wound healing in the patient with diabetes mellitus. Nurs Clin North Am 1990;25: 247-61. [ Links ]
39. Marhoeffer W, Stein M, Maeser E, Federlin K. Impairment of polymorphonuclear leukolyte function and metabolic control of diabetes. Diabetes care 1992;15:256-60. [ Links ]
40. Bissonnette B, Dalens BJ. Pediatric Anesthesia; principles and practice. Toronto: Mc Graw-Hill; 2001:138-160. [ Links ]
41. Northmpthom Hospital General. Federación Madill de Sociedades de Anestesiología (UK). Dirección clínica de Diabetes Mellitus durante la Anestesia y Cirugía; Disponibles en: URL: www.northamptongeneral.nhs.uk y URL: www.diabetes.org.uk [ Links ]
42. Peters A, Kerner W. Perioperative management of the diabetic patient. Exp Clin Endocrinol Diabetes 1995;103;213. [ Links ]
43. Martin MM, Martin ALA. Continuous low-dose infusion of insulin in the treatment of diabetic ketoacidosis in children. J Pediatr 1976; 89:560-564. [ Links ] [ Links ]
45. Mercker SK, Maier C, Neumann G, Wulf H. Lactic acidosis as a serious perioperative complication of antidiabetic biguanide medication with metformin. Anesthesiology 1997;87:1003. [ Links ]
46. Solano M, González C, Alvarez M, Llorente B, Echeg-aray M. Acidosis láctica en paciente diabético tratado con metformina. An Med Interna. 2004;21(6):288-90. [ Links ]
47. Hemmerling TM, Schmid MC, Schmit J, Kern S, Ja-cobi KE. Comparison of a continucos glucose-insulin-potassium infusion versus intermitent bolus application of insulin on perioperative glucose control and hormone status in insulin-treated type 2 diabetics. J Clin Anesth 2001;13:293-300. [ Links ]
48. Raucoules-Aime M, Labib Y, Levraut J, Gastaud P, Dolisi C, Grimaud D. v Use of i. insulin in well-controlled non-insulin-dependent diabetic undergoing major surgery. Br J Anaesth. 1996;76:198-202. [ Links ]
49. Gonzalez-Michaca L, Ahumada M, Ponce-de-Leon S. Insulin subcutaneous applications vs continuos infusion for postoperative blood glucose control in patients with non-insulin-dependent diabetes mellitus. Arch Med Res 2002;33:48-52. [ Links ]
50. Roemmich JN, Clark PA, Lusk M, Friel A, Weltman A, Epstein LH et al. Pubertal alterations in growth and body composition. Pubertal insulin resistance: relation to adiposity, body fat distribution and hormone release. Int J Obes Relat Metab Disord 2002;26:701-9. [ Links ]
Conflicto de intereses: ninguno declarado











 text in
text in 

