Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Colombian Journal of Anestesiology
versión impresa ISSN 0120-3347
Rev. colomb. anestesiol. v.39 n.4 Bogotá oct./dic. 2011
https://doi.org/10.5554/rca.v39i4.70
http://dx.doi.org/10.5554/rca.v39i4.70
Artículo de Revisión
Uso de dexmedetomidina en anestesia total intravenosa (TIVA)
Andrés García Botero*, Leonardo Rodríguez**, Félix Arturo Salazar Pérez***, Alberto Venegas Saavedra****
* Médico residente III de Anestesiología y Reanimación, Universidad Nacional de Colombia, Bogotá, Colombia. Correspondencia: Calle 47B sur No. 23B-70, int 22 apto 344 Bogota - Colombia. Correo electrónico: andresgarciabotero@yahoo.com
** Médico residente III de Anestesiología y Reanimación, Universidad Sur Colombiana, Huila, Colombia. Correo electrónico: leoroci@yahoo.com
*** Médico residente II de Anestesiología y Reanimación, Universidad Colegio Mayor Nuestra Señora del Rosario, Bogotá, Colombia. Correo electrónico: fe_ar@yahoo.com.ar
**** Coordinador nacional del Comité de Anestesia Intravenosa (Scare), Anestesiólogo Clínica el Country. Docente en: Universidad Nacional de Colombia, Universidad Mayor Nuestra Señora del Rosario, Universidad Javeriana, Fundación Universitaria de Ciencias de la Salud. Instructor Universidad el Bosque. Bogotá, Colombia. Correo electrónico: avanegass@hotmail.com
Recibido: abril 29 de 2011. Enviado para modificaciones: septiembre 28 de 2011. Aceptado: mayo 18 de 2011.
RESUMEN
La dexmedetomidina se usó para sedación inicialmente en unidades de cuidados intensivos. Sin embargo, sus efectos sedantes, analgésicos y ansiolíticos sin alteración de la función ventilatoria, permiten ampliar su uso en cirugía como anestésico intravenoso. La literatura reporta su utilidad en poblaciones quirúrgicas definidas, pero aún faltan estudios que respalden su utilización en todos los escenarios de la anestesia total intravenosa (TIVA). El propósito de la actual revisión es describir el papel de la dexmedetomidina en la misma.
Materiales y métodos. Se realizó la búsqueda de literatura en las bases de datos referenciales de PubMed, Medline, EMBASE, Cochrane y LILACS. Fue ampliada según la bibliografía encontrada en los artículos inicialmente revisados y analizados por los autores; la búsqueda fue hecha bajo los términos MeSH incluidos en las palabras claves.
Palabras clave: Dexmedetomidina, anestesia intravenosa, receptores adrenérgicos alfa 2, agonistas adrenérgicos. (Fuente: DeCS, BIREME).
INITRODUCCÍON
La dexmedetomidina es un agonista de los receptores adrenérgicos alfa 2 (RAA2) utilizado para sedación, analgesia y como coadyuvante de la anestesia, el cual disminuye los requerimientos de medicamentos anestésicos en los procedimientos que requieren anestesia total intravenosa (TIVA) (1,2,3). También proporciona protección neurovegetativa, ansiolisis, y posee efectos cardiovasculares y respiratorios predecibles en dosis dependiente. Así mismo, permite disminuir el uso de analgésicos en dolor quirúrgico posoperatorio, provee sedación con preservación de la memoria (4), supresión del temblor y mejoría de la recuperación posoperatoria (1).
En la presente revisión se explora el uso que ha tenido la dexmedetomidina en TIVA, perfilándose como una opción para considerar en poblaciones especiales de pacientes (5).
MATERIALES Y METODOLOGIA
Definición del problema: Uso de dexmedetomidina en la técnica anestésica TIVA.
Enunciación de los tesauros y realización de búsqueda en términos MeSH bajo las palabras ‘dexmedetomidina’ y ‘anestesia total intravenosa’, en bases de datos referenciales (PubMed, Medline, EMBASE, Cochrane y LILACS), los cuales se adicionaron en búsqueda unificada PubMed en “Search Box with AND” sin limitaciones, obteniendo 72 textos. La búsqueda fue ampliada a otros libros y textos; se realizó una revisión exhaustiva de la literatura, así como la selección y la exclusión de estudios por no tener relevancia o por no proporcionar acceso al resumen (abstract) y/o a su contenido.
Se desarrolló el documento bajo la metodología de revisión de toda la literatura.
ANTECEDENTES
El uso de dexmedetomidina se remonta al uso de la medetomidina en veterinaria. Es un fármaco imidazolínico compuesto por levomedetomidina (farmacológicamente inactivo) y dexmedetomidina (farmacológicamente activo). Comparte afinidad por los receptores adrenérgicos alfa 2 (RAA2) (5,6,7). Fue aprobada por la Food & Drug Administration como sedante-analgésico en unidades de cuidados intensivos (1,2,8); su uso se ha extendido a otras áreas (5) y su utilización se deriva de la observación del efecto ejercido por la clonidina en pacientes bajo anestesia (9,10). No ha sido aprobada en pediatría ni en obstetricia (11).
CARACTERISTICAS DE LOS RECEPTORES ALFA 2 ADRENERGICOS
Son receptores principalmente postsinápticos distribuidos en múltiples zonas, especialmente en el Locus Caeruleus (12,13) y en el núcleo solitario. Los efectos simpaticolíticos, sedantes y analgésicos, son dados por la acción de sustancias agonistas sobre los RAA2 centrales.
Estos receptores metabotrópicos asociados a la proteína G inhibitoria (Gi/o) disminuyen el adenosin monofosfato cíclico (AMP) a través de la inhibición de la adenilatociclasa e inducen el aumento de potasio (14) por aumento en la permeabilidad de canales de salida y entrada, hiperpolarizando la neurona postsináptica. Además, disminuyen los niveles citosólicos de calcio al reducir la permeabilidad de sus canales iónicos, disminuyendo la liberación de neurotransmisores presinápticos (6). Existen diversos tipos de Adrenoreceptores:
- Alfa 2A: se encuentran en vasos sanguíneos periféricos y producen vasoconstricción
- Alfa 2B y 2C: se encuentran en la medula espinal y en el cerebro en neuronas noradrenérgicas del sistema nervioso central (principalmente locus coeruleus y complejo motor medular dorsal). Inhiben la liberación de noradrenalina mediando hipertensión y bradicardia. También se hallan en las astas dorsales medulares, núcleos medulares ventrolaterales y en el sistema reticular activador ascendente. Así mismo, se ha reportado su presencia en el hígado, el páncreas, las plaquetas, los riñones, el tejido adiposo y los ojos (2).
- T T ipo C: median el control del tono vascular, proporcionan analgesia de origen espinal, disminuyendo la actividad de neuronas transmisoras del dolor.
- T T ipo D: son similares a los del tipo A (con menor afinidad a ligandos).
CARACTERÍSTICAS FARMACOLÓGICAS DE LA DEXMEDETOMIDINA
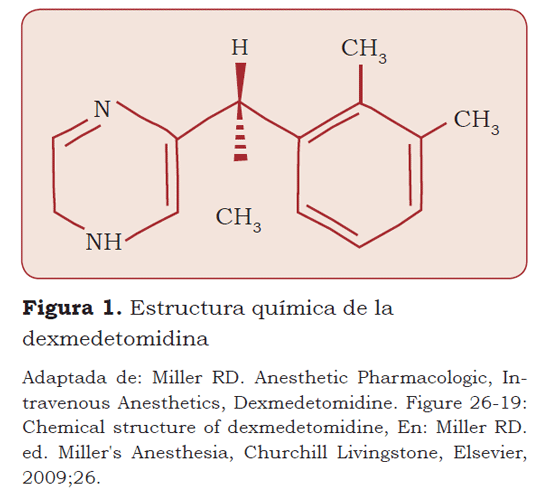
Estructura química: Es el dextro-enantiomero de la medetomidina, posee una estructura básica imidazolica con afinidad alfa 2:alfa 1 de 1600:1 (comparado, por ejemplo, con la clonidina que posee 200:1) (5,7,15,16) por lo cual se le denomina alfa agonista 2 adrenérgico puro. Posee gran solubilidad en agua (2).
Farmacodinamia: su acción adrenérgica alfa 2 agonista (A2A) bloquea la actividad aferente de fibras A y C, asociadas con reflejos somato-simpáticos y flujo somático espontáneo, brindando protección contra el estrés. Además, disminuyen el tono simpático colinérgico preganglionar y median la disminución en la liberación y la producción de otros neurotransmisores excitatorios.
A nivel periférico, se asocia con hipertensión inicial ante la administración de la dosis de carga. Disminuye la secreción de noradrenalina y el consumo metabólico de oxigeno cerebral, e inhibe la liberación de histamina (2,13). Posee acción analgésica aditiva y sinérgica con respecto a la depresión respiratoria. Puede presentar tolerancia cruzada con agonistas opioides causando depresión ventilatoria e hipoxica mínima (1). La hipnosis inducida es similar al sueño lento (4); se asocia con capacidad para la conservación de la función inmunológica y cognitiva (2).
Infusiones hasta de 40 horas no han reportado supresión adrenal debido a la estructura imidazolínica (6). Su efecto alfa2 central es se presenta con dosis dependiente, suministrando dosis bajas, medias o infusión sin carga, predomina el efecto alfa2 y con dosis altas, de carga o infusiones rápidas, el efecto alfa1 (11).
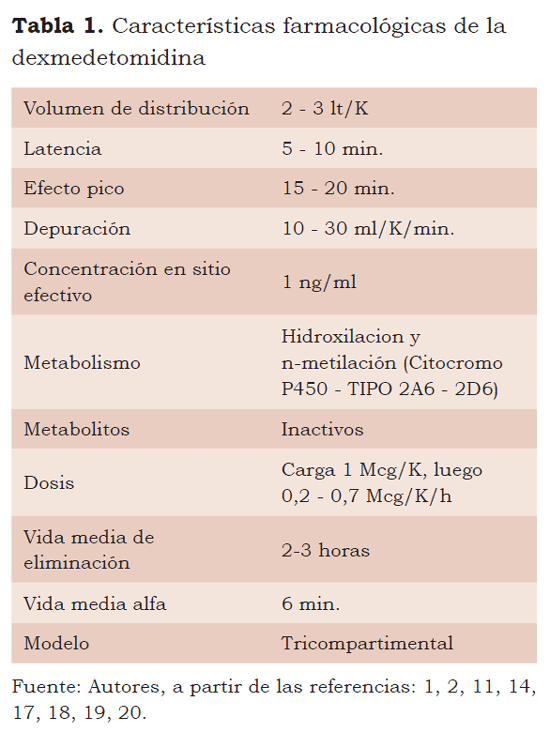
EFECTOS FARMACOLOGICOS DE LA DEXMEDETOMIDINA
Efectos neurológicos: su efecto neuroprotector no es bien conocido (21); la sedación ha sido descrita como “cooperativa” y “despertable”. Con dosis altas, pueden presentarse alteraciones en la memoria (11).
Efectos respiratorios: no presenta depresión respiratoria (22,23) (efecto con dosis dependiente). Las infusiones a concentraciones de 15ng/ml (sistema TCI) en sitio efectivo en voluntarios sanos no mostró cambios en el pH ni en la PaCo2, e incrementó la frecuencia respiratoria de 10 a 25 respiraciones por minuto (4). La respuesta ventilatoria a la hipercapnia no fue afectada cuando se comparó remifentanil con dexmedetomidina a dosis que producían respuesta negativa ante una vigorosa estimulación (2).
En el caso de dosis de 2 mcg/kg en bolo, puede ocurrir apnea transitoria (11).
Efectos cardiovasculares: El A2A media efectos como antiarrítmico, disminuye la presión arterial sistémica, reduce la frecuencia cardiaca y produce vasoconstricción (24,25,26). Se debe administrar con precaución en pacientes hipovolémicos con aumento de la resistencia vascular periférica del 22 % y disminución de la frecuencia cardiaca en un 27 %, las cuales regresan a la línea de base quince minutos después. Posteriormente, hay disminución de la tensión arterial de un 15 % (27). Puede presentarse disminución de la contractilidad miocárdica y gasto cardiaco.
Su uso ha demostrado reducción de complicaciones cardiovasculares como isquemia miocárdica en el perioperatorio (28), y también se asocia con aumento de requerimientos de medicamentos para el mantenimiento de la presión arterial (2,29).
USO DE DEXMEDETOMIDINA EN TIVA
El uso de dexmedetomidina en anestesia total intravenosa ha demostrado potenciación de analgesia y sedación quirúrgica (en el caso de dosis de 0.5 a 1 mcg/kg/hora), administrada en el lapso de 10 a 15 minutos como ayudante de otros anestésicos intravenosos antes del procedimiento. Se puede suministrar a igual rata de infusión entre 15 y 20 minutos antes de finalizar; lo cual favorece la ansiolisis durante la extubación, disminuye la presentación de temblor postoperatorio y reduce la utilización de analgésicos (1).
Puede ser utilizado como anestésico único suministrando dosis de 1 a 5 mcg/kg/hora iniciales durante lapsos de 10 a 15 minutos, continuando con dosis de 0,25 a 1 mcg/kg/hora (1,2,3).
Al disminuir la respuesta autónoma a la laringoscopia (30,31), se reduce el riesgo de aumento de la presión intraocular (31,32) y se inhibe la secreción salival por lo que se ha indicado en intubación orotraqueal (IOT) en paciente despierto. La dexmedetomidina se asocia con mejor respuesta hemodinámica a la IOT, comparada con el fentanil a 2 mcg/kg (30,31) y provee ansiolisis igual que el midazolam aplicado 90 minutos antes del procedimiento (2). También minimiza los efectos cardiovasculares y disminuye los requerimientos de thiopental y opioides en un 30 % (33,34).
Se debe tener precaución en pacientes con predominio del tono vagal y con bloqueos auriculoventriculares por su asociación con bradicardia y paro (1,11).
Se trata de un analgésico débil en especial ante estímulos dolorosos producidos por calor o eléctricos (2).
Las dosis de premedicación deben estar entre 0,33 y 0,67 mcg/kg y aplicarse 15 minutos antes de la cirugía. Resulta útil en neurocirugía de zonas elocuentes en paciente despierto por permitir una valoración clínica neurológica intraoperatoria. Es un medicamento con perspectivas favorables de uso en sedo-analgesia fuera del quirófano tanto en adultos como en niños (35,36).
La dexmedetomidina también ha mostrado utilidad en anestesia cardiovascular (37,38); infusiones hasta de 0,4 mcg/kg/hora han mostrado efectividad y estabilidad hemodinámica. Un metaanálisis del 2003 con 23 ensayos clínicos que comprenden a 3395 pacientes, concluye que el uso de agonistas adrenérgicos alfa 2 reduce la mortalidad y el infarto del miocardio durante y después de la cirugía cardiovascular; además, se observó una disminución en la isquemia que puede disminuir la mortalidad (39). Por otra parte, puede aumentar la predisposición a hipotensión (40).
Es posible que sea usada para manejar pacientes con hipertensión pulmonar durante una cirugía de reemplazo de la válvula mitral; en estos casos, la dexmedetomidina disminuyó los requerimientos de fentanilo y atenuó el aumento en el índice de resistencia vascular sistémico y pulmonar postesternotomia. Así mismo, disminuyó la presión arterial media, la presión arterial pulmonar media y la presión en cuña en comparación con el grupo placebo (41). En pacientes coronarios, un meta-análisis encontró que para demostrar una reducción de eventos cardiovasculares del 25 %, con adecuada significancia estadística, se requiere una muestra de más de 4000 pacientes, lo que aún no se ha logrado realizar (42).
Neuroanestesia: Algunos procedimientos neuroquirúrgicos requieren participación del paciente, como son la valoración de respuestas después de una estimulación profunda en el tratamiento del Párkinson, la implantación de electrodos, la electrocorticografía en cirugía de epilepsia y los procedimientos cerca del área de Broca y Wernicke (43). La dexmedetomidina es útil en estas situaciones, pues provee sedación durante la participación del paciente despierto en craneotomías (44).
En casos de laminectomias la TIVA con dexmedetomidina 0,2 mcg/kg/hora como coadyuvante muestra adecuada estabilidad cardiovascular, así como tiempos de extubación similares con respecto a otras técnicas anestésicas (propofol-remifentanil o propofol-fentanil). Se ha reportado menor consumo de morfina al mantener la infusión de dexmedetomidina (45).
La falla ventilatoria puede incrementarse durante el postoperatorio ante el uso concomitante de opioides y la existencia de condiciones tales como la obesidad, el síndrome de apnea hipopnea del sueño, o en los casos de procedimientos en vía aérea.
La dexmedetomidina disminuye el consumo de opioides, de otros analgésicos y de propofol, así como el riesgo de depresión respiratoria. Al tiempo asegura corto tiempo, de extubación y recuperación rápida. Las dosis utilizadas son de 0,8 mcg/kg en bolo seguidas de mantenimiento de 0,4 mcg/kg/hora (46).
TIVA con dexmedetomidina como único agente: Ramsay (3), en el 2004, reporta una serie de 3 casos con dexmedetomidina suministrada por hasta 10 mcg/kg/hora, obteniendo analgesia e hipnosis satisfactorias, así como estabilidad ventilatoria y hemodinámica en casos de ablación láser traqueal, resección de tumores faciales y en cambio de prótesis traqueal.
En cuatro pacientes pediátricos se usaron bolos de 2 - 5 mcg/kg para laringoscopia y broncoscopia con estabilidad cardiovascular y ventilatoria durante y después del procedimiento quirúrgico (47).
En un estudio con propofol y dexmedetomidina en TIVA realizado con el objetivo de reemplazar el remifentanil por esta última en pacientes para video laparoscopia ginecológica, no se encontraron diferencias significativas en cuanto a la presentación de efectos adversos, la existencia de recuerdos intraoperatorios, los niveles de cortisol, la glucosa sérica, la presión arterial y la frecuencia cardiaca, lo que permitió concluir que, a pesar de no haber una indicación para sustituir el opioide, hay algunas diferencias en los tiempos de extubación, aunque el tiempo total en recuperación fue similar en ambos grupos.
TIVA en pediatría: en el 2010 (49) se hizo una revisión sobre el estado de la TIVA en pediatría. Se documentó el uso de la dexmedetomidina para procedimientos en radiología intervencionista, endoscopia, cirugía de columna e instrumentaciones de vía aérea. Las concentraciones plasmáticas de propofol requeridas para anestesia cuando se reemplaza el remifentanil por dexmedetomidina en procedimientos endoscópicos en pediatría, no se afecta (en concentraciones efectivas: 50 de 3,7mcg/ml). Se pudo concluir que la efectividad analgésica de la dexmedetomidina en estos procedimientos es limitada (41). También se ha reportado el uso en pacientes pediátricos con disautonomía, en los cuales la dexmedetomidina se ha utilizado con éxito, produciendo ansiolisis postoperatoria y disminuyendo el riesgo de desencadenar crisis hipertensivas (42).
Otros usos de la dexmedetomidina: proporciona analgesia frente al dolor crónico neuropático, reduce del temblor postoperatorio, se usa en desintoxicación por opioides y también como ansiolítico por destete de sedoanalgesia en unidades de cuidados intensivos (UCI), en dosis de 0,6 mcg/kg/hora, casos en los que es similar al propofol suministrado correspondientemente en dosis de 3 mg/kg/hora; para ambos grupos, el índice biespectral fue de 50 con 5 puntos en la escala de Ramsay. Se observó disminución en la utilización de opioides (2,17,34) y reducción en el tiempo de extubación y de estancia en UCI.
No se recomendaban infusiones durante más de 24 horas (1,2,8).
Cuando la dexmedetomidina y el propofol fueron cifrados igualmente para sedación, no hubo cambios en la frecuencia respiratoria ante un índice biespectral de 85 (50).

EFECTOS SECUNDARIOS
Los efectos secundarios más frecuentes son: bradicardia (4,4 %), hipotensión (16 - 23 %), náusea (11 %), fibrilación auricular (7 %), anemia (3 %), edema pulmonar (2 %), oliguria (2 %) y sed (2 %). Suelen ceder tras la suspensión de la dosis de bolo de 1 mcg /kg.
La resequedad bucal ha sido propuesta como ventaja en intubación traqueal fibroóptica (IOT). (11,51,52)
Actualmente se cuenta con un antagonista para la dexmedetomidina, el atipamezol (53,54) (Antisedan, Pfizer), el cual tiene un perfil farmacocinético similar al de la dexmedetomidina, pero no se usa ampliamente porque los efectos secundarios de la dexmedetomidina (bradicardia, hipotensión, etc.) se revierten fácilmente utilizando anticolinérgicos o simpaticomiméticos.
CONCLUSIONES
La dexmedetomidina es un medicamento de relativa nueva aparición, cuyo uso solamente ha sido aprobado en cuidado intensivo y por periodos no mayores de 24 horas. Actualmente, se reportan usos fuera de la indicación. Así mismo, no hay suficientes estudios clínicos ni muestras de pacientes que soporten su utilización e indicación precisa en la práctica de la anestesia.
La dexmedetomidina bloquea la respuesta adrenérgica deletérea en el periodo perioperatorio, aporta analgesia de poca potencia y presenta un perfil cardiovascular estable aplicada en dosis que aún están por definirse adecuadamente.
Por lo pronto, es útil en poblaciones de pacientes especiales en los que las ventajas superan los efectos secundarios del medicamento, como son pacientes con riesgo de acumulación de opioides, depresión ventilatoria y, en los últimos años, la población pediátrica.
No existe ninguna indicación absoluta para reemplazar los opioides por dexmedetomidina, ni utilizarlo como “anestésico único y universal”. El papel actual de la dexmedetomidina es ser un adyuvante en el arsenal de medicamentos anestésicos intravenosos, el cual cuenta con la mejor evidencia posible en poblaciones específicas.
REFERENCIAS1. Venegas Saavedra A. Anestésicos intravenosos, anestesia intravenosa, 2 ed., Bogotá (DC): Editorial Médica Panamericana, 2008;5:194-8. [ Links ]
2. Miller RD. Anesthetic pharmacologic, Intravenous Anesthetics. En: Miller's Anesthesia. 7ed. Churchill Livingstone Elsevier, 2009;26. [ Links ]
3. Ramsay MA, Luterman DL. Dexmedetomidine as a total intravenous anesthetic agent. Anesthesiology 2004;101:787-90. [ Links ]
4. Talke Pekka O, Caldwell James E, Richardson Charles A, Kirkegaard-Nielsen H, Stafford M. The effects of increasing plasma concentrations of dexmedetomidine in humans. Anesthesiology 2000;93: 382-94. [ Links ]
5. Popat K, Purugganan R, Malik I. Off-Label Uses of Dexmedetomidine, Advances in Anesthesia Vol. 24, 2006:177-92. [ Links ]
6. Khan ZP, Ferguson CN, Jones RM. Alpha-2 and imidazoline receptor agonists: their pharmacology and therapeutic role. Anaesthesia 1999;54:146-65. [ Links ]
7. Kamibayashi T, Maze M. Clinical uses of a2 adrenergic agonists. Anesthesiology 2000;93:1345-9. [ Links ]
8. Tobias JD. Dexmedetomidine: applications in pediatric critical care and pediatric anesthesiology. Pediatr Crit Care Med 2007;8:115-31. [ Links ]
9. Maze M, Tranquilli W. Alpha-2 adrenoceptor agonists: defining the role in clinical anesthesia. Anesthesiology 1991;74:581-605. [ Links ]
10. Bekker A, Jorden VSB. Alpha-2 agonists in neuroanesthesia. Seminars in anesthesia, perioperative medicine and pain 2004;3:181-91. [ Links ]
11. Yazbeck-karam V, Aouad M. Perioperative uses of dexmedetomidine. Middle East Journal of Anesthesiology 2006;6:1043-58. [ Links ]
12. Guo TZ, Jiang JY, Buttermann AE, Maze M. Dexmedetomidine injection into the locus ceruleus produces antinociception. Anesthesiology 1996;84:873-81. [ Links ]
13. Nelson LE, Lu J, Guo T, Saper CB, Franks NP, Maze M. The alpha2-adrenoceptor agonist dexmedetomidine converges on an endogenous sleep-promoting pathway to exert its sedative effects. Anesthesiology 2003;98:428-36. [ Links ]
14. Nacif-Coelho C, Correa-Sales C, Chang LL, Maze M. Perturbation of ion channel conductance alters the hypnotic response to the alpha 2-adrenergic agonist dexmedetomidine in the locus coeruleus of the rat. Anesthesiology 1994;81:1527-34. [ Links ]
15. Venn RM, Bradshaw CJ, Spencer R, Brealey D, Caudwell E, Naughton C, et al. Preliminary UK experience of dexmedetomidine, a novel agent for postoperative sedation in the intensive care unit. Anaesthesia 1999;54:1136-42. [ Links ]
16. Virtanen R, Savola JM, Saano V, Nyman L. Characterization of the selectivity, specificity and potency of medetomidine as an alpha 2-adrenoceptor agonist. Eur J Pharmacol 1988;150:9-14. [ Links ]
17. Venn RM, Karol MD, Grounds RM. Pharmacokinetics of dexmedetomidine infusions for sedation of postoperative patients requiring intensive caret. Br J Anaesth 2002;88:669-75. [ Links ]
18. Dyck JB, Maze M, Haack C, Vuorilehto L, Shafer SL. The pharmacokinetics and hemodynamic effects of intravenous and intramuscular dexmedetomidine hydrochloride in adult human volunteers. Anesthesiology 1993;78:813-20. [ Links ]
19. De Wolf AM, Fragen RJ, Avram MJ, Fitzgerald PC, Rahimi-Danesh F. The pharmacokinetics of dexmedetomidine in volunteers with severe renal impairment. Anesth Analg 2001;93:1205-9. [ Links ]
20. Dyck JB, Maze M, Haack C, Azarnoff DL, Vuorilehto L, Shafer SL. Computer-controlled infusion of intravenous dexmedetomidine hydrochloride in adult human volunteers. Anesthesiology 1993;78:821-8. [ Links ]
21. Engelhard K, Werner C, Kaspar S, Möllenberg O, Blobner M, Bachl M, et al. Effect of the alpha2-agonist dexmedetomidine on cerebral neurotransmitter concentrations during cerebral ischemia in rats. Anesthesiology 2002;96:450-7. [ Links ]
22. Aantaa R, Kallio A, Virtanen R. Dexmedetomidine, a novel a2-adrenergic agonist: a review of its pharmacodynamic characteristics. En: Drugs Future 1993;18:49-56. [ Links ]
23. Frangoulidou E, Kuhlen R, Marenghi C. Sedative agents and respiratory depression: a unique profile of dexmedetomidine. En: Maze M, Morrison P, editors. Redefining Sedation. London (UK): The Royal Society of Medicine Press Ltd.;1998P. 40-50. [ Links ]
24. Riker RR, Fraser GL. Adverse events associated with sedatives, analgesics, and other drugs that provide patient comfort in the intensive care unit. Pharmacotherapy 2005; 25:8S-18S. [ Links ]
25. Lerch C, Park GR. Sedation and analgesia. En: BMJ 1999;55:76-95. [ Links ]
26. Pandharipande P, Pun B, Herr D, Maze M, Girard T, Miller R, et al. Effect of sedation with dexmedetomidine versus lorazepam on acute brain dysfunction in mechanically ventilated patients: the MENDS randomized controlled trial, JAMA 2007;298:2644-64. [ Links ]
27. Willigers HM, Prinzen FW, Roekaerts PM, De Lange S, Durieux ME. Dexmedetomidine decreases perioperative myocardial lactate release in dogs. Anesth Analg 2003;96:657-64. [ Links ]
28. Roekaerts P, Prinzen F, Willingers H. The effect of dexmedetomidine on systemic haemodynamics, regional myocardial function and blood flow during coronary artery stenosis in acute anaesthetized dogs. J Cardiothorac Anesth 1994;8:58. [ Links ]
29. Wallace AW, Galindez D, Salahieh A, Layug EL, Lazo EA, Haratonik KA, et al. Effect of clonidine on cardiovascular morbidity and mortality after noncardiac surgery. Anesthesiology 2004;101:284-93. [ Links ]
30 Aho M, Lehtinen AM, Erkola O, Kallio A, Korttila K. The effect of intravenously administered dexmedetomidine on perioperative hemodynamics and isoflurane requirements in patients undergoing abdominal hysterectomy. Anesthesiology 1991;74:997-1002. [ Links ]
31. Jaakola ML, Ali-Melkkilä T, Kanto J, Kallio A, Scheinin H, Scheinin M. Dexmedetomidine reduces intraocular pressure, intubation responses and anaesthetic requirements in patients undergoing ophthalmic surgery. Br J Anaesth 1992;68:570-5. [ Links ]
32. Scheinin B, Lindgren L, Randell T, Scheinin H, Scheinin M. Dexmedetomidine attenuates sympathoadrenal responses to tracheal intubation and reduces the need for thiopentone and peroperative fentanyl. Br J Anaesth 1992;68:126-31. [ Links ]
33. Aantaa R, Kanto J, Scheinin M, Kallio A, Scheinin H. Dexmedetomidine, an alpha 2-adrenoceptor agonist, reduces anesthetic requirements for patients undergoing minor gynecologic surgery. Anesthesiology 1990;73:230-5. [ Links ]
34. Triltsch AE, Welte M, von Homeyer P, Grosse J, Genähr A, Moshirzadeh M, et al. Bispectral index-guided sedation with dexmedetomidine in intensive care: a prospective, randomized, double blind, placebo-controlled phase II study. Crit Care Med 2002;30:1007-14. [ Links ]
35. Koroglu A, Demirbilek S, Teksan H, Sagir O, But AK, Ersoy MO. Sedative, haemodynamic and respiratory effects of dexmedetomidine in children undergoing magnetic resonance imaging examination: preliminary results. Br J Anaesth 2005;94:821-4. [ Links ]
36. Koroglu Ah, Teksan H, Sagir O, Yucel A, Toprak H, Ersoy O. A comparison of the sedative, hemodynamic, and respiratory effects of dexmedetomidine and propofol in children undergoing magnetic resonance imaging. Anesth Analg 2006;103:63-7. [ Links ]
37. Wijeysundera DN, Naik JS, Beattie WS. Alpha-2 adrenergic agonists to prevent perioperative cardiovascular complications: a meta-analysis. Am J Med 2003;114:742-52. [ Links ]
38. Jalonen J, Hynynen M, Kuitunen A, Heikkilä H, Perttilä J, Salmenperä M, et al. Dexmedetomidine as an anesthetic adjunct in coronary artery bypass grafting. Anesthesiology 1997;86:331-45. [ Links ]
39. But AK, Ozgul U, Erdil F, Gulhas N, Toprak HI, Durmus M, et al. The effects of preoperative dexmedetomidine infusion on hemodynamics in patients with pulmonary hypertension undergoing mitral valve replacement surgery. Acta Anaesthesiol Scand 2006;50:1207-12. [ Links ]
40. Sadhasivam S, Boat A, Mahmoud M. Comparison of patient-controlled analgesia with and without dexmedetomidine following spine surgery in children. Journal of Clinical Anesthesia 2009;21:493-501. [ Links ]
41. Hammer GB, Sam WJ, Chen MI, Golianu B, Drover DR. Determination of the pharmacodynamic interaction of propofol and dexmedetomidine during esophagogastroduodenoscopy in children, Pediatric Anesthesia 2009;19:138-44. [ Links ]
42. Biccard BM, Goga S, de Beurs J. Dexmedetomidine and cardiac protection for non-cardiac surgery: a meta-analysis of randomised controlled trials, Anaesthesia 2008;63:4-14. [ Links ]
43. Ruesch S, Levy J. Treatment of persistent tachycardia with dexmedetomidina during off-pump cardiac surgery. Anesth Analg 2002;95:316-8. [ Links ]
44. Ickeringill M, Shehabi Y, Adamson H, Ruettimann U. Dexmedetomidine infusion without loading dose in surgical patients requiring mechanical ventilation: haemodynamic effects and efficacy. Anaesth Intensive Care 2004;32:741-5. [ Links ]
45. Abulhasan Y, Buu N, Frigon C. Perioperative use of dexmedetomidine in an infant with familial dysautonomia. British Journal of Anaesthesia 2009;103(3):413-5. [ Links ]
46. Bakhamees H. Effects of dexmedetomidine in morbidly obese patients undergoing laparoscopic gastric bypass Middle East Journal of Anesthesiology 2007;19(3). [ Links ]
47. Shukry M, Kennedy K. Dexmedetomidine as a total intravenous anesthetic in infants. Pediatric anesthesia 2007;17:581-3. [ Links ]
48. Bulow NM, Barbosa NV, Rocha JB. Opioid consumption in total intravenous anesthesia is reduced with dexmedetomidine: a comparative study with remifentanil in gynecologic videolaparoscopic surgery. Journal of Clinical Anesthesia 2007;19:280-5. [ Links ] 49. Mani V, Morton NS. Overview of total intravenous anesthesia in children. Pediatric Anesthesia 2010;20:211-22. [ Links ]
50. Arain SR, Ebert TJ. The efficacy, side effects, and recovery characteristics of dexmedetomidine versus propofol when used for intraoperative sedation. Anesth Analg 2002;95:461-6. [ Links ]
51. Turgut N, Turkmen A, Gökkaya S, Altan A, Hatiboglu MA. Dexmedetomidine-based versus fentanyl-based total intravenous anesthesia for lumbar laminectomy, Minerva Anestesiologica 2008;74:469-74. [ Links ]
52. Carollo DS, Nossaman BD, Ramadhyani U. Dexmedetomidine: a review of clinical applications; current opinion. En: Anesthesiology 2008,21:456-61. [ Links ]
53. Aho M, Erkola O, Kallio A, Scheinin H, Korttila K. Comparison of dexmedetomidine and midazolam sedation and antagonism of dexmedetomidine with atipamezole. J Clin Anesth 1993;5:194-203. [ Links ]
54. Reid K, Hayashi Y, Guo TZ, Correa-Sales C, Nacif-Coelho C, Maze M. Chronic administration of an alpha 2 adrenergic agonist desensitizes rats to the anesthetic effects of dexmedetomidine. Pharmacol Biochem Behav 1994;47:171-5. [ Links ]
Conflicto de intereses: Ninguno declarado.
Financiación: Recursos propios.











 texto en
texto en 

