Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Colombian Journal of Anestesiology
versión impresa ISSN 0120-3347
Rev. colomb. anestesiol. v.40 n.1 Bogotá ene./mar. 2012
https://doi.org/10.1016/S0120-3347(12)70010-2
http://dx.doi.org/10.1016/S0120-3347(12)70010-2
Revisión
Tendencias actuales en el manejo preoperatorio de pacientes anticoagulados con warfarina
Current trends in the preoperative management of patients receiving warfarin for anticoagulation
Iván Mauricio Alvarado Arteaga*
Anestesiólogo, Hospital Universitario de San Ignacio. Profesor ad honórem, Pontificia Universidad Javeriana. Bogotá, Colombia
*Autor para correspondencia: Carrera 77 # 19 - 35, int. 2 apto. 702, Bogotá, Colombia. Correo electrónico: alvaradoivancolombia@yahoo.com (I.M. Alvarado).
© 2012 Publicado por Elsevier España, S.L. en nombre de Sociedad Colombiana de Anestesiología y Reanimación.
INFORMACIÓN DEL ARTÍCULO
Historia del artículo: Recibido el 28 de marzo de 2011 - Aceptado el 22 de noviembre de 2011RESUMEN
Introducción: El manejo de la anticoagulación perioperatoria en pacientes tratados crónicamente con warfarina y programados para procedimientos invasivos, electivos y urgentes es un problema clínico frecuente y de difícil manejo. La ausencia de esquemas de manejo claros y el uso indiscriminado de remplazo transitorio con heparina no fraccionada genera demoras, sobrecostos y días de hospitalización innecesarios.Objetivos: Revisar las tendencias actuales y evidencia que las soporta, concerniente al remplazo transitorio de la anticoagulación en el preoperatorio ("puenteo"), con énfasis en el uso de heparinas de bajo peso molecular, de manera ambulatoria.
Metodología: Se realizó una búsqueda en PubMed de las guías de manejo basadas en la evidencia, consensos de expertos y estudios originales al respecto.
Resultados: Se identificaron tres guías de práctica clínica, basadas en la evidencia y múltiples revisiones narrativas por expertos, cuatro de ellas recientes. Los estudios clínicos encontrados en ámbito quirúrgico, son puramente observacionales. Existen estudios comparativos, pero en escenarios no quirúrgicos.
Discusión: La evidencia respecto al manejo es limitada y las guías por consenso de expertos son inconsistentes.
Conclusiones: Existe evidencia sugestiva, aunque no concluyente, que soporta la utilidad de las heparinas de bajo peso molecular; en el remplazo transitorio y ambulatorio de la anticoagulación en el preoperatorio ("puenteo"). Se necesitan estudios comparativos, bien diseñados, realizados en el ámbito perioperatorio. Con base en la información disponible, se proponen algunos lineamientos con respecto al manejo de anticoagulación en casos electivos y urgentes, expresándolos gráficamente en un algoritmo novedoso y sencillo.
Palabras clave: Periodo perioperatorio - Anticoagulantes - Heparina - Trombosis.
© 2012 Sociedad Colombiana de Anestesiología y Reanimación. Publicado por Elsevier.
Todos los derechos resevados.
ABSTRACT
Introduction: The perioperative management of patients receiving chronic treatment with warfarin and scheduled for invasive, elective or emergency procedures is a difficult and frequently arising problem in clinical practice. The lack of clear management guidelines and the indiscriminate use of the temporary replacement with unfractionated heparin creates delays, increases costs and unnecessarily prolongs the length of hospital stay.
Objectives: To review current trends and their supporting evidence of temporary replacement ("bridging") during the pre-operative period, emphasizing the use of low-molecular-weight heparins on an outpatient basis.
Methodology: PubMed search of evidence-based management guidelines, expert consensus and original trials.
Results: Three evidence-based clinical practice guidelines, together with multiple narrative expert reviews, four of them recently published, were identified. Clinical trials found in the surgical setting were purely observational. Although there are comparative studies, none of them apply to the surgical setting.
Discussion: Management evidence is limited and expert consensus guidelines are inconsistent.
Conclusions: There is suggestive, though non-conclusive evidence supporting the use of low-molecular-weight heparins for temporary replacement ("bridging") of pre-operative anticoagulation on an outpatient basis. There is a need to conduct well-designed comparative studies in the perioperative setting. Guidelines for anticoagulation management in elective and emergency cases are proposed on the basis of the information available, expressed in the form of a simple and innovative graphic algorithm applicable to the Colombian situation.
© 2012 Sociedad Colombiana de Anestesiología y Reanimación. Published by Elsevier.
All rights reserved.
Introducción
Aproximadamente el 1,4% de la población adulta requiere anticoagulación oral continua1, porcentaje que podría venir en aumento2, y al menos el 10% de ellos enfrenta una intervención quirúrgica cada año3. Continuar el efecto anticoagulante en proximidad o durante el procedimiento quirúrgico podría generar sangrado excesivo3,4; por otra parte, suspenderlo durante el perioperatorio aumentaría el riesgo de eventos tromboembólicos5,6, y ello generaría un problema clínico muy común y de difícil manejo, que ya ha llamado la atención de la revista7,8.
Para sobrellevar el problema, muy a menudo se suspende la warfarina con varios días de anticipación y se utilizan fármacos anticoagulantes de más corta acción, con el fin de remplazar transitoriamente el efecto anticoagulante y minimizar el tiempo desprovisto de anticoagulación. Esta práctica recientemente se ha llamado puenteo (del inglés bridging), y tradicionalmente es realizada con infusión intravenosa de heparina no fraccionada (HNF); esto implica, sin embargo, días de hospitalización inoficiosos y sobrecostos para los pacientes, las instituciones y los sistemas de salud.
Últimamente ha surgido la tendencia de utilizar heparinas de bajo peso molecular (HBPM); dados su fácil administración subcutánea y su efecto predecible, estas permitirían el manejo ambulatorio, al disminuir la estancia hospitalaria y los costos, pero existen dudas y confusión entre los clínicos involucrados en el manejo perioperatorio en cuanto a su efectividad, su seguridad y la forma de utilizarlas.
Algunas sociedades científicas en el mundo entero han reunido la literatura disponible al respecto e intentado formular esquemas de manejo, a manera de guías de práctica clínica basadas en la evidencia9-11; además, existen numerosas revisiones narrativas por expertos en el tema12-15. Desafortunadamente, no hay consenso actual sobre las recomendaciones, y los esquemas propuestos tienden a ser excesivamente complejos o inaplicables.
El objetivo del presente texto es mencionar la evidencia más relevante que soporta las tendencias actuales de manejo en el periodo preoperatorio de casos electivos y urgentes, los cuales involucran más a menudo al anestesiólogo tratante; igualmente, proponer un algoritmo sencillo (fig. 1), en procura de resumir las recomendaciones internacionales y que sea aplicable al medio colombiano. El presente texto corresponde a una revisión narrativa.
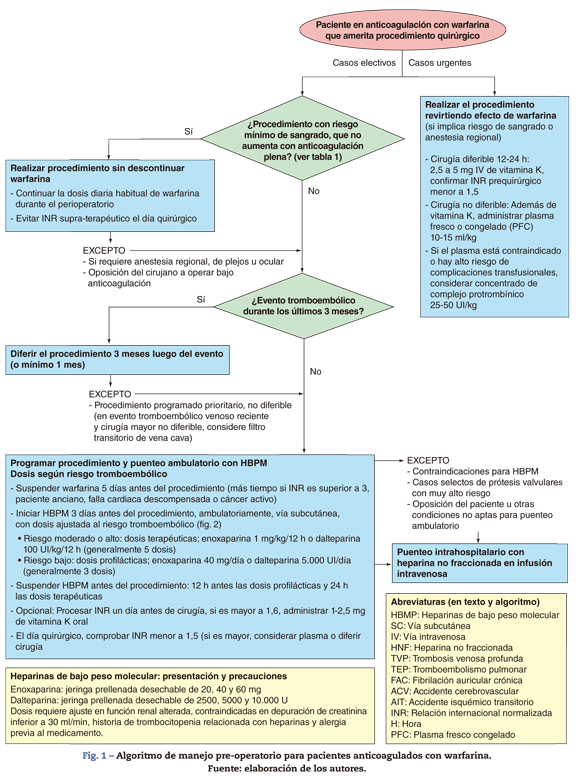
Variables y riesgos por considerar
De la multitud de factores para tener en cuenta, las dos variables más relevantes en la toma de decisiones durante el preoperatorio son el riesgo de sangrado relacionado con el procedimiento y el riesgo de eventos tromboembólicos relacionados con el paciente. El primero determina la necesidad de suspender oportunamente la warfarina y el segundo afecta a la pertinencia y la dosificación del puenteo.
Los riesgos involucrados se deben evaluar en términos de probabilidad y repercusión clínica (o morbimortalidad)15. Valiéndose de escalas de predicción de riesgo, se intenta clasificar dichos riesgos según su grado de severidad, con el fin de establecer luego puntos de corte relevantes para la toma de decisiones. Actualmente la predicción del riesgo tromboembólico ha resultado más consistente y precisa que la del sangrado.
Predicción del riesgo de sangrado perioperatorio
Se ha estimado un riesgo de muerte de entre el 3% y el 9%, por sangrado mayor relacionado con cumarínicos5,9; ello también afecta significativamente a la morbilidad, en términos de reoperación de urgencia, eventos adversos cardiacos y respiratorios, aumento del riesgo de infección y posibles consecuencias a largo plazo relacionadas con cicatrización y dolor crónico5,14; además, el sangrado puede retrasar el reinicio de la anticoagulación, y así aumentar el periodo en riesgo de eventos tromboembólicos16.
Con base en el procedimiento planeado se han propuesto múltiples escalas que intentan predecir el sangrado perioperatorio12,14, pero presentan graves inconsistencias en cuanto al número de grupos y los puntos de corte; más preocupante aún es su bajo poder predictivo, el cual se debe, posiblemente, a la gran diversidad de factores adicionales involucrados.
Por lo anterior, la clasificación minuciosa del procedimiento en un determinado grupo tendría poca relevancia en la planeación preoperatoria. Resulta más práctico, por el contrario, establecer un punto de corte con implicación en el manejo, y separar los procedimientos que se pueden realizar manteniendo la warfarina de aquellos que requieren suspensión previa y posible puenteo.
Conductas según el riesgo de sangrado
Existe un grupo de procedimientos mínimamente invasivos, de orden odontológico, endoscópico, oftalmológico y dermatológico, todos los cuales, consistentemente, se relacionan con grados insignificantes de sangrado; y además, dicho sangrado no aumenta con la anticoagulación oral plena.
La conducta por seguir, sustentada en estudios prospectivos y aleatorizados en odontología17,18, así como en cohortes prospectivos en el resto19-21, sería continuar la anticoagulación oral plena durante el perioperatorio, sin agente de puenteo, de acuerdo con las guías y el concepto de expertos en el tema9-15. No toda "cirugía menor" puede incluirse en este grupo, sino solo las estipuladas en la tabla 1. Como excepciones a la regla es posible citar la oposición del cirujano a realizar el procedimiento bajo anticoagulación, y los procedimientos que se planean bajo anestesia regional (neuroaxial, de plexos o bloqueo ocular)22,23.

El resto de procedimientos quirúrgicos cursan con algún riesgo de sangrado, que puede aumentar, por la anticoagulación oral, en severidad y en repercusión clínica3,5. Además, otros procedimientos pueden causar sangrados menores en cantidad, pero con serias repercusiones locales, que pueden aumentar con la anticoagulación, tales como aquellos que involucran el sistema nervioso central, la cámara posterior del ojo, una polipectomía mayor a 2 cm24,25, la biopsia de próstata26, el implante de un marcapasos o el cardiodesfibrilador27.
Para virtualmente todo procedimiento electivo que implique algún riesgo de sangrado (excluidos los de la tabla 1) o donde se planee anestesia regional, debe suspenderse oportunamente la warfarina, en acuerdo con las guías9-15. La necesidad adicional de puenteo y los posibles esquemas al respecto se tratarán más adelante.
Predicción del riesgo tromboembólico preoperatorio
Las condiciones clínicas que ameritan anticoagulación continua con warfarina son, principalmente, tres: la fibrilación auricular crónica (FAC), las válvulas cardiacas protésicas y el antecedente de tromboembolismo venoso o pulmonar (TVP-TEP). Cada una de ellas representa un grupo heterogéneo de riesgo tromboembólico que varía de acuerdo con los antecedentes de eventos previos, la comorbilidad y las condiciones asociadas.
En la FAC el riesgo aumenta si tiene sustrato valvular; de lo contrario, el riesgo depende de factores asociados, cuantificados por la escala CHADS228,29. Las prótesis valvulares tienen más riesgo al ser de vieja generación, al estar en posición mitral o tricuspídea y por otros factores similares al CHADS211,30. En TVP o TEP el riesgo varía según lo reciente del evento, el número de recurrencias, y la presencia y la severidad de condiciones trombofílicas subyacentes31,32.
Por cuestiones prácticas, se pueden reagrupar las condiciones antes mencionadas en una escala de riesgo tromboembólico basal, de acuerdo con la probabilidad anual de evento tromboembólico, si el paciente no estuviera anticoagulado.
Así, el riesgo se puede clasificar como bajo cuando es inferior al 4%; como moderado, si es del 4%-10%; y como alto, si está por encima del 10% (fig. 2)9. También es necesario tener en cuenta el grado de impacto clínico. En tal sentido, las trombosis arteriales (FAC o prótesis) tienen más repercusión en la calidad de vida y en la mortalidad, que las venosas (TVP-TEP)32,33.
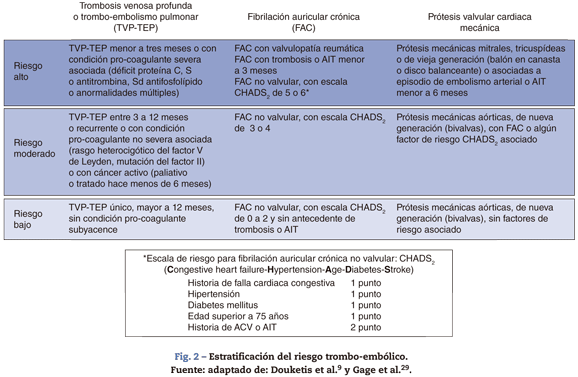
El riesgo por cada día sin anticoagulación durante el perio-peratorio equivaldría, matemáticamente hablando, al riesgo anual basal dividido en 3659. Algunos autores mencionan un posible elemento de riesgo adicional, relacionado con un periodo transitorio de hipercoagulabilidad, causado por la suspensión abrupta de la warfarina34. Aunque el tipo de cirugía afecta el riesgo tromboembólico postoperatorio35, no sería un factor adicional que considerar durante el preoperatorio.
Un reciente modelo de decisión analítica sugiere un punto de corte por encima del 5,6% de riesgo anual basal para considerar puenteo36, lo que se podría equiparar a los grupos moderado y alto.
Estrategias de disminución del riesgo tromboembólico preoperatorio
Tras un evento tromboembólico venoso reciente el riesgo de recurrencia desciende de manera drástica durante los primeros 3 meses, por lo cual algunos autores sugieren aplazar las cirugías no prioritarias al menos 1 mes; idealmente, 3 meses. Tal sugerencia se podría extender a los eventos arteriales o cardioembólicos recientes28. La implantación de un filtro de vena cava transitorio se podría considerar en TVP muy reciente y una cirugía mayor no diferible32,37.
En cuanto a la verdadera utilidad del puenteo perioperatorio, hasta hoy no existen estudios prospectivos, ni aleatorizados ni controlados contra placebo que aporten información fiable sobre su eficacia, su seguridad, su dosificación y las diferencias comparativas entre posibles fármacos y esquemas. La evidencia actual se deriva de estudios de buena calidad, pero tiende a ser extrapolada de escenarios no quirúrgicos y estudios de moderada calidad (puramente observacionales), en el ámbito perioperatorio.
En escenarios no quirúrgicos existe evidencia de buena calidad que soporta la utilidad de las HBPM en el manejo del TVP-TEP y en la disminución de la recurrencia después de un evento, y cuyo perfil de seguridad permite el manejo ambulatorio; incluso, se muestran superiores a la HNF32. Menos contundente es la evidencia que apoya las HBPM en el control de eventos arteriales o cardioembólicos, si bien hay evidencia indirecta que sugiere su utilidad en el manejo de FA crónica38, ACV isquémico subagudo39; también, aunque ello es más controvertido, en prótesis valvulares40.
Dentro del marco perioperatorio no hay estudios aleatorizados controlados que aporten evidencia fiable sobre la utilidad del puenteo con HBPM; existen, sin embargo, múltiples estudios descriptivos, prospectivos de cohorte, que muestran un bajo promedio de eventos tromboembólicos (1%) y de sangrado mayor (3%). En prótesis valvulares, al menos 14 estudios, que reúnen a 1.300 pacientes, muestran una tasa general de eventos tromboembólicos del 0,83%; en FA crónica, 10 estudios, con 1.400 pacientes, muestran una tasa del 0,57%; y en TVP-TEP, 9 estudios, que reúnen a 500 pacientes, muestran una tasa general del 0,6%. Los datos se consolidaron en una reciente revisión de la ACCP9. Existen dos estudios de buena calidad, actualmente en curso, que, probablemente, aporten información más confiable para el año 201441,42.
La utilidad de la heparina no fraccionada (HNF) como agente de puenteo perioperatorio es también apoyada por estudios puramente observacionales, aunque en menor cantidad. Al comparar puenteo perioperatorio con HNF contra HBPM en un estudio multicéntrico, de cohortes, prospectivo, aunque no aleatorizado, no se encontraron diferencias significativas en cuanto a eventos tromboembólicos, ni tasas de sangrado43. Tampoco se las halló al realizar un análisis del subgrupo de válvulas protésicas en el estudio anterior44, a pesar de lo cual algunas sociedades cardiológicas mantienen reservas en cuanto a HBPM en prótesis valvulares de alto riesgo11.
En cuanto a la dosis de puenteo con HBPM, las guías basadas en la evidencia9-11 coinciden en sugerir dosis terapéuticas de HBPM en los grupos de alto riesgo, y dosis profilácticas o ausencia de puenteo en los de bajo riesgo, con algunas incongruencias en riesgo tromboembólico moderado de origen venoso.
Por simplicidad y razones médicas y legales, se podría tratar de unificar las recomendaciones con la tendencia ligeramente más agresiva, sugerida por la guía de mayor difusión: profilácticas para bajo riesgo y terapéuticas para riesgos moderado y alto9.
Protocolo práctico de puenteo ambulatorio prequirúrgico con HBPM
Con base en estudios farmacológicos de los medicamentos involucrados45, en estudios clínicos en puenteo perioperatorio16 y en las guías mencionadas, se podrían sugerir los siguientes parámetros: suspender la warfarina de 4 a 5 días antes de la cirugía9-15, aunque algunas situaciones pueden requerir un lapso mayor (INR superior a 3, paciente anciano, falla cardiaca descompensada y cáncer activo)46; iniciar las HBPM 24 a 36 horas después de la última dosis de warfarina (3 días antes del procedimiento)9-15; los fármacos de uso más común, e incluidos en el POS, se citan en el algoritmo (fig. 1).
Para dosis terapéuticas se sugiere preferir los esquemas de doble aplicación diaria sobre los de aplicación única47. Las dosis profilácticas deben suspenderse 12 horas antes, y las terapéuticas, 24 horas antes del procedimiento o de la anestesia regional9-15,23. Dada la errática eliminación de la warfarina, se debe constatar un INR prequirúrgico menor a 1,59-15; algunos sugieren procesarlo 1 día antes, para en caso de estar alterado, administrarle al paciente dosis bajas de vitamina K oral (1 mg-2,5 mg), con el fin de evitar problemáticos aplazamientos de las cirugías o la administración no justificada de plasma48.
Reversión de warfarina en casos urgentes
En caso de cirugía urgente, dosis de 2,5 mg-5 mg de vitamina K, vía oral o intravenosa lenta pueden revertir la anticoagulación por warfarina, en el término de 12 a 24 horas49. Cuando la cirugía va a ser realizada en un lapso menor, además de la vitamina K se debe considerar plasma fresco congelado (PFC), a dosis de 10 ml/kg-15 ml/kg50, pero su procesamiento y su administración requieren tiempo, y se lo asocia a riesgos transfusionales (daño pulmonar agudo relacionado con la transfusión o TRALI, sobrecarga hídrica, riesgo infeccioso, reacciones anafilácticas); además, podría no ser suficiente para revertir estados de sobreanticoagulación.
Recientemente se ha introducido el concentrado de complejo protrombínico, a dosis de 25 UI/kg-50 Ul/kg, el cual luce como una opción prometedora, con ventajas comparativas sobre el PFC, al ser más rápido, más efectivo y más seguro, con ausencia de los efectos adversos relacionados con el PFC, sin embargo, la escasa evidencia en el perioperatorio y su elevado costo aún limitan su utilización51,52.
Conflictos de interés
Ninguno declarado
Fuente de financiación: recursos propios de los autores.
REFERENCIAS
1.Bevan F, Brookes M, Colebrook R, et al. The assumptions used in estimating a benchmark rate of population requiring anticoagulation therapy per year. National institute for Health and Clinical Excellence [internet]. 2010 [citado: 10 de febrero del 2011]. Disponible en: http://www.nice.org.uk/usingguid-ance/commissioningguides/anticoagulationtherapyservice/popbench.jsp. [ Links ]
2.Friberg J, Gislason GH, Gadsb0ll N, et al. Temporal trends in the prescription of vitamin K antagonists in patients with atrial fibrillation. J Intern Med. 2006;259:173-8. [ Links ]
3.McKenna R. Abnormal coagulation in the postoperative period contributing to excessive bleeding. Med Clin North Am. 2001;85:1277-310. [ Links ]
4. Linkins LA, Choi PT, Douketis JD. Clinical impact of bleeding in patients taking oral anticoagulant therapy for venous thromboembolism: a meta-analysis. Ann Intern Med. 2003;139:893-900. [ Links ]
5. Dunn AS, Turpie AG. Perioperative management of patients receiving oral anticoagulants: a systematic review. Arch Intern Med. 2003;163:901-8. [ Links ]
6. Gladstone DJ, Bui E, Fang J, et al. Potentially preventable strokes in high-risk patients with atrial fibrillation who are not adequately anticoagulated. Stroke. 2009;40:235-40. [ Links ]
7. Rincón PG. Anticoagulación y anestesia, caso clínico. Rev. Colomb. anestesiol. 1987;15:291-6. [ Links ]
8. Valencia W, Husbands JS. Tromboembolismo venoso postoperatorio: grave riesgo prevenible. Rev Colomb Anestesiol. 2010;38:499-507. [ Links ]
9. Douketis JD, Berger PB, Dunn AS, et al. The perioperative management of antithrombotic therapy: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest. 2008;133 (6 Suppl):S299-339. [ Links ]
10. Spyropoulos AC, Douketis JD. Guidelines for antithrombotic therapy: periprocedural management of antithrombotic therapy and use of bridging anticoagulation. Int Angiol. 2008;27: 333-43. [ Links ]
11. Bonow RO, Carabello BA, Chatterjee K, et al. American Col-lege of Cardiology/American Heart Association Task Force on Practice Guidelines. 2008 focused update incorporated into the ACC/AHA 2006 guidelines for the management of patients with valvular heart disease. J Am Coll Cardiol. 2008;52:1-142. [ Links ]
12. Spyropoulos AC. To bridge or not to bridge: that is the question. The argument FOR bridging therapy in patients on oral anticoagulants requiring temporary interruption for elective procedures. J Thromb Thrombolysis. 2010;29:192-8. [ Links ]
13. Jaff MR. Chronically anticoagulated patients who need surgery: can low-molecular-weight heparins really be used to "bridge" patients instead of intravenous unfractionated heparin? Catheter Cardiovasc Interv. 2009;74 Suppl 1:S17-21. [ Links ]
14. Douketis JD, Bakhsh E. Perioperative management of antithrombotic therapy. Pol Arch Med Wewn. 2008;118:201-8. [ Links ]
15. O'Donnell M, Kearon C. Perioperative management of oral anticoagulation. Cardiol Clin. 2008;26:299-309. [ Links ]
16. Douketis JD, Johnson JA, Turpie AG. Low-molecular-weight heparin as bridging anticoagulation during interruption of warfarin: assessment of a standardized periprocedural anticoagulation regimen. Arch Intern Med. 2004;164: 1319-26. [ Links ]
17. Jeske AH, Suchko GD. Lack of a scientific basis for routine discontinuation of oral anticoagulation therapy before dental treatment. J Am Dent Assoc. 2003;134:1492-7. [ Links ]
18. Bacci C, Maglione M, Favero L, et al. Management of dental extraction in patients undergoing anticoagulant treatment. Results from a large, multicentre, prospective, case-control study. Thromb Haemost. 2010;104:972-5. [ Links ]
19. Eisen GM, Baron TH, Dominitz JA, et al. American Society for Gastrointestinal Endoscopy. Guideline on the management of anticoagulation and antiplatelet therapy for endoscopic procedures. Gastrointest Endosc. 2002;55:775-9. [ Links ]
20. Hirschman DR, Morby LJ. A study of the safety of continued anticoagulation for cataract surgery patients. Nurs Forum.2006;41:30-7. [ Links ]
21. Katz J, Feldman MA, Bass EB, et al. Study of Medical Testing for Cataract Surgery Team. Risks and benefits of anticoagulant and antiplatelet medication use before cataract surgery. Ophthalmology. 2003;110:1784-8. [ Links ]
22. Kallio H, Paloheimo M, Maunuksela EL. Haemorrhage and risk factors associated with retrobulbar/peribulbar block: a pro-spective study in 1383 patients. Br J Anaesth. 2000;85:708-11. [ Links ]
23. Horlocker TT, Wedel DJ, Rowlingson JC, et al. Regional anesthesia in the patient receiving antithrombotic or thrombolytic therapy: American Society of Regional Anesthesia and Pain Medicine Evidence-Based Guidelines (Third Edition). Reg Anesth Pain Med. 2010;35:64-101. [ Links ]
24. Syed S, Adams BB, Liao W, et al. A prospective assessment of bleeding and international normalized ratio in warfarin-anticoagulated patients having cutaneous surgery. J Am Acad Dermatol. 2004;51:955-7. [ Links ]
25. Sorbi D, Norton I, Conio M, et al. Postpolypectomy lower GI bleeding: descriptive analysis. Gastrointest Endosc. 2000;51:690-6. [ Links ]
26. Ihezue CU, Smart J, Dewbury KC, et al. Biopsy of the prostate guided by transrectal ultrasound: relation between warfarin use and incidence of bleeding complications. Clin Radiol. 2005;60:459-63. [ Links ]
27. Wiegand UK, LeJeune D, Boguschewski F, et al. Pocket hematoma after pacemaker or implantable cardioverter defibrillator surgery: influence of patient morbidity, operation strategy, and perioperative antiplatelet/anticoagulation therapy. Chest.2004;126:1177-86. [ Links ]
28. Couillard P, Poppe AY, Coutts SB. Predicting recurrent stroke after minor stroke and transient ischemic attack. Expert Rev Cardiovasc Ther. 2009;7:1273-81. [ Links ]
29. Gage BF, Waterman AD, Shannon W, et al. Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation. JAMA. 2001;285: 2864-70. [ Links ]
30. Salem DN, Stein PD, Al-Ahmad A, et al. Antithrombotic therapy in valvular heart disease--native and prosthetic: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest. 2004;126 (3 Suppl):S457-82. [ Links ]
31. Heit JA, Mohr DN, Silverstein MD, et al. Predictors of recurrence after deep vein thrombosis and pulmonary embolism: a population-based cohort study. Arch Intern Med. 2000;160:761-8. [ Links ]
32. Büller HR, Agnelli G, Hull RD, et al. Antithrombotic therapy for venous thromboembolic disease: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest.2004;126 (3 Suppl):S401-28. [ Links ]
33. Longstreth WT Jr, Bernick C, Fitzpatrick A, et al. Frequency and predictors of stroke death in 5,888 participants in the Cardiovascular Health Study. Neurology. 2001;56:368-75. [ Links ]
34. Hermans C, Claeys D. Review of the rebound phenomenon in new anticoagulant treatments. Curr Med Res Opin. 2006;22:471-81. [ Links ]
35. Kearon C, Hirsh J. Management of anticoagulation before and after elective surgery. N Engl J Med. 1997;336:1506-11. [ Links ]
36. Dunn AS, Wisnivesky J, Ho W, et al. Perioperative management of patients on oral anticoagulants: a decision analysis. Med Decis Making. 2005;25:387-97. [ Links ]
37. Hann CL, Streiff MB. The role of vena caval filters in the management of venous thromboembolism. Blood Rev. 2005;19:179-202. [ Links ]
38. Amadeus Investigators, Bousser MG, Bouthier J, et al. Comparison of idraparinux with vitamin K antagonists for prevention of thromboembolism in patients with atrial fibrillation: a randomised, open-label, non-inferiority trial. Lancet. 2008;371:315-21. [ Links ]
39. Kalafut MA, Gandhi R, Kidwell CS, et al. Safety and cost of low-molecular-weight heparin as bridging anticoagulant therapy in subacute cerebral ischemia. Stroke. 2000;31:2563-8. [ Links ]
40. Shapira Y, Sagie A, Battler A. Low-molecular-weight heparin for the treatment of patients with mechanical heart valves. Clin Cardiol. 2002;25:323-7. [ Links ]
41. Ortel TL, Hasselblad V. A double blind randomized control trial of post-operative low molecular weight heparin bridging therapy versus placebo bridging therapy for patients who are at high risk for arterial thromboembolism (PERIOP-2). Canadian Institutes of Health Research (CIHR) [internet]. 2011 [citado: 10 de febrero de 2011]. Disponible en: URL: http://www.clinicaltrials.gov/ct2/show/NCT00432796?term=periop&rank=1 [ Links ]
42. Ortel TL, Hasselblad V. Effectiveness of bridging anticoagulation for surgery (The BRIDGE Study). National Heart, Lung, and Blood Institute (NHLBI) [internet]. 2009 [citado: 10 de febrero de 2011]. Disponible en: URL : http://www.clinicaltrials.gov/ct2/show/NCT00786474?term=bridge&rank=26 [ Links ]
43. Spyropoulos AC, Turpie AG, Dunn AS, et al. Clinical outcomes with unfractionated heparin or low-molecular-weight heparin as bridging therapy in patients on longterm oral anticoagulants: the REGIMEN registry. J Thromb Haemost.2006;4:1246-52. [ Links ]
44. Spyropoulos AC, Turpie AG, Dunn AS, et al. Perioperative bridging therapy with unfractionated heparin or low-molecular-weight heparin in patients with mechanical prosthetic heart valves on long-term oral anticoagulants (from the REGIMEN Registry). Am J Cardiol. 2008;102:883-9. [ Links ]
45. Ansell J, Hirsh J, Hylek E, et al. American College of Chest Physicians. Pharmacology and management of the vitamin K antagonists: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest. 2008;133 (6 Suppl):S160-98. [ Links ]
46. Hylek EM, Regan S, Go AS, et al. Clinical predictors of pro-longed delay in return of the international normalized ratio to within the therapeutic range after excessive anticoagulation with warfarin. Ann Intern Med. 2001;135:393-400. [ Links ]
47. Couturaud F, Julian JA, Kearon C. Low molecular weight heparin administered once versus twice daily in patients with venous thromboembolism: a meta-analysis. Thromb Haemost. 2001;86:980-4. [ Links ]
48. Woods K, Douketis JD, Kathirgamanathan K, et al. Low-dose oral vitamin K to normalize the international normalized ratio prior to surgery in patients who require temporary interruption of warfarin. J Thromb Thrombolysis. 2007;24:93-7. [ Links ]
49. Lubetsky A, Yonath H, Olchovsky D, et al. Comparison of oral vs intravenous phytonadione (vitamin K1) in patients with excessive anticoagulation: a prospective randomized controlled study. Arch Intern Med. 2003;163:2469-73. [ Links ]
50. Spence RK. Clinical use of plasma and plasma fractions. Best Pract Res Clin Haematol. 2006;19:83-96. [ Links ]
51. Leissinger CA, Blatt PM, Hoots WK, et al. Role of prothrombin complex concentrates in reversing warfarin anticoagulation: a review of the literature. Am J Hematol. 2008;83:137-43. [ Links ]
52. Demeyere R, Gillardin S, Arnout J, et al. Comparison of fresh frozen plasma and prothrombin complex concentrate for the reversal of oral anticoagulants in patients undergoing cardiopulmonary bypass surgery: a randomized study. Vox Sang.2010;99:251-60. [ Links ]











 texto en
texto en 

