Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Colombian Journal of Anestesiology
versión impresa ISSN 0120-3347
Rev. colomb. anestesiol. vol.40 no.2 Bogotá abr./jun. 2012
https://doi.org/10.1016/S0120-3347(12)70029-1
http://dx.doi.org/10.1016/S0120-3347(12)70029-1
Artículo de revisión
Hipocapnia en neuroanestesia: estado actual
Hypocapnia in Neuroanesthesia: Current Situation
María E. Solano C.a,*, Ichel Castillo B.b y María C. Niño De Mejíac
a Residente III año, Anestesiología, Universidad del Rosario, Bogotá, Colombia
b Residente III año, Anestesiología, Universidad de la Sabana, Bogotá, Colombia
c Neuroanestesióloga-Intensivista, Fundación Santa Fe de Bogotá, Bogotá, Colombia
* Autor para correspondencia: Transversal 39a # 39c-10 sur, Int 2, Apto 204, Alameda de Villamayor, Etapa 2, Bogotá, Colombia.
Correo electrónico: maryaches@hotmail.com (M.E. Solano).
INFORMACIÓN DEL ARTÍCULO
Historia del artículo: Recibido:el 19 de julio de 2011. Aceptado: el 18 de febrero de 2012.
Resumen
Introducción: La hiperventilación ha sido una maniobra común en el manejo anestésico de procedimientos neuroquirúrgicos. Hace unos años había escepticismo entre los médicos sobre si esto resultaba en isquemia cerebral. Hoy sabemos que es perjudicial y deteriora el estado y el pronóstico del paciente.
Objetivo: Hacer una revisión de los efectos adversos de la hipocapnia en diferentes órganos, principalmente el cerebro, e identificar las recomendaciones actuales de su utilidad.
Métodos: Realizamos una búsqueda de la literatura en la base de datos de PubMed utilizando términos MeSH incluidos en las palabras clave; se amplió con la revisión de algunos textos y la bibliografía de los artículos más relevantes.
Resultados: Con la revisión de la literatura, se ha demostrado que la hipocapnia es perjudicial tanto para el cerebro como para otros tejidos, y la recomendación actual es utilizarla sólo en dos situaciones (en caso de herniación inminente y para mejorar el campo quirúrgico) y por 20 min.
Conclusiones: La hiperventilación no debe ser una intervención anestésica rutinaria en el manejo del paciente neuroquirúrgico; debe tener una indicación precisa y, una vez la indicación haya cesado, la intervención debe ser retirada lo más pronto posible.
Palabras clave: Hipocapnia, anestesia, hiperventilación, dióxido de carbono.
© 2011 Sociedad Colombiana de Anestesiología y Reanimación. Publicado por Elsevier.Todos los derechos reservados.
ABSTRACT
Introduction: Hyperventilation has been a usual maneuver in the management of anesthesia in neurosurgical procedures. A few years back there used to be some medical skepticism about the potential of cerebral ischemia and today we know that it is detrimental and worsens the patient’s condition and prognosis.
Objective: To review the adverse effects of hypocapnia on various organs —mainly the brain— and to identify the current recommendations about its use.
Methodology: We conducted a PubMed literature search using MeSH terminology including the key words. The search was expanded to include a review of several texts and the bibliography of the most relevant articles.
Results: The literature review showed that hypocapnia is harmful for the brain and for other tissues and the current recommendation is to use it for two situations only: in case of imminent herniation and to improve the surgical field, limited to 20 minutes.
Conclusions: Hyperventilation should not be a routine anesthetic intervention for the management of the neurosurgical patient; there must be a precise indication and once the situation is corrected, the intervention must be immediately withdrawn.
Keywords: Hypocapnia Anesthesia Hyperventilation Carbon dioxide
© 2011 Sociedad Colombiana de Anestesiología y Reanimación. Published by Elsevier.
All rights reserved.
Introducción
La hiperventilación ha sido una maniobra común en el manejo anestésico de procedimientos neuroquirúrgicos electivos y emergentes1-4. Hace unos años había escepticismo sobre si la medida resultaba en isquemia cerebral3,4; esto puede ser inocuo en cerebros sanos, pero en condiciones patológicas puede ser perjudicial y deteriorar el estado clínico y el pronóstico del paciente1,4.
El objetivo del artículo es hacer una revisión de los efectos adversos de la hipocapnia en el cerebro y otros órganos, así como identificar las recomendaciones actuales de su utilidad.
Materiales y métodos
Realizamos una búsqueda en la literatura en base de datos de PubMed utilizando términos MeSH incluidos en las palabras clave; se amplió con la revisión de algunos textos y la bibliografía de los artículos más relevantes.
Metabolismo y transporte de CO2
El CO2 se excreta al líquido intersticial desde la célula como resultado final de la actividad metabólica5. Es un gas extremadamente soluble que se transporta en sangre en un 5-10% disuelto, que genera la presión arterial de CO2 (PaCO2); un 20-30% unido a proteínas formando complejos carbamino y un 65-70% como bicarbonato (HCO3 -)1. Este transporte es complejo y su centro es la reacción del CO2 con agua, formando ácido carbónico (H2CO3)6, que se mantiene en equilibrio con H+ y HCO3 - a través de una reacción lenta que tarda 40 s1,6. Esta reacción progresa considerablemente dentro de los eritrocitos, por presencia de la enzima anhidrasa carbónica y tarda menos de 10 ms en completarse6. El H2CO3 - se disocia en H+ y HCO3 -, y una gran fracción del bicarbonato se bombea al plasma y se intercambia por cloruro, y el hidrogenión es amortiguado por la hemoglobina6 (fig. 1).
La PaCO2 representa el balance entre producción y eliminación1,2, y esto en personas sanas se mantiene dentro de límites fisiológicos2.
La fórmula siguiente refleja tal situación:
PaCO2 = producción / eliminación + CO2 inspirado
Como el CO2 inspirado es insignificante y la disminución en su producción es inusual, concluimos que cambios en la PaCO2 son consecuencia directa de su eliminación, que depende de la ventilación alveolar2.
La hipocapnia accidental puede aparecer en el paciente crítico por ventilación mecánica excesiva2; igualmente, en el abordaje prehospitalario de pacientes con traumatismo craneoencefálico (TCE), en quienes los valores absolutos y la duración de la hipocapnia se asocian con resultados adversos7. La hipocapnia inducida intencionalmente se observa en el manejo de pacientes con presión intracraneal (PIC) aumentada o neonatos con hipertensión arterial pulmonar (HAP)1.
En personas sanas, la hipocapnia, aunque sea marcada, no produce efectos adversos importantes2 y la isquemia cerebral no ocurre con PaCO2 > 20 mmHg3. Cuando es sintomática cursa con parestesias, palpitaciones, mialgias y convulsiones2. Estudios realizados en voluntarios humanos y animales sanos con hipocapnia intensa (PaCO2 < 15 mmHg) observaron alteraciones metabólicas y electroencefalográficas3. Un estudio encontró alteraciones electroencefalográficas y parestesias con PaCO2 < 20 mmHg, que se revertía administrando oxígeno hiperbárico, lo que indica que el origen podría ser isquémico3.
La hiperventilación fue descrita por Lundberg en 1950 como un medio para reducir la PIC elevada4, y desde entonces históricamente se ha aceptado su utilidad como herramienta terapéutica para pacientes con hipertensión intracraneal (HIC) severa, principalmente la relacionada con TCE severo4 y neonatos con HAP2, en quienes la inducción transitoria de hipocapnia genera cambios fisiológicos que podrían salvarles la vida. Algunos reportes describen reversión de signos clínicos de herniación, como pupilas fijas y dilatadas, tras hiperventilación agresiva4. Lo contrario ocurre con la hipocapnia prolongada en pacientes críticos, en los que se relaciona con pobres resultados clínicos y mal pronóstico8.
Definición
Como la hipocapnia se define por PaCO2 < 35 mmHg a nivel del mar5 y esta disminución se obtiene por aumento en la ventilación alveolar, la hiperventilación se considera sinónimo de hipocapnia9.
En la clasificación de su severidad10, es importante resaltar que los niveles normales de PaCO2 deben ser corregidos de acuerdo con la presión barométrica a diferentes altitudes9.
Tendencia a utilizar hiperventilación
Históricamente se ha pensado que la hiperventilación es benéfica para disminuir los efectos adversos de la HIC11, pero en 1991 Muizelaar reportó peores resultados en pacientes con TCE hiperventilados que en quienes se mantenía la PaCO2 en 25 mmHg7,11. Su utilización y su seguridad en el manejo de HIC han sido objeto de debate durante años12,13, pero continúa siendo un manejo común en la UCI para pacientes comatosos con cualquier tipo de lesión cerebral7.
La hipocapnia se usa ampliamente en adultos y niños que cursan con lesión cerebral aguda, incluso en fases tempranas, sin que aún se haya desarrollado HIC10. Destacamos que el uso por personal médico y paramédico persiste a pesar de los conocidos efectos deletéreos y la existencia de guías que recomiendan no utilizar esta medida14.
Escenario en adultos
Neumann et al15 analizaron los gases arteriales de 2.269 episodios de ventilación en pacientes con TCE, y encontraron que la hiperventilación profiláctica temprana en las primeras 24 h se implementó en el 54% de los casos. Además, la mayoría de los pacientes sin HIC presentaron hipocapnia significativa más del 50% del tiempo total de ventilación14,15. Por desgracia, en Estados Unidos la tendencia de los neurocirujanos a utilizar sistemáticamente hiperventilación profiláctica para manejar a los pacientes con TCE severo es del 36%10,14.
Escenario en niños
La hipocapnia aún se utiliza ampliamente en los pacientes pediátricos con lesión cerebral aguda, a pesar de las guías de trauma publicadas en el 200316, donde se recomienda evitarla por los efectos indeseables encontrados en esta población, que se considera la más susceptible al daño. En un análisis realizado por la Brain Trauma Foundation (BTF), encontraron que el 52% de los pacientes eran hiperventilados, y los menores de 2 años eran el grupo más preocupante, por la mayor incidencia de hipocapnia severa y riesgo de hemorragia intraventricular17. En un artículo publicado por Rebecca Curry16 en 2009, se analiza la incidencia de hipocapnia severa (PaCO2 < 30 mmHg) en la población pediátrica con TCE posterior a la publicación de las guías; se concluye que, aunque la medición de PaCO2fue más frecuente y la hipocapnia severa disminuyó, la incidencia permanece alta durante las primeras 48 h posteriores a la admisión hospitalaria, y el tiempo para medir PaCO2 fue más largo en los niños más pequeños, lo que se asocia con mayor hipocapnia y se convierte en predictor de mortalidad.
Escenario prehospitalario
En Michigan, casi el 50% de los médicos de emergencias utilizan sistemáticamente hiperventilación profiláctica en pacientes con TCE severo, además de que la hiperventilación accidental también es común18; esto genera hipocapnia severa (CO2 espirado < 30 mmHg) en el 70% de los pacientes transportados en helicóptero, lo que resulta en pacientes hipocápnicos desde el manejo prehospitalario admitidos a la UCI y ensombrece más el pronóstico10,18.
Efecto en el cerebro
La hipocapnia disminuye el volumen sanguíneo cerebral (VSC) como consecuencia indirecta de disminuir el flujo sanguíneo cerebral (FSC), pero la magnitud del efecto es limitada10. Estudios de tomografía por emisión de positrones (PET) demostraron que sólo el 30% del VSC se encuentra en las arterias19.
El potencial de reducción del FSC es de alrededor del 3% por cada mmHg modificado en la PaCO2 en la franja de 20-60 mmHg10, así que reducir la PaCO2 20-25 mmHg disminuye el FSC un 40-50%1.
El efecto en los vasos venosos es mínimo, y PET dinámicas han demostrado que los cambios en VSC inducidos por CO2 se generan por alteraciones en el volumen arterial, no en el arteriolar o el venoso20. El efecto neto es una disminución del 30% del FSC, y el VSC sólo disminuye un 7%10. Conseguir más hipocapnia produciría mayor deterioro del FSC, pero no más efecto en VSC y PIC, así que, para alcanzar una disminución importante en VSC, se debe disminuir el CO2 a niveles que comprometerían el FSC, lo cual en cerebros agudamente enfermos sacrificaría la perfusión tisular.
Está en discusión si la vasorreactividad está mediada por cambios en CO2 o en pH. Estudios recientes favorecen la teoría del pH con efectos en el músculo liso, preferentemente en las arterias de menor tamaño (arteriolas piales), consideradas más sensibles, y en lo cual están involucrados varios mecanismos moleculares (óxido nítrico, prostanoides vasoactivos, canales de potasio sensibles a adenosintrifosfato y canales de calcio)10,21,22.
Hipoxia e isquemia cerebral inducida por hipocapnia
Las áreas lesionadas presentan vasorreactividad aumentada al CO2, lo que agrava la lesión isquémica, porque el flujo es derivado desde áreas lesionadas hacia áreas normales. Además, la alcalosis hipocápnica genera broncoconstricción y atenúa la vasoconstricción pulmonar hipóxica, lo que resulta en disminución de la PaO2 23.
La curva de disociación de la oxihemoglobina se altera, y a cualquier PaO2 se desvía hacia la izquierda, se vuelve más afín a la hemoglobina y se dificulta la entrega de O2 a los tejidos24.
También se puede agravar la isquemia cerebral al aumentar la demanda de O2 por aumento de la excitabilidad neuronal25,26. Esto contribuye a una mayor utilización y depleción de glucosa, cambiando a un metabolismo anaerobio27. La hipocapnia aumenta la tasa metabólica cerebral de oxígeno en los TCE28 y prolonga la actividad convulsiva, lo que resulta en producción local de aminoácidos excitatorios citotóxicos asociados a convulsión, como N-metil-D-aspartato29.
Efecto en el cerebro neonatal
La hiperventilación es deletérea para el cerebro prematuro; está implicada en la lesión de la sustancia blanca y se la considera factor independiente de riesgo de leucomalacia periventricular, síndrome asociado con mortalidad neonatal significativa y déficit en el neurodesarrollo30,31.
Se ha observado en prematuros expuestos a periodos cortos de hipocapnia severa (PaCO2 < 15 mmHg) una asociación con anormalidades neurológicas a largo plazo, como pérdida auditiva neurosensorial10. Entre los factores predisponentes, se incluyen áreas vulnerables con pobre desarrollo vascular, depleción de antioxidantes por aminoácidos excitatorios y efecto de citocinas y lipopolisacáridos inducidos por sepsis, que potencian la destrucción de la sustancia blanca10,32.
Una suspensión abrupta de la hiperventilación se asocia con hiperemia reactiva, pues normalizar la PaCO2 genera vasodilatación cerebral y hemorragia intracraneal en prematuros2,33.
Utilidad en el traumatismo craneoencefálico
El TCE es la lesión más incapacitante en Estados Unidos, y actualmente el 2% de los estadounidenses viven con incapacidades secundarias8.
La justificación de utilizar hiperventilación en pacientes con TCE tiene un fundamento teórico en la doctrina de Monro-Kellie, la cual plantea que, puesto que el cráneo es una cavidad no expansible, los volúmenes de sus contenidos deben permanecer equilibrados, y si alguno se modifica, los otros deben modificarse con el fin de mantener constante la sumatoria de contenidos10. Sabemos que la cavidad craneana es un espacio cerrado donde sus tres componentes principales -tejido cerebral (80%), volumen sanguíneo (5%) y líquido cefalorraquídeo (LCR) (15%)- son importantes en la homeostasis del FSC, y cuando alguno aumente sin ser compensado por un cambio en cualquiera de los otros o cuando se supera el umbral de compensación, se genera una precipitada elevación de la PIC, con la consiguiente disminución del FSC10.
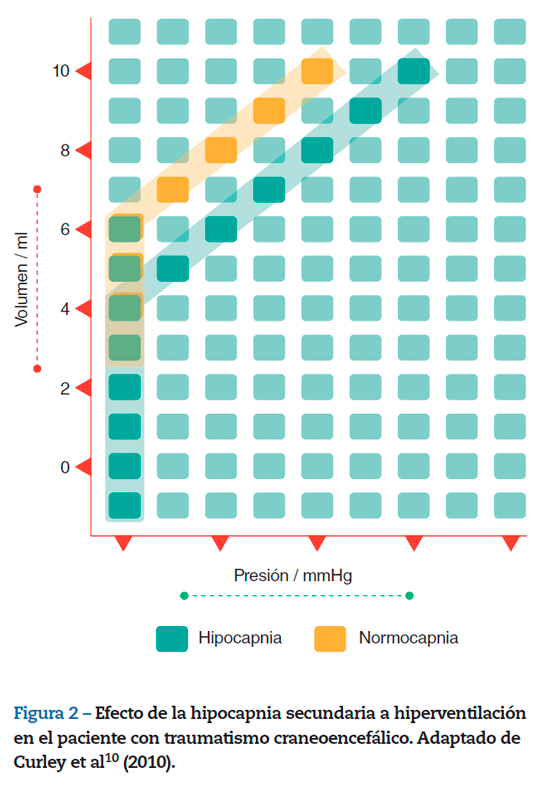
La hipocapnia es inducida para disminuir la PIC al generar vasoconstricción arterial cerebral y disminución del VSC10 (fig. 2).
En los TCE severos, se desarrolla edema cerebral en el 40% de los pacientes, y la HIC es una de las principales causas de muerte y discapacidad neurológica34. Sin embargo, el mecanismo de reducción de la PIC no es fisiológicamente inocuo, las primeras 24 h postraumáticas cursan con disminución del FSC, que expone al cerebro a sufrir isquemia secundaria a la hiperventilación agresiva10,11. Estudios de FSC postraumático indican que el FSC en las primeras 4-12 h disminuye a la mitad de lo normal35. Bouman et al36 encontraron que, dentro de las primeras 3 h de lesión, el FSC global/regional fue < 18 ml/100 g/min en el 31% de los pacientes, lo cual está por debajo del "umbral isquémico". Este flujo anormalmente bajo fue más común en el tejido cerebral dentro o alrededor de la lesión hemorrágica y subyacente al hematoma subdural agudo37. El Doppler transcraneal evidenció hasta en 2/3 de estos pacientes la presencia de FSC lento en forma temprana36,38.
Además, estudios en autopsias realizados por Graham et al39 encontraron cambios isquémicos en cerca del 90% de los pacientes fallecidos por TCE.
El estudio realizado por Muizelaar et al8 en pacientes con TCE moderado incluyó un grupo normocápnico y otro hipocápnico manteniendo PaCO2 en 35 y 25 mmHg respectivamente, con resultados a los 3 y 6 meses tras el traumatismo que revelaron pobres resultados en el grupo hiperventilado. Los centros donde se monitoriza saturación de O2 en vena yugular han observado que los valores bajos se pueden aumentar y el lactato medido en vena yugular se puede disminuir reduciendo el grado de hiperventilación40,41.
Efecto limitado de la hipocapnia
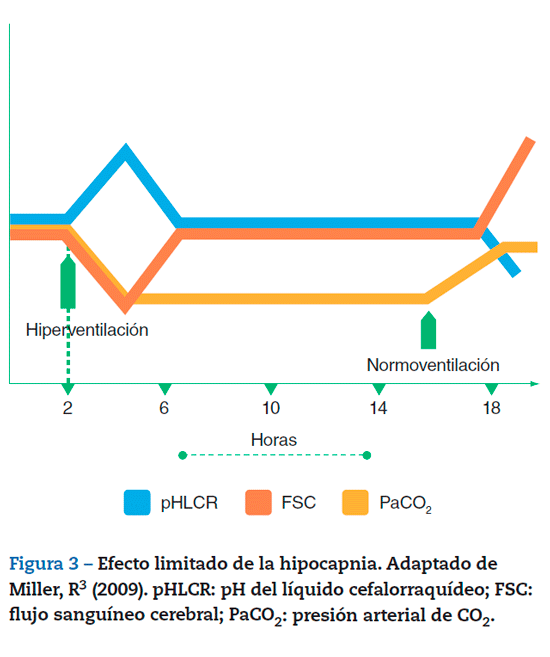
El efecto de la hipocapnia en el FSC no es persistente, sino que se va perdiendo progresivamente, y se debe a la pérdida del efecto en la PIC3. Una vez instaurada la hiperventilación, la hipocapnia y la alcalosis respiratoria resultantes elevan rápidamente el pH del LCR y del líquido extracelular del SNC, y como consecuencia el FSC disminuye. Durante la hipocapnia prolongada, el efecto es limitado por la acción de tampones que permiten que el pH del LCR vuelva a valores normales, y de esta forma el FSC se normaliza. El efecto tampón es un proceso bifásico; en primer lugar, la alcalosis generada por la hipocapnia estimula la salida de iones cloruro desde el líquido intracelular hacia el extracelular intercambiándose con bicarbonato; este mecanismo se conoce como buffer tisular y ocurre de manera casi inmediata. En segundo lugar, ocurre la respuesta renal, que se da por la inhibición de la reabsorción tubular de bicarbonato y de la secreción de hidrogeniones en el túbulo proximal; este proceso puede instaurarse en minutos y durar de horas a días. Como consecuencia, se logra normalizar el pH del LCR, y el FSC regresa a niveles normales en un periodo de 6 h, incluso si la PaCO2 permanece disminuida10. Hace cuatro décadas, se evidenció en voluntarios sanos que una reducción sostenida de 20 mmHg en la PaCO2 disminuía inmediatamente el FSC un 40%, mientras que a las 4 h el FSC se restauraba a un 90% del normal42.
Está bien descrita la elevación de rebote en la PIC después de restaurar la normocapnia, y esto se debe a que el aumento de la PaCO2 disminuye el pH del LCR que estaba normalizado por acción de los tampones. Esta acidosis respiratoria ocasiona un aumento del FSC, con la consecuente hiperemia de rebote10 (fig. 3).
Recomendaciones de la Brain Trauma Foundation
La BTF43 considera que no existen suficientes datos en la literatura para que la hiperventilación en TCE tenga un nivel de recomendación I.
La hiperventilación profiláctica (PaCO2 < 25 mmHg) en TCE no está recomendada. Estudios que midieron FSC utilizando xenón y termodifusión35,36,44 han evidenciado FSC peligrosamente disminuido tras el TCE y hasta por 48 h (nivel de recomendación II).
Se recomienda la hiperventilación como medida temporal para reducir la PIC elevada (nivel de recomendación III).
Conceptúan que la hiperventilación se debe evitar durante las primeras 48 h tras el TCE, ya que en ese momento el FSC frecuentemente está disminuido en forma crítica. Y recomiendan que si se utiliza, hay que realizar mediciones de SvjO2 y presión tisular cerebral de oxígeno (PbrO2), con el fin de monitorizar la entrega de oxígeno. Por tal razón, limitar el uso de hiperventilación posterior a TCE severo puede ayudar a mejorar la recuperación neurológica seguida del trauma, o por lo menos evitar una isquemia cerebral iatrogénica.
Otros efectos de la hipocapnia
La mayoría de los efectos sistémicos de la hiperventilación resultan de la alcalosis producida por disminución de PaCO2, y esto se ha documentado a nivel cerebral, pulmonar, cardíaco, placentario y tejidos periféricos45.
Disfunción psicomotora postoperatoria
El potencial de la hipocapnia, incluso por corto tiempo, de causar deterioro cognitivo se documenta claramente en el postoperatorio. Pacientes sanos sometidos a hipocapnia manifiestan función psicomotora deteriorada hasta por 48 h posoperatorias, más marcadamente en pacientes ancianos, que son más susceptibles y vulnerables a sus consecuencias, y les ocurre incluso con hipocapnias menos severas2,10. Además puede deteriorar la atención y el aprendizaje y generar cambios de personalidad que, aunque prolongados, son reversibles46.
Pulmón
La hipocapnia aumenta la resistencia de la vía aérea por broncospasmo y aumenta la permeabilidad en la microvasculatura2. Más del 20% de los pacientes con TCE tienen lesión pulmonar aguda (ILA) y contraen síndrome de dificultad respiratoria del adulto (SDRA), lo cual empeora el pronóstico. Por desgracia, se continúa hiperventilándolos, a pesar de conocerse la asociación entre volumen corriente alto y mortalidad en SDRA10.
La hipocapnia atenúa la vasoconstricción pulmonar hipóxica, empeora el cortocircuito intrapulmonar y deteriora la oxigenación sistémica2. Además, contribuye a ILA porque el volumen corriente alto lesiona directamente el pulmón10,47.
Sistema cardiovascular
En él los efectos comprenden principalmente alteraciones en oxigenación miocárdica y ritmo cardíaco2.
Isquemia miocárdica. La hipocapnia aguda disminuye la entrega miocárdica de oxígeno mientras aumenta la demanda, esto último por varios mecanismos (aumento de contractilidad miocárdica, frecuencia cardíaca y resistencia vascular sistémica)2,10. También está demostrado que facilita la trombosis, por aumento del número de plaquetas y de la agregación plaquetaria. Como consecuencia de estos efectos, ocurre franco espasmo coronario que resulta en angina variante, la cual característicamente se presenta con la hiperventilación espontánea48.
Arritmias cardíacas. La hipocapnia se asocia con desarrollo de arritmias en pacientes tanto críticos como con trastorno de pánico3. Incluyen arritmias auriculares paroxísticas y rara vez taquicardia ventricular o fibrilación ventricular10. Los efectos son secundarios a isquemia, pero también se asocia un efecto miocárdico directo.
Placenta y el feto. En la embarazada, la PaCO2 se mantiene 10 mmHg por debajo de los valores normales. Este estado fisiológico se acompaña de disminución en la concentración de bicarbonato, que se normaliza rápidamente tras el parto. Sin embargo, una disminución mayor, incluso por cortos períodos, podría tener importantes efectos adversos en el feto (disminución PaO2 fetal, aumento en déficit de base, bajo Apgar y demora en iniciar la respiración rítmica)49. La alcalosis asociada con la hipocapnia disminuye la perfusión placentaria, reduce la presión de oxígeno en la vena umbilical y estimula espasmo reflejo de la vena umbilical2,49.
Utilidad actual de la hipocapnia en lesión cerebral aguda
-Herniación cerebral inminente. Existe una fuerte razón fisiológica en el uso breve de hipocapnia para reducir agudamente la PIC. Aunque la evidencia es limitada, la rapidez de la inducción y su efecto inmediato en el FSC la convierten en una estrategia útil mientras se instauran medidas definitivas.
- Uso intraoperatorio durante neurocirugía. En esta situación se utiliza para facilitar el acceso quirúrgico y reducir agudamente el edema cerebral. Esto se demostró en un estudio aleatorizado prospectivo en pacientes con tumores supratentoriales; la hiperventilación durante 20 min logró disminuir el edema cerebral y la PIC50.
Una vez se instaura la hipocapnia, se debe restaurar la normocapnia tan pronto como sea posible, ya que se vuelve ineficaz en horas y genera daño al ocasionar hiperemia de rebote cuando se normaliza la PaCO210.
Conclusiones
Actualmente la recomendación para utilizar hipocapnia está limitada a casos especiales, ya que está comprobado su efecto dañino no sólo para el cerebro, sino para otros órganos donde la perfusión se compromete. La hiperventilación no debe ser una maniobra rutinaria en anestesiología, y menos en neuroanestesiología; las guías actuales están en contra de la hiperventilación profiláctica, y la evidencia disponible indica que puede resultar en isquemia, especialmente cuando el FSC basal está disminuido, como ocurre en las primeras 24 h después de un TCE.
Cuanto más severa sea la hipocapnia y mayor su duración, la posibilidad de daño aumenta. Por lo tanto, utilizar hipocapnia leve a moderada por períodos cortos (20 min) limita el daño y disminuye la posibilidad de causar hiperemia de rebote, con lo que se evita perder la posibilidad de usarla como rescate cuando sea necesaria.
Como cualquier intervención terapéutica, la hiperventilación debe tener una indicación clara (PIC elevada con inminencia de herniación y/o la necesidad de mejorar las condiciones del campo quirúrgico). Así que se debe usar teniendo en cuenta su potencial de daño, sólo por corto tiempo mientras se instauran medidas definitivas para controlar la PIC y, tan pronto su indicación haya cesado, normalizar inmediatamente la PaCO2.
Financiación
Recursos propios de los autores.
Conflicto de intereses
Ninguno declarado.
Referencias
1. Curley G, Laffey J, Kavanagh B. Bench-to-beside review: Carbon dioxide. Crit Care. 2010;14:220. [ Links ]
2. Laffey J, Kavanagh B. Hypocapnia. N Engl J Med. 2002. [ Links ]
3. Miller R. Miller's Anesthesia. 7.a ed. 2009. [ Links ]
4. Marion D, Puccio A, Wisniewski S. Effect of hyperventilation on extracellular concentrations of glutamate, lactate, and local cerebral blood flow in patients with severe traumatic brain injury. Crit Care Med. 2002;30:2619-25. [ Links ]
5. Patiño F, Celis E. Fisiología de la respiración e insuficiencia respiratoria aguda. 7.a ed. 2005. [ Links ]
6. Marino P. The UCI book. 3.a ed. Capítulo 2. 2007. [ Links ]
7. Ghajar J, Hariri R, Narayan R. Survey of critical care management of comatose, head-injured patients in the United States. Crit Care Med. 1995;23:560-7. [ Links ]
8. Muizelaar JP, Marmarou A, Ward JD. Adverse effects of prolonged hyperventilation in patients with severe head injury. J Neurosurg. 1991;75:731-9. [ Links ]
9. Stocchetti N, Maas A, Chieregato A. Hyperventilation in head injury. Chest. 2005;127:1812-27. [ Links ]
10. Curley G, Kavanagh B, Laffey J. Hypocapnia and the injured brain: More harm than benefit. Crit Care Med. 2010. [ Links ]
11. Caulfield E, Dutton R, Floccare D. Prehospital hypocapnia and poor outcome after severe traumatic brain injury. J Trauma. 2009;66:1577-83. [ Links ]
12. Carmona Suazo JA, Maas AIR, Van den Brink. CO2 reactivity and brain oxygen pressure monitoring in severe head injury. Crit Care Med. 2000;28:3268-74. [ Links ]
13. Skippen P, Seear M, Poskitt K. Effect of hyperventilation on regional cerebral blood flow in head-injured children. Crit Care Med. 1997;25:1402-9. [ Links ]
14. Marion DW, Spiegel TP. Changes in the management of severe traumatic brain injury: 1991-1997. Crit Care Med. 2000;28:16-8. [ Links ]
15. Neumann JO, Chambers IR, Citerio G. The use of hyperventilation therapy after traumatic brain injury in Europe. Intensive Care Med. 2008;34:1676-82. [ Links ]
16. Curry R, Hollingworth W, Richard G. Incidence of hypo- and hypercarbia in severe traumatic brain injury before and after 2003 pediatric guidelines. Pediatr Crit Care Med. 2008;9:141-6. [ Links ]
17. Brain Trauma Foundation. Use of hyperventilation in the acute management of severe pediatric traumatic brain injury. Pediatr Crit Care Med. 2003;4:45-7. [ Links ]
18. Huizenga JE, Zink B, Maio R. The penetrance of head injury management guidelines into the practice patterns of Michigan emergency physicians. Acad Emerg Med. 2000;7:1171. [ Links ]
19. Ito H, Kanno I, Iida H. Arterial fraction of cerebral blood volume in humans measured by positron emission tomography. Ann Nucl Med. 2001;15:111-6. [ Links ]
20. Ito H, Ibaraki Kanno I, Fukuda H, Miura S. Changes in the arterial fraction of human cerebral blood volume during hypercapnia and hipocapnia measured by positron emission tomography. J Cereb Blood Flow Metab 2005;25:852-857. [ Links ]
21. Kontos HA, Raper AJ, Patterson JL. Analysis of vasoactivity of local pH, PCO2 and bicarbonate on pial vessels. Stroke. 1977;8:358-60. [ Links ]
22. Ozan A. Optimizing the intraoperative management of carbon dioxide concentration. Curr Opin Anaesthesiol. 2006;19:19-25. [ Links ]
23. Domino KB, Emery MJ, Swenson ER, et al. Ventilation heterogeneity is increased in hypocapnic dogs. Respir Physiol. 1998;111:89-100. [ Links ]
24. Nunn JF. Applied respiratory physiology. 3.a ed. London: Butterworths; 1987. [ Links ]
25. Huttunen J, Tolvanen H, Heinonen E, et al. Effects of voluntary hyperventilation on cortical sensoryresponses. Electroencephalographic and magnetoencephalographic studies. Exp Brain Res. 1999;125:248-54. [ Links ]
26. Davis D. Early ventilation in traumatic brain injury. Resuscitation. 2008;76:333-40. [ Links ]
27. Samra SK, Turk P, Arens JF. Effect of hipocapnia on local cerebral glucose utilization in rats. Anesthesiology. 1989;70:523-6. [ Links ]
28. Coles JP, Fryer TD, Coleman MR, et al. Hyperventilation following head injury: Effect on ischemic burden and cerebral oxidative metabolism. Crit Care Med. 2007;35:568-78. [ Links ]
29. Graham EM, Apostolou M, Mishra OP, Delivoria-Papadopoulos M. Modification of the N-methyl-D-aspartate receptor in the brain of newborn piglets following hyperventilation induced ischemia. Neurosci Lett. 1996;218:29-32. [ Links ]
30. Ikonen RS, Janas MO, Koivikko MJ, Laippala P, Kuusinen EJ. Hyperbilirubinemia, hypocarbia and periventricular leukomalacia in preterm infants. Acta Paediatr. 1992;81:802-7. [ Links ]
31. Wiswell TE, Graziani LJ, Kornhauser MS, Stanley C, Merton DA, McKee L, et al. Effects of hypocarbia on the development of cystic periventricular leukomalacia in premature infants treated with high frequency jet ventilation. Pediatrics. 1996;98:918-24. [ Links ]
32. Yoon BH, Romero R, Kim CJ, Koo JN, Choe G, Syn HC, et al. High expression of tumour necrosis factor a and interleukin6 in periventricular leukomalacia. Am J Obstet Gynecol. 1997;177:406-11. [ Links ]
33. Gleason CA, Short BL, Jones D. Cerebral blood flow and metabolism during and after prolonged hypocapnia in newborn lambs. J Pediatr. 1989;115:309-14. [ Links ]
34. Narayan RK, Kishore PRS, Becker DP, Ward JD, Enas GG, Greenberg RP, et al. Intracranial pressure: to monitor or not to monitor. J Neurosurg. 1982;56:650-9. [ Links ]
35. Marion DW, Darby J, Yonas H. Acute regional cerebral blood flow changes caused by severe head injuries. J Neurosurg. 1991;74:407-14. [ Links ]
36. Bouma GJ, Muizelaar JP, Stringer WA, Choi SC, Fatouros P, Young HF. Ultra-early evaluation of regional cerebral blood flow in severely head-injured patients using xenon-enhanced computerized tomography. J Neurosurg. 1992;77:360-8. [ Links ]
37. Heiss WD, Rosner G. Functional recovery of cortical neurons as related to degree and duration of ischemia. Ann Neurol. 1983;14:294-301. [ Links ]
38. Van Santbrink H, Schouten JW, Steyerberg EW, et al. Serial transcranial Doppler measurements in traumatic brain injury with special focus on the early posttraumatic period. Acta Neurochir. 2002;144:1141-9. [ Links ]
39. Graham DI, Lawrence AE, Scott G, et al. Brain damage in fatal non-missile head injury without high intracranial pressure. J Clin Pathol. 1988;41:34-7. [ Links ]
40. Bouma GJ, Muizelaar JP, Choi SC, Newlon PG, Young HF. Cerebral circulation and metabolism after severe traumatic brain injury. J Neurosurg. 1991;75:685-93. [ Links ]
41. Gopinath SP, Robertson CS, Contant CF, Hayes C, Feldman Z, Narayan RK, et al. Jugular venous desaturation and outcome after head injury. J Neurol Neurosurg Psychiatry. 1994;57:717-23. [ Links ]
42. Raichle ME, Posner JB, Plum F. Cerebral blood flow during and after hyperventilation. Arch Neurol. 1970;23:394-403. [ Links ]
43. Guidelines for the Management of Severe Traumatic Brain Injury 2007. A Joint project of the Brain Trauma Foundation. Journal of Neurotrauma. [ Links ]
44. Sioutos PJ, Orozco JA, Carter LP, Weinand ME, Hamilton AJ, Williams FC. Continuous regional cerebral cortical blood flow monitoring in head-injured patients. Neurosurgery. 1995;36:943-9. [ Links ]
45. Newell DW, Weber JP, Watson R, Aaslid R, Winn HR. Effect of transient moderate hyperventilation on dynamic cerebral autoregulation after severe head injury. Neurosurgery. 1996;39:35-44. [ Links ]
46. Hovorka J. Carbon dioxide homeostasis and recovery after general anaesthesia. Acta Anaesthesiol Scand. 1982;26: 498-504. [ Links ]
47. Laffey JG, Engelberts D, Duggan M, Veldhuizen R, Lewis JF, Kavanagh B. Carbon dioxide attenuates pulmonary impairment resulting from hyperventilation. Crit Care Med. 2003;31:2634-40. [ Links ]
48. Hisano K, Matsuguchi T, Ootsubo H, Nakagaki O, Tomoike H, et al. Hyperventilation-induced variant angina with ventricular tachycardia. Am Heart J. 1984;108:423-5. [ Links ]
49. Cook PT. The influence on foetal outcome of maternal carbon dioxide tension at caesarean section under general anaesthesia. Anaesth Intens Care. 1984;12: 296-302. [ Links ]
50. Gelb AW, Craen RA, Rao GS, Reddy KRM, Megyesi J, Mohanty B, et al. Does hyperventilation improve operating condition during supratentorial craniotomy? Anesth Analg. 2008;106:585-94. [ Links ]











 texto en
texto en