Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.40 no.4 Bogotá Oct./Dec. 2012
https://doi.org/10.1016/j.rca.2012.05.001
http://dx.doi.org/10.1016/j.rca.2012.05.001
Revisión
La monitorización neuromuscular y su importancia en el uso de los bloqueantes neuromusculares
Joaquín Fabregat López *, César Augusto Candia Arana y Caridad Greta Castillo Monzón
Médico Especialista en Anestesiología y Reanimación, Departamento de Anestesia y Reanimación, Complejo Hospitalario Universitario de Cartagena, Murcia, España.
* Autor para correspondencia. Departamento de Anestesia y Cuidados Perioperatorios. Complejo Hospitalario Universitario Santa Lucia/Santa Maria del Rosell Cartagena, Murcia, Spain. C/ Mezquita, s/n, Paraje Los Arcos, 30202, Santa Lucía, Cartagena, Spain. Tel.: +968128600x951569; fax: +968128633.
Correo electrónico: kinoyo@hotmail.com (J. Fabregat López).
© 2012 Publicado por Elsevier España, S.L. en nombre de Sociedad Colombiana de Anestesiología y Reanimación.
INFORMACIÓN DEL ARTÍCULO
Historia del artículo: Recibido el 14 de enero de 2012 Aceptado el 11 de abril de 2012
On-line el 5 de julio de 2012
Resumen
Introducción: La necesidad por incorporar nuevas guías o estrategias en la buena práctica de uso de los bloqueantes neuromusculares no es un hecho de obligado cumplimento en la actualidad dentro de la anestesiología. Solo existen recomendaciones de actuación con el propósito de convencer que la monitorización neuromuscular es una herramienta muy útil para el buen uso racional de los bloqueantes neuromusculares.
Metodología: Las complicaciones surgen, y la parálisis residual es un evento destacado. Por esta razón, los autores propugnamos que la monitorización del bloqueo neuromuscular puede ser un factor determinante en la mejora del cuidado de nuestros pacientes, disminuyendo tanto la morbilidad como la mortalidad. Esta revisión y su metodología en base a la experiencia de los autores solo pretende exponer de forma sencilla conocimientos que consideramos básicos para su utilización sistemática en nuestra práctica rutinaria. Resultados y conclusiones: Esta actualización describe los principios fundamentales de los métodos que disponemos en la actualidad, priorizando las medidas cuantitativas de registro. Y también demuestra el diferente comportamiento de la musculatura al efecto de los bloqueantes neuromusculares, fundamentos relevantes que es preciso conocer. La monitorización neuromuscular es una práctica que debe utilizarse siempre que un bloqueo neuromuscular sea necesario. Somos conscientes que generar una recomendación explícita es difícil. Pero nuestro entusiasmo parte del beneficio de una experiencia personal con estos métodos que son conocidos desde antiguo. Debido a la potencial morbilidad asociada con bloqueos neuromusculares residuales, la monitorización perioperatoria de la función neuromuscular es esencial.
Palabras clave:Bloqueantes neuromusculares, Miografía, Anestesia, Parálisis.
© 2012 Publicado por Elsevier España, S.L. en nombre de Sociedad Colombiana de Anestesiología y Reanimación.
Abstract
Introduction: The incorporation of new guidelines or strategies as part of good practices in the use of muscle relaxants is not a requirement at present in the practice of anesthesia. There are only action recommendations designed to persuade clinicians of the fact that neuromuscular monitoring is a very useful tool for the rational use of muscle relaxants. Methodology:Complications occur, and residual paralysis is a significant event. For this reason, the authors advocate that monitoring neuromuscular block may be a determining factor in improving patient care and reducing morbidity and mortality. This review and its methodology based on the experience of the authors is designed to present, in a simple format, the knowledge that considered fundamental for the systematic use of neuromuscular monitoring in every day practice.
Results and conclusions: This update describes the fundamental principles of the methods available at present, emphasizing quantitative recording measurements. It then describes the different ways in which muscles respond to the effect of neuromuscular blockade, as these are critical fundamental principles that have to be known. Neuromuscular monitoring is a practice that should be implemented every time a neuromuscular block is required. We are aware of the difficulty of generating an explicit recommendation, but our enthusiasm is derived from the benefits we have personally experienced when applying these methods that have been known for a long time. Due to the potential morbidity associated with residual muscle relaxation, perioperative monitoring of neuromuscular function is essential.
Keywords: Neuromuscular blocking agents, Myography, Anesthesia Paralysis.© 2012 Published by Elsevier España, S.L. on behalf of Sociedad Colombiana de Anestesiología y Reanimación.
Introducción
Metodología de la revisión bibliográfica
Gracias a los trabajos de Beecher y Todd en 19541 -que publicaron la toxicidad de la d-tubocurarina (dTc) y la mortalidad derivada de su uso con respecto a los pacientes que no la recibían-, un grupo de autores como Christie y ChurchillDavidson sugirieron en 1958 el uso de un neuroestimulador como una herramienta en el diagnóstico de la apnea prolongada después del uso de un bloqueante neuromuscular. Estos investigadores popularizaron la observación de la respuesta del adductor pollicis (AP) estimulado por el nervio cubital en la muñeca2. Estas prácticas deben ser recordadas como «antiguas editoriales». «El único método satisfactorio de determinar un grado de bloqueo neuromuscular es estimular un nervio motor con una corriente eléctrica y observar el grado de contracción de los músculos inervados por ese nervio.3» La razón por la que la monitorización neuromuscular (MNM) no ha recibido la aceptación en la práctica clínica es un reflejo de la discrepancia entre lo que la literatura recomienda y lo que los clínicos podemos medir. Muchos anestesiólogos no monitorizan la función neuromuscular, o no saben interpretar correctamente sus resultados. Realmente no estamos convencidos de los beneficios que aporta la MNM4. Si añadimos que estamos todavía en la búsqueda de un monitor fácil de usar, barato y seguro, no es extraño afirmar que el uso de un neuroestimulador es más una excepción que una regla en cualquier servicio de anestesia. Podemos afirmar que la parálisis residual (PR) es una lección que no hemos aprendido, que nos cuesta aprender y a la que no damos el valor que se merece5.
Metodología de la revisión bibliográfica
Basada en la experiencia personal de los autores y en la búsqueda en PubMed de las siguientes expresiones: «neuromuscular monitoring / neuromuscular block/degree o muscle relaxation / residual paralysis/adductor pollicis muscle / corrugator supercilii muscle / mechanomyography / acceleromyography / electromyography / fade / twitch stimulation / train of four TOF / train of four ratio / post-tetanic count (PTC) / tetanus / normalization of the TOF/TOF-watch / intubation / guidelines».
Las guías de consenso deben demostrar su utilidad en las situaciones en que son necesarias, y el objetivo fundamental es mejorar los resultados. Después de más de 50 años desde la introducción de un estimulador nervioso periférico, su utilidad todavía sigue siendo discutida. La valoración de la función neuromuscular según el ASA Task Force on Postanesthetic Care solo incluye de forma ocasional la MNM6. La población científica trata de convencer: solo estamos en el camino de la mera recomendación, no es una norma de obligado cumplimento. La MNM necesita una curva de aprendizaje y capacitación. Existen factores intrínsecos de naturaleza técnica que hay que conocer. Los anestesiólogos implicados en esta materia debemos saber comunicar con espíritu crítico el verdadero sentido de este método. La evidencia en este campo es limitada. Los metaanálisis controlados y aleatorizados son pieza fundamental para crear evidencia científica, pero la opinión de expertos es también parte importante en el camino alternativo a la toma de decisiones7. Nuestra revisión trata de transmitir la experiencia personal de los autores. Detallamos primero los patrones de estimulación (estímulo supramaximal) y ponemos más énfasis en medidas de registro como la aceleromiografía (ACM), el método más usado en la actualidad por su fácil instalación. Para la visión práctica de la monitorización consideramos como factor primordial la estabilización de la señal para que la contracción muscular sea constante y de fácil interpretación. Finalmente, la relevancia clínica de la PR, su diagnóstico y las medidas para su tratamiento. La MNM es una práctica basada en la evidencia que debe utilizarse siempre que se precise un bloqueo neuromuscular8.
Razones para el uso de un monitor de la función muscular
La MNM es una buena guía cuando es preciso administrar un bloqueante neuromuscular, pues mejora significativamente la calidad de la intubación y disminuye las lesiones en la vía aérea9. También es útil para mantener un bloqueo neuromuscular adecuado. También es de gran utilidad en el diagnóstico de la PR. Incluso con un bloqueante neuromuscular no despolarizante (NDP) de duración intermedia se produce PR10. Solo la monitorización mediante un método objetivo puede eliminar la PR11. Las respuestas evocadas no requieren la cooperación del paciente.
La MNM informa sobre el grado de bloqueo neuromuscular únicamente en el músculo paralizado. Existen diferencias sustanciales entre los diversos grupos musculares. El músculo AP no refleja el bloqueo neuromuscular de la musculatura laríngea. Para la cirugía de tórax o abdominal donde se necesite profunda relajación, una segunda opción es monitorizar un músculo con similar comportamiento a la musculatura diafragmática y laríngea, como es el músculo corrugator supercilii (CSC)12. Para la extubación, en cambio, se prefiere monitorizar el AP, al ser un músculo más sensible. Una recuperación completa del AP descarta cualquier problema de PR13.
Métodos de valoración de la función neuromuscular
La MNM es una maniobra sencilla y rápida, pero debemos tener en cuenta una serie de aspectos si queremos que además sea fiable.
Principios de neuroestimulación (corriente supramaximal)
En la valoración muscular es determinante la amplitud de la estimulación del nervio. La reacción de la unión neuromuscular ante un estímulo eléctrico es del tipo «todo o nada», es decir, puede contraerse o no, pero cuando se contrae lo hace al máximo. Durante una estimulación nerviosa la fuerza de la contracción muscular aumenta conforme se incrementa la intensidad del estímulo hasta alcanzarse una fase de meseta cuando el estímulo es lo suficientemente intenso para activar todos los axones. Se obtiene entonces la intensidad supramáxima y la respuesta muscular no aumenta más aunque se incremente la intensidad del estímulo (esta intensidad varía dependiendo de los nervios y de los pacientes). Una estimulación supramáxima es requisito previo indispensable para garantizar que la respuesta muscular registrada dependa de forma exclusiva del grado de bloqueo neuromuscular.
Sitios de la monitorización neuromuscular
El sitio ideal de estimulación es aquel que sea más accesible durante la cirugía y cuya respuesta muscular pueda ser identificada de forma clara y sin errores. El músculo mejor estudiado es el AP. Es una buena herramienta como marcador de los aspectos más importantes de la función neuromuscular, como es la recuperación de la relajación muscular.
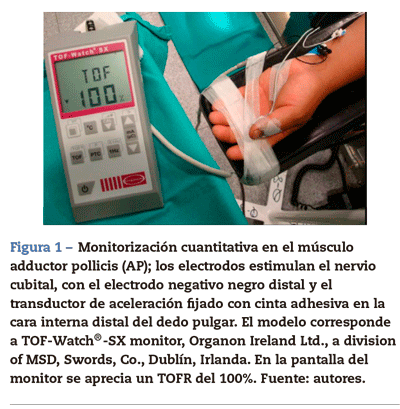
El grado de parálisis puede ser bien cuantificado por la valoración de la respuesta del AP (fig. 1). Si queremos monitorizar el AP, debemos estimular el nervio cubital: los electrodos se pegan en el lado palmar de la muñeca en la superficie de la piel a lo largo del trayecto del nervio cubital. El área de contacto de los electrodos de estimulación no debe exceder un diámetro de 7-11 mm. La gran mayoría de los conocimientos sobre farmacología de los bloqueantes neuromusculares NDP se debe a este «grupo nervio-músculo». Cuando no se obtiene acceso a los miembros superiores, se puede monitorizar la respuesta muscular a la estimulación del nervio facial.
Valoración táctil y visual
En la práctica habitual muchos anestesistas trabajan con evaluación táctil y visual del grado del bloqueo neuromuscular por medio de la estimulación de los nervios periféricos. Si bien se trata de un procedimiento sencillo, pues las respuestas se aprecian a simple vista y solo hay que contarlas, a este método le falta precisión, ya que la interpretación de las respuestas es subjetiva. Podemos contar y sentir debilitamiento, pero existe cierta incapacidad en calcular con seguridad la diferencia de la fuerza de contracción entre respuestas sucesivas. Incluso en pacientes conscientes la seguridad de los test clínicos es limitada y no excluyen con certeza PR14.
Medidas de registro de la respuesta muscular, monitorización cuantitativa
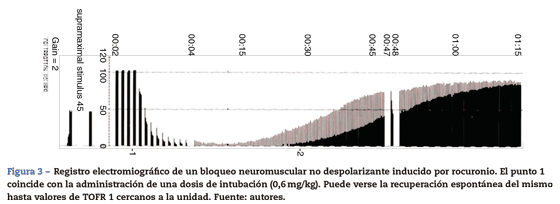
Esta evaluación puede ser medida con métodos cuantitativos de registro, tales como la mecanomiografía (MMG), que mide la contracción isométrica del AP en respuesta a la estimulación del nervio cubital15. La electromiografía (EMG) registra los potenciales de acción musculares producidos por la estimulación eléctrica de un nervio motor periférico. Un ejemplo de EMG es el Relaxograph NMT Monitor (Datex Instrumentarium Corp., Helsinki, Finlandia), que mide T1, train of four (TOF) y train offour ratio (TOFR) (figs. 2 y 3).
Aceleromiografía
La ACM (fig. 1) es una buena solución a las dificultades técnicas y comerciales de los métodos clásicos: registra la aceleración isotónica de un músculo (p.ej., el pulgar) en respuesta al estímulo de un nervio motor periférico. Fue descrita por Viby-Mogensen et al.16. La ACM puede ser aplicada en todos aquellos músculos cuyo movimiento o aceleración ante un estímulo eléctrico puedan ser evocados. Se basa en la segunda ley de Newton: la fuerza es igual a la masa por la aceleración (F = M x A). Si la masa del pulgar permanece constante, la aceleración será directamente proporcional a la fuerza. Cuando el pulgar responde a un estímulo con una respuesta, se produce una señal eléctrica proporcional a la aceleración generada. Las ventajas son muchas: consigue una medida objetiva de la función neuromuscular en tiempo real, la calibración es rápida y no necesita precarga ni especial inmovilización de la mano. El coste es bajo. El sensor de aceleración se fija con cinta adhesiva en la cara interna distal del pulgar, que debe tener movilidad libre, sin obstáculo. El modelo TOF-Watch®-SX (TOF-Watch®-SX monitoring software, Organon Ireland Ltd., a division of Merck and Co., Inc., Swords, Co., Dublín, Irlanda) permite la captura mediante un ordenador de las respuestas evocadas mediante un cable de fibra óptica y un excelente programa (TOF-Watch®-SX Monitor, versión 2.2 INT, Organon) que permite valorar los datos en tiempo real.
Práctica de la monitorización: interpretación de un bloqueo neuromuscular no despolarizante
La característica fundamental del bloqueo neuromuscular NDP es el «fenómeno de debilitamiento» (fade). La expresión gráfica, como veremos, es el TOFR, que consiste en la desaparición gradual de las respuestas tras la estimulación repetitiva en el paciente curarizado. Visualmente se observa una disminución de la fuerza de la contracción muscular. Desde un punto de vista fisiológico es preciso conocer el mecanismo de acción a nivel de los receptores de la placa motora, ya que los 2 fenómenos son la representación de mecanismos de acción diferentes según el lugar de acción. Así, la inhibición o bloqueo de la primera respuesta del TOF depende de una acción antagonista competitiva sobre el receptor nicotínico postsináptico (αβδε). El fenómeno de debilitamiento es el reflejo del bloqueo mediado fundamentalmente por el receptor nicotínico presináptico (αЗβ2)17.
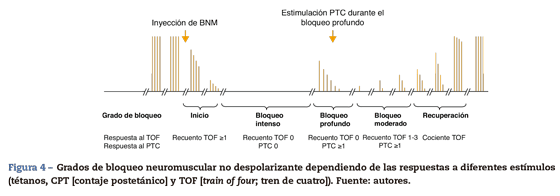
Grados de bloqueo neuromuscular no despolarizante18
Bloqueo intenso
Es el bloqueo neuromuscular inducido inmediatamente después de la administración de un bloqueante neuromuscular no despolarizante (BNMND) (dosis de intubación), no existe respuesta a estímulos simples evocados tras un estímulo tetánico (fig. 4).
Bloqueo profundo
Es la fase que sigue después de un bloqueo intenso. No existe respuesta al TOF. Empieza con respuestas a estímulos simples sucesivos a un estímulo tetánico (llamada cuenta postetánica) y termina con la aparición de la primera respuesta al TOF.
Bloqueo moderado
Se define como el período desde la aparición de la primera respuesta hasta la cuarta respuesta del TOF.
Fase de recuperación
Fase de aparición de la cuarta respuesta del TOF y establecimiento del TOFR.
Tipos de estímulos
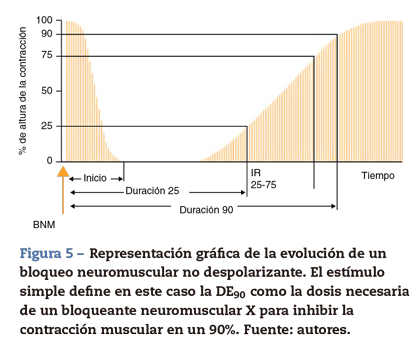
Estímulo simple
Consiste en la aplicación de estímulos supramáximos sobre un nervio motor periférico a una frecuencia que oscila entre 1 Hz (un estímulo cada segundo) y 0,1 Hz (un estímulo cada 10 s) (fig. 5). El estímulo simple es útil como una herramienta Dosis eficaz (DE90) = 90% de reducción de la fuerza de contracción para estudiar la farmacodinamia de los bloqueantes neuromusculares. Si después de la administración de 0,3 mg/kg de un BNMND se reduce la altura del estímulo único en un 90% sobre un valor control en un paciente concreto, a una frecuencia de 0,10 Hz podemos decir que la dosis administrada es la DE90 (dosis efectiva para producir un 90% de inhibición de la contracción). Es necesario realizar una medición previa a la administración de un bloqueante neuromuscular para poder calibrar la respuesta correctamente; de esta forma los cambios con respecto al control establecen el comienzo de acción (CA) del bloqueo neuromuscular. A veces el nivel de control previo no está disponible y no es posible comparar o valorar la debilidad muscular en el postoperatorio. En grados superficiales de curarización o cuando se trata de evaluar efectos residuales, la respuesta muscular al estímulo único es de escasa significación, pues puede provocar contracciones de similar amplitud a las observadas durante el período control. Idealmente debemos tener la posibilidad de estimar cuantitativamente el grado de bloqueo neuromuscular sin la necesidad de una respuesta control, sobre todo si sospechamos PR.
Tren de cuatro (train of four)
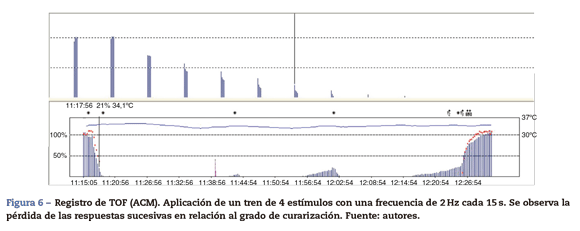
El tren de cuatro, train offour o TOF es el método estándar de la MNM (fig. 6). En 1971. Ali et al.19 publicaron que cuando 4 estímulos eran producidos en intervalos de 0,5 s había un progresivo debilitamiento de las respuestas sucesivas en pacientes curarizados y que la magnitud del debilitamiento dependía del grado de curarización. La técnica del TOF ha permanecido como el método más útil para la evaluación de la función neuromuscular durante más de 40 años, debido a su simplicidad y a su facilidad de evaluación. Este método se basa en la observación de que el aumento en la frecuencia de estimulación produce fatiga muscular o debilitamiento. La frecuencia del TOF es lo suficientemente lenta para distinguir las contracciones de forma individualizada y lo suficientemente rápida para observar debilitamiento. La proporción resultante de la división de la cuarta respuesta entre la primera respuesta evocada es el train-of-four ratio (T4/T1) (TOFR). El TOF ha sido recomendado en la práctica clínica debido a que es el test que mide exclusivamente la función neuromuscular, capaz de dar información aunque no se haya obtenido un valor control previo, es fácil de usar y puede ser utilizado de forma repetitiva20. Se ha establecido la siguiente regla del TOF en el AP: la aparición de la 1.a, 2.a, 3.a y 4.a respuesta se corresponde de forma aproximada con la altura sobre el valor control del 5, 15, 25 y 35%, respectivamente21. Así pues, la cuenta del TOF es una excelente guía, nos informa no solo del grado de bloqueo neuromuscular sino también del estado de recuperación del mismo, y de la predicción en la recuperación del bloqueo neuromuscular (balance entre la actividad de los anticolinesterásicos y la recuperación espontánea del bloqueo neuromuscular)22.Valoración de la train-of-four ratio (TOFR). Nuevos conocimientos, curva de aprendizaje.
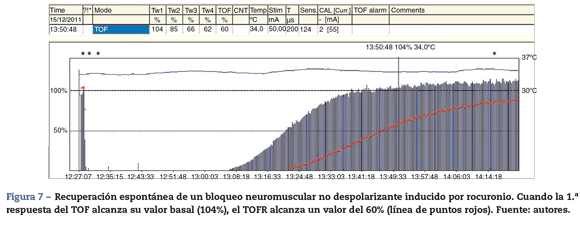
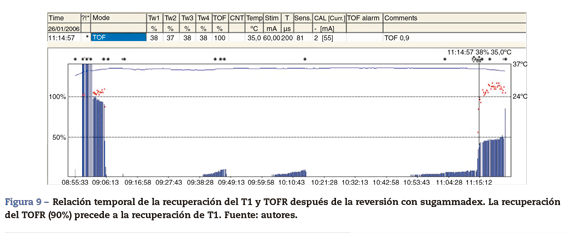
La TOFR es la expresión gráfica y cuantitativa del fenómeno de debilitamiento típico de un BNMND23. Esta relación refleja los efectos de un BNMND a nivel presináptico. Durante la fase de recuperación espontánea de un BNMND, así como la reversión con un anticolinesterásico, cuando la 1.a respuesta del TOF alcanza su valor control (100%) el TOFR alcanza cifras variables entre 64 y el 80%24 (figs. 7 y 8). Podemos considerar que esto es un patrón típico en ambas circunstancias 1.a respuesta del TOF precede siempre el TOFR Esto quiere decir que no debemos utilizar la 1.a respuesta del TOF como un simple criterio de la recuperación de la función neuromuscular, ya que el fenómeno de debilitamiento TOFR persiste durante más tiempo (línea de puntos rojos de las figuras 7 y 8). La relación temporal de la recuperación de la 1.a respuesta y TOFR después de la reversión con sugammadex tras un bloqueo neuromuscular inducido por rocuronio es diferente. Staals et al. han sido los primeros autores en demostrar este hallazgo. La recuperación del TOFR de 0,9 precede a la recuperación de la altura de la 1.a respuesta (fig. 9). El verdadero significado de este hallazgo es desconocido y probablemente no tenga repercusión clínica significativa. Pero concluyen que el TOFR en estas circunstancias, como una medida de reversión adecuada, necesita ir acompañado de una recuperación completa de la 1.a respuesta25. Normalización de la respuesta del TOF. Recientemente se ha publicado que la ACM tiene cierta variabilidad en su calibración previa que podría cuestionar la recuperación del bloqueo neuromuscular si la comparamos con la MMG y la EMG26.
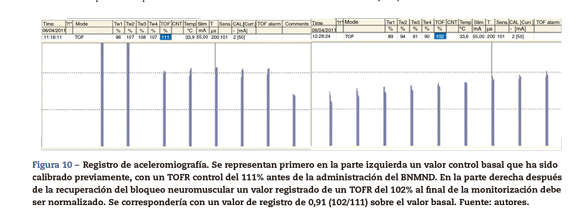
A diferencia de los métodos anteriores MMG y EMG en donde previamente a la administración de un bloqueante neuromuscular (BNM) el valor del TOFR basal es 1 (T4 es el 100% de T1), el valor TOFR control de la aceleromiografía tiende a ser superior al 100%. Para evitar este hallazgo es preciso una estabilización de la señal (calibración basal). Este efecto muy común con la ACM sugiere que el TOFR debe ser «normalizado» o corregido. La corrección supone comparar los valores al final de la monitorización con los valores previos o basales. Por ejemplo, si el TOFR control es tan alto como 111%, un valor registrado de 102% al final de la monitorización se correspondería con un valor de registro de 0,91 (102/111) sobre el valor basal (fig. 10). La ACM es un método de MNM que viene demostrando su utilidad tanto en el uso diario como en programas de investigación. Sin embargo, una calibración inicial antes de la administración del bloqueante neuromuscular, con el fin de obtener un valor T4/T1 lo más aproximado al 100%, modula la amplitud de la estimulación y favorece la interpretación y la información para evitar el peligro potencial que representa un bloqueo neuromuscular incompleto. Se considera que la normalización de un TOFR de 1,027 con respecto al valor basal garantiza una recuperación adecuada del bloqueo neuromuscular y mejora la detección de una PR28.
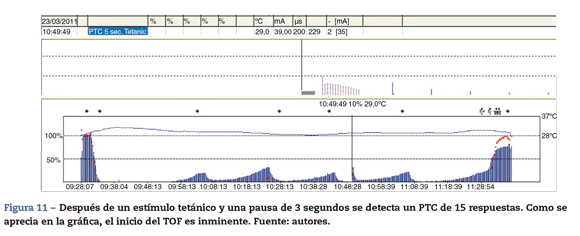
Recuento de la estimulación postetánica (post-tetanic count [PTC]). Test de curarización profunda. La utilidad del TOF es limitada durante el período de bloqueo profundo. El clínico no puede valorar con certeza el nivel de parálisis muscular. La respuesta a este problema fue resuelta por Viby-Mogensen et al.29, quienes demostraron que la potenciación postetánica es una herramienta útil para valorar exactamente el grado de BNMND. Es decir, el clínico puede observar después de un estímulo tetánico respuestas a estímulos simples donde previamente no existían. Sugirieron así una secuencia de la siguiente manera: estímulo tetánico a 50 Hz durante 5 s, 3 s de pausa, seguido por 20 estímulos simples a intervalos de 1 s. En el paciente con un bloqueo profundo solo es detectable inicialmente una contracción postetánica (PTC: 1). A medida que la recuperación del bloqueo neuro-muscular NDP progresa, el PTC aumenta. Estos autores fueron capaces de demostrar que la PTC es una guía muy práctica de la evolución del bloqueo neuromuscular NDP. La cuenta pos-tetánica también es un método válido para predecir el tiempo de la aparición de la primera respuesta del TOF30 (fig. 11). La explicación fisiológica es la siguiente: la estimulación tetánica de alta frecuencia produce la liberación transitoria yexagerada de grandes cantidades de A-c en el terminal presináptico, yse induce de esta forma un estado a favor del neurotransmisor A-c en la placa terminal. Esto se manifiesta en la clínica con un aumento transitorio en la altura de las contracciones sucesivas evocadas por estímulos simples: es el llamado fenómeno de facilitación o potenciación postetánica.31.
Diferente comportamiento de la musculatura: aplicaciones prácticas
El AP es utilizado por «conveniencia» porrazones prácticas. Sin embargo, existen diferencias importantes entre los músculos. Así pues, la respuesta del AP no es representativa del estado de relajación de todo el cuerpo, pero podría ser interpretada conociendo las diferencias que existen entre los músculos. Durante el período de bloqueo neuromuscular profundo o dificultad de acceso al AP, podemos monitorizar otros músculos que son más resistentes y que nos van a servir de guía en estas situaciones, y como veremos serán mejores predictores del momento de la intubación.
Monitorización del músculo corrugator supercilii como guía para la intubación traqueal
Se puede predecir buenas condiciones de intubación si utilizamos como guía el músculo CSC. Su perfil de comportamiento neuromuscular es el mismo que la musculatura laríngea32. El bloqueo neuromuscular en el músculo CSC garantiza el tiempo óptimo más apropiado para estimar el momento de la intubación. Después de la administración de un BNMND, si esperamos a que la musculatura de la mano esté completamente paralizada, entonces este tiempo de espera puede sobreestimar el tiempo necesario para el bloqueo de la musculatura laríngea. El CSC es un pequeño músculo localizado en la ceja (zona medial), y su acción es tirar de la ceja hacia la nariz. La monitorización del CSC puede realizarse con ACM pero tiene una serie de peculiaridades para poder efectuarla correctamente. El séptimo par craneal (nervio facial) puede ser estimulado sobre la parte externa del arco superciliar con una intensidad de corriente supramaximal de solo 20 mA. El transductor se coloca en la mitad interna del arco superciliar con un ángulo de 90° (perpendicular) a la dirección de la contracción muscular del CSC33 (fig. 12).
Músculo corrugator supercilii. Perfil de sensibilidad
La sensibilidad de la musculatura a los bloqueantes neuromusculares NDP está relacionada con en el número de receptores musculares en la placa motora y el tamaño de la fibra muscular. La composición morfológica de las fibras musculares ha sido determinada por estudios histológicos34. La densidad de receptores de la musculatura central es más alta que la musculatura periférica. Así pues, la relación del número de receptores de A-C y el grosor de la fibra muscular es un factor predictor morfológico de las diferentes respuestas (sensibilidad) de los músculos a los bloqueantes neuromusculares NDP. La sensibilidad aumenta con el tamaño y el diámetro de la fibra y disminuye en relación al número de recepores de A-C. Este importante factor anatómico explica por qué el perfil de sensibilidad de la musculatura laríngea y de la musculatura facial es similar (mayor resistencia). Por esta razón la monitorización de la respuesta del músculo CSC es una guía que predice de una forma más adecuada el momento óptimo de la intubación35 con respecto a la musculatura periférica (AP).
Parálisis residual: relevancia clínica
Los efectos adversos de la PR son causa de morbilidad y mortalidad en el postoperatorio inmediato36. Las siguientes consideraciones, basadas en un uso sistemático de la MNM y la administración de un agente reversor, son los principales factores que contribuyen a disminuir el problema.
Diagnóstico e incidencia de parálisis residual: train-of-four ratio (T4/T1)
La ausencia de PR significa que la transmisión neuromuscular se ha recuperado suficientemente, y para tal fin se precisa una medida capaz de definirlo. En ausencia de bloqueo neuromuscular las 4 respuestas son de igual altura, por lo que el TOF será de 1. El TOFR es un test muy sensible y se correlaciona bien con los test clínicos empleados para valorar el grado de recuperación del bloqueo neuromuscular.
Desde 1970, con la introducción del TOF se estableció que el TOFR37 en el AP se correlacionaba bien con los signos clínicos de recuperación, es un parámetro básico de la MNM. Valores < 0,6 se asociaban con importante debilidad muscular. En 1979, Viby-Mogensen et al. fueron los primeros en demostrar que a pesar de una recuperación clínica aparente, el 42% de los pacientes tenían un TOFR < 0,738. En la actualidad, después de numerosos estudios, los autores se han puesto de acuerdo en definir el TOFR que representa un nivel seguro de recuperación. Con la ACM se ha aceptado que el TOFR más seguro debe ser > 0,9. Este endpoint asegura el control completo de la musculatura faríngea y la respuesta ventilatoria normal a la hipoxia39,40. A la hora de valorar todos los estudios que hablan sobre la amplia incidencia de PR en las unidades de reanimación es preciso tener en cuenta una serie de detalles sobre el tratamiento intraoperatorio que no siempre se conocen. ¿Se usó un neuroestimulador? ¿Se antagonizó el bloqueo residual? Podemos sugerir que, con la MNM, la PR es muy poco frecuente. Ya que el AP es uno de los músculos que más tardan en la recuperación, es preferible valorar la recuperación mediante la monitorización del AP41.
Estrategias que es preciso seguir para disminuir la parálisis residual
La aplicación de los siguientes principios son pasos que deberíamos cumplir para excluir la PR42-44:
1. MNM intraoperatoria. La ACM como método cuantitativo es superior a la valoración visual en el diagnóstico de la PR.
2. Evitar la inhibición total del TOF.
3. Uso de un bloqueante neuromuscular NDP de acción intermedia.
4. La administración de anticolinesterásicos con cierto grado de recuperación espontánea de la transmisión neuromuscular es un paso crítico en reducir o eliminar la PR.
5. Retrasar la extubación hasta no conseguir una TOFR de 0,9.
6. Un propuesta desarrollada recientemente es la utitilización de la nueva molécula sugammadex (abreviación de sugar y -y-cyclodextrina) diseñada específicamente para unirse de un forma selectiva al rocuronio, en el momento actual aprobada y comercializada en Europa y en Australia pero no en Norteamérica. La principal ventaja es su rapidez de acción y mínima variación interindividual después de una dosis adecuada es capaz de conseguir TOFR de 0,9 (3-5 min)45.
Extubación y parálisis residual
Investigaciones en el postoperatorio inmediato, durante el momento de la extubación, han demostrado PR con mayor posibilidad de morbilidad. En el trabajo de Murphy et al.46 se realizó un estudio del TOFR cuantificados con ACM inmediatamente antes de la extubación traqueal. Se concluyó que la PR estuvo presente en la mayoría de los pacientes en el momento de la extubación. A pesar de un protocolo dirigido a la monitorización y reversión, y del uso de un BNMND intermedio, hubo cierto grado de PR al final de la cirugía en el quirófano. Estos autores recomiendan la MNM para asegurar que la recuperación sea completa y que la función respiratoria y la faríngea sean normales.
Prevención de la parálisis residual
Probablemente una de las evidencias más convincentes en la valoración de la PR ha surgido de los estudios de Baillard et al. Este grupo de trabajo demostró que la MNM intraoperatoria mediante un método objetivo la ACM y un esfuerzo educacional permitieron reducir la incidencia de PR del 62% a niveles muy bajos47,48. Este hallazgo contribuyó a equipar todos los quirófanos con métodos de valoración cuantitativa de la función neuromuscular.
Conclusiones. ¿Cuál es la lección final?
A pesar del hito que supuso en el año 1942 la introducción en clínica del curare y los grandes avances en el entendimiento de la fisiología de la transmisión neuromuscular, sorprendentemente en la actualidad la MNM sigue siendo solo una opción.
El interés de esta revisión es transmitir razones prácticas y académicas para convencer que la MNM sea un acto cotidiano para todos los pacientes. Las encuestas publicadas demuestran una baja utilización de la MNM; un ejemplo reciente es la realizada en el Reino Unido sobre 715 anestesiólogos, que demuestra esta práctica. El 28% usaron un monitor solo de forma ocasional, el 10% de forma rutinaria y hasta el 62% nunca lo usaron49. Somos conscientes de que la MNM no constituye una garantía absoluta para que las condiciones de intubación sean perfectas, para que la relajación quirúrgica sea óptima y para que la recuperación sea completa. La monitorización del AP puede utilizarse durante todo el acto anestésico, alternando en caso de necesidad la modalidad de la CPT. La información del monitoreo neuromuscular (MNM) tiene que ser interpretada considerando el paciente, los fármacos utilizados y los signos clínicos. La MNM es muy útil siempre que sea interpretada de forma correcta. La ACM y un TOFR de 1 al final de la cirugía es un dato evidente de exclusión de PR. Ericksson concluye en el siguiente editorial50: Es el momento de pasar a la acción, debemos introducir un monitor de la transmisión neuromuscular en todos los quirófanos de forma prioritaria y siempre que utilicemos bloqueantes neuromusculares NDP, no debiendo ser una herramienta exclusiva solo para investigadores. Es nuestra labor como autores interesados en esta materia llamar la atención sobre los progresos del arte y la ciencia y resaltar que, además de emplear un monitor, se deben administrar los bloqueantes neuromusculares con criterio para mantener el grado de relajación adecuado a cada momento y necesidad.
Financiación
Recursos propios.
Conflicto de intereses
Ninguno declarado relacionado con el artículo.
Agradecimientos
Agradecemos a la enfermera de nuestra Unidad de Reanimación (Belén Mingorance Diaz) su colaboración en la imagen de la monitorización del músculo CSC.
REFERENCIAS1. Beecher HK, Todd DP. A study of the deaths associated with anesthesia and surgery. Ann Surg. 1954;140:2-35. [ Links ]
2. Churchill-Davidson HC, Christie TH. The diagnosis of neuromuscular block in man. Br J Anaesth. 1959;31:290-301. [ Links ]
3. Churchill-Davidson HC. The d-tubocurarine dilemma. Anesthesiology. 1965;26:132-3. [ Links ]
4. Naguib M, Kopman A, Cynthia AL, Hunter J, Lopez A, Brull SJ. A survey of current management of neuromuscular block in the United States and Europe. Anesth Analg. 2010;111:110-9. [ Links ]
5. Murphy GS, Brull SJ. Residual neuromuscular block: lessons unlearned, part I: definitions, incidence, and adverse physiologic effects of residual neuromuscular block. Anesth Analg. 2010;111:120-8. [ Links ]
6. The American Society of Anesthesiologists Task for on Post-anesthesia Care. Practice Guidelines for Postanesthetic Care. Anesthesiology. 2002;96:742-52. [ Links ]
7. Crosby ET. Anevidence-based approach to airway management: is there a role for clinical practice guidelines? Anaesthesia. 2011;66 Suppl. 2:112-8. [ Links ]
8. Murphy GS, Szokol JW, Avram MJ, Greenberg SB, Marymont JH, Vender JS, et al. Intraoperative acceleromyography monitoring reduces symptoms of muscle weakness and improves quality of recovery in the early postoperative period. Anesthesiology. 2011;115:946-54. [ Links ]
9. Mencke T, Fuchs-Buder T. Does the timing of tracheal intubation based on neuromuscular monitoring decrease laryngeal injury? A randomized, prospective, controlled trial. Anesth Analg. 2006;102:306-12. [ Links ]
10. Hayes AH, Mirakhur RK, Breslin DS, Reid JE, McCourt KC. Postoperative residual block after intermediate acting neuromuscular blocking drugs. Anaesthesia. 2001;56:312-8. [ Links ]
11. Viby-Mogensen J. Postoperative residual curarization and evidence based anaesthesia. Br J Anaesth. 2000;84, 301-304. [ Links ]
12. Hemmerling TM, Donati F, Beaulieu P, Babin D. Phonomyography of the corrugator supercilii muscle: signal characteristics, best recording site and comparison with acceleromyography. Br J Anaesth. 2002;88:389-93. [ Links ]
13. Fabregat López J. Monitorización de la relajación muscular, revisión actual. Diferencias entre músculos. Act Anest Reanim (Madrid). 2002;12:59-62. [ Links ]
14. Viby-Mogensen J, Jensen NH, Engbaek J, Ording H, Skovgaard LT. Tactile and visual evaluation of the response to train-of-four nerve stimulation. Anesthesiology. 1985;63:440-3. [ Links ]
15. Rowaan CJ, Vandenbrom RHG, Wierda JMKH. The Relaxometer: a complete and comprehensive computer controlled neuromuscular transmission measurement system. J Clin Monit. 1993;9:38-44. [ Links ]
16. Viby-Mogensen J, Jensen E, Werner M, Kirkegaard Neilsen H. Measurement of acceleration a new method of monitoring neuromuscular function. Acta Anaesthesiol Scand. 1988;32:45-8. [ Links ]
17. Martyn JA, Fagerlund MJ, Eriksson LI. Basic principles of neuromuscular transmission. Anaesthesia. 2009;64 Suppl.1:11-9. [ Links ]
18. Fuchs Buder T, Claudius C, Skovgaard LT, Eriksson LI, Mirakhur RK, Viby-Mogensen J. Good clinical research practice in pharmacodynamic studies of neuromuscular blocking agents II: the Stockholm revision. Acta Anaesthesiol Scand. 2007;51:789-808. [ Links ]
19. Ali HH, UttingJE, Gray TC. Stimulus frequency in the detection of neuromuscular block in humans. Br J Anaesth. 1970;42:967-78. [ Links ]
20. Kopman F, Klewicka MM, Neuman GG. The relationship between acceleromyographic train-of-four fade and single twitch depression. Anesthesiology. 2002;96:583-7. [ Links ]
21. Lee CM, Katz RL. Fade of neurally evoked compound EMG during neuromuscular block by d-tubocurarine. Anesth Analg. 1977;56:271-5. [ Links ]
22. Beemer GH, Bjorksten AR, Dawson PJ, Dawson RJ, Heenan PJ, Robertson BA. Determinants of the reversal time of competitive neuromuscular block by anticholinesterases. Br J Anaesth. 1991;66:469-75. [ Links ]
23. Glavinovic MI, Law Min JC, Kapural L, Donati F, Bevan DR. Speed of action of various muscle relaxants at the neuromuscular junction binding vs. buffering hypothesis.J Pharmacol Exp Ther. 1993;265:1181-6. [ Links ]
24. Ali HH, Savarese JJ, Lebowitz PW, Ramsay FM. Twitch, tetanus and train-of-four as indices of recovery from non-depolarizing neuromuscular blockade. Anesthesiology. 1981;54:294-7. [ Links ]
25. Staals LM, Driessen JJ, Van Egmond J, De Boer HD, Klimer M, Flockton EA, et al. Train-of-four ratio recovery often precedes twitch recovery when neuromuscular block is reversed by sugammadex. Acta Anaesth Scand. 2011;55:700-7. [ Links ]
26. Kopman AF, Chin WA. A dose-response study of rocuronium. Do acceleromyographic and electromyographic monitors produce the same results? Acta Anaesthesiol Scand.2005;49:323-7. [ Links ]
27. Capron F, Alla F, Hottier C, Meistelman C, Fuchs-Buder T. Can acceleromyography detec low levels of residual paralysis? Anesthesiology. 2004;100:1119-24. [ Links ]
28. Suzuki T, Fukano N, Kitajima O, Saeki S, Ogawa S. Normalization of acceleromyographic train-of-four ratio by baseline value for detecting residual neuromuscular block. Br J Anaesth. 2006;96:44-7. [ Links ] [ Links ]
30. Aitoh Y, Fujii Y, Takahashi K, Makita K, Tanaka H, Amaha K. Recovery of posttetanic count and train-of-four responses at the great toe and thumb. Anaesthesia. 1998;53:44-8. [ Links ]
31. Bowman WC. En: Fukushima K, Ochiai R, editores. Mechanisms of action of reversal agents, muscle relaxants: physiologic and pharmacologic aspects. Tokyo: Springer Verlag; 1995. p. 19-30. [ Links ]
32. Plaud B, Debaene B, Donati F. The corrugator supercilii, not the orbicularis oculi reflects rocuronium neuromuscular blockade at the laryngeal adductor muscles. Anesthesiology. 2001;95:96-101. [ Links ]
33. Ortiz Gómez JR, Fabregat López J, Palacio-Abizanda FJ, Fornet Ruiz I, Perez Cajaraville J, Armo Irujo JJ, et al. Monitorización del bloqueo neuromuscular. 2a parte. Rev Esp Anestesiol Reanim. 2010;57:161-72. [ Links ]
34. Ibebunjo C, Srikant C, Donati F. Morphological correlates of the differential responses of muscles to vecuronium. Br J Anaesth. 1999;83:284-91. [ Links ]
35. Hemmerling TM, Le N. Brief review: neuromuscular monitoring: an update for the clinician. Can J Anaesth. 2007;54:58-72. [ Links ]
36. Bevan DR. Recovery from neuromuscular block and its assessment. Anesth Analg. 2000;90:S7-13. [ Links ]
37. Ali HH, Utting JE, Gray TC. Quantitative assessment of residual antidepolarizing Block (Part II). Br J Anaesth. 1971;43:478-85. [ Links ]
38. Viby-Mogensen J, Chraemmer Jorgensen B, Ordin H. Residual curarization in the recovery room. Aneshesiology. 1979;50:539-1. [ Links ]
39. Eriksson LI, Lennmarken C, Wyon N, Johnson A. Attenuated ventilatory response to hypoxaemia after vecuronium induced partial neuromuscular block. Acta Anaesthesiol Scand. 1992;36:710-5. [ Links ]
40. Eriksson LI, Sundman E, Olsson R, Nilsson L, Witt H, Ekberg O. Functional assessment of the pharynx at rest and during swallowing in partially paralyzed humans: simultaneous videomanometry and mechanomyography of awake human volunteers. Anesthesiology. 1997;87:1035-43. [ Links ]
41. Baillard C. Monitorage de la curarisation. EMC (Elsevier Masson SAS, Paris). Anesthésie-Réanimation. 2011,36-390-A-10. [ Links ]
42. Murphy GS. Residual neuromuscular blockade: incidence, assessment, and relevance in the postoperative period. Minerva Anestesiol. 2006;72:97-109. [ Links ]
43. Plaud B, Debaene B, Donati F, Marty J. Residual paralysis after emergence from anesthesia. Clinical concepts and commentary. Anesthesiology. 2010;112:1013-22. [ Links ]
44. Donati F. Neeuromuscular monitoring: what evidence do we need to be convinced? [editorial]. Anesth Analg. 2010;111:1-2. [ Links ]
45. Sorgenfrei IF, Norril DK, Larsen PB, Stensballe J, Ostergaard D, Prins ME, et al. Reversal of rocuronium-induced neuromuscular block by these elective relaxant binding agent sugammadex: A dose-finding and safety study. Anesthesiology 2006;104:667-74 [ Links ]
46. Murphy GS, Szokol JW, Marymont JH, Franklin M, Avram ML, Vender JS. Residual paralysis at the time of tracheal extubation. Anesth Analg. 2005;100:1840-5. [ Links ]
47. Baillard C, Gehan G, Reboul Marty J, larmignat P, Samana CM, Cupa M. Residual curarization in the recovery room after vecuronium. Br J Anaesth. 2000;84:301-3. [ Links ]
48. Baillard C, Clec'h C, Catineau J, Catineau J, Salhi F, Gehan G, et al. Postoperative residual neuromuscular block: a survey of management. Br J Anaesth. 2005;95:622-6. [ Links ]
49. Grayling M, Sweeney BP. Recovery from neuromuscular blockade: a survey of practice. Anaesthesia. 2007;62:806-9. [ Links ]
50. Eriksson LI. Evidence-based practice and neuromuscular monitoring: it's time for routine quantitative assessment. Anesthesiology. 2003;98:1037-9. [ Links ]











 text in
text in