Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Colombian Journal of Anestesiology
versión impresa ISSN 0120-3347
Rev. colomb. anestesiol. vol.41 no.3 Bogotá jul./set. 2013
https://doi.org/10.1016/j.rca.2013.05.008
Revisión
La farmacología de la anestesia total intravenosa en pediatría
Pharmacology of paediatric total intravenous anaesthesia
Brian J. Anderson *
PhD, FANZCA, FJF1CM, Departamento de Anestesiología, Universidad de Auckland, Nueva Zelanda
* Autor para correspondencia: PICU Auckland Children';s Hospital Park Road, Auckland, New Zealand. Correo electrónico: briana@adhb.govt.nz
0120-3347/$ - see front matter © 2013 Sociedad Colombiana de Anestesiología y Reanimación. Publicado por Elsevier España, S.L. Todos los derechos reservados.
INFORMACIÓN DEL ARTÍCULO
Historia del artículo: Recibido el 10 de febrero de 2013 - Aceptado el 28 de mayo de 2013.
RESUMEN
Los parámetros farmacocinéticos estimados en los modelos de adultos sobreestiman las concentraciones plasmáticas en niños. Se han publicado diversos conjuntos de parámetros que describen modelos de tres compartimentos para propofol y algunos están disponibles para bombas de infusión de uso pediátrico. La farmacocinética en niños está influenciada por el tamaño y la edad. Otras variables siguen siendo pobremente entendidas. No existen análisis integrados farmacocinéticos-farmacodinámicos. Sin embargo, existe la metodología que permite establecer un nexo entre los parámetros farmacocinéticos con datos farmacodinámicos y poder así calcular la constante de velocidad que vincula las concentraciones plasmáticas con las del sitio de efecto. En este estudio se hizo una revisión de la literatura en relación con el tema de anestesia intravenosa en pediatría para evaluar estos parámetros (modelos) y para destacar la farmacología detrás de ellos, sus limitaciones y problemas.
Palabras clave: Anestesia, Farmacocinética, Pediatría, Farmacología, Propofol.
ABSTRACT
Adult parameter estimates for pharmacokinetic models over-predict plasma concentrations in children. Parameter sets that describe 3-compartment pharmacokinetic models for propofol have been published and some are now incorporated into commercially available paediatric infusion pumps. Pharmacokinetics in children is influenced by size and age. Other covariates remain poorly understood. There are no integrated pharmacokinetic-pharmacodynamic analyses available. However, methodology exists that enables us to link pharmacokinetic parameter sets with pharmacodynamic data in order to calculate a rate constant linking serum and effect site concentrations. Literature concerningpaediatric total intravenous anaesthesia was reviewed to appraise these parameter sets (';models';) and to outline the pharmacology behind them, their limitations and pitfalls.
Keywords: Anesthesia, Pharmacokinetics, Pediatrics, Pharmacology, Propofol.
Introducción
La meta del tratamiento farmacológico es una respuesta deseada, conocida como el efecto objetivo. Comprender la relación concentración-respuesta (es decir, la farmacodina-mia FD) ayuda a predecir la concentración objetivo necesaria para el logro de tal efecto objetivo en un niño típico1. El conocimiento farmacocinético (FC) (p.ej., depuración, volumen) determina entonces la dosis que logrará la concentración objetiva. Sin embargo, cada niño es un poco diferente y hay variabilidad asociada a todos los parámetros que se usan en las ecuaciones de FC y FD (conocidas como modelos). La información sobre covariables (p. ej., peso, edad, patología, interacciones farmacológicas, farmacogenómica) puede usarse para ayudar a predecir la dosis típica en un determinado paciente. El Santo Grial de la farmacología clínica es predecir la FC y la FD de cada paciente2, y esto requiere conocimiento de las covariables que contribuyen a la variabilidad.
Los anestesiólogos son farmacólogos practicantes, y la administración de la anestesia total intravenosa (TIVA) utilizando propofol es un buen ejemplo de «farmacología en acción». Existe un efecto objetivo definido (p.ej., índice biesprectral BIS 50), existe una concentración objetivo de propofol a la cual se sabe que esto se logra (p.ej., 3mg/l) y se ha descrito la FC de propofol en niños. Los conceptos avanzados en modelaje FC y en tecnología de computación han desarrollado a sistemas de administración sofisticados que facilitan la anestesia administrada por vía intravenosa. Quedan ciertas limitaciones respecto al uso actual de la infusión objetivo controlada en niños. Las limitaciones de equipos, carencia de datos FC en niños y problemas de monitorización objetiva restringen su uso. La dosis del fármaco es menor que en adultos y debe tenerse cuidado con el volumen muerto, las velocidades de flujo y el fluido administrado y las infusiones concomitantes3,4. Aunque las bombas computarizadas han tenido un avance notable en comparación con las técnicas manuales utilizadas inicialmente para niños5,6 -que solamente se concentraban en el plasma-, estas requieren el insumo de parámetros tanto FC como FD igualmente, una falta de estimados FC y FD robustos limita el uso de infusión controlada a objetivo (TCI) en niños.
Se realizó una revisión de la literatura en PubMed, utilizando palabras y frases de búsqueda de "children, total intravenous anaesthesia, PKPD modelling, maturation and size models". La presente revisión evalúa conjuntos de parámetros FC ("modelos") disponibles en la actualidad para niños y revisa la farmacología que los sustenta, sus limitaciones y sus inconvenientes.
¿Qué es un modelo farmacocinético-farmacodinámico?
Los modelos FC-FD son ecuaciones que usan para describir tanto los cambios en la concentración plasmática con el tiempo (FC) como las relaciones concentración-efecto (FD). Las dos propiedades farmacocinéticas principales de un fármaco son la depuración (CL) y la distribución de volumen (V).
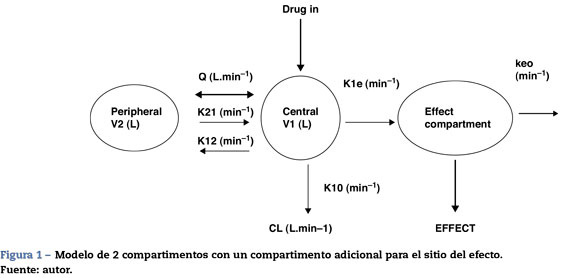
Las dos propiedades FD principales de un fármaco son el efecto máximo (Emax) y la concentración que produce el 50% del máximo efecto (EC50). Invariablemente hay una demora en el tiempo entre la concentración plasmática y la que se presume es directamente responsable de la respuesta en el sitio del efecto; esta demora suele describirse con una constante de tasa de primer orden. La figura 1 muestra un dibujo esquemático de un fármaco descrito utilizando un modelo de dos compartimentos con un compartimento adicional para el sitio del efecto.
El modelo FC de 2 compartimentos suele describirse utilizando dos volúmenes (V1, V2) y dos depuraciones (CL, Q), en donde Q es la depuración inter-compartimento y la distribución de volumen en estado estable (Vss) es la suma de V1and V2. Otro sistema de parametrización es el uso de un volumen central y tres constantes de tasa (k10,k12,k21) que describen la distribución del fármaco entre compartimentos.
La relación entre la concentración del fármaco y su efecto posría describirse mediante la ecuación de Hill7:
Efecto = E0 + E max xCey/(ECy50 + Cey)
donde E0 es la respuesta basal, Emax es el cambio de efecto máximo, Ce es la concentración en el compartimento del efecto, EC50 es la concentración que produce 50% Emax y es el coeficiente Hill que define lo escarpado de la curva concentración-respuesta. Jeleazcov et al.8 han descrito la farmacodinamia del propofol en niños de 1-16 años utilizando BIS en donde E0 se estimó como 93,2, Emax -83,4, EC50 5,2mgl-1 e y 1,4. La constante de tasas (keo) que describe el efecto compartimento fue de 0,6 min-1 (T1/2keo 1,15 min).
Cuando se recopilan simultáneamente tanto los datos de FC como de FD y se estiman en conjunto los parámetros para ambos modelos, el modelo se describe como "integrado". Los estimados de FC no se pueden aplicar con estimados de FD tomados de un conjunto de datos diferente sin unos cuantos «factores manipulados». Actualmente no existen análisis FC-FD integrados para niños dentro del rango de edad pediátrica.
Por qué los parámetros farmacocinéticos de adultos no funcionan en niños
El uso de conjuntos paramétricos de adultos en bombas TCI para niños resulta en concentraciones menores a las observadas en adultos. Un esquema manual simple para infusión de propofol en adultos9 consiste en un bolo de 1mgkg-1 seguido de una infusión de 10mgkg-1h-1 (0-10min), 8mgkg-1h-1 (10-20min) y 6mgkg-1h-1 en adelante. Sin embargo, los requerimientos para los niños son mayores. Una dosis de carga de 2,5mgkg-1 seguida de una tasa de infusión de 15mgkg-1 h-1 para los primeros 15 min; 13mgkg-1 h-1 de 15 a 30min; 11mgkg-1 -h-1 de 30 a 60min; 10mgkg-1 h-1 de1a 2 h, y 9 mgkg-1 h-1 de 2 a 4h, resultó en una concentración objetivo de estado estable de 3mg-l-1 en niños de 3-11 años5. Los mayores requerimientos en los niños pueden atribuirse a factores de tamaño. Los menores requerimientos en neonatos se deben a sistemas de depuración inmaduros. También la disfunción orgánica produce menores requerimientos.
Tamaño
La depuración en niños de 1-2 años de edad, expresada como lh-1kg-1, es mayor a la observada en niños de mayor edad o en adolescentes. Esto es un efecto de tamañoynosedebe a hígados más grandes ni a un aumento del flujo sanguíneo hepático en esa subpoblación. Este «artefacto de tamaño» desaparece cuando se usa la escala alométrica. La alometría es un término que se usa para describir la relación no lineal entre tamaño y función. Muchas variables fisiológicas, estructurales y temporales escalan predeciblemente dentro y entre especies con exponentes (PWR) de peso (W) de 3/4, 1 y 1/4, respectivamente10. Estos exponentes tienen aplicabilidad en los parámetros farmacocinéticos tales como depuración (CL exponente de 3/4), volumen (V exponente de 1) y tiempo medio (T1/2 exponente de 1/4)11. El factor tamaño (Fsize) para la depuración total del fármaco podría expresarse así:
Fsize = (W/70)3/4
La depuración de remifentanilo en niños de 1 mes-9 años es similar a las tasas de los adultos cuando se transforman a escala utilizando un exponente alométrico de 3/412. Una depuración estandarizada de 2.790 ml min-1-70 kg-1 es similar a la reportada por otros en niños13,14 y en adultos15,16. Las estearasas no específicas que metabolizan el remifentanilo están maduras al nacimiento17.
Maduración
La alometría por sí sola es insuficiente para predecir la depuración en neonatos y lactantes a partir de los estimados para la mayoría de los fármacos para adultos (excluyendo el remi-fentanilo). Se necesita contar con un modelo que describa la maduración. El modelo Hill7 ha resultado de utilidad para describir este proceso de maduración (MF):
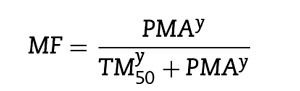
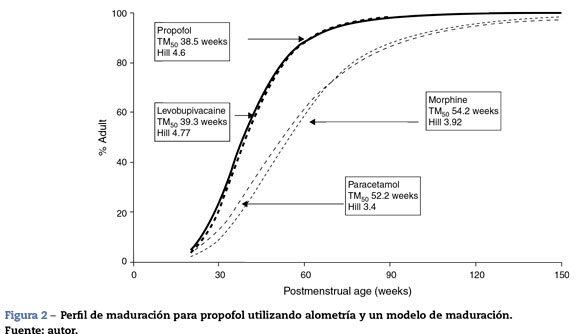
El TM50 describe el tiempo medio de maduración, mientras que el coeficiente Hill (y) se relaciona con la pendiente de este perfil de maduración. La maduración de la depuración comienza antes del nacimiento, sugiriendo que la edad posmenstruación (PMA) sería un mejor predictor de eliminación del fármaco que la edad posnatal (PNA). La figura 2 muestra el perfil de maduración para propofol utilizando alometría y un modelo de maduración. La depuración es inmadura durante la niñez y madura rápidamente dentro de los 6 primeros meses de vida.
La tasa de infusión de un fármaco en estado estable está directamente relacionada con la depuración. No haber reconocido que la depuración de bupivacaína (CYP3A4) era inmadura al nacimiento resultó en convulsiones en neonatos que recibieron infusiones epidurales administradas a tasas utilizadas en adultos18.
Función orgánica
La función hepática o renal comprometida reducirá la depuración. Los parámetros FC (P) pueden describirse en un individuo como el producto de las influencias del tamaño (Fsize), de la maduración (MF) y de la función orgánica (OF), mientras que Pstd es el valor paramétrico en un adulto de tamaño estándar sin cambios patológicos en la función orgánica19:
P = Pstd • Fsize • MF • OF
En consecuencia, la programación de los parámetros FC para niños en todas las edades (0-16 años) en bombas TCI podría ser ligeramente más compleja que la programación para adultos.
Conjuntos paramétricos farmacocinéticos pediátricos
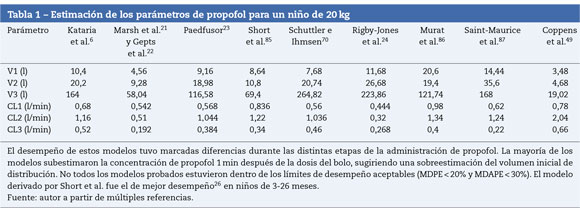
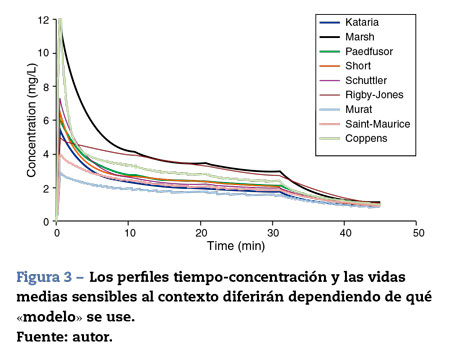
La mayoría de las técnicas de TCI utilizan propofol y remifen-tanilo como los fármacos principales para la inducción y el mantenimiento de la anestesia20. Los programas pediátricos populares utilizados para alcanzar una concentración plasmática con la infusión de propofol se basan en datos de Marsh et al.21 y Gepts et al.22 (Diprifusor), Kataria et al.6o Absalom et al.23 (Paedfusor). Los estimados paramétricos son diferentes para cada autor (tabla 1). Las influencias de covariables tales como la severidad de la enfermedad no se toman en consideración; por ejemplo, el volumen en compartimento central está aumentado en niños luego de cirugía cardiaca24. Tanto el método de administración (bolo intravenoso o infusión)25 como la recolección de sangre venosa para ensayos en lugar de la sangre arterial tendrán influencia sobre los estimados paramétricos de la FC en la fase temprana cuando se está produciendo el movimiento del fármaco hacia el compartimento. Los perfiles tiempo-concentración (fig. 3) y las vidas medias sensibles al contexto diferirán dependiendo de qué «modelo» se use26.
Los estudios de validación son escasos. Se ha examinado el Paedfusor23 y se ha reportado que tiene una media de error de desempeño, sesgo (MDPE) del 4,1% y un error medio absoluto de desempeño, precisión (MDAPE) del 9,7% sobre el rango de edad investigado (1-15 años). Un estudio posterior sugirió que todos salvo Marsh et al. se desempeñaron aceptablemente en niños de 3-26 meses26. Otros han descrito una mala concordancia con Kataria et al., el modelo más popular27. Sin embargo, la depuración (Lh-1kg-1) disminuye con la edad y MDPE se minimiza a bajas depuraciones y se exagera a mayores valores. Evaluar modelos fuera del rango de edad para el cual se determinaron aumentará el sesgo y empeorará la precisión.
Se seguirán utilizando los parámetros FC de remifentanilo en adultos15 para los dispositivos TCI en todas las edades, a pesar del mayor conocimiento sobre este medicamento en niños28. Existe un elemento de seguridad en este enfoque, porque tanto el volumen de distribución13 como la depuración (expresados como mlmin-1 kg-1)12 disminuyen con la edad a lo largo de toda la niñez y porque la vida media de eliminación es pequeña, con una vida media constante sensible al contexto. El mayor volumen de distribución produce concentraciones pico más bajas después del bolo; la depuración más elevada en niños produce una menor concentración plasmática cuando se infunde a tasas de adulto expresada en mg-min-1 -kg-1. Debido a estas mejores tasas de depuración (a menor edad) los niños requerirán mayores tasas de infusión de remifentanilo que los niños más grandes (mayores) y que los adultos para lograr concentraciones equivalentes en sangre.
Los muy jóvenes
Desafortunadamente, los conjuntos de datos de propofol utilizados comúnmente6,21,23 solo han investigado la FC en niños que acaban de salir de la lactancia. Allegaert et al.29 han tratado de vincular los datos neonatales con los de los niños, sugiriendo que la depuración es apenas el 10% de la del valor maduro a las 28 semanas de gestación y a las 38 semanas de embarazo (fig. 2). Un neonato a término logrará el 90% de depuración del adulto (1,831 min-1-70 kg-1) a las 30 semanas después del nacimiento30. La edad posnatal (PNA) también podría tener un efecto adicional sobre la maduración de la depuración de propofol por encima de los predichos por PMA31.
Se han sugerido tasas de infusión de propofol para lactantes32. Estos esquemas se determinaron adaptando un esquema de dosis de adulto a los requerimientos de la población más joven. Los números totales yeltiempo de administración de los bolos, así como el tiempo hasta el despertar, se registraron y se utilizaron como criterios para ajustar el esquema de dosificación. Las tasas de infusión esperadas son altas (p.ej., 24mgkg-1h-1 durante los primeros 10min en neonatos) y deben usarse con cautela. En neonatos y lactantes se reporta despertar tardío, hipotensión y una mayor incidencia de bradicardia32. El propofol puede producir hipotensión profunda en neonatos, y las relaciones FC-FD en este grupo etario aún no se han esclarecido33.
Puntos finales farmacodinámicos
La medida del efecto común utilizada para evaluar la profundidad de la anestesia es el electroencefalograma (EEG) o una modificación de las señales detectadas por el EEG (frecuencia de borde espectral, biespectral, entropía, índice de estado cerebral)34. El BIS mostró una estrecha relación con la concentración modelada del propofol en el sitio del efecto y sirve como medida del efecto del fármaco anestésico en niños de más de un año de edad8. En lactantes su uso aún no puede respaldarse en teoría ni en la práctica35,36. Durante la anestesia, el EEG en lactantes es fundamentalmente diferente del EEG en niños mayores; se hace necesario contar con algoritmos específicos derivados de neonatos si se van a usar monitores para la profundidad de la anestesia derivados del EEG para neonatos y lactantes.
La concentración objetivo deseada en el sitio del efecto variará con el efecto buscado. Comúnmente se usa una concentración de propofol de 2-3 mg-l-1 para sedación, mientras que se busca una concentración de 4-6mg-l-1 para anestesia. Tanto la pérdida como la recuperación de la conciencia se producen a concentraciones objetivo similares en el sitio del efecto (2,0 DE 0,9mgl-1 vs. 1,8 DE 0,7mgl-1) en adultos37., y en niños se describe una concentración de «despertar» de 1,8mgl-1 38.
Las concentraciones objetivo de remifentanilo en el sitio del efecto utilizadas comúnmente para TIVA también varían. Un objetivo de 2-3 µgl-1 es adecuado para laringoscopia, 68 ixgl-1 para laparotomía, y puede buscarse una concentración de 10-12 µg-l-1 para reducir la respuesta al estrés asociada con la cirugía cardiaca39. Se ha sugerido una ED50 de 3-3,5 µg/kg para intubación, cuando se usa en combinación con propofol 5mgkg-1, aun cuando la dosis puede cambiar con la edad40. Los niños de mayor edad tuvieron una mayor duración de la apnea que los lactantes, lo cual es un reflejo de un aumento de la depuración (por kilo) en los lactantes. La concentración objetivo también puede variar con la patología. Por ejemplo, la dosis del opiáceo suele reducirse en niños con deterioro cognoscitivo41, una práctica respaldada por puntuaciones BIS más bajas en esta cohorte42. La determinación de la dosis del bolo para lograr una concentración objetivo depende del volumen de distribución y aumenta con la disminución de la edad 13.
El parámetro enlace
La TCI de circuito abierto en lugar de circuito cerrado es la rutina en anestesia pediátrica43,44. Un único parámetro de primer orden (T1/2keo) describe el tiempo medio de equilibrio entre los compartimentos central y de efecto. Por lo tanto, un estimado exacto de esta demora es clave para controlar la profundidad de la anestesia durante la inducción, la recuperación o la titulación del fármaco durante la fase de mantenimiento45. Permite que los sistemas TCI apunten directamente a la concentración en el sitio del efecto y optimicen la administración del fármaco alcanzando un nivel elegido de efecto lo más rápidamente posible sin excederse45.
Ni el T1/2keo para propofol ni para remifentanilo en niños se han descrito a partir de un modelo de FC-FD integrado. Un estimado de T1/2keo utilizado comúnmente en el modelo Marsh para adultos es de 2,6 min, a pesar de que la derivación de este valor es vaga; el estimado de 3,4min de Billard et al.46 es más largo, pero es mucho menor que los 0,58 min de Struys et al.47 o los 0,43 min de Schnider25. Este último estimado se determinó de una forma novedosa para obviar la dificultad usual en simulación de farmacología clínica, en donde hay una amplia gama de modelos farmacocinéticos pero solamente uno o dos modelos de FC-FD vinculadas publicados45. Se utilizó el curso de tiempo de las concentraciones de propofol en el sitio del efecto, como lo pronosticó un modelo de FC-FD vinculadas25,48 para simular un gráfico que ilustra el tiempo de la concentración pico (Tpeak) en este sitio del efecto. Luego se usaron parámetros pediátricos del modelo Marsh21 para estimar un T1/2keo (1,93 min) que lograra el mismo Tpeak. El T1/2keo estimado es específico para los parámetros FC utilizados y no puede aplicarse de manera indiscriminada a un conjunto de parámetros PC diferente49. Los estimados paramétricos varían entre investigadores y predicen diferentes perfiles de tiempo-concentración. El T1/2keo también será diferente para otras medidas de efecto. Se estimó un T1/2keo de 0,3 min para el Paedfusor utilizando entropía de estado en niños de 6-15 años50. Además, Tpeak dependerá de la tasa a la cual se infunde el fármaco junto con otras interacciones de medicamentos hipnóticos y el efecto deseado51,52. La ansiedad y la liberación de catecolaminas podrían complicar aún más esta medición52.
El uso de señales procesadas del EEG podría asociarse con demora en el procesamiento de la señal. Los puntos finales clínicos tales como el reflejo de parpadeo o el movimiento del brazo son toscos. El uso de modelos incorrectos o mal comprendidos puede dar lugar a efectos adversos, tales como despertar intraoperatorio o hipotensión. Por ejemplo, basado en la teoría alométrica, podemos esperar un menor T1/2keo con una menor edad, y esto es exactamente descrito por Jeleazcov et al.53. La dependencia del modelo de T1/2keo fue demostrada por un estimado de 1,7 min con el conjunto de datos de Kata-ria et al.6 y 0,8 con el modelo Paedfusor23. La medida de efecto utilizada para calcular la demora entre plasma y efecto también tendrá impacto. Los registros del BIS en niños produjeron tiempos más cortos hasta el Tpeak (65 DE 14 s) que los producidos por un monitor de potenciales evocados auditivos (201 DE 74 s)54. Una alternativa al modelo FC-FD integrado es correlacionar la dosis directamente con el efecto clínico (modelo FC-FD)55. Esta es una herramienta clínica efectiva, pero la variabilidad FC no desaparece; simplemente se desplaza hacia parámetros farmacodinámicos.
Un T1/2keo producirá una dosis excesiva en un niño de corta edad si el objetivo es el sitio del efecto y se prevé que Tpeak sea más tarde de lo que realmente es porque se determinó en un adolescente o en un adulto. Las prácticas tales como apuntar a la concentración plasmática en lugar de la concentración en el sitio del efecto podrían evitar la hipotensión, pero lo sofisticado de las actuales bombas TCI podría permitir un mejor control si se programan con mejor información.
Variabilidad del parámetro farmacocinético-farmacodinámico
Existe una considerable variabilidad en cualquier concentración plasmática medida cuando se administran dosis idénticas a individuos. Los valores típicos de variabilidad del parámetro FC de la población son 50% para cumplimiento con esquemas de medicamento, 30% para absorción, 10% para distribución tisular, 50% para eliminación metabólica y 20% para eliminación renal56. Existe una variabilidad similar para los parámetros FD.
Son varios los factores, aparte de la tamaño y la edad, que contribuyen a esta variabilidad: temperatura, patología, tipo de cirugía, ritmos circadianos, farmagenómica, todos tendrán un impacto57. Un factor que adquiere cada vez mayor importancia es la obesidad.
Un escalador de dosificación en niños obesos
Se sabe que las propiedades farmacocinéticas de ciertos medicamentos cambian con la obesidad58. A pesar de que la grasa corporal tiene una actividad metabólica mínima, la masa adiposa contribuye al tamaño corporal global y puede tener una influencia indirecta sobre la depuración tanto metabó-lica como renal. Por otra parte, el volumen de distribución de un fármaco depende de sus propiedades fisicoquímicas59. Hay fármacos cuyo volumen de distribución aparente podría ser independiente de la masa adiposa (p. ej. dioxina) o está determinado en gran medida por esta (p. ej., diazepam). Se han sugerido una serie de descriptores de tamaño para usarlos en el paciente obeso; por ejemplo, el peso corporal total, el peso corporal magro, el peso corporal ideal, el índice de masa corporal (IMC), la masa libre de grasa y la masa grasa normal.
Un tema controvertido para el ajuste de la dosis de propofol en el obeso ha sido la selección de un descriptor de tamaño adecuado para escalar los parámetros farmacocinéticos60,61. En sujetos de peso normal, el peso corporal total es un buen descriptor de tamaño y una buena aproximación de la masa corporal magra60. Sin embargo, en pacientes obesos el peso corporal total sobreestimará la masa corporal magra porque el aumento de esta variable apenas representa del 20 al 40% del exceso total de peso58,61-63. Aún existe controversia respecto a cuál es el descriptor de tamaño que brinda la información más exacta sobre la relación entre la dosis de propofol y sus concentraciones plasmáticas61.
La dosis efectiva de propofol para la pérdida del reflejo de la pestaña fue significativamente menor en pacientes pediátricos obesos (ED95 2,0mgkg-1) en comparación con pacientes no obesos (3,2 mgkg-1). Los niños obesos (IMC >95 percentil de edad y género) requieren una dosis de propofol basada en el peso más baja para la inducción de la anestesia que los niños de peso normal64. Esto se debe a que existe una relación no lineal entre peso, V1 y CL. A pesar de que se ha dicho que un peso corporal magro es la medición ideal para la inducción con propofol65,66, la escalación alométrica utilizando el peso corporal total con un exponente de 0,75 podría ser más apropiada para mantenimiento67,68. Se reporta un exponente de 0,75 de depuración para propofol en adultos obesos69 y adultos y niños no obesos70. Un análisis reciente sugiere un exponente de 0,8 en niños obesos71, un estimado prácticamente indiferenciable del 0,75 a través de la gama de pesos en humanos69.
Un modelo alométrico utilizando el peso corporal total podría ser adecuado para la depuración de propofol, pero no lo es para remifentanilo, en cuyo caso el peso corporal magro podría ser un mejor descriptor de tamaño72. El descriptor de tamaño podría ser diferente para cada fármaco. El uso de la masa adiposa normal con escalamiento alométrico como descriptor de tamaño podría resultar versátil73. En tamaño basado en la masa grasa normal supone que la masa libre de grasa es el principal determinante de tamaño con un factor adicional (que podría ser positivo o negativo) que determina cuánto contribuye la masa adiposa al tamaño.
Interacciones farmacológicas
En adultos se reportan interacciones farmacológicas entre propofol y alfentanilo74 y midazolam75. Ambos fármacos reducen las depuraciones metabólicas y la distribución rápida y lenta de propofol. La competencia por la vía de depuración del CYP3A4 entre propofol, midazolam y alfentanilo también podría impactar en la depuración de alfentanilo. Adicional-mente, una reducción en la presión arterial media se asocia con alteraciones farmacocinéticas de propofol que aumentan la concentración de propofol en sangre75. Podríamos esperar interacciones similares en niños.
El uso de fanobarbitona para el control de las convulsiones en niños induce las enzimas responsables de la depuración de la ketamina (CYP3A4, CYP2C9, CYP2B6)76. Las curvas concentración-respuesta, tanto para la sedación con ketamina como para los efectos de la actividad EEG, son escarpadas77,78. Esto significa que pequeños cambios en la concentración sérica tendrán un efecto espectacular sobre el grado de sedación observado. En consecuencia, los niños que reciben fenobarbitona en el largo plazo requieren más ketamina para la sedación y se despiertan más temprano que los que no reciben el barbiturato79.
Los modelos de interacción farmacodinámica utilizan una modificación del modelo Emax:
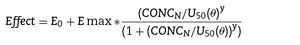
Las concentraciones farmacológicas de los dos diferentes fármacos se normalizan a una potencia relativa y se combinan, creando lo que podría considerarse un «nuevo fármaco»80. Esto se expresa de la siguiente forma:
![]()
donde CONCA es la concentración del fármaco A, ECso.a es la concentración del fármaco A asociado con un 50% del máximo efecto del medicamento, CONCB es la concentración del fármaco B, EC50,B es la concentración del fármaco B asociado con el 5o% del máximo efecto del medicamento (o Emax) y CONCN representa la concentración normalizada controlada de ambos fármacos. Esta metodología se ha usado en niños. La EC50Remifentanilo,la keo Remifentanilo,la EC50Fentanilo y la keo Fentanilo fueron 24,1 µgl-1, 0,71min-1, 8,6 µgl-1 y 0,28 min-1, respectivamente8. Estos datos respaldan las observaciones de que remifentanilo reduce a la mitad la EC50 de propofol para una exitosa inserción de la máscara laríngea y del catéter laríngeo en pacientes pediátricos81. Esta interacción farmacológica aditiva implica que fentanilo y remifentanilo podrían ser intercambiables para obtener un valor BIS predeterminado.
Efectos adversos
La dosis de carga inicial de remifentanilo podría producir hipotensión. Esta respuesta hipotensora se ha cuantificado en niños sometidos a cirugía de cranioplastia. Una concentración de remifentanilo de estado estable de 14 µgl-1 típicamente lograría una reducción del 30% en MAP. Esta concentración
es el doble de la necesaria para laparotomía, pero se logra fácilmente con inyección de bolo. El T1/2keo de 0,86 min para este efecto hemodinámico82 es menor a los cambios del borde espectral inducidos por remifentanilo descritos en adultos (T1/2keo = 1,34 min)15.
Fentanilo combinado con propofol puede producir un efecto similar al de propranolol sobre el nodo sinusal, con la posibilidad de mejorar el tono vagal cardiaco83. Los efectos hipotensores33, la reversión a la circulación neonatal y la menor depuración que produce una sedación prolongada en neonatos siguen siendo obstáculos para el uso de TIVA en este grupo etario84 .
Conclusiones
Las bombas programadas de farmacocinética controlada a objetivo pueden tanto ayudar a la anestesia clínica como servir de herramientas educativas para demostrar la farmacología dinámica. Nuestro creciente conocimiento de las covariables (p.ej., talla, edad, patología, interacciones farmacológicas) ayudará a programar la bomba en niños. Sin embargo, el uso en niños muy pequeños está limitado hasta que no se esclarezcan los perfiles FC y de efectos adversos. El uso en lactantes mejorará con una mejor monitorización. La enorme cantidad de conjuntos paramétricos FC disponibles actualmente que no están debidamente validados y la falta de modelos FD integrados confunden a los operadores novicios. A pesar de estas limitaciones, el uso de TIVA pediátrico sigue creciendo en popularidad con «soluciones provisionales» (p.ej., determinación de keo según la metodología de Tpeak) o soluciones empíricas basadas en la práctica común.
Financiación
Ninguna declarada.
Conflicto de intereses
El autor declara no tener conflicto de intereses.
Agradecimiento
Mi agradecimiento al Dr. Ignacio Cortinez (Santiago, Chile) por la traducción al español.
REFERENCIAS
1. Holford NH. The target concentration approach to clinical drug development. Clin Pharmacokinet. 1995;29:287-91. [ Links ]
2. Benet LZ. A Holy Grail of clinical pharmacology: Prediction of drug pharmacokinetics and pharmacodynamics in the individual patient. Clin Pharmacol Ther. 2009;86:133-4. [ Links ]
3. Ma H, Lovich MA, Peterfreund RA. Quantitative analysis of continuous intravenous infusions in pediatric anesthesia: Safety implications of dead volume, flow rates, and fluid delivery. Paediatr Anaesth. 2011;21:78-86. [ Links ]
4. Tsao AC, Lovich MA, Parker MJ, Zheng H, Peterfreund RA. Delivery interaction between co-infused medications: An in vitro modeling study of microinfusion. Paediatr Anaesth. 2013;23:33-9. [ Links ]
5. McFarlan CS, Anderson BJ, Short TG. The use of propofol infusions in paediatric anaesthesia: A practical guide. Paediatr Anaesth. 1999;9:209-16. [ Links ]
6. Kataria BK, Ved SA, Nicodemus HF, Hoy GR, Lea D, Dubois MY, et al. The pharmacokinetics of propofol in children using three different data analysis approaches. Anesthesiology. 1994;80:104-22. [ Links ]
7. Hill AV. The possible effects of the aggregation of the molecules of haemoglobin on its dissociation curves. J Physiol. 1910;14:iv-vii. [ Links ]
8. Jeleazcov C, Ihmsen H, Schmidt J, Ammon C, Schwilden H, Schuttler J, et al. Pharmacodynamic modelling of the bispectral index response to propofol-based anaesthesia during general surgery in children. Br J Anaesth. 2008;100:509-16. [ Links ]
9. Roberts FL, Dixon J, Lewis GT, Tackley RM, Prys Roberts C. Induction and maintenance of propofol anaesthesia. A manual infusion scheme. Anaesthesia. 1988;43 Suppl:14-7. [ Links ]
10. West GB, Brown JH, Enquist BJ. The fourth dimension of life: Fractal geometry and allometric scaling of organisms. Science. 1999;284:1677-9. [ Links ]
11. Anderson BJ, Holford NH. Mechanism-based concepts of size and maturity in pharmacokinetics. Annu Rev Pharmacol Toxicol. 2008;48:303-32. [ Links ]
12. Rigby-Jones AE, Priston MJ, Sneyd JR, McCabe AP, Davis GI, Tooley MA, et al. Remifentanil-midazolam sedation for paediatric patients receiving mechanical ventilation after cardiac surgery. Br J Anaesth. 2007;99:252-61. [ Links ]
13. Ross AK, Davis PJ, Dear Gd GL, Ginsberg B, McGowan FX, Stiller RD, et al. Pharmacokinetics of remifentanil in anesthetized pediatric patients undergoing elective surgery or diagnostic procedures. Anesth Analg. 2001;93:1393-401. [ Links ]
14. Davis PJ, Wilson AS, Siewers RD, Pigula FA, Landsman IS. The effects of cardiopulmonary bypass on remifentanil kinetics in children undergoing atrial septal defect repair. Anesth Analg. 1999;89:904-8. [ Links ]
15. Minto CF, Schnider TW, Egan TD, Youngs E, Lemmens HJ, Gambus PL, et al. Influence of age and gender on the pharmacokinetics and pharmacodynamics of remifentanil. I. Model development. Anesthesiology. 1997;86:10-23. [ Links ]
16. Egan TD. Remifentanil pharmacokinetics and pharmacodynamics. A preliminary appraisal. Clin Pharmacokinet. 1995;29:80-94. [ Links ]
17. Welzing L, Ebenfeld S, Dlugay V, Wiesen MH, Roth B, Mueller C. Remifentanil degradation in umbilical cord blood of preterm infants. Anesthesiology. 2011;114:570-7. [ Links ]
18. Berde C. Convulsions associated with pediatric regional anesthesia. Anesth Analg. 1992;75:164-6. [ Links ]
19. Tod M, Jullien V, Pons G. Facilitation of drug evaluation in children by population methods and modelling. Clin Pharmacokinet. 2008;47:231-43. [ Links ]
20. Ogawa S, Okutani R, Suehiro K. Anesthetic management using total intravenous anesthesia with remifentanil in a child with osteogenesis imperfecta. J Anesth. 2009;23:123-5. [ Links ]
21. Marsh B, White M, Morton N, Kenny GN. Pharmacokinetic model driven infusion of propofol in children. Br J Anaesth. 1991;67:41-8. [ Links ]
22. Gepts E, Camu F, Cockshott ID, Douglas EJ. Disposition of propofol administered as constant rate intravenous infusions in humans. Anesth Analg. 1987;66:1256-63. [ Links ]
23. Absalom A, Amutike D, Lal A, White M, Kenny GN. Accuracy of the ';Paedfusor'; in children undergoing cardiac surgery or catheterization. Br J Anaesth. 2003;91:507-13. [ Links ]
24. Rigby-Jones AE, Nolan JA, Priston MJ, Wright PM, Sneyd JR, Wolf AR. Pharmacokinetics of propofol infusions in critically ill neonates, infants, and children in an intensive care unit. Anesthesiology. 2002;97:1393-400. [ Links ]
25. Minto C, Schnider T. Expanding clinical applications of population pharmacodynamic modelling. Br J Clin Pharmacol. 1998;46:321-33. [ Links ]
26. Sepulveda P, Cortinez LI, Saez C, Penna A, Solari S, Guerra I, et al. Performance evaluation of paediatric propofol pharmacokinetic models in healthy young children. Br J Anaesth. 2011;107:593-600. [ Links ]
27. Rigouzzo A, Servin F, Constant I. Pharmacokinetic-pharmacodynamic modeling of propofol in children. Anesthesiology. 2010;113:343-52. [ Links ]
28. Marsh DF, Hodkinson B. Remifentanil in paediatric anaesthetic practice. Anaesthesia. 2009;64:301-8. [ Links ]
29. Allegaert K, de Hoon J, Verbesselt R, Naulaers G, Murat I. Maturational pharmacokinetics of single intravenous bolus of propofol. Paediatr Anaesth. 2007;17:1028-34. [ Links ]
30. Anderson BJ. Pediatric models for adult target-controlled infusion pumps. Paediatr Anaesth. 2010;20:223-32. [ Links ]
31. Allegaert K, Peeters MY, Verbesselt R, Tibboel D, Naulaers G, de Hoon JN, et al. Inter-individual variability in propofol pharmacokinetics in preterm and term neonates. Br J Anaesth. 2007;99:864-70. [ Links ]
32. Steur RJ, Perez RS, de Lange JJ. Dosage scheme for propofol in children under 3 years of age. Paediatr Anaesth. 2004;14:462-7. [ Links ]
33. Lerman J, Heard C, Steward DJ. Neonatal tracheal intubation: An imbroglio unresolved. Paediatr Anaesth. 2010;20:585-90. [ Links ]
34. Bennett C, Voss LJ, Barnard JP, Sleigh JW. Practical use of the raw electroencephalogram waveform during general anesthesia: The art and science. Anesth Analg. 2009;109:539-50. [ Links ]
35. Davidson AJ. Measuring anesthesia in children using the EEG. Pediatr Anesthesia. 2006;16:374-87. [ Links ]
36. Davidson AJ, Huang GH, Rebmann CS, Ellery C. Performance of entropy and Bispectral Index as measures of anaesthesia effect in children of different ages. Br J Anaesth. 2005;95:674-9. [ Links ]
37. Iwakiri H, Nishihara N, Nagata O, Matsukawa T, Ozaki M, Sessler DI. Individual effect-site concentrations of propofol are similar at loss of consciousness and at awakening. Anesth Analg. 2005;100:107-10. [ Links ]
38. McCormack J, Mehta D, Peiris K, Dumont G, Fung P, Lim J, et al. The effect of a target controlled infusion of propofol on predictability of recovery from anesthesia in children. Paediatr Anaesth. 2010;20:56-62. [ Links ]
39. Mani V, Morton NS. Overview of total intravenous anesthesia in children. Paediatr Anaesth. 2009;20:211-22. [ Links ]
40. Hume-Smith H, McCormack J, Montgomery C, Brant R, Malherbe S, Mehta D, et al. The effect of age on the dose of remifentanil for tracheal intubation in infants and children. Paediatr Anaesth. 2010;20:19-27. [ Links ]
41. Long LS, Ved S, Koh JL. Intraoperative opioid dosing in children with and without cerebral palsy. Paediatr Anaesth. 2009;19:513-20. [ Links ]
42. Valkenburg AJ, de Leeuw TG, Tibboel D, Weber F. Lower bispectral index values in children who are intellectually disabled. Anesth Analg. 2009;109:1428-33. [ Links ]
43. Rigouzzo A, Girault L, Louvet N, Servin F, De-Smet T, Piat V, et al. The relationship between bispectral index and propofol during target-controlled infusion anesthesia: A comparative study between children and young adults. Anesth Analg. 2008;106:1109-16. [ Links ]
44. Liu N, Bourgeois E, Chazot T, Murat I, Fischler M. Closed-loop administration of propofol and remifentanil guided by the Bispectral Index in patient requiring an emergency lung volume reduction. Paediatr Anaesth. 2007;17: 909-10. [ Links ]
45. Minto CF, Schräder TW, Gregg KM, Henthorn TK, Shafer SL. Using the time of maximum effect site concentration to combine pharmacokinetics and pharmacodynamics. Anesthesiology. 2003;99:324-33. [ Links ]
46. Billard V, Gambus PL, Chamoun N, Stanski DR, Shafer SL. A comparison of spectral edge, delta power, and bispectral index as EEG measures of alfentanil, propofol, and midazolam drug effect. Clin Pharmacol Ther. 1997;61:45-58. [ Links ]
47. Struys MM, de Smet T, Depoorter B, Versichelen LF, Mortier EP, Dumortier FJ, et al. Comparison of plasma compartment versus two methods for effect compartment-controlled target-controlled infusion for propofol. Anesthesiology. 2000;92:399-406. [ Links ]
48. Schnider TW, Minto CF, Shafer SL, Gambus PL, Andresen C, Goodale DB, et al. The influence of age on propofol pharmacodynamics. Anesthesiology. 1999;90:1502-16. [ Links ]
49. Coppens MJ, Eleveld DJ, Proost JH, Marks LA, Van Bocxlaer JF, Vereecke H, et al. An evaluation of using population pharmacokinetic models to estimate pharmacodynamic parameters for propofol and bispectral index in children. Anesthesiology. 2011;115:83-93. [ Links ]
50. Hahn JO, Khosravi S, Dumont GA, Ansermino JM. Two-stage vs mixed-effect approach to pharmacodynamic modeling of propofol in children using state entropy. Paediatr Anaesth. 2011;21:691-8. [ Links ]
51. Sneyd JR, Rigby-Jones AE. Effect site: who needs it? Br J Anaesth. 2007;98:701-4. [ Links ]
52. Rigby-Jones A, Sneyd JR. Cardiovascular changes after achieving constant effect site concentration of propofol. Anaesthesia. 2008;63:780. [ Links ]
53. Jeleazcov C, Schmidt J, Schmitz B, Becke K, Albrecht S. EEG variables as measures of arousal during propofol anaesthesia for general surgery in children: Rational selection and age dependence. Br J Anaesth. 2007;99:845-54. [ Links ]
54. Munoz HR, Leon PJ, Fuentes RS, Echevarría GC, Cortinez LI. Prospective evaluation of the time to peak effect of propofol to target the effect site in children. Acta Anaesthesiol Scand. 2009;53:883-90. [ Links ]
55. Hahn JO, Dumont GA, Ansermino JM. A direct dynamic dose-response model of propofol for individualized anesthesia care. IEEE Trans Biomed Eng. 2012;59:571-8. [ Links ]
56. Holford NHG, Peck CC. Population pharmacodynamics and drug development. En: Boxtel CJ, Holford NHG, Danhof M, editores. The In Vivo Study of Drug Action. New York: Elsevier Science Publishers; 1992. p. 401-14. [ Links ]
57. Anderson BJ. My child is unique; the pharmacokinetics are universal. Pediatr Anesth. 2012;22:530-8. [ Links ]
58. Han PY, Duffull SB, Kirkpatrick CM, Green B. Dosing in obesity: A simple solution to a big problem. Clin Pharmacol Ther. 2007;82:505-8. [ Links ]
59. Abernethy DR, Greenblatt DJ. Drug disposition in obese humans. An update. Clin Pharmacokinet. 1986;11:199-213. [ Links ]
60. Bouillon T, Shafer SL. Does size matter? Anesthesiology. 1998;89:557-60. [ Links ]
61. Green B, Duffull SB. What is the best size descriptor to use for pharmacokinetic studies in the obese? Br J Clin Pharmacol. 2004;58:119-33. [ Links ]
62. Casati A, Torri G. Cardiovascular stability during inhalational anaesthesia in morbidly obese patients: Which is better, sevoflurane or desflurane? Br J Anaesth. 2004;93:153-4. [ Links ]
63. Peters AM, Snelling HL, Glass DM, Love S, Bird NJ. Estimated lean body mass is more appropriate than body surface area for scaling glomerular filtration rate and extracellular fluid volume. Nephron Clin Pract. 2010;116:c75-80. [ Links ]
64. Olutoye OA, Yu X, Govindan K, Tjia IM, East DL, Spearman R, et al. the effect of obesity on the ED95 of propofol for loss of consciousness in children and adolescents. Anesth Analg. 2012;115:147-53. [ Links ]
65. Green B, McLeay SC. Anesthetizing the obese. Anesth Analg. 2011;113:1-3. [ Links ]
66. McLeay SC, Morrish GA, Kirkpatrick CM, Green B. Encouraging the move towards predictive population models for the obese using propofol as a motivating example. Pharm Res. 2009;26:1626-34. [ Links ]
67. Anderson BJ, Holford NH. Mechanistic basis of using body size and maturation to predict clearance in humans. Drug Metab Pharmacokinet. 2009;24:25-6. [ Links ]
68. Rigby-Jones AE, Sneyd JR. Pharmacokinetics and pharmacodynamics-is there anything new? Anaesthesia. 2012;67:5-11. [ Links ]
69. Cortinez LI, Anderson BJ, Penna A, Olivares L, Munoz HR, Holford NH, et al. Influence of obesity on propofol pharmacokinetics: derivation of a pharmacokinetic model. Br J Anaesth. 2010;105:448-56. [ Links ]
70. Schuttler J, Ihmsen H. Population pharmacokinetics of propofol: A multicenter study. Anesthesiology. 2000;92:727-38. [ Links ]
71. Diepstraten J, Chidambaran V, Sadhasivam S, Esslinger HR, Cox SL, Inge TH, et al. Propofol clearance in morbidly obese children and adolescents: Influence of age and body size. Clin Pharmacokinet. 2012;51:543-51. [ Links ]
72. Egan TD, Huizinga B, Gupta SK, Jaarsma RL, Sperry RJ, Yee JB, et al. Remifentanil pharmacokinetics in obese versus lean patients. Anesthesiology. 1998;89:562-73. [ Links ]
73. Rhodin MM, Anderson BJ, Peters AM, Coulthard MG, Wilkins B, Cole M, et al. Human renal function maturation: A quantitative description using weight and postmenstrual age. Pediatr Nephrol. 2009;24:67-76. [ Links ]
74. Mertens MJ, Olofsen E, Burm AG, Bovill JG, Vuyk J. Mixed-effects modeling of the influence of alfentanil on propofol pharmacokinetics. Anesthesiology. 2004;100:795-805. [ Links ]
75. Vuyk J, Lichtenbelt BJ, Olofsen E, van Kleef JW, Dahan A. Mixed-effects modeling of the influence of midazolam on propofol pharmacokinetics. Anesth Analg. 2009;108:1522-30. [ Links ]
76. Sumpter A, Anderson BJ. Phenobarbital and some anesthesia implications. Pediatr Anesth. 2011;21:995-7. [ Links ]
77. Herd DW, Anderson BJ, Keene NA, Holford NH. Investigating the pharmacodynamics of ketamine in children. Paediatr Anaesth. 2008;18:36-42. [ Links ]
78. Schuttler J, Stanski DR, White PF, Trevor AJ, Horai Y, Verotta D, et al. Pharmacodynamic modeling of the EEG effects of ketamine and its enantiomers in man. J Pharmacokinet Biopharm. 1987;15:241-53. [ Links ]
79. Eker HE, Yalcin Cok O, Aribogan A, Arslan G. Children on phenobarbital monotherapy requires more sedatives during MRI. Pediatric Anesthesia. 2011;21:998-1002. [ Links ]
80. Minto CF, Schnider TW, Short TG, Gregg KM, Gentilini A, Shafer SL. Response surface model for anesthetic drug interactions. Anesthesiology. 2000;92:1603-16. [ Links ]
81. Park HJ, Lee JR, Kim CS, Kim SD, Kim HS. Remifentanil halves the EC50 of propofol for successful insertion of the laryngeal mask airway and laryngeal tube in pediatric patients. Anesth Analg. 2007;105:57-61. [ Links ]
82. Standing JF, Hammer GB, Sam WJ, Drover DR. Pharmacokinetic-pharmacodynamic modeling of the hypotensive effect of remifentanil in infants undergoing cranioplasty. Pediatr Anesth. 2010;20:7-18. [ Links ]
83. Fujii K, Iranami H, Nakamura Y, Hatano Y. Fentanyl added to propofol anesthesia elongates sinus node recovery time in pediatric patients with paroxysmal supraventricular tachycardia. Anesth Analg. 2009;108:456-60. [ Links ]
84. Allegaert K. Is propofol the perfect hypnotic agent for procedural sedation in neonates? Curr Clin Pharmacol. 2009;4:84-6. [ Links ]
85. Short TG, Aun CS, Tan P, Wong J, Tam YH, Oh TE. A prospective evaluation of pharmacokinetic model controlled infusion of propofol in paediatric patients. Br J Anaesth. 1994;72: 302-6. [ Links ]
86. Murat I, Billard V, Vernois J, Zaouter M, Marsol P, Souron R, et al. Pharmacokinetics of propofol after a single dose in children aged 1-3 years with minor burns. Comparison of three data analysis approaches. Anesthesiology. 1996;84:526-32. [ Links ]
87. Saint-Maurice C, Cockshott ID, Douglas EJ, Richard MO, Harmey JL. Pharmacokinetics of propofol in young children after a single dose. Br J Anaesth. 1989;63:667-70. [ Links ]











 texto en
texto en