Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.42 no.4 Bogotá Oct./Dec. 2014
https://doi.org/10.1016/j.rca.2014.04.004
http://dx.doi.org/10.1016/j.rca.2014.04.004
Investigación científica y tecnológica
Desempeño predictivo y clínico de un dispositivo target-controlled infusion para sevofluorano en una estación de trabajo convencional: correlación farmacocinética del modelo empleado
Predictive and clinical performance of a target-controlled infusion device for sevoflurane at a conventional workstation: Pharmacokinetic correlation of the model used
César Augusto Candia Aranaa,* Caridad Greta Castillo Monzóna, José Antonio Álvarez Gómeza, Joaquín Roca Gonzálezb y Javier Hernando Eslava Schmalbachc
a Especialista en Anestesiología y Reanimación, Servicio de Anestesiología y Reanimación, Complejo Hospitalario Universitario de Cartagena, Cartagena, Murcia, Españab Profesor titular, Grupo de Investigación de Electrónica Médica e Industrial, Universidad Politécnica de Cartagena, Cartagena, Murcia, España
c Profesor titular, Grupo de Equidad en Salud, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá, Colombia
*Autor para correspondencia: Calle Ronda, Ciudad de la Unión n.° 8, Esc 2, 2A, CP 30203 Cartagena, Murcia, España. Correo electrónico: ccandia@hotmail.es (C.A. Candia Arana).
Recibido el 10 de enero de 2014 - Aceptado el 7 de abril de 2014
Resumen
Introducción: La racionalización de recursos y el calentamiento global han despertado el interés en la anestesia inhalatoria con flujos mínimos (0,3-0,5 l/min).
Objetivos: Conocer el desempeño predictivo, clínico y la correlación farmacocinética de un dispositivo target-controlled infusion (TCI) para sevofluorano.
Metodología: Estudio prospectivo, longitudinal y analítico en 25 pacientes adultos. Flujo de gas fresco empleado 0,5 l/min. Concentración objetivo de sevofluorano 1,2% v/v. Infusión continua y variable en el circuito de la estación de anestesia. Controlador desarrollado con LABVIEW 6.1. Datos hemodinámicos, respiratorios y profundidad anestésica capturados cada 5 s con software de la estación de anestesia. Se determinó en la primera hora: sesgo (Mediana del Error Predictivo, MDPE%), inexactitud (Mediana del valor absoluto del Error Predictivo, MDAPE%), oscilación y divergencia del TCI; análisis del área bajo la curva de las concentraciones objetivo y espirada con pkcollapse STATA-12. Resultados expresados en media (IC 95%) y mediana [IQR]*.
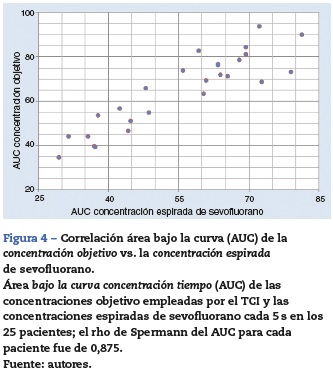
Resultados: Concentración objetivo empleada 1,22 [1,14-1,37]%*, alcanzada en 04:07 [03:1506:15]* min:s (en rama espiratoria). Duración anestésica 1:10:50 (0:56:57-1:24:43) h:min:s. Consumo de sevofluorano 6,9 (5,7-8,0) ml. MDPE% -12,8 (-17,6 a -8,1)%; MDAPE% 15,9 (11,919,8) %; oscilación 6,9 (5,0-8,7) % y divergencia 0,89 (-5,96-7,7)%h-1. Interacciones por hora sobre el TCI de 3 (2-4). Correlación del área bajo la curva, Spermann rho = 0,8577; p < 0,00001. La inexactitud ≥ 15% se asoció con edad > 65 años y obesidad.
Conclusiones: El TCI sevoflurane© ó buen desempeño, la concentración objetivo se alcanzó rápidamente y se mantuvo estable, siendo necesarias pocas interacciones sobre el dispositivo durante la primera hora. No hubo sobredosificación ni alteraciones clínicas significativas.
Palabras clave: Anestésicos por inhalación, Calentamiento global, Farmacocinética, Economía farmacéutica, Anestesia.
Abstract
Introduction: Good governance of resources and global warming has attracted interest on minimal flow (0.3–0.5 l/min) inhalation anesthesia.
Objectives: To evaluate the predictive and clinical performance of a TCI (Target-controlled infusion) device, and its pharmacokinetic correlation for sevoflurane.
Methods: Prospective, longitudinal, and analytical study on 25 adult patients. Fresh gas flow used 0.5 l/min. Target concentration of 1.2% (v/v). Continuous and variable infusion into the circuit of the anesthesia workstation. Controller developed with LABVIEW 6.1. Hemodynamic, respiratory and anesthetic depth data collected every 5 s using the anesthesia workstation software. Bias (MDPE%), inaccuracy (MDAPE%), wobble, and divergence of the TCI device were determined in the first hour. STATA-12 pk collapse was used to analyze the area under the curve of the target and expired concentrations. The results are expressed as Mean (CI 95%) and Median [IQR]*.
Results: Target concentration used 1.22 [1.14–1.37] %*, reached in 04:07 [03:15–06:15]* min:s (expiratory branch). Anesthetic duration 1:10:50 (00:56:57–1:24: 43) h:min:s. Sevoflurane consumption 6.9 (5.7–8.0) ml. MDPE% -12.8 (-17.6 to -8.1) %;MDAPE% 15.9 (11.9–19.8) %;wobble 6.9 (5.0–8.7)% and divergence 0.89% (-5.96 to 7.7)%h-1. Interactions per hour on the TCI of 3 (2–4). Correlation of the area under the curve, Spearman's rho = 0.8577, p < 0.00001. =15% inaccuracy was associated with age >65 years and obesity.
Conclusions: The TCI sevoflurane© showed good performance, and the target concentration was rapidly reached and remained stable, with few interactions with the device needed during the first hour. There were neither overdosing nor clinically significant alterations.
Keywords: Anesthetics, inhalation Global warming Pharmacokinetics Economics, pharmaceutical Anesthesia.
Introducción
La anestesia con flujos bajos de gas fresco (FBGF), 0,51,0 l/min, ha demostrado reducir el consumo y los costos sanitarios1, minimizar la exposición laboral y la contaminación atmosférica2; además, permite calentar y humidificar los gases inspirados3, características que se optimizan con el uso de flujos mínimos de gas fresco (FMGF), 0,3-0,5 l/min.
A pesar de que el uso de sevofluorano con FMGF fue asociado con acumulación de sustancias tóxicas y nefrotoxicidad, hasta la actualidad esta no ha sido demostrada en humanos4, ni durante intervenciones prolongadas5, ni empleando cal sodada6. Se desaconseja el empleo de óxido nitroso (N2O) para evitar la administración de mezclas hipóxicas; como prescindir del uso de FMGF en pacientes con hematomas grandes, hemólisis severa y transfusión masiva para evitar la acumulación endógena de monóxido de carbono por degradación del grupo Hem7.
Ryan y Nielsen8, empleando un FGF de 2 l/min (O2+ aire) y una concentración alveolar mínima durante una hora (CAMh) calcularon el equivalente de dióxido de carbono emitido durante 20 año (CDE20) para el sevofluorano, encontrándolo similar al emitido por un automóvil al recorrer 28 km (6.980 g de CO2/h); el asociar N2O al 60% incrementó 5,9 veces este efecto.
Diferentes aplicaciones se han utilizado para implementar FBGF y FMGF con vaporizador: el simulador Gasman®9, el software predictivo en tiempo real de las concentraciones de halogenado desarrollado por Kennedy et al.10, y un software que alerta si el FGF supera un litro o2CAM-h para sevofluorano11. Estos 2 últimos programas lograron reducir el FGF empleado un 35%12 y un 24%, respectivamente.
La primera estación de trabajo con control en lazo cerrado e inyección del halogenado fue la Phisioflex® (Phisio B.V. Haarlem, Holanda)13, la cual fue retirada del mercado por su alto costo de adquisición. Posteriormente, la estación Drager-Zeus® (Drägerwerk AG &Co, Lübeck, Alemania) demostrór constantes las concentraciones inspirada de oxígeno y espirada de anestésico, mostrando un menor consumo de halogenado y mayor estabilidad hemodinámica14. Recientemente se reporta, con el módulo ET Control® e la estación de trabajo Aisys-GETM (GE healthcare, Madison, EE. UU.), una reducción del 27% del consumo y del 44% de las emisiones de gases con efecto invernadero15.
Inicialmente la inyección de sevofluorano líquido con jeringa se realizó para determinar el modelo de captación en circuito cerrado16,17. Actualmente se dispone del dispositivo AnaConDaTM (Hudson RCI, Uppsland Väsby, Suecia), el cual inyecta el halogenado en un circuito de no reinhalación, con un ahorro de anestésico similar a una técnica de FBGF18.
A mediados de los noventa, Candia y Acosta19 desarrollaron el primer modelo de TCI para halogenados basado en la ecuación propuesta por Lowe y Ernest20; esta aplicación informática permitió la inyección continua del halogenado, eliminando la administración de bolos y el empleo del cronómetro. En una segunda versión se simularon otros modelos de captación y se ajustó la infusión a la superficie corporal. Posteriormente los autores Candia y Roca desarrollaron la tercera versión del TCI sevoflurane© a estaciones de trabajo actuales, empleando FMGF21.
Los objetivos principales del estudio fueron evaluar el desempeño del TCI sevoflurane© en la población general de nuestro hospital con la metodología aceptada para TCI y estimar la correlación farmacocinética del modelo, determinando el área bajo la curva de las concentraciones objetivo y espirada. Fueron objetivos secundarios: conocer el comportamiento durante la primera hora de las variables hemodinámicas, respiratorias, la profundidad anestésica y analizar la relación entre el desempeño del controlador y las características de los pacientes.
Métodos
Estudio prospectivo, longitudinal y analítico, realizado en el Complejo Hospitalario Universitario de Cartagena. El protocolo fue aprobado por el Comité de Ética e Investigación Clínica del hospital y se obtuvo el consentimiento informado. Fueron incluidos 30 pacientes adultos que cumplieron los siguientes criterios: edad entre 16 y 90 años, ASA I-III y programados para cirugía electiva con duración mayor a 30 min. Fueron excluidos: población obstétrica, fumadores crónicos y pacientes con antecedentes de farmacodependencia. Se premedicaron 20 min previos a la inducción con midazolam 1-2 mg o fentanilo 50-100 μg. Desnitrogenización durante 3 min con O2 a 8 l/min. Inducción con TCI de propofol y remifentanilo a concentraciones efecto de 3-4,5 μg/ml y 3-4,7 ng/ml respectivamente y rocuronio 2DE95. Tras la intubación se redujo el FGF a 0,5 l/min (O2 0,35 l/min + aire 0,15 l/min), se suspendió el propofol y se inició el TCI sevoflurane© con una concentración objetivo de 1,2% v/v; valor medio obtenido del análisis de estudios realizados para determinar la concentración necesaria para obtener un BIS ≤ 50 en pacientes de edad ≤ 40 años (MACBIS50)22-24. Se utilizó remifentanilo para el mantenimiento por su sinergia con sevofluorano25.
El TCI se desarrolló con el programa Labview® 6,1 (National Instruments, Austin, EE. UU.), que permitió la infusión continua y variable del sevofluorano líquido en la estación Aespire-View® (GE-Healthcare, Madison, EE. UU.), empleando la jeringa infusora Harvard Apparatus 22 (South Natick, EE. UU.). Con los parámetros de edad, peso, talla y sexo se estimó: la con centración objetivo ajustada a la edad26, el consumo de oxígeno y volumen minuto27 y el volumen efectivo pulmonar28. La dosis de purga del sistema (circuito-paciente) se administró en el primer minuto. Se empleó un modelo biexponencial negativo derivado de un estudio de captación en circuito cerrado17. Si eran necesarias, se realizaron interacciones sobre el TCI, modificando la concentración objetivo, guiadas por el analizador de gases (fig. 1).
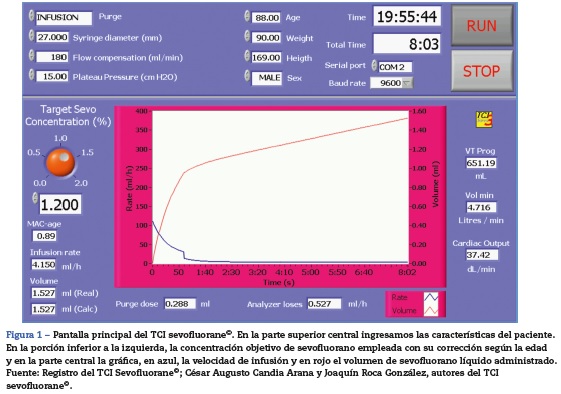
El volumen del sistema incluyó un circuito tipo adulto (M1019499, GE, Helsinki, Finlandia), el humidificador, la conexión del analizador y el tubo orotraqueal. Las fugas del analizador de gases fueron adicionadas al modelo. La absorción y degradación del sevofluorano por la cal sodada no fueron incluidas en los cálculos, por considerarlas de poca importancia clínica29. La cal sodada empleada estaba parcialmente usada y humedecida. El sevofluorano fue envasado en jeringa con un adaptador (26042, Sedana Medical AB, Sundbyberg, Suecia) y mediante una extensión (MFX1954-ALARIS®, Höchberg, Alemania) fue acoplada en la rama inspiratoria a un conector en tmetálico modificado del descrito por Parra30. La jeringa y la extensión plástica mantuvieron su estabilidad física31.
Las variables principales fueron: las concentraciones objetivo, inspirada y espirada de sevofluorano, capturadas cada 5 s con el software S/5TMCollect4 (GE Healthcare, Helsinki, Finlandia); la precisión para la medición fue 0,15% v/v, según prospecto del fabricante. Variables secundarias: la presión arterial sistólica (PAS), la frecuencia cardiaca (FC), el CO2 teleespiratorio (CO2-ET), la fracción inspirada de oxígeno (FiO2), las entropías de estado (ES) y de respuesta (ER).
El desempeño del TCI32 se fundamentó en el cálculo del error predictivo (PE%)

Cada 5 s inferimos el sesgo (MDPE%),la inexactitud (MDAPE%) y la oscilación del controlador. La MDPE% es la mediana del PE%. Es el signo del error indica: sobredosificación (+) o infradosificación (-). La MDAPE % es la mediana del valor absoluto del PE%. Es la magnitud del error. La oscilación es la mediana del valor absoluto de la diferencia de cada PE% con el MDPE% del sujeto. Mide la inestabilidad o variabilidad de la predicción en cada paciente. La divergencia es la pendiente de la curva de regresión lineal de los valores absolutos del PE% vs. tiempo, se expresa en porcentaje de divergencia por hora; su valor positivo indica la tendencia de la concentración objetivo en el tiempo a alejarse de la concentración medida o espirada y su valor negativo indica convergencia.
Se determinó la normalidad de los datos con el estadístico Shapiro-Wilks. La comparación de medianas de las concentraciones objetivo, inspirada y espirada se realizó con el test de rango de los signos. Se empleó el chi cuadrado o el test exacto de Fischer y el análisis de regresión logística binaria para buscar asociación entre las variables agrupadas de los pacientes por: edad ≥ 65 años, sexo, IMC ≥ 30, clasificación ASA y número de interacciones sobre el TCI < 3 por hora; comparándolos con los parámetros agrupados visualmente del desempeño del TCI: MDPE% < -13%, MDAPE% < 15%, oscilación < 7% y divergencia negativa.
El análisis de datos se realizó con SPSS 21 (IBM®, Armonk, EE. UU.) y Excel 2007 (Microsoft®, Redmond, EE. UU.), el análisis farmacocinético del área bajo la curva de la concentración objetivo y la concentración espirada de sevofluorano, con el módulo de generación de datos farmacocinéticos (pkcollapse) de Stata 12 (Stata Corp, College Station, EE. UU.). Los resultados se expresaron en media (IC 95%) para los normalmente distribuidos y mediana con rango intercuartílico Me [IQR 25-75%]* para los no paramétricos y el nivel de significación aceptado fue p < 0,05. Como estimador se utilizó odds ratio (IC 95%). El tama no muestral con un error alfañ= 0,05 y una potencia beta = 0,8 fue de 25 pacientes y se estimó con base en nuestro estudio piloto22, empleando la varianza de la MDAPE% = 9,86.
Resultados
Completaron el estudio 25 de 30 pacientes, 3 fueron excluidos por pérdida de datos y 2 por fugas del circuito. El 80% de los pacientes tuvieron IMC ≥ 25. El 48% de las cirugías se realizaron por laparoscopia (tabla 1).
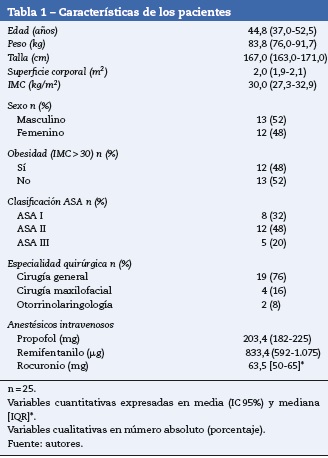
Las concentraciones objetivo, inspirada y espirada mostraron distribuciones no paramétricas; la mediana de la concentración espirada de sevofluorano fue un 18,4% inferior a la mediana de la concentración objetivo empleada. Un 84,5% de los valores del PE% mostró distribución normal, por lo cual se expresó MDPE%, MDAPE%, oscilación y divergencia del TCI con media (IC 95%) (tabla 2).
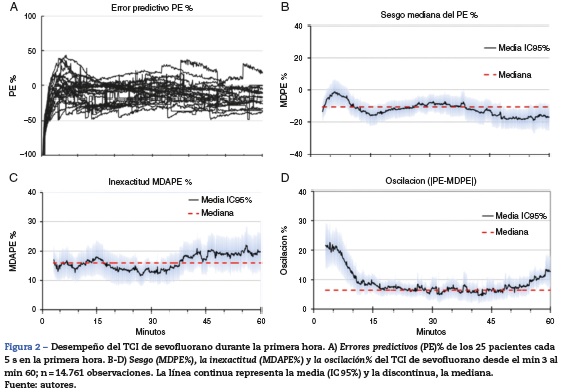
En valores absolutos, la MDPE% se correspondió con una infradosificación < 0,16% v/v (fig. 2B). La MDAPE% en promedio fue del 16% hasta el min 40 (fig. 2C). La oscilación en promedio fue < 10% (0,12% v/v) entre los min 10 y 55 (fig. 2D).
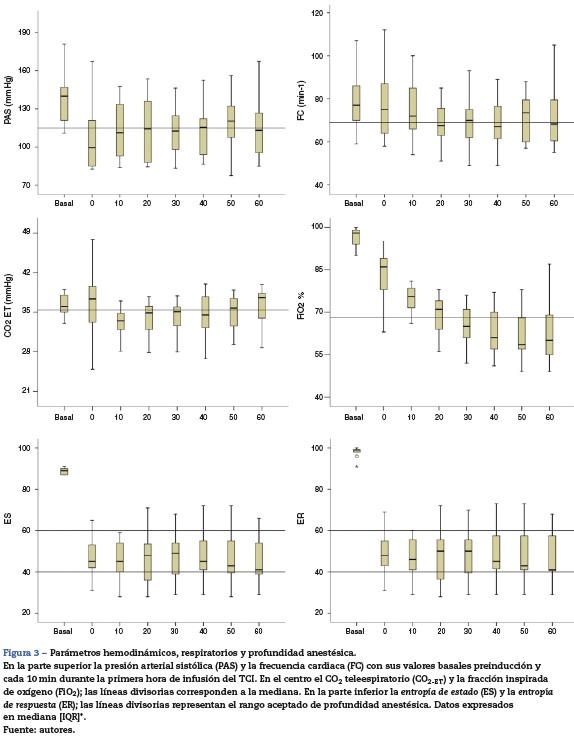
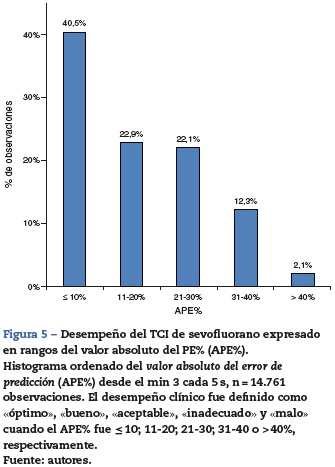
El desempeño clínico del TCI se muestra con diagramas de cajas (fig. 3). La PAS mostró una reducción del 13% en el 50% de los pacientes al min 0. La FC, el CO2-ET, la ES y la ER no mostraron alteraciones significativas. La FiO2 mostró desde el lavado del nitrógeno un descenso rápido en los primeros 30 min y se mantuvo entre el 70 y el 60% entre el min 30 y el 60. La correlación del área bajo la curva del tiempo de las concentraciones objetivo y espirada de cada uno de los pacientes fue alta (r2 = 0,766) (fig. 4). El desempeño cada 5 s semostró con un histograma ordenado del valor absoluto del PE% (fig. 5).
De las variables agrupadas se encontró asociación entre el número de interacciones por hora sobre el TCI < 3 y la MDAPE < 15%, con un valor p < 0,033 y un odds ratio (IC 95%) de 7,77 (1,3-46,1). La edad < 65 años se relacionó conMDAPE < 15% con un valor p < 0,039 y un odds ratio de 0,381 (0,22-0,66). La presencia de obesidad se relacionó con una MDAPE = 15% con una significación p < 0,036 unilateral y un odds ratio (IC 95%) de 4,5 (0,87-23,26). Los demás parámetros del controlador y características agrupadas no mostraron asociación.
Discusión
Este estudio evaluó el desempeño predictivo, clínico y la correlación farmacocinética de un dispositivo TCI para sevofluorano, empleando FMGF desde el inicio de la anestesia. Una concentración objetivo de 1,2% v/v permitió mantener estable la concentración espirada de sevofluorano. La CAM empleada 0,6 mantuvo la estabilidad de los parámetros hemodinámicos, respiratorios y de profundidad anestésica evaluados. La mezcla de gases empleada oxígeno-aire mantuvo la FiO2 en niveles seguros durante la hora de evaluación (fig. 3).
Tradicionalmente para efectuar la anestesia con FMGF se han empleado modificaciones del FGF y del dial del vaporizador33, su validación utilizando sevofluorano mostró una sobredosificación menor al 20%34,35; inversamente, el TCI sevoflurane© mostró una infradosificación menor del 16%. El TCI sevoflurane© detectó trazas de halogenado y alcanzó la concentración objetivo en la rama espirada en 35 s y 04:07 min respectivamente (tabla 2). El dispositivo AnaConDaTM36 obtuvo estos mismos parámetros en 3:50 min y 13:09 min. El TCI sevoflurane© alcanzó la concentración objetivo en menor tiempo debido a la administración de un bolo en el primer minuto; a diferencia de esto, la AnaConDaTM requiere una infusión manual y constante, lo cual retrasa el tiempo de inducción cuando se utiliza en el quirófano.
El tiempo para extubación fue en promedio de 7 min, correspondiéndose con las 3 constantes de tiempo (τ = 2,5 min) necesarias para realizar el lavado del 95% del sevofluorano a nivel cerebral y con las 3 vidas medias de la constante proporcional de equilibrio de primer orden entre el alvéolo y el sitio efecto (T1/2 Keo = 2,4 min)37. El TCI sevoflurane© permitió la normocapnia empleando un volumen corriente entre 7 y 8ml/kg; a diferencia de la AnaConDaTM donde el espacio muerto hace necesario un incremento del volumen corriente a 10 ml/kg, para prevenir la hipercapnia y la condensación de vapor de agua36. También la AnaConDaTM absorbe el CO2 exhalado, el cual es reinhalado en la siguiente respiración, creando un efecto de espacio muerto equivalente a 180 ml adicionales a su volumen interno de 100 ml. Este efecto debe ser estudiado y modificado antes de incluir este dispositivo en la práctica anestésica, según los autores38.
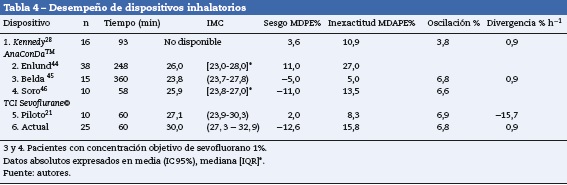
Inicialmente el desempeño de los dispositivos TCI se consideró aceptable con MDPE%<± 20% y MDAPE% del 20-40%39; recientemente40 se acepta como buen desempeño MDPE% < ±15% y MDAPE% < 25%, condición que cumple el TCI sevoflurane© (tabla 3)39–43.
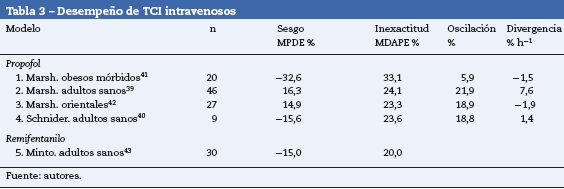
En este estudio, el rango de edad de la población fue amplio (16-88); la asociación encontrada entre MDAPE%=15% en pacientes mayores de 65 años se podría explicar por la presencia de comorbilidades, evidenciada por la ausencia de pacientes con clasificación de estado físico ASAI en este grupo. En la AnaConDaTM, empleando el modelo de Enlund et al.44, el MDAPE% fue más alto por varias razones: utilizaron circuito de reinhalación, rango amplio de concentraciones (0,5-8%), incluyeron a pacientes pediátricos y la inducción se realizó durante 30 s. A diferencia de Belda et al.45 y Soro et al.46, encontraron menor MDAPE%, empleando circuitos de no-reinhalación, concentraciones fijas por grupos de pacientes, rangos de edad estrechos y la inducción la realizaron en 10 min. Soro et al.46 explicaron sus diferencias con el estudio de Belda et al.45 porque el tiempo de evaluación fue menor a una hora y sus mediciones fueron afectadas por el proceso temprano de captación del tejido graso. En cuanto a la asociación encontrada entre MDAPE > 15% e IMC > 30, el TCI sevoflurane© reveló diferencias, en la primera evaluación21 no se incluyeron obesos mórbidos, y mostró: MDPE% positivo, MDAPE% y oscilación baja, con divergencia negativa. En la evaluación actual la MDPE% se hizo negativa y la MDAPE% se duplicó, posiblemente por 2 factores: la reducción del volumen del circuito calculado y la mayor proporción de sobrepeso y obesidad en la población evaluada (tabla 4).
El TCI sevoflurane© mostró un consumo promedio de sevofluorano de 6,9 ml en 71 min. El dispositivo de lazo cerrado ET Control®47 mostró mayor consumo de sevofluorano de 11 ml/h. Explicamos nuestro menor consumo por el uso de FMGF desde el inicio de la infusión y la baja concentración empleada. El ET Control® realiza variaciones automáticas tanto del FGF como del dial del vaporizador electrónico.
El impacto ambiental del TCI sevoflurane© podría ser teóricamente más bajo, al emplear la mitad de la CAM y la cuarta parte del FGF del estudio de Rian y Nielsen8.
Los dispositivos que sugieren el ajuste del vaporizador y el FGF logran reducir temporalmente el consumo, pero al retirarlos se incrementa de nuevo el FGF, lo que ha obligado a una supervisión periódica para mantener la reducción alcanzada11,12,48. El TCI sevoflurane©, al trabajar siempre con FMGF desde el inicio, posibilitaría mantener el ahorro cuando se implemente.
El TCI sevoflurane©, al ser un controlador de asa abierta no pudo «per se» corregir la variabilidad biológica. En los cálculos se desestimó tanto la absorción como la degradación del sevofluorano por la cal sodada29, tampoco se corrigió el metabolismo del sevofluorano (3-5%). Por lo antedicho, el modelo puede ser optimizado pero sin llegar a ser perfecto para todos los pacientes, como destaca Hendricks49. Por lo tanto, se necesita del analizador de gases para realizar los ajustes. Son recomendables validaciones con grupo control con vaporizador, incluir procedimientos de mayor duración validados como seguros con FMGF5,6 y , así, en un futuro, podríamos disponer de jeringas TCI que incluyeran la opción sevofluorano, lo cual simplificaría la técnica de FMGF. Otro potencial desarrollo de este dispositivo sería emplear las mediciones del analizador de gases disponibles cada 5 s para corregir el error de predicción en forma automática con un controlador de lógica difusa o un controlador PID (Proporcional-Integral-Derivativo), podría compensar la deriva del área bajo la curva y la tendencia del error. Además, empleando las mediciones de la profundidad anestésica se podría ajustar la concentración espirada de halogenado al nivel de hipnosis deseado, como se ha publicado para isofluorano50 y en nuestro medio, recientemente para propofol51.
Conclusiones
El TCI sevoflurane© mostró buen desempeño, la concentración objetivo se alcanzó rápidamente y se mantuvo estable, siendo necesarias pocas interacciones sobre el dispositivo durante la primera hora. No hubo sobredosificación ni alteraciones clínicas significativas y mantuvo una adecuada profundidad anestésica. Se pudo disponer de un TCI para sevofluorano en una estación de trabajo convencional, prescindiendo en este estudio del uso del vaporizador, empleando FMGF desde el inicio de la anestesia y guiado por las concentraciones del halogenado. Su desempeño comparado con otros dispositivos empleados para la administración de anestesia inhalatoria como la AnaConDa y los TCI intravenosos fue similar. Teniendo en cuenta el bajo consumo de sevofluorano observado en nuestro estudio, podemos afirmar que con su empleo se redujo la exposición laboral, la polución ambiental y los costos económicos.
Financiación
Recursos propios de los autores.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses. El algoritmo del TCI sevoflurane© fue escrito por César A. Candia Arana y programado por Joaquín Roca González.
Agradecimientos
A José Antonio Álvarez Gómez, Jefe de Servicio por su invaluable colaboración en este proyecto durante más de 10 años y Ana Isabel Torres Pérez, PhD, por la lectura crítica del manuscrito.
Bibliografía
1. Weinberg L, Story D, Nam J, McNicol L. Pharmacoeconomics of volatile inhalational anaesthetic agents: An 11-year retrospective analysis. Anaesth Intensive Care. 2010;38:849-54. [ Links ]
2. Sherman J, Le C, Lamers V, Eckelman M. Life cycle greenhouse gas emissions of anesthetic drugs. Anesth Analg. 2012;114:1086-90. [ Links ]
3. De Castro Jr J, Bolfi F, de Carvalho LR, Braz JR. The temperature and humidity in a low-flow anesthesia workstation with and without a heat and moisture exchanger. Anesth Analg. 2011;113:534-8. [ Links ]
4. Candia CA. Anestesia cuantitativa. Estado actual. Rev Colomb Anestesiol. 2001;29:33-41. [ Links ]
5. Fukuda H, Kawamoto M, Yuge O, Fujii K. A comparison of the effects of prolonged (>10 hour) low-flow sevoflurane, high-flow sevoflurane, and low-flow isoflurane anaesthesia on hepatorenal function in orthopaedic patients. Anaesth Intensive Care. 2004;32:210-80. [ Links ]
6. Marini F, Bellugi I, Gambi D, Pacenti M, Dugheri S, Focardi L, et al. Compound A, formaldehyde and methanol concentrations during low-flow sevoflurane anaesthesia: Comparison of three carbon dioxide absorbers. Acta Anaesthesiol Scand. 2007;51:625-32. [ Links ]
7. Brattwall M, Warren-Stomberg M, Hesselvik F, Jakobsson J. Brief review: Theory and practice of minimal fresh gas flow anesthesia. Can J Anaesth. 2012;59:785-97. [ Links ]
8. Ryan SM, Nielsen CJ. Global warming potential of inhaled anesthetics: Application to clinical use. Anesth Analg. 2010;111:92-8. [ Links ]
9. Feldman JM. Managing fresh gas flow to reduce environmental contamination. Anesth Analg. 2012;114:1093-110. [ Links ]
10. Kennedy RR, French RA. The development of a system to guide volatile anaesthetic administration. Anaesth Intensive Care. 2011;39:182-90. [ Links ]
11. Nair BG, Peterson GN, Neradilek MB, Newman SF, Huang EY, Schwid HA. Reducing wastage of inhalation anesthetics using real-time decision support to notify of excessive fresh gas flow. Anesthesiology. 2013;118:874-84. [ Links ]
12. Kennedy RR, French RA. Changing patterns in anesthetic fresh gas flow rates over 5 years in a teaching hospital. Anesth Analg. 2008;106:1487-90. [ Links ]
13. Hemmerling TM. Automated anesthesia. Curr Opin Anaesthesiol. 2009;22:757-63. [ Links ]
14. Lortat-Jacob B, Billard V, Buschke W, Servin F. Assessing the clinical or pharmaco-economical benefit of target controlled desflurane delivery in surgical patients using the Zeus anaesthesia machine. Anaesthesia. 2009;64: 1229-35. [ Links ]
15. Tay S, Weinberg L, Peyton P, Story D, Briedis J. Financial and environmental costs of manual versus automated control of end-tidal gas concentrations. Anaesth Intensive Care. 2013;41:95-101. [ Links ]
16. Vagts DA, Lockwood GC. The uptake of sevofluorane during anaesthesia. Anaesthesia. 1998;53:862-6. [ Links ]
17. Hendrickx JFA, van Zundert AAJ, de Wolf AM. Sevoflurane pharmacokinetics: Effect of cardiac output. Br J Anaesth. 1998;81:495-501. [ Links ]
18. Enlund M, Lambert H, Wiklund L. The sevoflurane saving capacity of a new anaesthetic agent conserving device compared with a low flow circle sytem. Acta Anaesthesiol Scand. 2002;46:506-11. [ Links ]
19. Candia CA, Acosta EAR. Anestesia cuantitativa continua asistida por computador evaluación de un controlador de asa abierta. Rev Colomb Anestesiol. 2001;29:43-9. [ Links ]
20. Lowe HJ, Ernst EA. The quantitative practice of anesthesiause of closed circuit. Baltimore: Williams and Wilkins; 1981. [ Links ]
21. Candia CA, Alvarez JA, Roca J. Predictive performance of an open-loop controller for sevoflurane with minimal fresh gas flow. Eur J Anest. 2008;25 Suplement 44:32 (3AP3-4). [ Links ]
22. Matsuura T, Oda Y, Tanaka K, Mori T, Nishikawa K, Asada A. Advance of age decreases the maintaining bispectral index below 50. BrJ Anaesth. 2009;102:331-5. [ Links ]
23. Kennedy RR, Minto C, Seethepalli A. Effect-site half-time for burst suppression is longer than for hypnosis during anaesthesia with sevoflurane. Br J Anaesth. 2008;100:72-7. [ Links ]
24. Soehle M, Ellerkmann RK, Grube M, Kuech M, Wirz S, Hoeft A, et al. Comparison between bispectral index and patient state index as measures of the electroencephalographic effects of sevoflurane. Anesthesiology. 2008;109:799-805. [ Links ]
25. Manyam SC, Gupta DK, Johnson KB, White JL, Pace NL, Westenskow DR, et al. Opioid-volatile anesthetic synergy: A response surface model with remifentanil and sevoflurane as prototypes. Anesthesiology. 2006;105:267-78. [ Links ]
26. Mapleson WW. Effect of age on mac in humans. A meta-analysis. Br J Anaesth. 1996;76:179-85. [ Links ]
27. Lerou JG, Booij LH. Model-based administration of inhalation anaesthesia. Br J Anaesth. 2001;86:12-28. [ Links ]
28. Kennedy RR, French RA, Spencer C. Predictive accuracy of a model of volatile anesthetic uptake. Anesth Analg. 2002;95:1616-2210. [ Links ]
29. Liu J, Laster MJ, Eger EI, Taheri S. Absorption and degradation of sevoflurane and isoflurane in a conventional anesthetic circuit. Anesth Analg. 1991;72:785-9. [ Links ]
30. Parra CJ. Esquema práctico para la anestesia cuantitativa. Rev Colomb Anestesiol. 1982;10:7. [ Links ]
31. Renfrew CW, Murray JM, Fee JP. A qualitative investigation into the physical stability of polypropylene and polyethylene in liquid isoflurane and sevoflurane. Anaesthesia. 2000;55: 793-7. [ Links ]
32. Varvel J, Donoho D, Shafer S. Measuring the predictive performance of computer-controlled infusion pumps. J Pharmacokinet Biopharm. 1992;20:63-94. [ Links ]
33. Mapleson WW. The theoretical ideal fresh-gas flow sequence at the start of low-flow anaesthesia. Anaesthesia. 1998;53:264-72. [ Links ]
34. Ip-Yam PC, Goh MH, Chan YH, Kong CF. Clinical evaluation of the Mapleson theoretical ideal fresh gas flow sequence at the start of low-flow anaesthesia with isoflurane, sevoflurane and desflurane. Anaesthesia. 2001;56:160-4. [ Links ]
35. Sobreira DP, Jreige MM, Saraiva R. The fresh-gas flow sequence at the start of low-flow anaesthesia. Anaesthesia. 2001;56:379-80. [ Links ]
36. Nishiyama T, Kohno Y, Ozaki M, Koishi K. Usefulness of an anesthetic conserving device (AnaConDaTM) in sevoflurane anesthesia. Minerva Anestesiol. 2012;78:310-4. [ Links ]
37. Candia CA. Controlador de asa abierta para sevofluorano con flujos mínimos guiado por entropía. Rev Mex Anest. 2009;32 Supl. 1:S177-81. [ Links ]
38. Sturesson LW, Malmkvist G, Bodelsson M, Niklason L, Jonson B. Carbon dioxide rebreathing with the anaesthetic conserving device AnaConDa®. Br J Anaesth. 2012;109:279-83. [ Links ]
39. Swinhoe CF, Peacock JE, Glen JB, Reilly CS. Evaluation of the predictive performance of a 'Diprifusor' TCI system. Anaesthesia. 1998;53:61-7. [ Links ]
40. Glen JB, Servin F. Evaluation of the predictive performance of four pharmacokinetic models for propofol. Br J Anaesth. 2009;102:626-32. [ Links ]
41. Albertin A, Poli D, la Colla L, Gonfalini M, Turi S, Pasculli N, et al. Predictive performance of 'Servin's formula' during BIS-guided propofol-remifentanil target-controlled infusion in morbidly obese patients. Br J Anaesth. 2007;98:66-75. [ Links ]
42. Li YH, Xu JH, Yang JJ, Tian J, Xu JG. Predictive performance of 'Diprifusor' TCI system in patients during upper abdominal surgery under propofol/fentanyl anesthesia. J Zhejiang Univ Sci B. 2005;6:43-8. [ Links ]
43. Mertens MJ, Engbers FH, Burm AG, Vuyk J. Predictive performance of computer-controlled infusion of remifentanil during propofol/remifentanil anaesthesia. Br J Anaesth. 2003;90:132-41. [ Links ]
44. Enlund M, Kietzmann D, Bouillon T, Züchner K, Meineke I. Population pharmacokinetics of sevoflurane in conjunction with the AnaConDa: Toward target-controlled infusion of volatiles into the breathing system. Acta Anaesthesiol Scand. 2008;52:553-60. [ Links ]
45. Belda JF, Soro M, Badenes R, Meiser A, García ML, Aguilar G, et al. The predictive performance of a pharmacokinetic model for manually adjusted infusion of liquid sevofluorane for use with the Anesthetic-Conserving Device (AnaConDa): A clinical study. Anesth Analg. 2008;106:1207-14. [ Links ]
46. Soro M, Badenes R, Garcia-Perez ML, Gallego-Ligorit L, Martí FJ, Aguilar G, et al. The accuracy of the anesthetic conserving device (Anaconda©) as an alternative to the classical vaporizer in anesthesia. Anesth Analg. 2010;111: 1176-9. [ Links ]
47. Singaravelu S, Barclay P. Automated control of end-tidal inhalation anaesthetic concentration using the GE Aisys CarestationTM. Br J Anaesth. 2013;110:561-6. [ Links ]
48. Ryu HG, Lee JH, Lee KK, Gil NS, Kim CS, Sim SE, et al. The effect of low fresh gas flow rate on sevoflurane consumption. Korean J Anesthesiol. 2011;60:75-7. [ Links ]
49. Hendrickx JF, de Wolf A. Special aspects of pharmacokinetics of inhalation anesthesia. Handb Exp Pharmacol. 2008: 159-86. [ Links ]
50. Locher S1, Stadler KS, Boehlen T, Bouillon T, Leibundgut D, Schumacher, et al. A new closed-loop control system for isoflurane using bispectral index outperforms manual control. Anesthesiology. 2004;101:591-602. [ Links ]
51. Gómez Oquendo FJ, Casas Arroyabe FD, Fernández JM, Guarín Grisales GA. Anestesia total intravenosa en un sistema de lazo cerrado: reporte del primer caso en Colombia. Rev Colomb Anestesiol. 2013;41:306-10. [ Links ]











 text in
text in 

