Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Colombian Journal of Anestesiology
versão impressa ISSN 0120-3347
Rev. colomb. anestesiol. vol.43 no.1 Bogotá jan./mar. 2015
http://dx.doi.org/10.1016/j.rca.2014.09.007
Revisión
Manejo de líquidos, lidocaína y epinefrina en liposucción. La forma correcta
Liquid handling, lidocaine and epinephrine in liposuction. The properly form
Jore Enrique Bayter Marin*
MD, Anestesiólogo e Intensivista, Director Médico, Clínica El Pinar, Coordinador Comité Anestesia para Cirugía Plástica, Sociedad Colombiana de Anestesiología y Reanimación (S.C.A.R.E.), Bucaramanga, Colombia
* Anestesiología, Clínica el Pinar, Cra 39 n.ª 48-103, apto 901, Bucaramanga, Colombia.
Correos electrónicos: jokibay@yahoo.com, jokibay@icloud.com.
Información del artículo resumen
Historia del artículo: Recibido el 28 de abril de 2014 Aceptado el 13 de septiembre de 2014 On-line el 11 de diciembre de 2014
Palabras clave:
Lipiectomía Edema pulmonar Anestésicos locales Toxicidad Cirugía plástica Introducción: El mal manejo de los líquidos en liposucción conduce a edema pulmonar en un paciente previamente sano. El edema pulmonar se considera la tercera causa de muerte en cirugía plástica después del TEP y la intoxicación por lidocaína. El principal factor de riesgo que conduce a este desenlace es el desconocimiento en el manejo de líquidos y la mala comunicación entre el cirujano y el anestesista. Objetivos: Revisar las causas que llevan a edema pulmonar en liposucción y las opciones válidas de manejo correcto de líquidos. Métodos: Se realizó una revisión de la literatura no sistemática en las bases de datos PubMed y Medline. Resultados y conclusiones: El correcto manejo de líquidos en liposucción se basa en una estrecha comunicación entre el cirujano y el anestesista para sumar los líquidos infiltrados a nivel subcutáneo y los colocados por vía venosa, siempre teniendo en cuenta que los líquidos de la infiltración pasan a la circulación central.
Abstract
Keywords:
Lipectomy Pulmonary edema Anesthetics, Local Toxicity Surgery, Plastic Introduction: Fluid mismanagement in liposuction leads to pulmonary edema in a previously healthy individual. Pulmonary edema is considered the third cause of death in plastic surgery after PTE and lidocaine toxicity. The most important risk factor leading to this outcome is inadequate knowledge of fluid management and poor communication between the surgeon and the anaesthetist. Objectives: To review the causes leading up to pulmonary edema in liposuction and the valid options for correct fluid management.
Methods: Non-systematic review of the literature in PubMed and Medline. Results and conclusions: Correct fluid management in liposuction is based on a close communication between the surgeon and the anaesthetist in order to keep track of the total amount of subcutaneous fluid infiltration plus fluids delivered intravenously, always bearing in mind that infiltration fluids go to the central circulation.
Introducción
La liposucción es el procedimiento de cirugía estética más realizado en EE. UU.1 e igualmente en Colombia. El avance en las técnicas de infiltración para permitir incluir epinefrina en la solución y así disminuir el sangrado en el lipoaspirado ha permitido la realización de grandes volúmenes de liposucción lo que conlleva grandes cambios en el comportamiento de líquidos en los compartimentos y el riesgo de edema pulmonar y falla cardiaca2.
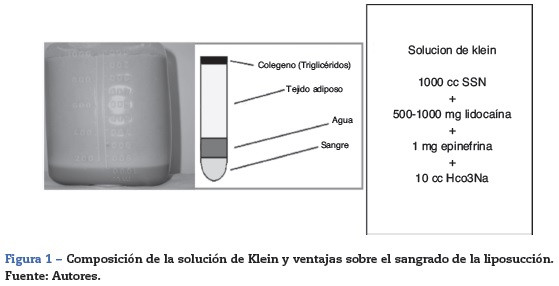
Si a esto le sumamos que el Dr. Klein inventó en 1987 una solución tumescente que incluía 500-1.000 mg de lidocaína y 1 mg de epinefrina en cada 1.000 cc de SSN3 (fig. 1) y que es una solución muy utilizada hoy en día, para la infiltración subcutánea, el riesgo de intoxicación por lidocaína es una realidad y la segunda causa de muerte en cirugía plástica según la Sociedad Americana de Cirugía Plástica y Estética (ASAPS).
El gran problema de estas nuevas técnicas de infiltración, especialmente las técnica superhúmeda y tumescente, son los grandes volúmenes de infiltración utilizados, ya que se usan radios entre lo infiltrado y lo aspirado desde 1:1 en la técnica superhúmeda hasta 2 a 3:1 en la técnica tumescente4. Esto quiere decir que en una liposucción de 3 l se pueden infiltrar a nivel subcutáneo entre 3-9 l y esta gran cantidad de líquidos requiere una consideración especial desde el punto de vista anestésico.
Metodología
Se realizó una revisión no sistemática de la literatura en bases de datos como PubMed y Medline, introduciendo las palabras claves en inglés, fluid management, liposuction, pulmonary edema, larger infiltration, aspiration volumes. Se procedió a la lectura de cada artículo, se investigaron artículos de las referencias seleccionadas con el tema y de acuerdo a esta metodología se seleccionaron 51 referencias.
Revisión
La utilización de grandes volúmenes de infiltración en la solución tumescente complica en gran manera el manejo anestésico en la liposucción. El riesgo de hipervolemia, edema pulmonar, efectos cardiovasculares por la epinefrina e intoxicación por lidocaína están siempre latentes5.
El uso de soluciones de infiltración, cuando estas se realizan con epinefrina 1 mg en 1.000 cc de Hartman o SSN, tiene como objetivo disminuir el sangrado del lipoaspirado a menos del 5% del volumen extraído6, lo que permite hacer grandes volúmenes de liposucción con las complicaciones que esto trae. Algunos estudios realizados por Burk et al.7 han mostrado utilización de hasta 10 mg de epinefrina en la infiltración en concentraciones de 1:1.000.000 en pacientes sanos, sin ningún efecto deletéreo derivado de la intoxicación, tales como taquicardia e hipertensión, aunque estas megadosis pueden llevar a consecuencias fatales en pacientes con enfermedad cardiaca coexistente, no estudiada.
El segundo problema, cuando se infiltra soluciones de Klein, son las altas dosis de lidocaína infiltradas (de 500 a 1.000 mg de lidocaína al 1% en cada 1.000 cc de SSN). Existen múltiples estudios en la literatura mundial realizados en pacientes de cirugía plástica que han demostrado que podrían ser seguras dosis muy altas de lidocaína, hasta 35-55 mg/kg8,9, debido a que la infiltración se hace en la grasa, que es un tejido poco vascularizado y se le suma a esto la vasoconstricción adicional por la epinefrina de la dilución. En estos estudios se ha demostrado cierto margen de seguridad en miles de liposucciones realizadas, sin que existan riesgos de llevar a niveles tóxicos a pesar de las altas dosis de lidocaína infiltradas.
Desde el punto de vista anestésico, la FDA solo acepta dosis máximas de 7-10 mg/kg. La ASAPS ha mencionado que la intoxicación por lidocaína puede ser una causa importante de muerte en cirugía plástica y podría explicar algunas muertes ocurridas en el intra-y postoperatorio por paro cardiaco, con saturación de oxígeno normal; pero esto es muy difícil de demostrar por los problemas en la medición de los niveles séricos post mórtem que se hacen tardíamente o no se hacen. Hay que anotar que la utilización de grandes dosis de lidocaína permitió a los dermatólogos y cirujanos realizar la liposucción en consultorios con anestesia local y sin anestesista, con el único objetivo de poder disminuir los costos de utilización de quirófanos y del recurso humano en anestesia. Es por esto que nuestra recomendación, en caso de realizar infiltración con grandes cantidades de lidocaína, es hacerla siempre con anestesista en sala, el cual debe estar preparado para el manejo de la parada cardiaca por intoxicación de lidocaína; además, en estas salas es obligatorio que existan lípidos al 20%, como única medida eficaz para revertir la parada cardiaca, mientras se realiza la resucitación. En la figura 2 se encuentra el protocolo de manejo de la parada cardiaca por intoxicación de anestésicos locales, avalado por la Sociedad Americana de ASAPS y que está publicado en la página http://www.lipidrescue.org con los respectivos sustentos bibliográficos.
El tercer problema tiene que ver con los grandes volúmenes infiltrados y la sobrecarga de volumen, ya que en una liposucción de 4 l se pueden infiltrar hasta 12 l a nivel subcutáneo.
The University Texas Southwestern Medical Center's en 1998 definió que una liposucción de grandes volúmenes está por encima de los 4.000 cc de grasa extraída y la de pequeños volúmenes por debajo de 4.000 cc. En ese mismo estudio definió que los líquidos administrados son iguales a los líquidos de la infiltración puestos por el cirujano plástico y los intravenosos colocados por el anestesista, y que al sumarlos y dividirlos por el volumen de la liposucción esta relación no debe ser mayor de 2 para liposucciones menores de 4 l (o sea, 8 l de líquidos administrados, entre los intravenosos y el infiltrado, en una liposucción de 4 l) y de 1,4 para liposucciones mayores de 4 l. En este estudio de 53 no se presentó ningún caso de complicaciones o sobrecarga hídrica y demostró mantener diuresis mayores de 1 cc/k/h. Posteriormente, Rohrich et al.10 mostraron en un estudio de 89 pacientes que al utilizar esta misma fórmula para liposucción no hay complicaciones.
En el caso de cirugía plástica, el edema pulmonar es la tercera causa de muerte, y es debido principalmente a error humano, por desconocimiento de fundamentos fisiológicos básicos de la infiltración, a la falta de protocolos y a una pobre comunicación entre el cirujano y el anestesista. En un estudio hecho en Holanda, en el 50% de los hospitales, entre 1995 y 1997, se encontró que entre el 2-4% de todas las muertes anestésicas fueron por mal manejo de líquidos y edema pulmonar, y en estas muertes se demostró error médico en el 85% de los casos11.
La principal consideración fisiológica a tener en cuenta es que, de los líquidos infiltrados, la mayoría pasan a la circulación general y solo se recuperan con el lipoaspirado, entre el 22% y el 29%12,13. Esto quiere decir que hasta el 70% de los líquidos infiltrados, la lidocaína y epinefrina pasan a nivel intravascular. Estudios posteriores han mostrado que 1 l de infiltración subcutánea se absorbe completamente si no es removida en 163 min, y que el 70% de la lidocaína y epinefrina se absorbe completamente con picos máximos a las 12 y 5h4.
En un estudio llevado a cabo en 5 mujeres sanas ASA14, a quienes se les realizó liposucción de grandes volúmenes, se colocó catéter de Swan-Ganz y fueron monitorizadas en cuidados intensivos durante 24 h, midiendo continuamente parámetros hemodinámicos para evaluar los efectos de la infiltración y de las altas dosis de adrenalina, se encontró que el índice cardiaco, la frecuencia cardiaca y la presión media de la arteria pulmonar aumentaron más de un 45% y la presión venosa central aumentó de4a14 cmdeagua en la hora 8 del postoperatorio14; además, en este mismo estudio se mostró que todos los pacientes estaban hipotérmicos en cirugía y tenían temperaturas menores de 35,5 °C.
De forma rutinaria, en la liposucción se utilizan altas dosis de epinefrina, con todos los efectos hemodinámicos que esto conlleva. Los niveles de epinefrina llegan a su máxima concentración 3-5 h después de la aplicación subcutánea. Después de la infiltración de 7 mg de adrenalina se alcanzan niveles séricos de 323 Pg/Ml, muy parecidos a los que se encuentran en el pinzamiento de la aorta o en el bypass coronario7,15,que es3o4veces los valores basales. En realidad los reportes de complicaciones a la epinefrina han sido anecdóticos, en pacientes con enfermedad coronaria previa no diagnosticada, esto debido a la baja tasa de absorción sistémica en la grasa y debido a su efecto vaso-constrictor y por el posible efecto protector antiarrítmico de la lidocaína7.
La lidocaína en la infiltración puede llevar a complicaciones graves y fatales. Con niveles por encima de 5 µg/cc aparecen síntomas neurológicos y por encima de 10 µg/cc sobreviene el colapso cardiovascular16. Muchos estudios al parecer han mostrado cierto margen de seguridad de la lidocaína infiltrada a nivel subcutáneo inclusive en dosis hasta de 55 mg/kg, por la baja vascularidad de la grasa y el efecto vasoconstrictor de la adrenalina17-19. El problema es que la liberación de la grasa es también lenta y se ha mostrado que los niveles máximos se alcanzan 8-12 horas después de la infiltración20, cuando el paciente está en casa y se genera un riesgo adicional posterior. También hay que tener en cuenta las tasas de absorción diferenciales, ya que cuando se infiltra la cara, las concentraciones máximas se alcanzan a las 5 h, pero al infiltrar abdomen y muslos se logran a las 12 h y en algún momento puede haber coincidencia de estos18. Lo que puede agravar la situación en casos de intoxicación es su metabolismo. La lidocaína es eliminada principalmente por metabolismo hepático en un 95%, mientras que solo un 5% se elimina por la orina21, es desacetilada a monoetilglicinexilidina que es de nuevo desacetilada a glicinexilidina. Las 2 enzimas responsables de esto son la CYP3A4 y la CYP1A2 que pertenecen a la familia de isoenzimas del citocromo P45021,22; estas isoenzimas se pueden ver inhibidas por diversos fármacos, algunos de uso común como ciprofloxacina, cimetidina, eritromicina, amiodarona, ketoconazol, fluconazol e incluso el propofol21,22, o bien puede verse alterado el metabolismo por fármacos que compiten por la misma enzima, como es el caso del midazolam y el fentanilo que también son metabolizados por la CYP3A421,22; esto es muy importante no solo porque estos fármacos pueden alterar el metabolismo, sino porque pueden enmascarar los síntomas iniciales de intoxicación y llevar a síntomas neurológicos o cardiovasculares graves. Aunque los niveles de lidocaína con estas megadosis de 35-50 mg/kg a nivel subcutáneo parecen ser subóptimos, se han reportado muertes de pacientes en el intraoperatorio, por bloqueos cardiacos con saturación de oxígeno normal, donde la necropsia no muestra ninguna alteración23, donde los niveles de lidocaína posterior pueden ser normales, pero la verdad, hasta ahora no se ha demostrado la estabilidad de la lidocaína post mórtem. En el censo realizado a todos los miembros de la Sociedad Americana de Cirujanos Plásticos en el año 2000, se demostró una mortalidad en liposucción en 1 de cada 5.000 procedimientos, la primera causa de muerte fue el TEP, pero además se dieron cuenta de que la mayoría de las muertes ocurrieron en la primera noche después de la cirugía por lo que no descartan la intoxicación con lidocaína y los efectos residuales anestésicos como causa importante de mortalidad.
Aunque el TEP es la principal causa de muerte, hay protocolos estrictos y serios de profilaxis, que pueden disminuir la incidencia de TVP y TEP en un 85% y de TEP fatal en un 95%. El problema con el manejo de líquidos en liposucción es que con las nuevas técnicas de infiltración superhúmeda y tumescente, la sobrecarga hídrica es un riesgo potencial y hasta hoy no hay consenso en la forma en como se deben manejar. Solo hay algunas fórmulas empíricas de división de líquidos administrados versus el infiltrado que nos pueden guiar la terapia hídrica24-26. Con estas fórmulas se deduce que los líquidos a administrar en una liposucción menor de 4 l debía ser una radio de 2 entre los líquidos infiltrados más los intravenosos, sobre el aspirado y una radio de 1,4 si la liposucción era mayor de 4 l24-26. A pesar de estas fórmulas, sigue siendo un problema la sobrecarga hídrica y hay reportes de casos de muerte durante la liposucción al usarlas. Cada vez son menos los líquidos intravenosos utilizados en liposucción y aunque el estándar está en no utilizar técnicas tumescentes(3:1), sino solo superhúmeda(1:1) esto ha permitido poder bajar los líquidos administrados hasta relaciones entre administrados (intravenosos más infiltración) y la grasa extraída según Rohrich et al. a 1,224. En un estudio publicado recientemente en 30 pacientes sometidos a liposucciones de grandes volúmenes, por encima de los 6 l de aspirado, a la mitad de se les administró líquidos según la fórmula de Rohrich o sea 1,2 de radio (para una liposucción de 6 l, como máximo le podían colocar entre los infiltrados más los intravenosos 7.200 cc) y la otra mitad de los pacientes solo se les administró líquidos guiados por variación del volumen sistólico, por técnica de termodilución en la línea arterial (LIDCO)27. Este estudio demostró que, en liposucciones de grandes volúmenes donde la infiltración era mayor de 1:1, los líquidos intravenosos eran solo de mantenimiento, o sea 500 o 600 cc en 5 h de cirugía y con esto mantenían un excelente volumen latido y la diuresis siempre estuvo por encima de 1,2cc/kg/h27-29. Los estudios realizados nos muestran que la cantidad de líquidos intravenosos debe ser mínima cuando se utiliza la técnica superhúmeda30,31 (tabla 1), inclusive algunos han mencionado abolir los líquidos intravenosos32. En conclusión, hoy en día, en liposucción, cuando se hace como procedimiento único, el manejo de líquidos intravenosos debe ser muy conservador, ya que los líquidos de infiltración pasan a la circulación central, y en resumen, la recomendación es manejar solo líquidos de mantenimiento.
Pero como vimos, el manejo de líquidos no es solo el del volumen, incluye el manejo de la infiltración, de los niveles de lidocaína, epinefrina, sumado a la hipotermia33, que juntos son responsables de numerosos reportes de muertes por infarto de miocardio, edema pulmonar e intoxicación por lidocaína, reportados en la literatura33-43.
Aunque no es el objetivo del artículo, no podemos dejar de mencionar que la infusión de esta gran cantidad de líquidos de infiltración a temperatura ambiente, a nivel subcutáneo, lleva a que todos los pacientes tengan temperaturas por debajo de 36 °C y debemos tomar medidas para evitarlas ya que conlleva problemas como sangrado, infarto agudo de miocardio, seromas44-47.
Conclusiones
El correcto manejo de líquidos y de la infiltración es, después de la prevención de la TVP y el TEP, la medida más importante para disminuir complicaciones y muertes en cirugía plástica. Con respecto al manejo de líquidos en la liposucción, cuando se hacen técnicas superhúmedas o tumescentes, la recomendación mundial es manejar la mínima cantidad de líquidos intravenosos, es decir, solo líquidos de mantenimiento, ya que con la infiltración es suficiente (relación máxima entre lo administrado y la grasa extraída de 1,2)
Con respecto a las dosis de epinefrina en la infiltración, se debe utilizar un máximo de 6 mg o 0,1 kg/kg, siempre y cuando el paciente no tenga enfermedades cardiovasculares adyacentes.
Cuando se trata de la lidocaína, a pesar de que la FDA recomienda dosis máximas de 7-10 mg/kg, hay múltiples estudios que muestran relativa seguridad con dosis mayores (35 mg/kg) y por esto nuestra recomendación en caso de realizar infiltración con grandes cantidades de lidocaína es que esta debe hacerse bajo supervisión de un anestesista en sala y este debe estar preparado para el manejo de la parada cardiaca por intoxicación de lidocaína, además en estas salas es obligatorio que existan lípidos al 20% como única medida eficaz para revertir la parada cardiaca mientras se realiza la resucitación.
Financiación
Ninguna.
Conflicto de intereses
El autor es coordinador del Comité de Anestesia para Cirugía Plástica de la Sociedad Colombiana de Anestesiología y Reanimación (S.C.A.R.E.).
Referencias
1. Rohrich RJ, Beran SJ, Fodor PB. The role of subcutaneous infiltration in suction-assisted lipoplasty: a review. Plast Reconstr Surg. 1996;9:514. [ Links ]
2. Grazer FM, Meister FL. Factors contributing to adverse effects of the tumescent technique (surgical strategies). Aesthetic Surg J. 1997;7:411-6. [ Links ]
3. Klein JA. The tumescent technique for liposuction surgery. Am J Cosmetic Surg. 1987;4:263-6. [ Links ]
4. Trott SA, Beran SJ, Rohrich RJ, Kenkel JM, Adams WP, Klein KW. Safety considerations and fluid resuscitation in liposuction: an analysis of 53 consecutive patients. Plast Reconstr Surg. 1998;102:2220-5. [ Links ]
5. Burk RW, Guzman-Stein G, Vasconez LO. Lidocaine and epinephrine levels in tumescent technique liposuction. Plast Reconstr Surg. 1996;97:1379-85. [ Links ]
6. Klein JA. Tumescent technique for local anesthesia improves safety in large-volume liposuction. Plast Reconstr Surg. 1993;92:1085-90. [ Links ]
7. Burk RW, Guzman-Stein G, Vasconez LO. Lidocaine and epinephrine levels in tumescent technique liposuction. Plast Reconstr Surg. 1996;97:1379-84. [ Links ]
8. Klein JA. Tumescent technique for regional anesthesia permits lidocaine doses of 35 mg/kg for liposuction. J Dermatol Surg Oncol. 1990;16:248-52. [ Links ]
9. Ostad A, Kageyama N, Moy R. Tumescent anesthesia with a lidocaine dose of 55 mg/kg is safe for liposuction. Dermatol Surg. 1996;22:921-8. [ Links ]
10. Rohrich RJ, Jason E, Leedy, Swamy JR. Fluid resuscitation in liposuction: a retrospective review of 89 consecutive patients. Plast Reconstr Surg. 2006;117:431-6. [ Links ]
11. Arbous MS, Grobbee DE, van Kleef JW. Mortality associated with anaesthesia: a qualitative analysis to identify risk factors. Anaesthesia. 2001;56:1141-53. [ Links ]
12. Samdal F, Amland PF, Bugge JF. Blood loss during liposuction using the tumescent technique. Aesthetic Plast Surg. 1994;18:157-62. [ Links ]
13. Pitman GH, Aker JS, Tripp ZD. Tumescent liposuction. Clin Plast Surg. 1996;23:633-8. [ Links ]
14. Kenkel JM, Lipschitz AH, Luby M, Kallmeyer I. Hemodynamic physiology and thermoregulation in liposuction. Plast Reconstr Surg. 2004;114:503-13. [ Links ]
15. Brown SA, Lipschitz AH, Kenkel JM, et al. Pharmacokinetics and safety of epinephrine use in liposuction. Plast Reconstr Surg. 2004;114:756-65. [ Links ]
16. Rubin JP, Zhongcong X, Davidson Ch, et al. Rapid absorption of tumescent lidocaine above the clavicles: a prospective clinical study. Plast Reconstr Surg. 2005;115:1744-51. [ Links ]
17. Feisher LA. Risk of anesthesia. In: Miller RD, editor. Anesthesia. Churchill Livingstone; 2005. p. 893-920. [ Links ]
18. Hughes CE. Reduction of lipoplasty risks and mortality: an ASAPS survey. Ann Plast Surg. 2001;21:120-7. [ Links ]
19. Butterwick KJ, Goldman MP, Sriprachya-Anunt S. Lidocaine levels during the first two hours of infiltration of dilute anesthetic solution for tumescent liposuction: rapid versus slow delivery. Dermatol Surg. 1999;25:681-5. [ Links ]
20. Sweeney BP, Bromilow J. Liver enzyme induction and inhibition: implications for anaesthesia. Anaesthesia. 2006;61:159-77. [ Links ]
21. Rao RB, Ely SF, Hoffman RS. Deaths related to liposuction. N Engl J Med. 1999;340:1471-5. [ Links ]
22. Rohrich RJ, Kenkel JM, Jani JE, Beran SJ, Fodor PB. An update on the role of subcutaneous infiltration in suction-assisted lipoplasty. Plast Reconstr Surg. 2003;111:926-7, discussion 928. [ Links ]
23. Basile AR, Fernandes F, Basile VV, Basile FV. Fluid resuscitation in liposuction: a prospective analysis of infiltrate total-aspirate ratios lower than used for the super wet technique. Aesthetic Plast Surg. 2006;30:659-65, discussion 666. [ Links ]
24. Trott SA, Beran SJ, Rohrich RJ, Kenkel JM, Adams WP Jr, Klein KW. Safety considerations and fluid resuscitation in liposuction: an analysis of 53 consecutive patients. Plast Reconstr Surg. 1998;102:2220-9. [ Links ]
25. Jain AK, Khan AM, Asma MM. Stroke volume variation as a guide for fluid resuscitation in patients undergoing large-volume liposuction. Plast Reconstr Surg. 2012;130:462-9. [ Links ]
26. Reuter DA, Felbinger TW, Kilger E, Schmidt C, Lamm P, Goetz AE. Optimizing fluid therapy in mechanically ventilated patients after cardiac surgery by on-line monitoring of left ventricular stroke volume variations: a comparison to aortic systolic pressure variations. Br J Anaesth. 2002;88:124-6. [ Links ]
27. Reuter DA, Kirchner A, Felbinger TW, et al. Usefulness of left ventricular stroke volume variation to assess fluid responsiveness in patients with reduced cardiac function. Crit Care Med. 2003;31:1399-404. [ Links ]
28. de Jong RH, Grazer FM. Perioperative management of cosmetic liposuction. Plast Reconstr Surg. 2011;107:1039-44. [ Links ]
29. Pitman GH, Aker JS, Tripp ZD. Tumescent liposuction: a surgeon's perspective. Clin Plast Surg. 1996;23:633-41. [ Links ]
30. Sasaki GH, Tevez A. Larger infiltration/aspiration volumes, plasma/subcutaneous fluid lidocaine levels and quantitative abdominal tissue accommodation after water-assisted liposuction (WAL): comparative safety and efficacy to traditional liposuction (TL) in advanced techniques in liposuction and fat transfer. 11th ed; 2011. p. 81-94. [ Links ]
31. Grazer FM, de Jong RH. Fatal outcomes from liposuction: census survey of cosmetic surgeons. Plast Reconstr Surg. 2000;105:436-42. [ Links ]
32. Barillo DJ, Cancio LC, Kim SH, et al. Fatal and near fatal complications of liposuction. South Med J. 1998;91:487-94. [ Links ]
33. Gorney M. Suction-assisted lipoplasty: complications and fatal outcomes. In: Presented at the annual meeting of the American Society of Plastic and Reconstructive Surgeons. 1998. [ Links ]
34. Gingrass MG. Lipoplasty complications and their prevention. Clin Plast Surg. 1999;26:341-9. [ Links ]
35. de Jong RH, Grazer FM. Tumescent liposuction alert: deaths from lidocaine cardiotoxicity. Am J Forensic Med Pathol. 1999;20:100-7. [ Links ]
36. Platt MS, Kohler LJ, Ruiz R, et al. Deaths associated with liposuction: case reports and review of the literature. J Forensic Sci. 2002;47:205-9. [ Links ]
37. American Society of Plastic Surgeons. Procedural Statistics Report. Arlington Heights Ill. American Society of Plastic Surgeons; 2001. [ Links ]
38. Klein JA. The tumescent technique: anesthesia and modified liposuction technique. Dermatol Clin. 1990;8:425-32. [ Links ]
39. Samdal F, Amland PF, Bugge JF. Blood loss during liposuction using the tumescent technique. Aesthetic Plast Surg. 1994;18:157-63. [ Links ]
40. Lillis PJ. Liposuction surgery under local anesthesia: limited blood loss and minimal lidocaine absorption. J Dermatol Surg Oncol. 1988;14:1145-52. [ Links ]
41. Iverson RE. Patient safety in office-based surgery facilities: 1. Procedures in the office-based surgery setting. Plast Reconstr Surg. 2002;110:1337-45. [ Links ]
42. Sessler DI. Perioperative heat balance. Anesthesiology. 2000;92:578-84. [ Links ]
43. Yamakage MY, Kamada Y, Homma Y, Tsujiguchi N, Namiki A. Predictive variables of hypothermia in the early phase of general anesthesia. Anesth Analg. 2000;90:456-63. [ Links ]
44. Alfonsi P. Postanesthetic shivering: epidemiology, pathophysiology, and approaches to prevention and management. Drugs. 2001;61:2193-9. [ Links ]
45. Scheeren TW. Relation between oxygen consumption and cardiac output during inhalation anesthesia under the influence of catecholamines: a study in dogs. Anasthesiol Intensivmed Notfallmed Schmerzther. 2000;35:214-22. [ Links ]
46. Hoffman BB. Catecholamines, sympathomimetic drugs and adrenergic receptors antagonists. In: Hardman JG, Limbird LE, Gilman AG, editors. The pharmacological basis of therapeutics. 10th ed. New York: McGraw-Hill; 2001. p. 215-68. [ Links ]
47. Cheung PY, Barrington KJ. The effects of dopamine and epinephrine on hemodynamics and oxygen metabolism in hypoxic anesthetized piglets. Crit Care. 2001;5:158-65. [ Links ]











 texto em
texto em