Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.45 no.3 Bogotá July/Sept. 2017
Reporte de casos
Manejo perioperatorio de hemoptisis masiva durante la realización de fibrobroncoscopia: reporte de caso
a Obstructive Sleep Apnea Study Group, School of Medicine, Pontificia Universidad Javeriana, Bogotá D.C., Colombia.
b Physician, Pontificia Universidad Javeriana, Bogotá D.C., Colombia.
c Anesthesiologist, Hospital Universitario San Ignacio, Pontificia Universidad Javeriana, Bogotá D.C., Colombia.
d Internist-Pulmonologist, Hospital Universitario San Ignacio, Pontificia Universidad Javeriana, Bogotá D.C., Colombia.
La broncoscopia flexible es un procedimiento diagnóstico o terapéutico con baja incidencia de complicaciones (0,08-6,8%). El sangrado por biopsia transbronquial es una complicación rara (0-2,8% de los casos), suele ser leve y resuelve con medidas locales. No existe una definición clara de hemoptisis masiva y, por su baja incidencia, no hay guías de práctica clínica para el tratamiento de esta complicación, que puede ser catastrófica. Presentamos un caso de hemoptisis masiva durante la realización de una broncoscopia flexible más biopsia transbronquial y revisamos la literatura acerca del manejo intraoperatorio.
Palabras clave: Hemoptisis; Broncoscopia; Periodo perioperatorio; Anestesia; Radiología; intervencional
Flexible bronchoscopy is a diagnostic or therapeutic procedure with a low incidence of complications (0.08-6.8%). Bleeding after transbronchial biopsy is a rare complication (0-2.8% of the cases), usually resulting in minor bleeding that resolves with local measures. There is no clear definition of massive hemoptysis and due to the low incidence of this condition, there are no practical guidelines for the treatment of this complication that may be catastrophic. This case discusses the occurrence of massive hemoptysis during a transbronchial biopsy under flexible bronchoscopy, including a literature review on perioperative management.
Keywords: Hemoptysis; Bronchoscopy; Perioperative period; Anesthesia; Radiology interventional.
Introducción
La broncoscopia flexible es uno de los procedimientos más utilizados para el diagnóstico o tratamiento de enfermedades de vía aérea y parénquima pulmonar. La incidencia de complicaciones es 0,08-6,8%1-7.
El sangrado leve es una complicación que ocurre uno o 2 días después del procedimiento y resuelve de forma espontánea, y es más frecuente en pacientes con tratamiento antiagregante, anticoagulante o con coagulopatía. El sangrado por biopsia transbronquial se presenta hasta en el 2,8% de los casos y suele resolver con medidas locales (solución salina helada)1.
Los anestésicos intravenosos o locales inhiben el reflejo tusígeno y aumentan el riesgo de depresión respiratoria; volúmenes bajos de sangrado en la vía aérea alteran la relación ventilación/perfusión y aumentan el riesgo de falla respiratoria hipoxémica8.
No existe una definición exacta de hemoptisis masiva con volúmenes entre 100 y 1.000 ml en 24 h9-12; se ha propuesto que se base en el grado de funcionalidad comprometido por el sangrado11. Algunos autores incluyen en la definición el requerimiento de hemoderivados, falla respiratoria hipoxémica o inestabilidad hemodinámica, entre otros12-16.
Por su baja incidencia, no hay guías de práctica clínica sobre el manejo de hemoptisis masiva durante la realización de broncoscopia17. Se presenta un caso de hemoptisis masiva posterior a biopsia transbronquial con broncoscopia flexible.
Reporte de caso
Paciente de 34 años, con antecedente de VIH, no adherente a tratamiento, en manejo por criptococosis meníngea. Sintomático respiratorio con signos de ocupación alveolar en imágenes de tórax y sospecha de infección por microorganismos oportunistas. Es programado para broncoscopia flexible, lavado broncoalveolar y biopsia transbronquial. Clase funcional II/ZV (escala NYHA). Examen físico sin hallazgos positivos; tiempos de coagulación y hemograma normales.
Monitorización básica y comportamiento hemodinámico (fig. 1). Inducción anestésica con fentanilo (150 µg intravenosos [iv]), propofol (150 mg iv) y succinilcolina (50 mg iv); colocación de máscara laríngea # 5. Mantenimiento con fentanilo y propofol en infusión continua.

Fuente: Historia clínica (consentimiento informado)
Figura 1 Comportamiento hemodinámico durante el procedimiento. Flecha roja: inicio de sangrado posterior a biopsia transbronquial y paso de tubo de doble luz izquierdo. EtCO2:CO2 al final de espiración; FC: frecuencia cardiaca; SpO2: saturación de pulso de oxígeno.
Al realizar biopsia transbronquial (fig. 1), presenta sangrado con posterior desaturación, bradicardia e hipotensión. Se administra atropina (1 mg iv) y etilefrina (3 mg iv). Se canaliza línea arterial radial. Se pasa tubo de doble luz izquierdo a ciegas, con verificación con fluoroscopio; se aplican 2 cc al neumotaponador (la hemoptisis no permite visualización con fibrobroncoscopio); se inicia ventilación unipulmonar protectora (de acuerdo al peso del paciente) con posterior SpO2 77% y con FiO2 100%. Se realizan maniobras de reclutamiento alveolar, presión de vía aérea 57 cm de H2O, se cambia a ventilación bipulmonar con volumen corriente 475 ml, frecuencia respiratoria 20, relación inspiración:espiración 1:2, presión positiva al final de espiración 10 cm de H2O, FiO2 100%, presión inspiratoria máxima y meseta 66 y 23 cm de H2O, respectivamente, a pesar de relajación neuromuscular.
Se realiza fibrobroncoscopia sin encontrar sitio de sangrado. Hipotensión persistente; se inicia soporte vasopresor con noradrenalina con el que se logra estabilidad hemodinámica. Los gases arteriales (tabla 1) evidencian acidemia respiratoria, hemoglobina de 4,4g/dl y hematocrito de 13%. El cálculo aproximado de sangrado intraoperatorio es de 1.300 cc; se decide transfundir 2 unidades de glóbulos rojos. El tromboelastograma postransfusión reporta R: 6,1 min, K: 3,6 min, ángulo 46,5°, MA: 57,1 mm, IC: -2,6, interpretado como normal. Por comorbilidades, se decide no transfundir otros hemoderivados.
Tabla 1 - Gases arteriales
BE: base exceso; SaO2: saturación arterial de oxígeno; UCI: Unidad de Cuidados Intensivos.
Fuente: Historia clínica (consentimiento informado).
En Radiología Intervencionista se le realiza arteriografía en la que se evidencia vasoespasmo severo del sitio del sangrado, por lo que se difiere embolización (fig. 2).

Fuente: Historia clínica (consentimiento informado)
Figura 2 Aortografía y arteriografía bronquial. El estudio arteriográfico permite la cateterización selectiva de todos los troncos intercostales bilaterales por encima y por debajo del ángulo traqueobronquial izquierdo, sin obtener cateterización arterial bronquial, lo que indica vasoespasmo y coincide con el detenimiento del sangrado activo. Sangrado no visible en estudio aortográfico. Tubo de doble luz en bronquio fuente izquierdo.
Una radiografía de tórax portátil confirma la posición del tubo de doble luz y el sangrado en el pulmón izquierdo (fig. 3). Se traslada a Unidad de Cuidados Intensivos con signos vitales estables, gases arteriales de control con mejoría de acidemia respiratoria, ácido láctico normal, tiempos de coagulación normales, hemoglobina de 10,8 g/dl, hematocrito de 34%, recuento manual de plaquetas de 69.000, lo que indica posible hemodilución en el transoperatorio con MA normal y se decide diferir la transfusión de plaquetas.
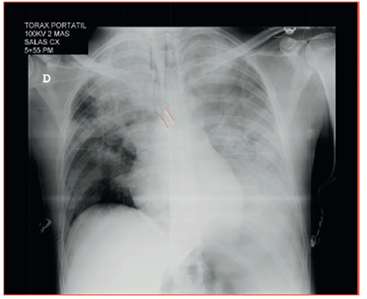
Fuente: Historia clínica (consentimiento informado)
Figura 3 Radiografía de tórax posterior al procedimiento. Se observan opacidades parenquimatosas de ocupación alveolar que comprometen casi la totalidad del pulmón izquierdo y, en el pulmón derecho, principalmente el lóbulo superior. Tubo endotraqueal selectivo en el bronquio fuente izquierdo (líneas rojas).
Discusión
El manejo de la hemoptisis masiva durante la realización de fibrobroncoscopia tiene 3 objetivos: estabilidad hemodinámica, aislamiento pulmonar y control del sangrado17.La figura 4 muestra el algoritmo propuesto para este manejo.

Figura 4 Algoritmo propuesto para el manejo de hemoptisis masiva durante la realización de fibrobroncoscopia. Hemoptisis leve: sin compromiso hemodinámico y sangrado autolimitado. Hemoptisis severa: produce inestabilidad hemodinámica, requerimiento de transfusión o falla respiratoria hipoxémica. *Con fibrobroncoscopio (FB) rígido si se sospecha sangrado proximal o flexible si es distal. SSN: solución salina normal.
Grandes volúmenes de sangre perdidos deben repletarse rápidamente con el fin de evitar isquemia tisular, choque irreversible y falla multiorgánica. El uso de cristaloides es la primera línea de tratamiento: los coloides no han demostrado mejores desenlaces en mortalidad, falla multiorgánica, número de días en Unidad de Cuidados Intensivos o en estancia hospitalaria, días de requerimiento de ventilación mecánica o de terapia de reemplazo renal18. En nuestro caso se utilizó lactato de Ringer porque la SSN isotónica se relaciona con hipercloremia y acidosis metabólica19,20.
La transfusión masiva inmediata debe considerarse en hemorragia no controlada e inestabilidad hemodinámica. Se define como el empleo de más de 10 unidades en las primeras 24 h, más de 4 unidades en una hora o reemplazo de más de 50% de volemia en 3 h21-23.
Los protocolos de transfusión masiva con estrategias transfusionales con proporciones fijas de GR/plasma fresco/plaquetas (1:1:1 o 2:1:1) no han demostrado un beneficio entre unos y otros23. En nuestro caso, solo fueron necesarias 2 unidades de GR: por el resultado del tromboelastograma no se administraron otros hemoderivados ni se activó el protocolo de transfusión masiva.
El uso de vasopresores como norepinefrina no tratan la causa del choque hipovolémico y disminuyen la perfusión tisular periférica. La decisión de su uso debe ser basada en la clínica de cada paciente.
Para ubicar el sitio de sangrado, los signos clínicos (sibilancias, agregados pulmonares, matidez a la percusión) pueden ser inespecíficos. Elbroncoscopio rígido tiene mayor diámetro, lo cual tiene como ventaja mayor poder de succión y mantenimiento de la vía aérea permeable: es de elección en caso de sangrado proximal de la vía aérea, pero no en sangrado periférico, razón por la cual el fibrobroncoscopio flexible es el ideal en estos casos; sin embargo, su menor calibre limita las posibles intervenciones terapéuticas e impide una adecuada succión en hemoptisis masiva16.
La posición del paciente del lado del pulmón sangrante tiene el objetivo de evitar que el sangrado llegue al pulmón sano y aumente el cortocircuito pulmonar, empeorando la relación ventilación/perfusión. En la literatura revisada no hay estudios que midan la utilidad de dicha maniobra y la prioridad debe ser asegurar la vía aérea16.
La intubación con tubo de doble luz es lo ideal para asegurar la vía aérea, ya que permite aislar el pulmón sangrante y ventilar el otro pulmón. El adecuado posicionamiento debe hacerse o verificarse bajo visión directa, lo cual requiere experiencia y es difícil de realizar con sangrado abundante de la vía aérea; además, varios intentos fallidos pueden aumentar la morbimortalidad del paciente16,24,25. En nuestro caso, fue posible la intubación con un tubo de doble luz en el primer intento. Otras posibilidades son intubación selectiva con tubo orotraqueal normal o el uso de bloqueador bronquial.
El control del sitio de sangrado debe ser oportuno para mejorar los desenlaces perioperatorios. El fibrobroncoscopio permite la visualización del sangrado: si es leve, permite controlarlo con aplicación continua de 50 ml de agua fría (4 °C)26. Otra posibilidad es la colocación de un bloqueador bronquial, aunque la literatura sobre la eficiencia es escasa y en un sangrado masivo es muy difícil su adecuado posicionamiento16,26-29. Las técnicas endobronquiales que usan dispositivos eléctricos (láser, crioterapia y argón plasma) podrían ser una opción para el tratamiento definitivo, aunque es difícil su implementación en hemoptisis masiva30.
En nuestro caso, no fue posible realizar una embolización guiada por arteriografía por presentar un severo vasoespasmo del sitio de sangrado (fig. 2), lo cual contraindica su realización. Esta técnica es una opción diagnóstica y terapéutica del sitio de sangrado31,32. Alrededor del 90% de las hemoptisis masivas provienen de las arterias bronquiales33; la embolización selectiva de estas arterias controla el sangrado hasta en un 90% de los casos34,35.
La cirugía de urgencia (lobectomía o segmentectomía) es la última opción para el control de la hemoptisis severa. La mortalidad puede llegar hasta el 25%, aunque suele ser menor con resecciones más pequeñas36.
Por último, nosotros no utilizamos terapia antifibrinolítica (ácido tranexámico) para el control de hemoptisis. La literatura es escasa, no es comparable y tiene un bajo nivel de evidencia37. Hay evidencia insuficiente para saber si la terapia antifibrinolítica debe ser usada en el tratamiento de hemoptisis de cualquier causa, aunque algunos estudios indican una reducción de la duración del sangrado38.
En conclusión, el manejo de la hemoptisis masiva debe ser multidisciplinario (anestesiólogo, neumólogo intervencionista, cirujano de tórax y radiólogo intervencionista). Los 3 pilares del tratamiento se basan en lograr una estabilidad hemodinámica, asegurar una adecuada ventilación del pulmón sano y controlar el sitio del sangrado (fig. 4). Si bien la incidencia de esta complicación es baja, puede tener consecuencias fatales y se requieren más estudios para su adecuado tratamiento.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
REFERENCIAS
1. Pue CA, Pacht ER. Complications of fiberoptic bronchoscopy at a university hospital. Chest. 1995;107:430-2. [ Links ]
2. Jin F, Mu D, Chu D, Fu E, Xie Y, Liu T. Severe complications of bronchoscopy. Respiration. 2008;76:429-33. [ Links ]
3. Facciolongo N, Patelli M, Gasparini S, Lazzari Agli L, Salio M, Simonassi C, et al. Incidence of complications in bronchoscopy. Multicentre prospective study of 20,986 bronchoscopies. Monaldi Arch Chest Dis. 2009;71:8-14. [ Links ]
4. Carr IM, Koegelenberg CF, von Groote-Bidlingmaier F, Mowlana A, Silos K, Haverman T, et al. Blood loss during flexible bronchoscopy: a prospective observational study. Respiration 2012;84:312-8 [ Links ]
5. Tukey MH, Wiener RS. Population-based estimates of transbronchial lung biopsy utilization and complications. Respir Med. 2012;106:1559-65. [ Links ]
6. Ost DE, Ernst A, Lei X, Kovitz KL, Benzaquen S, Diaz-Mendoza J, et al. Diagnostic yield and complications of bronchoscopy for peripheral lung lesions. Results of the AQuIRE Registry. Am J Respir Crit Care Med. 2016;193:68-77. [ Links ]
7. Eapen GA, Shah AM, Lei X, Jimenez CA, Morice RC, Yarmus L, et al. Complications, consequences, and practice patterns of endobronchial ultrasound-guided transbronchial needle aspiration: results of the AQuIRE registry. Chest. 2013;143:1044-53. [ Links ]
8. Schnabel RM, van der Velden K, Osinski A, Rohde G, Roekaerts PM, Bergmans DC. Clinical course and complications following diagnostic bronchoalveolar lavage in critically ill mechanically ventilated patients. BMC Pulm Med. 2015;15:107. [ Links ]
9. Dweik RA, Stoller JK. Role of bronchoscopy in massive hemoptysis. Clin Chest Med. 1999;20:89-105. [ Links ]
10. Corey R, Hla KM. Major and massive hemoptysis: reassessment of conservative management. Am J Med Sci. 1987;294:301-9. [ Links ]
11. Ibrahim WH. Massive haemoptysis: the definition should be revised. Eur Respir J. 2008;32:1131-2. [ Links ]
12. Sakr L, Dutau H. Massive hemoptysis: an update on the role of bronchoscopy in diagnosis and management. Respiration. 2010;80:38-58. [ Links ]
13. Flume PA, Yankaskas JR, Ebeling M, Hulsey T, Clark LL. Massive hemoptysis in cystic fibrosis. Chest. 2005;128:729-38. [ Links ]
14. Ong TH, Eng P. Massive hemoptysis requiring intensive care. Intensive Care Med. 2003;29:317-20. [ Links ]
15. Valipour A, Kreuzer A, Koller H, Koessler W, Burghuber OC. Bronchoscopy-guided topical hemostatic tamponade therapy for the management of life-threatening hemoptysis. Chest. 2005;127:2113-8. [ Links ]
16. Yendamuri S. Massive airway hemorrhage. Thorac Surg Clin. 2015;25:255-60. [ Links ]
17. Finfer S, Bellomo R, Boyce N, French J, Myburgh J, Norton R, et al. A comparison of albumin and saline for fluid resuscitation in the intensive care unit. N Engl J Med. 2004;350:2247-56. [ Links ]
18. Gheorghe C, Dadu R, Blot C, Barrantes F, Vazquez R, Berianu F, et al. Hyperchloremic metabolic acidosis following resuscitation of shock. Chest. 2010;138:1521-2. [ Links ]
19. Burdett E, Dushianthan A, Bennett-Guerrero E, Cro S, Gan TJ, Grocott MP, et al. Perioperative buffered versus non-buffered fluid administration for surgery in adults. Cochrane Database Syst Rev. 2012;12:CD004089. [ Links ]
20. Nordin AJ, Mäkisalo H, Höckerstedt KA. Failure of dobutamine to improve liver oxygenation during resuscitation with a crystalloid solution after experimental haemorrhagic shock. Eur J Surg. 1996;162:973-9. [ Links ]
21. Llau JV, Acosta FJ, Escolar G, Fernández-Mondéjar E, Guasch E, Marco P, et al. Multidisciplinary consensus document on the management of massive haemorrhage (HEMOMAS document). Med Intensiva. 2015;39:483-504. [ Links ]
22. Klein HG, Spahn DR, Carson JL. Red blood cell transfusion in clinical practice. Lancet. 2007;370:415-26. rev colomb anestesiol. 2017;45(3):256-261 [ Links ]
23. Scully PR. Major trauma and transfusion in the north east of England. In: Sen B, editor. Injury extra. 2010. p. 208-9. [ Links ]
24. Garzon AA, Cerruti MM, Golding ME. Exsanguinating hemoptysis. J Thorac Cardiovasc Surg. 1982;84:829-33. [ Links ]
25. Conlan AA, Hurwitz SS. Management of massive haemoptysis with the rigid bronchoscope and cold saline lavage. Thorax. 1980;35:901-4. [ Links ]
26. Freitag L, Tekolf E, Stamatis G, Montag M, Greschuchna D. Three years experience with a new balloon catheter for the managemen of haemoptysis. Eur Respir J. 1994;7:2033-7. [ Links ]
27. Jolliet P, Soccal P, Chevrolet JC. Control of massive hemoptysis by endobronchial tamponade with a pulmonary artery balloon catheter. Crit Care Med. 1992;20:1730-2. [ Links ]
28. Kato R, Sawafuji M, Kawamura M, Kikuchi K, Kobayashi K. Massive hemoptysis successfully treated by modified bronchoscopic balloon tamponade technique. Chest. 1996;109:842-3. [ Links ]
29. Saw EC, Gottlieb LS, Yokoyama T, Lee BC. Flexible fiberoptic bronchoscopy and endobronchial tamponade in the managemen of massive hemoptysis. Chest. 1976;70:589-91. [ Links ]
30. Bhattacharyya P, Dutta A, Samanta AN, Chowdhury SR. New procedure: bronchoscopic endobronchial sealing; a new mode of managing hemoptysis. Chest. 2002;121:2066-9. [ Links ]
31. Yoon W, Kim JK, Kim YH, Chung TW, Kang HK. Bronchial and nonbronchial systemic artery embolization for life-threatening hemoptysis: a comprehensive review. Radiographics. 2002;22:1395-409. [ Links ]
32. Chun HJ, Byun JY, Yoo SS, Choi BG. Added benefit of thoracic aortography after transarterial embolization in patients with hemoptysis. AJR Am J Roentgenol. 2003;180:1577-81. [ Links ]
33. Chen J, Chen LA, Liang ZX, Li CS, Tian Q Yang Z, et al. Immediate and long-term results of bronchial artery embolization for hemoptysis due to benign versus malignant pulmonary diseases. Am J Med Sci. 2014;348:204-9. [ Links ]
34. Fruchter O, Schneer S, Rusanov V, Belenky A, Kramer MR. Bronchial artery embolization for massive hemoptysis: long-term follow-up. Asian Cardiovasc Thorac Ann. 2015;23:55-60. [ Links ]
35. Alexander GR. A retrospective review comparing the treatment outcomes of emergency lung resection for massive haemoptysis with and without preoperative bronchial artery embolization. Eur J Cardiothorac Surg. 2014;45:251-5. [ Links ]
36. Moen CA, Burrell A, Dunning J. Does tranexamic acid stop haemoptysis? Interact Cardiovasc Thorac Surg. 2013;17 :991-4. [ Links ]
37. Prutsky G, Domecq JP, Salazar CA, Accinelli R. Antifibrinolytic therapy to reduce haemoptysis from any cause. Cochrane Database Syst Rev. 2012:CD008711. [ Links ]
38. Maguire MF, Berry CB, Gellett L, Berrisford RG. Catastrophic haemoptysis during rigid bronchoscopy: a discussion of treatment options to salvage patients during catastrophic haemoptysis at rigid bronchoscopy. Interact Cardiovasc Thorac Surg. 2004;3:222-5. [ Links ]
Recibido: 30 de Octubre de 2016; Aprobado: 15 de Marzo de 2017











 text in
text in 



