Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.46 no.1 Bogotá Jan./Mar. 2018
https://doi.org/10.1097/cj9.0000000000000009
REVISIÓN
Manejo del dolor agudo en el paciente gran quemado: Revisión no sistemática de la literatura
a Coordinadora académica, Clínica del Dolor y Cuidado Paliativo, Fundación Cardiovascular de Colombia, Floridablanca, Colombia
b Director Clínica del Dolor y Cuidado Paliativo, Fundación Cardiovascular de Colombia, Docente del posgrado de Anestesiología y Reanimación de la Universidad Industrial de Santander, Bucaramanga, Colombia
c Médica asistencial, Fundación Cardiovascular de Colombia, Floridablanca, Colombia
d Residente de Anestesiología y Reanimación, Universidad Autónoma de Bucaramanga, Bucaramanga, Colombia
e Residente de Anestesiología y Reanimación, Universidad Industrial de Santander, Colombia
f Coordinador académico de la Unidad de Cuidados Intensivos del Hospital Universitario de Santander, Docente del posgrado de Anestesiología y Reanimación de la Universidad Industrial de Santander, Bucaramanga, Colombia
Introducción:
El manejo del dolor agudo es fundamental en el tratamiento de los pacientes quemados. Los esquemas actuales de manejo de dolor se enfocan en el control del componente somático que refleja la noxa, sin embargo es un evento con componentes emocionales, físico y psíquicos, que requiere manejo multidisciplinario incluyendo intervenciones farmacológicas y no farmacológicas, para romper el círculo vicioso del dolor y sus complicaciones.
Objetivo:
Realizar una revisión no sistemática de la literatura sobre el manejo farmacológico y no farmacológico del dolor agudo en el paciente gran quemado.
Metodología:
Se realizó una revisión no sistemática en MEDLINE/PubMed, Embase, Science Direct, SciELO, LILACS, Google Scholar, libros académicos, guías de manejo institucionales, desde el año 2000 hasta el 2016.
Resultados:
Luego de analizar la literatura se encuentra que el manejo del dolor agudo en el paciente gran quemado debe recibir un enfoque multidisciplinario.
Conclusiones:
El manejo agudo del dolor en el paciente gran quemado no se debe centrar solamente en los componentes somáticos del mismo, sino que debe extenderse a los componentes emocionales físicos y psicosociales, para brindar un manejo integral, tanto farmacológico como no farmacológico.
Palabras clave: Dolor; Dolor Agudo; Analgésico; Quemaduras; Manejo del Dolor
Introduction:
Management of acute pain is essential in the treatment of burned patients. Current pain management approaches focus on the control of the somatic component reflecting the insult. However, the injury comprises emotional, physical, and psychological components that require multi-disciplinary management, including pharmacological and nonpharmacological interventions to break the vicious circle of pain and its complications.
Objective:
To perform a nonsystematic review of the literature on the pharmacological and nonpharmacological management of pain in patients with extensive burns.
Methods:
Nonsystematic review of the literature published between 2000 and 2016 in MEDLINE/PubMed, Embase, Sciencedirect, SciELO, LILACS, Google Scholar, academic books, and institutional management guidelines.
Results:
After analyzing the literature, it was found that the management of acute pain in the patients with severe burn injury should be based on a multidisciplinary approach.
Conclusions:
Management of acute pain in patients with severe burn injury should not focus only on the somatic components of pain but should also encompass the emotional, physical, and psychosocial components, in order to provide comprehensive management, both pharmacological and nonpharmacological.
Keywords: Pain; Acute Pain; Analgesics; Burns; Pain Management
Introducción y objetivos
Uno de los pilares fundamentales del tratamiento de pacientes con quemaduras en fase aguda es el manejo efectivo del dolor, lo que significa además, el manejo indirecto y precoz de las complicaciones que pueden surgir de la atención inefectiva del mismo, tanto a corto plazo (trombosis venosa, hipertensión con órgano blanco, taquicardia, evento coronario, hiperglicemia, inmunosupresión, entre otras) como a largo plazo (dolor neuropático, depresión, ansiedad, contracturas articulares).1-6
En la literatura actual, los esquemas de manejo de dolor en pacientes que sufren quemaduras se enfocan en el control del componente somático que refleja la noxa traumática; sin embargo, el dolor en quemaduras es un suceso mucho más complejo, que implica compromiso en múltiples niveles (físico, emocional y psíquico), e involucra mecanismos fisiopatológicos que significan mucho más que un fenómeno controlable con la administración de opioides, debiéndose involucrar, por tanto, un manejo basado en la mejor evidencia disponible, realizado por un grupo multidisciplinario, y que incluya intervenciones tanto farmacológicas como no farmacológicas,5,6 con el fin de romper el círculo vicioso del dolor y las complicaciones enunciadas anteriormente, que podrían desencadenarse tras la lesión por quemadura.
Por todo lo anterior surgió la necesidad de realizar una revisión no sistemática de literatura sobre el manejo integral del dolor agudo en el paciente gran quemado, sintetizando los hallazgos más relevantes, para ser aplicado en el Hospital Universitario de Santander uno de los pocos centros médicos del país que cuenta con unidad de atención de pacientes quemados, este documento fue desarrollado por la Universidad Industrial de Santander, y tiene como fin brindar pautas en el manejo agudo del dolor en esta población de pacientes, para ser aplicadas en cualquier punto de la atención aguda, no solo limitándose al manejo en un tercer o cuarto nivel de atención en salud en nuestro país.
Metodología
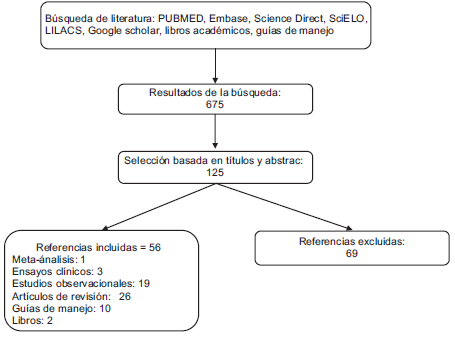
Se realizó una revisión no sistemática de literatura desde el año 2000 hasta el año 2016, provenientes de bases de datos como: MEDLINE/PUBMED, Embase, Science Direct, SciELO, LILACS, Google scholar, libros académicos, guías de manejo institucionales o documentos regulatorios, con lossiguientestérminosde busqueda en inglés y español como: Acute pain, Burns, Analgesics, therapy, pathophysiology of burns, non-pharmacologic analgesic for acute burn pain, management of pain in children burns, virutal reality in burn pain, opioid withdrawal, opioid overdose, management of pruritus in burns, Dolor agudo en quemados, quemadura, analgesia, manejo perioperatorio en quemados, manejo de dolor en el paciente pediátrico quemado, sobre-dosis con opioides, destete de opioides, manejo del prurito en quemados. Se consideraron meta-análisis, ensayos clínicos, estudios observacionales, artículos de revisión, series de casos, guías de manejo y libros, excluyendo aquellos que no aportaban información relevante sobre manejo agudo y los que no cumplían con la fecha de bu squeda (Figura 1). Se realiza lectura de los artículos encontrados por parte de los autores, seleccionando los referenciados en la bibliografía, los resultados de esta revisión se presentan a continuación, bajo el punto de vista de los autores.
Desarrollo del tema
Evaluación del dolor
La evaluación del dolor se debe realizar antes, durante y después de un procedimiento álgico, también a los 30 minutos de una intervención analgésica, ésta debe ser objetiva con base en un horario regular con un instrumento validado como por ejemplo:6,7
Visual Analogue Scale (VAS, sigla en inglés), o Escala Visual Análoga, en mayores de 12 años.8
Verbal Numeric Scale (VNS, sigla en inglés) o Escala Verbal Numérica, en mayores de 12 años, y en escenarios donde hayan limitaciones en comprensión de VAS.8
Verbal Global Scale (VGS, sigla en inglés), o Escala Verbal global, en mayores de 12 años, y en escenarios donde hayan limitaciones en comprensión de VAS y VNS.8
Smiles Pain Rating Scale (SRPS, sigla en inglés), o Escala de Evaluación de dolor con Caras Sonrientes, en pacientes de 5 - 12 años.8
FLACC (sigla en inglés): Facies de dolor, movimientos de miembros inferiores, agitación, consolabilidad y llanto, en menores de 5 años.8
Manejo farmacológico: generalidades
Los fármacos opioides potentes son la piedra angular del manejo de dolor agudo causado por quemaduras.8-11 Se sugiere iniciar manejo con fármacos opioides potentes y luego desescalar, en lugar de ir escalando en potencia.9,12 En todo servicio donde dichos fármacos se utilicen rutinariamente, se deberá contar con acceso a fuentes de oxígeno, equipos para reanimación cardio cerebro pulmonar (RCCP), personal entrenado en la misma y naloxona.8-10 Adicionalmente se deben prever y tratar agresivamente los efectos secundarios a la administración de opioides.9-11,13
Los procedimientos intensamente dolorosos, o no tolerados por el paciente, se deben realizar bajo anestesia general.9,10,12,14
Manejo de dolor de base: paracetamol y antiinflaamatorios no esteroideos (AINEs)
Se sugiere indicar a todos los pacientes acetaminofén8,10,11,14 por horario (500 mg cada 6 horas en adultos, 10 - 15mg/kg dosis cada 6 horas en niños vía oral (v.o), como parte del manejo de dolor de base, a menos que esté contraindicado.10,11 Se puede considerar la adición de (AINEs) por horario12,13 (ibuprofeno 400 mg vía oral cada 8 horas, 10mg/kg dosis cada 8 horas en niños mayores de 6 meses, o diclofenaco 50 mg v.o cada 12 horas, 75 mg intravenoso (i.v) cada 12 horas en adultos, 1-2mg/kg cada 12 horas en niños mayores de 5 años) en ciclo corto (máximo 3 días), el acetaminofén por horario en pacientes no críticos, con v.o preservada en fase aguda de quemadura.9
Manejo de dolor de base: opioides
En caso de no lograrse el control del dolor con la administración de acetaminofén o el ciclo corto de AINEs, se debe adicionar al manejo farmacológico un agonista opioide débil por horario, como el tramadol a 1mg/kg/ dosis cada 6-8 horas en niños o 50 - 100 mg i.v cada 6 - 8 horas, máximo 400 mg día en adultos, o codeína 1mg/kg/ dosis cada 6 - 8 horas en niños, o 30 - 60 mg vía oral cada 6 horas en adultos, máximo 240 mg al día.6,7,9,15
Si las medidas anteriores no son suficientes para controlar adecuadamente el dolor, se deberá iniciar el manejo farmacológico con un agonista opioide fuerte por horario, teniendo la precaución de suspender primero la administración de opioide débil, así: titulación de morfina con dosis bajas (1 - 2mg en adultos, 0,01mg/ kg en niños) i.v cada 5 - 10 minutos hasta control del dolor, o presencia de somnolencia, dejando la dosis total titulada cada 4-6 horas si se prevé que la causa del dolor continuará.9,16,17
Si no se dispone de opioide fuerte, en lugar del opioide débil, se puede administrar un opioide agonista -antagonista por horario tipo nalbufina a 0,4mg/kg/dosis cada 4-6 horas.17
Manejo de dolor incidental
Otra opción del manejo agudo es la analgesia controlada por el paciente, (PCA por sus siglas en inglés), cuya utilidad principal se encuentra en el manejo del dolor incidental. Se recomienda el uso de PCA de fentanilo con bolo inicial 1 mcg/kg, demandas de 30 mcg, con intervalo de cierre 5 minutos, o morfina intravenosa 0,05 - 0,2 mg/kg/dosis cada 4 - 6 horas.7 También es util en el manejo de dolor incidental el uso de meperidina 1 mg/kg/dosis (máximo 4 dosis en total).16
Manejo de dolor procedimental
Para el manejo de dolor causado por la realización de procedimientos en esta población de pacientes, tenemos varias opciones con alta calidad de evidencia. La primera de ellas es la aplicación de opioide fuerte previo al procedimiento (morfina 0,05 - 0,2mg/kg 10 minutos antes, o fentanilo 1mcg/kg 5 minutos antes) o el uso de PCA asociado a una benzodiacepina previa al procedimiento (midazolam 0,05 mg/kg 30 minutos - 1 hora antes)6,7,12,14,18,19 La asociación de Ketamina se ha utilizado ampliamente por más de 40 años en pacientes quemados, pero su uso se había reducido por sus efectos secundarios, los cuales se pueden evitar con la asocia-ción de una benzodiacepina. Laketaminaadosis de 1mg/kg con una benzodiacepina (midazolam 0,05 mg/ kg) y un antisialagogo (atropina 0,01mg/kg) es una excelente opción analgésica, siempre y cuándo se administre en instalaciones dónde se cuente con anestesiólogo.6,8,14,15,19-21
Otra asociación de fármacos con excelente efecto analgésico en dolor procedimental es el uso de dexme-detomidina bolo 1mcg/kg, asociado a Ketamina bolo 2 mg/kg y Tramadol 1 mg/kg, en instalaciones equivalentes a cuidado intermedio, con presencia de personal entrenado en RCCP o anestesiólogo.10,20,22,23
Por otra parte dentro de las intervenciones no farmacológicas, en adolescentes se encuentra la asociación de realidad virtual, realizada en instalaciones con la infraestructura adecuada y personal debidamente entrenado,6,13,18,24-29 así como el uso de estimulación eléctricatranscutánea(TENS), antes, durante y después del procedimiento, previa explicación al paciente, y en asociación con esquemas farmacológicos.19,30
Manejo de dolor postoperatorio
Considerar desde el servicio de Anestesiología de Cirugía Plástica, involucrar esquemas de analgesia sistémica preventiva con AINEs o acetaminofén sistémico antes del procedimiento,16,19 anestesia tumescente,(6 bloqueos regionales6,13,14,18,21 o lidocaína tópica en curaciones6,8,15 buscando brindar efecto analgésico residual posterior al procedimiento quirúrgico - anestésico. En Pacientes estables, que toleren la vía oral, se puede considerar el uso de opioides débiles como codeína a dosis entre 30 - 60 mg cada 6 horas, con dosis máxima 240 mg día, buscando activamente, y tratando oportunamente efectos secundarios. Asimismo, se puede considerar el uso de oxicodona convencional, a dosis de 5 -10 mg cada 8 horas, o fórmula de liberación prolongada cada 12 - 24 horas, Metadona 2,5 - 5mg cada 6 horas, o Hidrocodona 5 - 10 mg cada 4 - 6 horas. Se debe procurar no usar opioides orales por más de 10 días, con el fin de evitar dependencia física.6,8,18,19,31
Manejo de dolor neuropático
Dadas las características de las lesiones en los pacientes que sufren quemaduras, es coimin que se presente dolor neuropático en esta población, por lo que se recomienda la asociación precoz de pregabalina que ha demostrado eficacia clínica en la reducción del dolor neuropatico a nivel periférico y central, a dosis tituladas desde 37,5 mg con opioide por v.o ante dolor de dichas características.19,32-34 En situaciones donde no se cuente con acceso a pregabalina, se debe considerar el uso de gabapentina titulada desde 300 mg v.o al día.33,35-36
Prurito
El prurito debe ser tratado con medidas farmacológicas como gabapentina en dosis incrementales desde 300mg hasta 1500mg/día v.o37-42 y no farmacológicas efectivas,37,40 recordando que la v.o puede ser una vía de administración de medicamentos en quemaduras leves,11,43 y que no deben usarse las vías intramuscular ni subcutánea en fases agudas de quemadura.6,43
Manejo no farmacológico
Se deben ofrecer opciones no farmacológicas junto con las opciones farmacológicas.9,10,21,31 En servicios con instalaciones adecuadas y personal entrenado, se podrían ofrecer como estrategias de manejo no farmacológico musicoterapia, hipnosis, esquemas de realidad virtual no inmersiva (imágenes, videos, videojuegos) o inmersiva, y psicoterapia pre, postprocedimiento y transterapéutico.10,24-28,44
Manejo de complicaciones secundarias al uso de medicamentos para el manejo analgésico en pacientes quemados
Depresión respiratoria por opioides
El uso de opioides a dosis elevadas en los pacientes con quemaduras conlleva el riesgo de que se presenten eventos adversos secundarios al uso de los mismos. De ellos, el efecto adverso más grave es la depresión respiratoria. Es necesario reconocerla o sospecharla rápidamente si nos enfrentamos a un paciente con antecedente confirmado de administración de dosis elevadas de opioides, que presente una frecuencia respiratoria inferior a 8 por minuto, miosis, oximetría de pulso inferior a 90% y somnolencia o estupor. La respuesta debe ser inmediata, avisando prioritariamente al servicio de anestesiología de urgencias e iniciando estimulación táctil y auditiva al paciente, sumado a la titulación de naloxona, con dosis de lmcg/kg intravenoso cada 3 a 5 minutos hasta que se resuelva la bradipnea o el paciente presente recuperación de estado de conciencia y saturación arterial de oxígeno de 91% o superior. El médico que brinda la atención debe evaluar si el paciente requiere manejo básico y/o avanzado de la vía aérea y ventilación, de acuerdo a lineamientos sobre RCCP, sobre los cuales debe estar capacitado. Se debe vigilar la eventualidad de renarcotización, dependiendo del opioide causante de depresión, y de la forma de uso.9,13,22,45-47
Depresión respiratoria por benzodiazepinas
Ante sospecha de depresión respiratoria secundaria al uso de benzodiacepinas, se recomienda administrar flumaze-nil 0,2 mg IV cada minuto hasta recuperación de estado de conciencia, seguir los demás lineamentos descritos anteriormente en el apartado de manejo de depresión respiratoria por opioides.8,22,48,49
Crisis psicomimética por ketamina
Ante alteración sensoperceptiva (alucinaciones, ilusiones) o conductual (agitación, inatención) del paciente, sospechada por la administración de ketamina, se recomienda avisar al servicio de anestesiología de urgencias prioritariamente y simultáneamente administrar midazolam dosis de 0,05mg/kg.22,49-50
Destete de opioides fuertes parenterales en unidad de cuidados intermedios - cuidados intensivos
Siempre, ante sospecha de síndrome de abstinencia de opioides, solicitar apoyo activo del servicio de Clínica del Dolor y de los servicios de Psicología y Psiquiatría de la institución.
En pacientes manejados con opioides fuertes parenterales en Unidad de Quemados (Unidad Intermedia) o Unidad de
Cuidados Intensivos, sospechar abstinencia de opioides ante síntomas sugestivos (taquicardia, diaforesis, hipertensión, midriasis, piloerección, calambres musculares, calambres abdominales, diarrea), sugiriéndose destete de opioides fuertes, si se han usado por más de 5 días, disminuyendo inicialmente un 20 - 40% la dosis, y posteriormente reducciones subsecuentes de 10% cada 12 - 24 horas.51-54
Ante hallazgos físicos de abstinencia de opioides, y con uso de opioides fuertes por más de 10 días, considerar inicio de terapia sustitutiva con metadona a dosis equianalgésica fraccionada cada 6 - 8 horas, y disminuyendo el 20% de dicha dosis semanalmente hasta suspensión completa hacia la 5ta semana.51,55
Se sugiere el uso de terapia no sustitutiva (Benzodiacepinas, Clonidina), concomitantemente con terapia sustitutiva.54-56
Conclusiones
El manejo de dolor en el paciente quemado constituye un desafío debido al enfoque multidisciplinario que idealmente debe recibir. Entender la fisiopatología de las lesiones por quemadura es fundamental para entender los tipos de dolor que suelen presentar estos pacientes y la severidad de los mismos. El manejo agudo del dolor no se debe centrar solamente en los componentes somáticos del mismo, sino que debe extenderse a los componentes emocionales y psicosociales, para brindar un manejo integral, tanto farmacológico como no farmacológico.
Responsabilidades éticas
Protección de personas y animals. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
REFERENCIAS
1. Browne A, Andrews R, Schug S, et al. Persistent pain outcomes and patient satisfaction with pain management after burn injuries. Clin J Pain 2011; 27:136-145. [ Links ]
2. Ramírez C, Ramírez C, González L, et al. Fisiopatología del paciente quemado. Reu Salud UIS 2010; 42:55-65. [ Links ]
3. Dauber A, Osgood P, Breslau A, et al. Chronic persistent pain after severe burns: a survey of 358 burn survivors. Pain Med 2002; 3:6-17. [ Links ]
4. Dyster-Aas J, Willebrand M, Wikehult B, et al. Major depression and posttraumatic stress disorder symptoms following severe burn injury in relation to lifetime psychiatric morbidity. J Trauma 2008; 64:1349-1356. [ Links ]
5. Patterson D, TininenkoJ, PtacekJ. Pain during burn hospitalization predicts long term outcome. J Burn Care Res 2006; 27:719-726. [ Links ]
6. Faucher L, Furukawa K. Practice guidelines for the management of pain. J Burn Care Res 2006; 27:659-668. [ Links ]
7. European Burns Association. Practice Guidelines for Burn Care, 2nd ed. Vienna; 2013. [ Links ]
8. Larrea B, Avila M, Raddatz C. Manejo de dolor en pacientes quemados. Reu Chil Anest 2015; 44:78-95. [ Links ]
9. Midlands Burn Care Network, Guidelines For Pain and Itch Management For Patients Within The Midland Burn Care Network, Birmingham (England). 1 Ed. 2011. [ Links ]
10. Alencar R, Cunha P, Kimiko R. Tratamiento del dolor en quemados. Reu Bras Anestesiol 2013; 63:149-158. [ Links ]
11. Aguilera F. Anestesia y manejo perioperatorio del paciente quemado. Reu Salud Bosque 2016; 6:65-78. [ Links ]
12. Macintyre P, Schug S, Scott D, et al; APM: SE Working Group of the Australian and New Zealand College of Anaesthetists and Faculty of Pain Medicine. Acute Pain Management: Scientific Evidence 3er ed. Melbourne: ANZCA & FPM; 2010. [ Links ]
13. Guidelines for Pain Management For patients within the Midland Burn Operational Delivery Network. Birmingham: Review date 2016. [ Links ]
14. Cordero I, Rodriguez R, Miquet L, et al. Conducta perioperatoria del paciente quemado. Reu Cub Anest Rean 2005; 4:75-92. [ Links ]
15. Ministerio de Salud de Chile Guía Clínica gran Quemado. Santiago: Minsal. 2007. [ Links ]
16. Marret E, Kurdi O, Zufferey P, et al. Effects of nonsteroidal, anti-inflammatory drugs on patient-controlled analgesia morphine side effects: meta-analysis of randomized, controlled trials. Anesthesiology 2005; 102:1249-1260. [ Links ]
17. Ramírez C, Ramírez C, Ramírez M, Ramírez N. Manejo del paciente quemado. Rev Univ Ind Santander Salud 2007:73-86. [ Links ]
18. Richardson P, Mustard L. The management of pain in the burns unit. Burns 2009; 35:921-936. [ Links ]
19. Ministerio de Salud de Chile Guías clínicas AUGE gran quemado. Santiago: Minsal 2016. [ Links ]
20. Zor F, Ozturk S, Bilgin F, et al. Pain relief during dressing changes of major adult burns: ideal analgesic combination with ketamine. Burns 2010; 36:501-505. [ Links ]
21. Larrea B. Dolor en trauma térmico. Boletín el dolor 2006; 15:14-25. [ Links ]
22. Morgan Ge. Morgan GE. Coadyuvantes de la Anestesia. Anestesiología Clínica 4 ed.2009; Mc Graw Hill, 277-279. [ Links ]
23. Walker J, MacCallum M, Fischer C, et al. Sedation using dexmedetomidine in pediatric burn patients. J Burn Care Res 2006; 27:206-210. [ Links ]
24. Kipping B, Rodger S, Miller K, et al. Virtual reality for acute pain reduction in adolescents undergoing burn wound care: a prospective randomized controlled trial. Burns 2012; 38:650657. [ Links ]
25. Mott J, Bucolo S, Cuttle L, et al. The efficacy of an augmented virual reality system to alleviate pain in children undergoing burns dressing changes: a randomised controlled trial. Burns 2008; 34:803-808. [ Links ]
26. Hoffman H, Chambers G, Meyer W, et al. Virtual reality as an adjunctive non-pharmacologic analgesic for acute burn pain during medical procedures. Ann Behau Med 2011; 41:183-191. [ Links ]
27. Jonhson S, Coxon M. Sound can enhance the analgesic effect of virtual reality. R Soc Open Sci 2016; 3:150567. [ Links ]
28. Hoffman H, Sharar S, Coda B, et al. Manipulating presence influences the magnitude of virtual reality analgesia. Pain 2004; 111:162-168. [ Links ]
29. Morris L, Louw Q Grimmer-Somers K. The effectiveness of virtual reality on reducing pain and anxiety in burn injury patients: a systematic review. Clin J Pain 2009; 25:815-826. [ Links ]
30. Vásquez K, García R, Cruz M, et al. Electroterapia como manejo alternativo del dolor en quemaduras. Reu San Milit Mex 2008; 62:141-144. [ Links ]
31. Gandhi M, Thomson C, Lord D, et al. Management of pain in children with burns. Int J Pediatr 2010; 2010:1-9. [ Links ]
32. Grey P, Kirby J, Smith M, et al. Pregabalin in severe burn injury pain: a double-blind, randomized placebo-controlled trial. Pain 2011; 52:1279-1288. [ Links ]
33. Grey P. Acute neuropathic pain, diagnosis and treatment. Curr Opin Anaesthesiol 2008; 21:590-595. [ Links ]
34. Wong L, Turner L. Treatment of postburn neuropathic pain: evaluation of pregrabalin. Burns 2010; 36:769-772. [ Links ]
35. Cuignet O, Pirson J, Soudon O, et al. Effects of gabapentin on morphine consumption and pain in severely burned patients. Burns 2007; 33:81-86. [ Links ]
36. Grey P, Williams B, Cramond T. Successful use of gabapentin in acute pain management following burn injury: a case series. Pain Med 2008; 9:371-376. [ Links ]
37. Ahuja R, Chatterjee P. Postburn pruritus: a practical review. Indian J Burns 2014; 22:13-22. [ Links ]
38. Ahuja R, Gupta G. A four arm, double blind, randomized and placebo controlled study of pregabalin in the management of postburn pruritus. Burns 2013; 39:24-29. [ Links ]
39. Goutos I, Eldardiri M, Khan A, et al. Comparative evaluation of antipruritic protocols in acute burns. The emerging value of gabapentin in the treatment of burn pruritus. J Burn Care Res 2010; 31:57-63. [ Links ]
40. Goutos I. Review of therapeutic agents for burns pruritus and protocols for management in adult and pediatric patients using the grade classification. Indian J Plast Surg 2010; 43:51-62. [ Links ]
41. Orellana M, Yañez , Gutiérrez J, et al. Prurito neuropático. Reuista el dolor 2012; 57:28-32. [ Links ]
42. Goutos I. Neuropathic mechanisms in the pathophysiology of burns pruritus: redefining directions for therapy and research. J Burn Care Res 2013; 34:82-93. [ Links ]
43. Connolly S. Clinical Practice Guidelines: Burn Patient Management. Sydney: Agency for Clinical Innovation, 2011. [ Links ]
44. Moix J. La hipnosis en el tratamiento del dolor. Reu Soc Esp Dolor 2002; 9:525-532. [ Links ]
45. Boyer E. Management of opiod analgesic overdose. N Engl J Med 2012; 367:146-155. [ Links ]
46. Mugabure B, González S, Uría A, et al. Actualizaciones en el manejo clínico de los opioides espinales en el dolor agudo postoperatorio. Reu Soc Esp Dolor 2012; 19:72-94. [ Links ]
47. Cadavid A. Analgesia opioide en el postoperatorio, en: Opiodes en la práctica médica. 2009; Asociación colombiana para el estudio del dolor, Bogotá (Colombia):45-66. [ Links ]
48. Acuña J. Intoxicación grave por psicofármacos. Reu Med Clin Condes 2011; 22:332-339. [ Links ]
49. Oses I, Burillo-Putze G, Munne P, et al. Intoxcaciones medicamentosas, psicofármacos y antiarrítmicos. ANALES Sis San Nauarra 2003; 26:49-63. [ Links ]
50. Eslava S. Aguilera F. Anestésicos endovenosos. Anestesiología y Medicina Perioperatoria 4th ed. Celsus: Bogotá; 2010; 158-164. [ Links ]
51. Zapantis A, Leung S. Tolerance and withdrawal issues with sedation. Crit Care Nurs Clin North Am 2005; 17:211-223. [ Links ]
52. Rivera R. Sedación y analgesia: una revisión. Acta Pediátr Costarricense 2002; 16:6-21. [ Links ]
53. Galinkin J, Lee J. Recognition and management of iatrogenically-induced opioid dependence and withdrawal in children. Pediatrics 2014; 133:152-155. [ Links ]
54. Suttner J, White A, Vernachio K. Best practices in tapering methods in patients undergoing opioid therapy. Adu Pharmacol Pharm 2013; 1:42-57. [ Links ]
55. Celis E, Besso J, Birchenall C, et al. Guía de práctica clínica basada en la evidencia para el manejo de la sedoanalgesia en el paciente adulto críticamente enfermo. Med Intensiva 2007; 31:428-471. [ Links ]
56. Baltieri D, Strain E, Dias J, et al. Brazilian guideline for the treatment of patients with opioids dependence syndrome. Reu Bras Psiquiatr 2004; 26:259-268. [ Links ]











 text in
text in