Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.46 no.2 Bogotá Apr./June 2018
https://doi.org/10.1097/cj9.0000000000000023
Investigación científica y tecnológica
Análisis de la incidencia de eventos adversos relacionados a aplicación de dipirona
f Residente de Anestesiología (Tercer Año), Fundación Universitaria de Ciencias de la Salud (FUCS). Bogotá, Colombia.
g Residente de Anestesiología (Segundo Año), Fundación Universitaria de Ciencias de la Salud (FUCS). Bogotá, Colombia.
h Residente de Anestesiología (Primer Año), Fundación Universitaria de Ciencias de la Salud (FUCS). Bogotá, Colombia.
i Miembros investigadores del Grupo "DEORUM OPUS" para el estudio de la Anestesiología, Departamento de Anestesiología, Fundación Hospital Infantil Universitario de San José, Bogotá, Colombia.
a Facultad de Medicina, Fundación Universitaria de Ciencias de la Salud (FUCS). Bogotá, Colombia.
b Facultad de Medicina, Universidad de la Sabana. Chía, Colombia.
c Departamento de Anestesiología, Fundación Hospital Infantil Universitario de San José. Bogotá, Colombia.
d AUDIFARMA. Bogotá, Colombia.
e Clínica Universidad de la Sabana. Chía, Colombia.
Introducción:
A pesar del amplio espectro de uso de la dipirona, su asociación a eventos adversos ha reducido su empleo clínico, siendo la agranulocitosis el evento adverso más estudiado, y al parecer de mayor impacto clínico. Estudios en América Latina han controvertido dichas afirmaciones.
Objetivo:
Analizar la incidencia y reporte de eventos adversos asociados al uso de dipirona en un hospital de alta complejidad.
Materiales y métodos:
Estudio observacional descriptivo de una cohorte Incidente. Población: Pacientes usuarios de dipirona durante su estancia hospitalaria. Análisis cuantitativo de Incidencias, y descriptivo de los casos incidentes de adversos relacionados al uso de dipirona.
Resultados:
Incidencia de Eventos Adversos Globales=0,3% (En 48.496 dosis de dipirona formuladas en 2.747 pacientes). Ningún caso de Agranulocytosis. 100% de eventos adversos no severos (Todos asociados a reacción toxidérmica).
Conclusiones:
Se reporta una baja incidencia de eventos adversos relacionados al uso de dipirona. Se controvierte la óptima ejecución de los reportes de eventos adversos institucionales. Se sugiere la realización de la medición de eventos adversos posterior a un más riguroso seguimiento de los pacientes usuarios de este medicamento, y a una estandarización clara y puntual de pautas para una mejor prescripción y control médico luego de su formulación.
Palabras clave: Efectos Adversos; Dipirona; Incidencia; Estudio Observacional; Agranulocitosis
Introduction:
Notwithstanding the widespread use of dipyrone, its association with adverse events has reduced its clinical use, with Agranulocytosis being the most studied adverse event, and apparently of primary clinical impact. Studies in Latin America have disputed these claims.
Objective:
To analyze the incidence and reports of adverse events associated with the use of dipyrone in a high complexity hospital.
Materials and methods:
Descriptive observational study of an incident cohort. Population: Patients receiving dipyrone during their hospital stay. Quantitative analysis of incidents and description of dipyrone-associated adverse events.
Results:
Incidence of global adverse events=0.3% (in 48,946 doses of dipyrone prescribed to 2747 patients). No cases of Agranulocytosis. A total 100% non-severe adverse events. (All were associated with toxidermia).
Conclusion:
A low incidence of dipyrone-associated adverse events is reported. Optimal reporting of institutional adverse events is controversial, and the recommendation is to measure any adverse events with a more rigorous follow-up of patients using dipyrone, and a clear and specific standardization of the guidelines for improved prescription and medical control.
Keywords: Adverse Effects; Dipyrone; Incidence; Observational Study; Agranulocytosis
Introducción
La dipirona, fue lanzada comercialmente por Hoechst AG* (Alemania-1922),1 y por cerca de un siglo se ha utilizado en el ámbito clínico por sus efectos analgésicos, antiInflamatorios y antipiréticos.2,3 Desde hace mas de tres décadas, con el advenimiento de la Analgesia Múltimodal, la dipirona pasó a ser parte relevante de los esquemas analgésicos postoperatorios.2-5
Sin embargo, a partir de las alertas generadas a través de la Food and Drug Administration (FDA),6,7 las cuales asociaron a la dipirona con trastornos hematológicos, la comunidad científica americana se vio obligada a retirarla del mercado local. En sintonía con Estados Unidos, más de 20 naciones siguieron sus pasos tras considerar que los riesgos superaban los beneficios (Reino Unido, Suecia, Italia, India, Alemania, entre otros).
A pesar de considerarse como incontrovertibles dichas ponencias, científicos en diversas latitudes no han podido reproducir lo hallado por la FDA. De hecho, a pesar de contar con: Una restringida documentación, estudios clínicos limitados, reportes de poca capacidad de inferencia (sin potentes cálculos del tamaño de muestra para analizar el daño atribuido por este medicamento), diversos grupos de investigación con la intención de mantener una atención libre de adversos, han sugerido pautas para una prescripción segura y eficaz. De hecho, Cochrane ha seguido analizando el uso del dipirona (metamizol), y bajo diferentes indicaciones (dolor agudo postoperatorio, dolor agudo de cólico renal y cefaleas primarias agudas) ha demostrado un adecuado perfil de seguridad a corto plazo.4,8-11
Es claro que el temor asociado deriva de la aparente alta incidencia de trastornos hematológicos de alta letalidad, lo cual ha sido causal primario de su retiro. En los años 80, el Estudio Internacional de Agranulocitosis y Anemia Aplasica (IAAS) informó un alto riesgo de dichos eventos.6,12 En su informe (participando centros médicos de Israel, España, Alemania, Italia, Hungría, Bulgaria y Suecia) se reveló una incidencia global anual de agranulocitosis de 6,2 casos por millón, y una tasa de mortalidad de 0,5 por millón. Sin embargo afirmaron una amplia variabilidad regional en la presentación de discrasias sanguíneas.6 Posteriormente, Hedenmalm y Spigset7 expresaron que el riesgo podría ser mayor con base en ocho casos de un total de 10.892 dosis aplicadas ('95-'99).
Por lo contrario, Kõtter5 en su revisión sistemática y metanálisis de eventos adversos asociados al uso de metimazol (2013), luego de incluir 79 ensayos clínicos con aproximadamente 4.000 pacientes en los que se administró dipirona por periodos menores a 2 semanas, no reportó agranulocitosis ni muertes asociadas. Lo anterior concuerda con lo expuesto por autores como Fieler (2015); en su ensayo clínico de metimazol, para dolor agudo postoperatorio en 1177 niños, describió una incidencia de eventos adversos graves de 0,3%.8 Así mismo Ibáñez y Vidal (2005) en su artículo, de agranulocitosis asociada a metimazol, revisaron bases de datos con casos de agranulocitosis y concluyeron que los trastornos hematológicos asociados a dipirona son raros.13
En nuestro medio, el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA) para el periodo 2002-2015 reportó 2499 reacciones adversas asociadas a dipirona, de las cuales 85,2% fueron leves y 14,8% graves. Además, estableció una incidencia del 0,5% para eventos adversos comprometiendo células blancas (sistema hematopoyético), pero sin describir el tipo de alteración, severidad, ni reversibilidad. Al igual publicaron 12 casos de mortalidad asociada, sin analizar su relación causal con dipirona.14
En la actualidad, la escasa evidencia científica ha generado una controversia relacionada a eventos adversos asociados a dipirona y a su eficacia analgésica. Al investigar políticas en salud conservadoras y restrictivas con respecto al uso de la dipirona, surge la pregunta de investigación: ¿Por qué otros países continUan comercializándola? La certeza sobre su uso en otras naciones controvierte las conclusiones americanas y pone de manifiesto la presencia de diferencias regionales, las cuales podrían hablar de una predisposición inmunológica hacia el compromiso medular.
Métodos
Previa aprobación del Comité de Investigaciones de la Facultad de Medicina y del Comité financiador de Convocatoria Interna de la Fundación Universitaria de Ciencias de la Salud (FUCS); y del Comité de Investigaciones y del Comité de Ética de la Fundación Hospital Infantil Universitario de San José, se recolectaron 2.747 registros médicos según protocolo.
Basados en un estudio observacional descriptivo de una cohorte incidente, fueron incluidos registros hospitalarios de pacientes usuarios de dipirona intrahospitalaria, por al menos dos días consecutivos (los anteriores conformaron la cohorte abierta a estudiar). Se excluyeron registros clínicos incompletos, o con el desenlace de interés previo al uso de la dipirona.
Las reacciones adversas fueron establecidas según el reporte de evento adverso hospitalario y las notas en la historia clínica. Estas se dividieron en dos grupos: Grupo 1 (No severos): y Grupo 2 (Severos). El grupo 1 fue conformado por: náuseas, vómito, dolor epigástrico, xerostomía, astenia, exantema e hipotensión no colapsante. El grupo 2 fue conformado por: anafilaxia, reacciones asmatiformes, colapso hemodinámico, enfermedad del suero, síndrome de Steven Johnson, vasculitis, alveolitis, neumonitis, hepatitis, síndrome hemolítico urémico y agranulocitosis. Para este último grupo se protocolizó el análisis de causalidad por algoritmo de Naranjo (OMS). La información fue recolectada en una hoja de cálculo Excel. Se validaron los registros por doble verificación de los investigadores.
Considerando una prevalencia probable del 0,3% de complicaciones severas asociadas al uso de dipirona, con una precisión del 0,2% y una confianza del 95%, calculamos que eran necesario evaluar 2746 pacientes.
Análisis Estadístico
Las variables se resumieron según su clasificación. Las cualitativas se presentaron con frecuencias y porcentajes; las cuantitativas (previo análisis de su distribución) se describieron con promedios y valores de dispersión (desviaciones estándar o rangos). Se analizaron variables demográficas y clínicas (edad, sexo, comorbilidades, diagnósticos y servicio que realiza la prescripción). El principal cálculo realizado fue la medición de la incidencia de eventos adversos, el cual se calculó como el porcentaje de casos incidentes sobre la población expuesta, además del estadístico de casos/días-persona y casos/1000-dosis. A su vez los casos incidentes de adversos fueron sometidos a análisis estratificados según variables demográficas, clínicas e interacciones medicamentosas. Se describieron las variables características de la formulación de la dipirona (dosis acumulada diaria, tiempo de formulación, dosis acumulada total, dosis formuladas, y la indicación de la formulación de dipirona). Adicionalmente se analizaron las interacciones medicamentosas de todos aquellos fármacos empleados y que presentaran asociación con alguno de los subtipos de reacción adversa. Para los cálculos estadísticos se utilizó el paquete estadístico STATA14 (Stata_Corp®).
Resultados
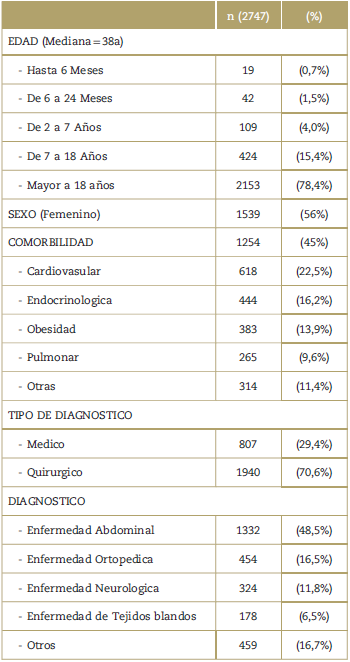
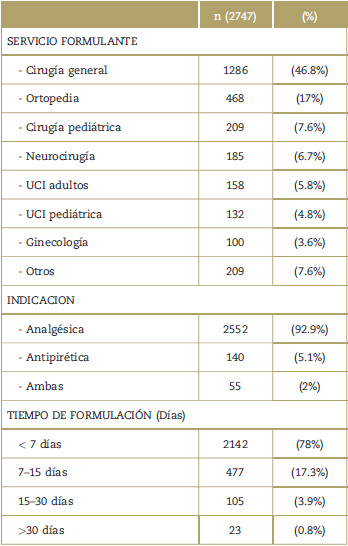
La mayoría de pacientes incluidos en el estudio fueron mayores de 18 años (78%), sin diferencias significativas en la distribución por género. Hasta el 45% de los pacientes presentaron al menos una comorbilidad, siendo la más frecuente la de tipo cardiovascular (22.5%), seguida por la de origen endocrino (16,2%) (Tabla 1). El 70% de los pacientes en quienes se indicó el uso de dipirona se encontraron en un contexto quirúrgico y/o con una condición abdominal (48,5%), y en su mayoría a cargo del servicio de cirugía general (46,8%). 92% de los pacientes en quienes se administró dipirona, tuvieron indicación analgésica, a una dosis promedio de 4gr/día.
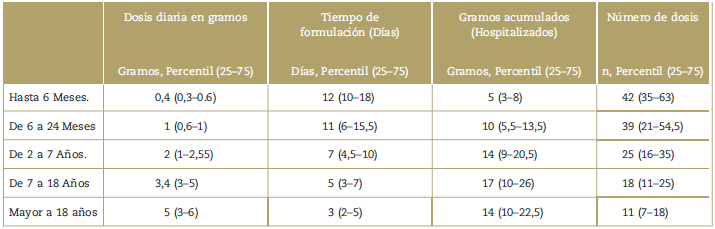
La información del servicio que prescribe o que formula, la indicación de uso y las características de formulación (dosis diaria en gramos, tiempo de formulación, gramos acumulados en la hospitalización y dosis administradas) se presentan en la Tablas 2 y 3.Lamayoríade los pacientes(76%) recibieron menos de 7 días. Sin embargo se evidencia mayor tiempo de duración conforme disminuye la edad (siendo para los grupos entre 0-6meses y >18 años, de 12 y 3 días respectivamente); sin ser despreciable que 17,7% recibió dipirona por más de unasemanay4,65%pormásdedossemanas.
La incidencia de eventos adversos globales asociados a la aplicación de dipirona fue del 0,3%(7/2743), en términos de una cohorte dinámica como la presente, la tasa incidente de eventos adversos fue de 0,5 casos/1000días-persona y 0,14 casos/1000 dosis. En otras palabras, un caso-incidente por cada 1979 días-persona y 6928 dosis-persona. 100% de los casos correspondieron al grupo 1 (No-severos). No se presentó mortalidad ni se requirió manejo en cuidado intensivo por reacciones derivadas asociadas a la dipirona. El 100% de las reacciones adversas reportadas correspondieron a reacciones cutáneas, las cuales revirtieron con la suspensión del medicamento y terapia específica. Ningún paciente presentó diagnóstico de agranulocitosis o aplasia medular durante su seguimiento. No se presentó una relación estadísticamente significativa (Chi2-p < 0.05) entre los eventos adversos y el sexo, edad, diagnóstico o comorbilidad.
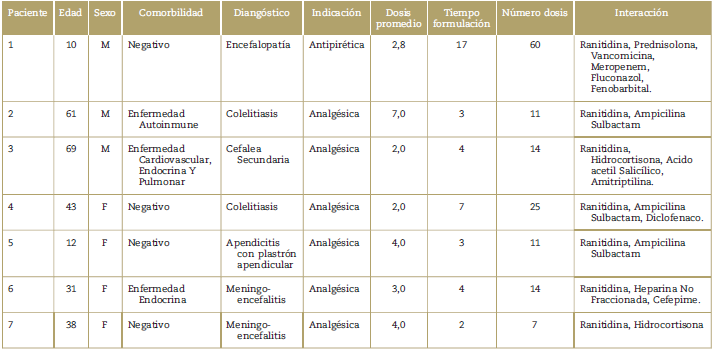
Si bien las medidas de asociación fueron negativas para cada una de los medicamentos considerados interacción (Chi2-p > 0.05), es relevante mencionar que un grueso grupo de pacientes fue expuesto simultáneamente a dipirona y otros fármacos de asociación comprobada con los adversos severos definidos en la metodología de este trabajo (Tabla 4). El 100% de pacientes con reacción toxidérmica recibieron simultáneamente dipirona y ranitidina.
Discusión
El presente reporte acogió una cohorte de 2.747 pacientes usuarios de dipirona con una distribución demográfica similar a la de estudios previos. Su constitución en género y edad fue parecida a la presentada por Hedenmalm.7 En dicha publicación, al analizar casos de discrasia sanguínea en población sueca durante un amplio periodo de tiempo (1966-1999), halló una distribución prevalente de datos en mujeres (77%), mayores de 18 años (media = 55años) e indicación analgésica para el control del cólico biliar (62%). Datos semejantes fueron a su vez presentados tanto en el estudio piloto, como en el informe final del estudio LATIN realizado en centros de Brasil, Argentina y México, en los cuales se describió una incidencia de eventos hematológicos de 0,4 por millón de habitantes año.12,15 Los casos reportados de agranulocitosis y anemia aplasica, tuvieron similares características poblacionales: mujeres (68% y 75% respectivamente), y mayores de 19 años (65% en ambos casos). Estudios en España y Polonia13,16,17 han descrito estadísticos poblacionales análogos en individuos con complicaciones hematológicas relacionadas con la dipirona (>65 años en 55% de los casos).13,16 Por último, en la revisión sistemática realizada por el equipo de Kótter5 en estudios diseñados para el análisis de todo tipo de eventos adversos asociados al uso de la dipirona, describió un promedio de edad de 45 años (21-64 años), y en un 70% de los casos: empleada en escenarios quirúrgicos. Lo anterior no solo cataloga como similar a la población objetivo, sino que también permite la inferencia de las observaciones regionales halladas por este grupo de trabajo tanto para comunidad latina como mundial.
A pesar de que se evidencia una relación directamente proporcional entre la edad y la dosis acumulada por día, así como dosis total; no se pueden realizar análisis concretos considerando la ausencia de la variable "Peso" en la totalidad de los pacientes, a pesar de la posible relación con la asociación inversamente proporcional entre dosis y peso.
La escasa publicación de estudios con muestras significativas o de constructo metodológico óptimo para el análisis de las manifestaciones alérgicas en relación con el uso de dipirona, hace que la única evidencia de calidad reportada en este estudio sea la derivada de reportes de casos y series de casos. Dichas publicaciones se han hecho principalmente en pacientes mayores de 18 años, mujeres y de contexto quirúrgico, características comparables a las presentes en casos de rash y toxidermia informados previamente.18,19
Debido a lo anterior, la validez del cálculo de la incidencia o prevalencia de eventos adversos medicamentosos subyace en la homogénea caracterización de la población incluida en el seguimiento fármaco-epidemiológico, y a tamaños muestrales amplios que permitan determinar relaciones causales. En los resultados del presente proyecto, la búsqueda se centró en la determinación de cualquier tipo de desenlace adverso independiente de su nominación hematopoyética.
La incidencia reportada en grandes estudios de casos y controles para agranulocitosis, si bien ha sido variable (entre 0,4 a 3,4 casos por millón de habitantes/año),12,15-17 se afirma como de fuerte asociación para su desarrollo cuando se ha aplicado dipirona. De manera contraria a estos hallazgos, la incidencia de adversos hematológicos en esta cohorte de usuarios de dipirona, fue nula. Consideramos que dichos cuestionamientos, deben ser apreciados con un fuerte criterio clínico que sopese la posibilidad de un comportamiento biológico regional diferente (posiblemente por susceptibilidad genética) o que los resultados derivaron de un sub registro. No se descarta una baja incidencia en relación a la presencia de casos leves, sin requerimiento de estudios adicionales o que cursen sin complicaciones.
Si bien no se encontraron eventos severos, se describen 7 casos no graves en el grupo de estudio. En su totalidad manifestaciones cutáneas leves, no fatales y sin requerimiento de cuidado intensivo, contrario a otros reportes de manifestaciones alérgicas, con compromiso cardiovascular y pulmonar, e incluso requerimiento de manejo por cuidado crítico y mortalidad.19
El objetivo de la formulación de dipirona en la población evaluada fue prevalentemente analgésica (92,9%). Lo anterior es concordante con lo hallado en diversos estudios, en los cuales, ésta es la principal indicación de su uso clínico.1-3,20 Por ende es consonante que la formulación general de dipirona en este estudio, haya sido realizada principalmente por especialidades quirúrgicas (81% de prescripciones), siendo cirugía general (46.8%) la moda. Dicho hallazgo es respaldado por diferentes grupos de investigación.2,3,5,8-11,20
En Colombia, el INVIMA ha recomendado la formulación de dipirona en el ámbito hospitalario, en población adulta y pediátrica, por periodos cortos (<7días).14 Lo anterior es acorde a la evidencia internacional para la prevención de eventos adversos relacionados a la dipir-ona.14,20 En el presente estudio, un importante número de individuos recibió dicho medicamento por menos de siete días (76,79%). Si bien, este indicador demuestra un compromiso mayoritario por una administración segura de medicamentos, no solventa que aún falta por incorporarse buenas prácticas de fármaco-vigilancia en la rutina médica, y por ende es aun prioritaria su intervención e inclusión en la políticas de mejoramiento de la calidad de la atención médica, las cuales deberían incluir una administración segura y un seguimiento integro de la función hematopoyética y renal cuando la dipirona es prescrita por más de siete días.5,14,20
Vale la pena destacar que al grupo de pacientes que recibió dipirona por más de siete días en el presente estudio, le fue realizado durante su hospitalización estudios paraclínicos en relación a la evolución de su enfermedad de base, sin especificar en ningún momento, que esto correspondía al seguimiento de la administración segura de dipirona. Es allí donde toma gran relevancia esta consideración para el establecimiento del protocolo de buenas prácticas médicas con relación a la formulación y administración de dipirona en la institución, y que hace parte de la segunda cohorte que se encuentra en curso.
En el presente reporte se evidencia una dosis acumulada por día concordante con las dosis consideradas seguras publicadas en diversos estudios clínicos y de reflexión realizados en población adulta (4gr) y pediátrica (10-20mg/Kg/dosis).14,20 Si bien no hallamos una relación proporcional entre la dosis diaria y la edad de los pacientes en el estudio, se sugiere una relación inversa entre el total de gramos de la hospitalización y la edad, en posible relación con marcadas diferencias en la prescripción de dipirona dentro de la muestra, siendo más liberal en la población pediátrica respecto a la población adulta.
Al considerar los eventos adversos asociados a la dipirona, es esencial analizar las interacciones medicamentosas implicadas, de allí el sustento del algoritmo propuesto por Naranjo y avalado por la OMS.21 Es de destacar en este estudio el abultado número de interacciones medicamentosas que se pueden establecer en los pacientes hospitalizados con diversas enfermedades de base, e indicaciones médicas y quirúrgicas. Entre ellas destacamos el uso de: anticoagulantes, esteroides, barbitúricos, benzodiacepinas, antidepresivos e inmunosupresores. Es por ello que la polifarmacia (más de tres medicamentos usados simultáneamente en la prescripción diaria) es un problema intrínseco en el trabajo medico rutinaria. A pesar de constituirse este elemento como sesgo en el establecimiento de causalidad en la presencia de adversos, es poco probable en el escenario hospitalario, que los pacientes reciban menos de este número de medicamentos, por la mera necesidad de no llamarse "polifarmacia".
No negamos que la aplicación de un medicamento, concordante con la indicación de formación (analgésica, antibiótica, inmunosupresora, etc.), también constituya un escenario provisto de adversidades de severidad variable y por ende el chequeo clínico rutinario, una actualizada lex artis y un juicioso acto médico son las únicas herramientas con la que proveemos atención de calidad a nuestros pacientes.
Conclusión
La fragilidad de la totalidad de los estudios discutidos en este reporte (incluido el actual) subyace en la escasa investigación y control del médico tratante con respecto a la aparición de eventos adversos generados por la aparente toxicidad de los fármacos formulados, y por lo tanto, a la mala clasificación de eventos adversos que posiblemente si estén acaeciendo en los individuos expuestos. Es claro que el hecho de no haberse reportado, inscrito o clasificado en la historia clínica de ninguna manera anula la existencia de estos eventos, y por lo tanto es muy probable que se esté subestimando la incidencia real. De ninguna forma esto respalda a las investigaciones primarias que asociaron a la dipirona con diversos daños orgánicos, lo único que apoya es la escasa investigación de calidad y la necesidad de un registro nacional más robusto, lo cual incluye investigaciones de mayor calidad.
Agradecimientos
Agradecemos el apoyo de la Fundación Universitaria de Ciencias de la Salud FUCS, su Facultad de Medicina, la Fundación Hospital Infantil Universitario de San José, y su departamento de Anestesiología. (ASCP).
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
REFERENCIAS
1. Nikolova I, Petkova V, Tencheva J, et al. Metamizole: a review profile of a well-known “forgotten” drug. Part II: Clinical profile. Biotechnol Biotechnol Equip 2013; 27:3605-3619. [ Links ]
2. Hearn L, Derry S, Moore RA. Single dose dipyrone (metamizole) for acute postoperative pain in adults (review). Cochrane Database Syst Rev 2016; 4:CD011421. [ Links ]
3. Derry S, Faura C, Edwards J, et al. Single dose dipyrone for acute postoperative pain. Cochrane Database Syst Rev 2014; 9:CD003227. [ Links ]
4. Edwards J, Meseguer F, Faura C, et al. Single dose dipyrone for acute renal colic pain. Cochrane Database Syst Rev 2002; 4: CD003867. [ Links ]
5. Kötter T, da Costa BR, Fässler M, et al. Metamizole-associated adverse events: a systematic review and meta-analysis. PLoS One 2015; 10:e0122918. [ Links ]
6. The International Agranulocytosis, Aplastic Anemia StudyRisks of agranulocytosis and aplastic anemia. A first report of their relation to drug use with special reference to analgesics. JAMA 1986; 256:1749-1757. [ Links ]
7. Hedenmalm K, Spigset O. Agranulocytosis and other blood dyscrasias associated with dipyrone (metamizole). Eur J Clin Pharmacol 2002; 58:265-274. [ Links ]
8. Fieler M, Eich C, Becke K, et al. Metamizole for postoperative pain therapy in 1177 children: a prospective, multicentre, observational, postauthorisation safety study. Eur J Anaesthesiol 2015; 32:839843. [ Links ]
9. Bigal M, Bordini C, Speciali J. Intravenous metamizol (dipyrone) in acute migraine treatment and in episodic tension-type headache-a placebo-controlled study. Cephalalgia 2001; 21:90-95. [ Links ]
10. Edwards J, Meseguer F, Faura C, et al. Single dose dipyrone for acute postoperative pain. Cochrane Database Syst Rev 2010; 9: CD003227. [ Links ]
11. Bigal ME, Bordini CA, Tepper SJ, et al. Intravenous dipyrone in the acute treatment of migraine without aura and migraine with aura: a randomized, double blind, placebo controlled study. Headache 2002; 42:862-871. [ Links ]
12. Hamerschlak N, Maluf E, Cavalcanti AB, et al. Incidence and risk factors for agranulocytosis in Latin American countries-the Latin Study. Eur J Clin Pharmacol 2008; 64:921-929. [ Links ]
13. Ibanez L, Vidal X, Ballarín E, et al. Agranulocytosis associated with dipyrone (metamizol). Eur J Clin Pharmacol 2005; 60:821-829. [ Links ]
14. INVIMA. Comision Revisora-Sala Especializada de Medicamentos y Productos Biológicos. Informes de Seguridad (3.6.1. Dipirona). Acta No. 03. Sesión ordinaria-presencial del 23, 24, 25 y 26 de Febrero de 2015. 2015. Paginas: 525-31, Bogotá, Colombia. Available at: https://www.invima.gov.co/rss/239-salas-especializadas/sala-especializada-de-medicamentos-y-productos-bio/ 3741-actas-2015.html. [Accessed 12 Ago 17]. [ Links ]
15. Hamerschlak N, Maluf E, Pasquini R, et al. Incidence of aplastic anemia and agranulocytosis in Latin America: the LATIN study. Sao Paulo Med J 2005; 123:101-104. [ Links ]
16. Ibáñez L, Vidal X, Ballarín E, et al. Population-based drug-induced agranulocytosis. Arch Intern Med 2005; 165:869-874. [ Links ]
17. Maj S, Lis Y. The incidence of metamizole sodium-induced agranulocytosis in Poland. J Int Med Res 2002; 30:488-495. [ Links ]
18. Borja J, Galindo P, Gomez E, et al. Delayed skin reactions to metamizol. Allergy 2003; 58:84-85. [ Links ]
19. Stamer UM, Soehle M, Park T-W, et al. Anaphylactic reaction after intravenous dipyrone. Acute Pain 2007; 9:221-227. [ Links ]
20. Buitrago-González TP, Calderón-Ospina CA, Vallejos-Narváez Á. Dipirona: ¿Benefícios subestimados o riesgos sobredimensiona-dos? Revisión de la literatura. Rev Colomb Cienc Quim Farm 2014; 43:173-195. [ Links ]
21. Holloway K, Green T. Comitês de farmacoterapia, Guía practica. 1a ed.2003; OMS, Ginebra, Suiza:163. [ Links ]











 text in
text in