Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Colombian Journal of Anestesiology
versión impresa ISSN 0120-3347
Rev. colomb. anestesiol. vol.46 supl.1 Bogotá dic. 2018
https://doi.org/10.1097/cj9.0000000000000045
Artículo de revisión
Craneotomía en el paciente despierto: Indicaciones, beneficios y técnicas
a Departamento de Anestesiología, The University of Texas Health Science Center at Houston. Houston, Estados Unidos.
b Departamento of Anestesia y Cuidados Perioperatorios, University of California, San Francisco. San Francisco, Estados Unidos.
La craneotomía con el paciente despierto se utiliza fundamen talmente para el mapeo y la resección de lesiones en áreas de vital importancia en el cerebro, en donde las imágenes no son suficientemente sensibles. Se trata por lo general de las áreas del habla y motoras. El abordaje con el paciente despierto ha adquirido cada vez más popularidad y se han ampliado sus indicaciones gracias a la ventaja de mejores desenlaces neurológicos y perioperatorios, entre ellos la analgesia y la náusea y vómito postoperatorios. Los avances en los agentes y las técnicas de anestesia, particularmente la mascarilla laríngea (LMA), han hecho grandes aportes. Los medicamentos de uso frecuente son propofol, dexmedetomidina y remifentanilo. Los esquemas anestésicos comunes van desde la sedación leve a moderada, sedación profunda, o anestesia general durante las fases pre y post-mapeo. En todas las técnicas de sedación - anestesia, los pacientes se encuentran despiertos y con capacidad para hablar y/ o moverse durante la fase de mapeo. Este abordaje al procedi miento quirúrgico intracraneal requiere pericia, experiencia y compromiso por parte de todo el equipo de la sala de cirugía. Esta revisión, desde la perspectiva de los autores, hace referencia a las indicaciones y contraindicaciones, beneficios, técnicas de anestesia, desafíos y manejo, así como a posibles orientaciones a futuro de la craneotomía con el paciente despierto.
Palabras clave: Craneotomía; Despertar Intraoperatorio; Neurocirugía; Anestesia; Monitoreo Fisiológico
Awake craniotomy is mainly used for mapping and resection of lesions in vitally important brain areas where imaging is not sufficiently sensitive. These are most commonly speech and motor areas. The awake approach has become increasingly popular with wider indications due to the advantage of better neurological and other perioperative outcomes including analge sia and postoperative nausea and vomiting. Improvements in anesthetic agents and techniques especially LMA have made a great contribution. Frequently used medications are propofol, dexmedetomidine, and remifentanil. Common anesthetic regi mens range from light-moderate sedation, deep sedation, or general anesthesia during the pre-mapping and postmapping phases. In all sedation-anesthesia techniques, the patients are awake and able to speak and/or move during the mapping phase. This approach to intracranial surgical procedure requires skill, experience, and commitment on the part of the entire OR team. This review, from the point of view of authors, discusses the indications and contraindications, benefits, anesthetic techni ques, challenges, and management, as well as potential future directions of awake craniotomy.
Keywords: Craniotomy; Intrao perative Awareness; Neurosurgery; Anesthesia; Monitoring; Physiologic
Introducción
La craneotomía con el paciente despierto puede definirse como un procedimiento quirúrgico intracraneal durante el cual el paciente se encuentra deliberadamente despierto durante parte de la cirugía, generalmente para el mapeo y resección de la lesión. La técnica tiene una larga historia que precede a la anestesia general, pues hay muchos ejemplos en pinturas y descripciones de tales procedimientos, especialmente de trepanación, que se remontan a más de mil años atrás. Durante las últimas décadas, este procedimiento ha adquirido creciente popularidad, con indicaciones más amplias que son el resultado de la evidencia acumulada de que los pacientes sometidos a craneotomía despiertos tienen mejores resultados en muchos sentidos. Los avances en los agentes anestésicos y en las técnicas, particularmente una duración de acción más corta y más confiable, también han contribuido de manera importante. Se discuten algunos aspectos de la craneotomía con el paciente despierto, incluyendo las indicaciones, contraindicaciones, beneficios, técnicas de anestesia, desafíos y orientaciones a futuro. Los procedi mientos mínimamente invasivos que se realizan a través una trepanación, por ejemplo la colocación de electrodos profundos en el cerebro para la enfermedad de Parkinson, son también técnicamente craneotomías con el paciente despierto, pero este tema está fuera del alcance de la presente revisión. 1,2
Indicaciones
La craneotomía con el paciente despierto se utiliza para toda lesión tumoral intra axial que, de acuerdo con las imágenes preoperatorias, se encuentre adyacente al cerebro o en zonas elocuentes del cerebro, incluyendo la corteza motora y del lenguaje, y también la corteza responsable por otras funciones, como por ejemplo, funciones del lóbulo ejecutivo frontal. Las lesiones son principalmente gliomas corticales y subcorticales, tanto de alto como de bajo grado, pues la tasa de sobrevida está relacionada con la amplitud de la resección. 3 El mapeo de estimulación intraoperatoria en un paciente despierto también puede utilizarse en: 1) epilepsia refractaria, puesto que los focos de convulsión extra-temporales se encuentran con frecuencia cerca de zonas elocuentes del cerebro; 4 2) lesiones vasculares (Ej. Malformaciones arteriovenosas) cerca de zonas elocuentes. 5
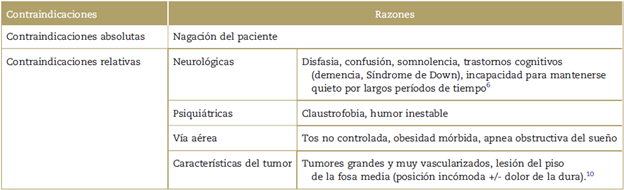
Contraindicaciones
En la Tabla 1 se muestran las contraindicaciones absolutas y relativas. También hay algunas contraindicaciones debatibles, tales como condiciones médicas graves (insuficiencia cardiaca congestiva, cuando la fracción de eyección <10%),6 3er trimestre del embarazo con crisis neurológica inminente, 7 y la edad del paciente (el rango de edad reportado es de 9 a 90 años). 8 La cirugía de tumores cerebrales con el paciente despierto la pueden realizar con seguridad equipos con experiencia, con bajos índices de complicaciones. Esto es independiente de: sitio del tumor y patología, índice de masa corporal (IMC), tabaquismo, clasificación ASA, duración y frecuencia de las convulsiones, e historia emocional o psiquiátrica. 9
Beneficios
El objetivo de la craneotomía con el paciente despierto es maximizar la resección tumoral, a la vez que se preserva la función neurológica. Esto se logra mediante el mapeo de estimulación intraoperatoria en un paciente despierto. Con el mapeo del lenguaje y sensorial-motor, pueden delinearse con mayor precisión los aspectos funcionales del cerebro, de manera que se pueda realizar una resección del tumor más extensa, se reduce la necesidad de monitoreo en cuidados intensivos postoperatorios, y se disminuyen los costos; 11,12 a menos déficits neurológicos (7% vs 23%), menor tiempo de hospitalización (1,7d vs. 9d) 13 y mayor sobrevida. Más aun, luego de una craneo tomía con el paciente despierto, los pacientes requieren menos vasopresores intraoperatorios, presentan menos dolor, se reduce el consumo de narcóticos y hay menos nausea y vómitos postoperatorios. A pesar de que este procedimiento puede ser estresante, llegando a un 30% de los pacientes que presentan dolor considerable y entre un 10-14% experimenta mucha ansiedad, la aceptación de los pacientes y la satisfacción post-operatoria con elevadas. 14 Aparentemente no se presenta trastorno de estrés post-traumático. 15 Puesto que la craneotomía con el paciente despierto con sedación leve a moderada no requiere ventilación mecánica, además de evitar la molestia sicológica asociada a la anestesia general. Recientemente se hizo una revisión de las posibles desventajas de la anestesia general, 16 cuyos datos sugieren que la craneotomía con el paciente despierto pudiera mejorar el acceso al cuidado neuroquirúrgico en países más pobres. 17
Técnicas anestésicas
La craneotomía con el paciente despierto requiere pericia, experiencia y el compromiso del equipo de la sala de cirugía.
La entrevista preoperatoria al paciente por parte de todos los miembros del equipo es esencial para desarrollar confianza y compromiso. Una de las causas frecuentes del fracaso es la mala comunicación intraoperatoria con el paciente. Los cirujanos, los anestesiólogos y la enfermera le brindan al paciente tranquilidad y empatía, mitigando su ansiedad. A los pacientes se les debe informar acerca de las constantes interacciones frente a frente y otros detalles como el posicionamiento, la inserción de una sonda urinaria, el ruido de la craneotomía y las tareas relativas al mapeo. Es necesario realizar una evaluación preoperatoria de la función del lenguaje.
Premedicación
La premedicación debe ser individualizada según la condición y las necesidades del paciente. En general, deben evitarse ciertos medicamentos o usarse con cautela, como es el caso de midazolam, atropina y escopolamina, los cuales pueden afectar la función neurocognitiva, produciendo confusión y delirio. Sin embargo, una pequeña dosis de midazolam (1-2 mg IV) es beneficiosa en pacientes más jóvenes y con mucha ansiedad, con una función neuroló gica preoperatoria normal. Los pacientes que se someten a mapeo por convulsiones no deben recibir ningún medicamento que suprima la actividad epileptifome como midazolam y los anticonvulsivantes. No existe consenso acerca de la necesidad de administrar anticonvulsivantes a pacientes que no han tenido convulsiones previamente.
Monitoreo
Se utiliza monitoreo estándar con ECG, oximetría, presión arterial e intra-arterial no invasiva, EtCO2, frecuencia respiratoria y gasto urinario. Los monitores deberán colocarse del mismo lado de la lesión cerebral para evitar interferencias con el monitoreo sensorial motor contral ateral. El monitoreo con EEG procesado (Ej. BIS, SedLine) puede ayudar a acortar el tiempo de despertar del paciente. 18
Posicionamiento
Los pacientes generalmente se colocan en posición lateral o semi-lateral, a 90 grados con respecto a la estación de trabajo de anestesia y de frente al equipo de anestesió-logos para permitir una interacción cara a cara y un manejo de la vía aérea. Generalmente la cabeza se asegura con un marco cefálico.
Anestésicos
En la actualidad son varias las técnicas utilizadas en la práctica clínica y se dividen principalmente en dos grupos:
Dormido-despierto-dormido. El paciente recibirá anestesia general con LMA/ETT para la craneotomía y el cierre, pero se despertará y extubará para el mapeo y la resección.
Despierto-despierto-despierto. El paciente estará despierto con sedación (ligera a moderada o profunda) con ventilación espontánea para la craneotomía y el cierre. En ambos sistemas generalmente no se administran medicamentos durante la fase de mapeo. La elección de la técnica debe tomar en consideración la preferencia del equipo, la localización del tumor, la condición neurológica, el tamaño corporal, la edad, la motivación y las comorbilidades, además de la condición física del paciente.
La selección de medicamentos varía de una una a otra institución y de un equipo a otro. A fin de lograr transiciones sin inconvenientes y facilitar el mapeo intraoperatorio, los anestésicos deben ser de rápido inicio y terminación, titulables, y con un mínimo de efectos posteriores al procedimiento. Los agentes más utilizados son propofol, fentanilo, remifentanilo ydexmedetomidina (DEX); también se utiliza sevoflurano en algunas institu ciones. DEX tiene la ventaja unica de producir apenas una ligera depresión respiratoria, pero ofrece algo de sedación y analgesia y puede usarse en combinación con otros agentes o como unico sedante.19 A diferencia de propofol y midazolam, no aumenta la disfunción neurológica. 20
Fase pre-despierto
La anestesia local, bien sea por infiltración local y/o bloqueo del cuero cabelludo, ofrece un control efectivo del dolor, tanto para la craneotomía con el paciente despierto, como para la anestesia general y reduce el uso de opioides endovenosos. Usualmente, el bloqueo nervioso del cuero cabelludo y la infiltración local a lo largo de la línea de incisión se usan con una combinación de lidocaína, un agente de mayor duración de acción (bupivacaina o ropivacaina) y epinefrina. Por lo general no hay dolor cuando se manipula la dura; sin embargo, la irritación de los nervios que inervan la dura muy cerca de las vasos de las meninges, pueden ocasionar dolor. Esto suele manejarse con infiltración de anestesia local a lo largo de los vasos de las meninges.
Esquemas anestésicos comúnmente utilizados en la craneotomía con el paciente despierto
Sedación leve - moderada: Las infusiones con bajas dosis de propofol (20-50ug/kg/min o 0,5-2,0ug/ml) y remifentanilo (0,01-0,06ug/kg/min o 0,2-1,5ng/ml) deben titularse para que el paciente se ponga somnoliento pero despertable, sin obstrucción de la vía aérea. Se puede utilizar DEX 0,3-0,5 ug/kg/h cuando el propofol y el remifentanilo no sean satisfactorios o cuando la hipo-ventilación y la obstrucción de la vía aérea requieran que se reduzca o se pare el uso de propofol y/o remifentanilo. Algunos pacientes se desinhiben exageradamente con propofol y debe añadirse DEX o sustituir por completo el propofol.
Sedación Profunda. El objetivo es mantener la ventilación espontánea, pero con uso de un dispositivo para la vía aérea para mantener su permeabilidad, por ejemplo tubos o trompetas nasal, o la máscara laríngea.
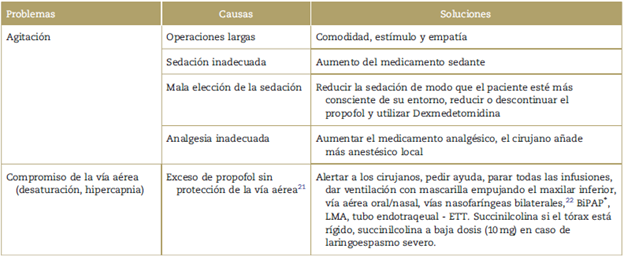
En la Tabla 2 se muestran los desafíos que presenta la sedación
Tabla 2. Desafíos de la sedación leve - moderada durante la fase pre-despierto.
Fuente: Recopilado por los autores con base en su experiencia personal y en la literatura.
∗ BiPAP: presión positiva bi-nivel de la vía aérea; ETT: Tubo endotraqueal; LMA: mascarilla laríngea.
Esquemas anestésicos para anestesia general
Las infusiones endovenosas (propofol 50-100ug/kg/min o 1,5-4,0ug/ml; remifentanilo 0,1-0,2ug/kg/min o 2-4ng/ ml), o el uso de agentes inhalados (sevoflurano o desflurano < 0,5 MAC), junto con remifentanilo 0,1-0,2 ug/kg/min o 2-4 ng/ml, pueden afectar la transición de dormido a despierto sin inconvenientes. En el pasado se ha utilizado la intubación endotraqueal, bien sea oral o nasal; sin embargo, la transición de dormido a despierto puede ser muy difícil debido a la presencia de tos o de agitación. Actualmente se prefiere el uso de la mascarilla laríngea - LMA - que produce menos estimulación y permite una transición más suave. 23
Fase del paciente despierto
La meta es lograr una transición suave y rápida sin agitación, confusión ni adormecimiento, de la sedación o la anestesia al despertar el paciente. El paciente debe estar involucrado, cooperar y sentirse cómodo para el mapeo y la resección del tumor. Todos los agentes se paran, aun cuando algunas veces es útil mantener una dosis muy baja de remifentanilo (0,01-0,05 ug/kg/min o 0,2-1 ng/ml) o administrar pequeñas dosis de fentanilo como analgésico. El dolor deberá manejarse con anestésico local complementario y posiblemente con acetaminofén endovenoso. Debe utilizarse un manejo intraoperatorio no farmacológico para reducir el miedo y la ansiedad. 24 La empatía, sujetar la mano del paciente, animarlo, orientarlo y conversar con él son todas técnicas útiles e importantes. Se puede usar una compresa empapada en agua helada para humedecer los labios y la boca del paciente para su comodidad. Al paciente se le puede permitir mover las extremidades y las caderas en ciertos momentos apropiados. Se utiliza una cobija de aire que suministre aire caliente o frío para mantener una temperatura confortable.
Examen Psicológico
Vías Motoras y Sensoriales. La cirugía con el paciente despierto permite un mapeo preciso tanto de las vías superficiales como profundas de la extremidades, del rostro y de la boca. El mapeo puede producir o inhibir los movimientos. Las respuestas de la musculatura orofacial, la actividad laríngea y las vocalizaciones pueden registrarse como cosquilleo o movimiento; por ejemplo, retiro de la lengua protruida, o paro del habla. 25 Igualmente, se puede generar cosquilleo, contracciones o movimientos de las extremidades, más comúnmente de los brazos y de las manos. El anestesiólogo deberá observar al paciente cuidadosamente y reportarle cada movimiento al cirujano; igualmente, se debe instruir al paciente para que reporte cualquier movimiento o sensación anormales. El mapeo de estimulación permite no solamente delinear las áreas corticales, sino que también le permite al cirujano estimular y monitorear los tractos subcorticales.
Lenguaje. Las zonas correspondientes al lenguaje y al habla no se pueden localizar con seguridad basándose en los reparos anatómicos. Para evaluar el habla, se utiliza frecuentemente la prueba de nombrar los objetos que el paciente ve. La prueba de nombrar los objetos de Boston (Boston Naming Test) consta de 60 dibujos de objetos comunes calificados según su grado de dificultad; por ejemplo ventana, carro, perro, guitarra. Además, se pueden estudiar las funciones del lenguaje con mayor refinamiento y complejidad. 26 Los pacientes bilingües deben examinarse en los dos idiomas ya que las áreas anatómicas no se superponen completamente.
Visual. El mapeo visual - intraoperatorio del cerebro de la corteza visual cortical, con mapeo subcortical de los tractos visuales, puede resultar útil para minimizar el riesgo de hemianopsia permanente en tumores localizados en el área parieto-occipital. La identificación de las radiaciones ópticas por estimulación subcortical directa es un método confiable para reducir las lesiones permanentes durante la cirugía de gliomas que comprometen las vías visuales. 27 Los métodos para identificar otras fun ciones, como la memoria y contar, son interesantes y se está trabajando en su desarrollo. 28
Desafíos durante la fase despierta del paciente. Algunos de los desafíos comunes son la hipertensión, convulsiones, somnolencia, agitación, desaturación de oxígeno, elevación de la presión intracraneal y escalofríos. 2 9
Hipertensión: Muy frecuentemente es secundaria al dolor, a la agitación y a la ansiedad. Sin embargo, es necesario buscar otras causas como la hipoxia, hipercap nia y aquellas asociadas con la dexmedetomidina. El tratamiento debe enfocarse en controlar la causa. Algunas veces puede ser necesario el uso de Labetalol o esmolol.
Convulsiones: La incidencia de convulsiones es de 3%-16% y se presentan durante el mapeo de estimulación cortical y subcortical. La incidencia se reduce si el cirujano evita estimular la zona dos veces en sucesión rápida. El monitoreo continuo con electrocorticografía para identificar picos u ondas marcadas dentro de los 5 segundos siguientes a cada estimulación, permite la detección precoz. Los pacientes con antecedentes de convulsiones y los pacientes más jóvenes, especialmente con tumores del lóbulo frontal, tienen una mayor tendencia a desar rollar convulsiones. 19 Las convulsiones intraoperatorias tienen una mayor incidencia de deterioro motor transitorio y tiempos de hospitalización prolongados. 30,31 El tratamiento de primera línea de las convulsiones evocadas por estimulación es la irrigación de la corteza con solución cristaloide fría, la cual puede repetirse con tanta frecuencia como sea necesario. El propofol endovenoso a pequeñas dosis (30-50 mg) repetidas, es efectivo pero se debe tener cuidado de no producir coma inducido por medicamentos que comprometan la vía aérea. La fosfenitoina, el valproato, el lorazepam o un barbiturico por vía endovenosa rara vez se necesitan de manera perentoria. En la mayoría de los casos la situación se resuelve sin desenlaces adversos. Puede presentarse paro cardiaco y apnea. En el caso de convulsiones prolongadas >5min es necesario recurrir a intubación de emergencia y convertir a anestesia general.
Pueden presentarse agitación y delirio al despertar si la fase pre-despierto es con anestesia general o con sedación profunda. Los factores que contribuyen son la edad avanzada, el dolor, la desorientación, el uso inadecuado de naloxone, flumazenil, neostigmina y atropina, desaturación de oxígeno, hipercapnia, estimula ción uretral y distensión de la vejiga. Puede ser muy difícil controlar esta situación y no hay consenso respecto a cuál es la mejor opción. Una posibilidad es re-inducir la anestesia con un bolo de propofol (30-50mg), y posteriormente administrar un bolo de dexmedetomidina 0,1-0,2ug/kg antes del segundo intento por despertar al paciente. También se sugieren estrategias como una infusión de remifentanilo a baja dosis 0,01-0,05 ug/kg/ min o 0,2-1 ng/ml, droperidol o haloperidol antes del re-despertar y un bolo de isostigmina 0,5-1,0mg.
Somnolencia: Usualmente es el reflejo de efectos anestésicos residuales o de anticonvulsivantes. La mejor estrategia es la prevención, terminando precozmente la dexmedetomidina y el propofol y evitando las grandes dosis de midazolam o de opioides de acción más prolongada.
Nausea y Vómito: Estos se asocian más frecuentemente al uso de opioides, pero otros factores pueden serla edad, el género y la ansiedad. La incidencia es mucho menor con el uso coimin de propofol. El manejo incluye la empatía, el uso de ondansetron, y una pequeña dosis de propofol (20-30mg).
Hipotermia y escalofrío: deben prevenirse con el uso de mantas, dispositivos de aire caliente y una temperatura ambiente adecuada. El tramadol 50 mg o 25-30 mg de meperidina pueden ser efectivos.
Post-despertar. De manera similar a la fase del pre-despertar, puede elegirse ventilación espontánea con el paciente despierto, bajo sedación ligera o profunda, o anestesia general con control de la vía aérea. La sedación suele ser suficiente. Por lo general el paciente requiere menores tasas de infusiones sedantes durante la fase post-despertar que durante la fase del pre-despertar, ya que los pacientes suelen sentirse fatigados y hay menor nivel de estímulos dolorosos durante el cierre del cráneo.
Cuidados postoperatorios. Inicialmente el paciente debe atenderse en una unidad de alto nivel o en una UCI donde estén familiarizados con los pacientes neuroquirurgicos. El manejo del dolor puede hacerse con pequeñas dosis de opioides endovenosos, incluso con analgesia controlada por el paciente (PCA), opioides orales combinados con acetaminofén. 32
Investigaciones a futuro
Falta investigación con estudios clínicos aleatorizados de alta calidad, pertinentes al papel de la anestesia en los resultados posteriores a la resección de tumores cerebrales con el paciente despierto. Se necesitan estudios orientados a desenlaces que comparen la anestesia general con MAC (Anestesia Monitoreada) y el impacto de agentes anestésicos específicos sobre los desenlaces en tumores cerebrales (recidiva y progresión del tumor, tasa de sobrevida). A pesar de los muchos estudios que comparan los resultados en el corto plazo con diferentes anestésicos y analgésicos, es necesario contar con grandes estudios clínicos aleatorizados, controlados que examinen los desenlaces en el largo plazo, incluyendo la recidiva del tumos, la sobrevida y la calidad de vida. 33-35
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
REFERENCIAS
1. Hansen E, Seemann M, Zech N, Doenitz C, Luerding R, Brawanski A. Awake craniotomies without any sedation: the awake-awake-awake technique. Acta neurochir 2013;155:1417-1424. [ Links ]
2. Sajonz BE, Amtage F, Reinacher PC, Jenkner C, Piroth T, Katzler J, Urbach H, Coenen VA. Deep Brain Stimulation for Tremor Tractographic Versus Traditional (DISTINCT): Study Protocol of a Randomized Controlled Feasibility Trial. JMIR Res Protoc 2016; 5:e244. [ Links ]
3. Hervey-Jumper SL, Berger MS. Maximizing safe resection of low-and high-grade glioma. J Neurooncol 2016;130:269-282. [ Links ]
4. Sommer B, Grummich P, Coras R, Kasper BS, Blumcke I, Hamer HM, Stefan H, Buchfelder M, Roessler K. Integration of functional neuronavigation and intraoperative MRI in surgery for drug-resistant extratemporal epilepsy close to eloquent brain areas. Neurosurg Focus 2013;34:E4. [ Links ]
5. Gabarros A, Young WL, McDermott MW, Lawton MT. Language and motor mapping during resection of brain arteriovenous malformations: indications, feasibility, and utility. Neurosurgery 2011;68:744-752. [ Links ]
6. Meng L, Weston SD, Chang EF, Gelb AW. Awake craniotomy in a patient with ejection fraction of 10%: considerations of cerebro-vascular and cardiovascular physiology. J Clinical Anesth 2015;27:256-261. [ Links ]
7. Meng L, Han SJ, Rollins MD, Gelb AW, Chang EF. Awake brain tumor resection during pregnancy: Decision making and technical nuances. J Clin Neurosci 2016;24:160-162. [ Links ]
8. Balogun JA, Khan OH, Taylor M, Dirks P, Der T, Carter Snead Iii O, et al. Pediatric awake craniotomy and intra-operative stimulation mapping. J Clin Neurosci 2014;21:1891-1894. [ Links ]
9. Hervey-Jumper SL, Li J, Lau D, Molinaro AM, Perry DW, Meng L, Berger MS. Awake craniotomy to maximize glioma resection: methods and technical nuances over a 27-year period. J Neurosurg 2015;123:325-339. [ Links ]
10. Dziedzic T, Bernstein M. Awake craniotomy for brain tumor: indications, technique and benefits. Expert Rev Neurother 2014;14:1405-1415. [ Links ]
11. Brown T, Shah AH, Bregy A, et al. Awake craniotomy for brain tumor resection: the rule rather than the exception? J Neurosurg Anesthesiol 2013;25:240-247. [ Links ]
12. Hervey-Jumper SL, Berger MS. Technical nuances of awake brain tumor surgery and the role of maximum safe resection. J Neurosurg Sci 2015;59:351-360. [ Links ]
13. Groshev A, Padalia D, Patel S, et al. Clinical outcomes from maximum-safe resection of primary and metastatic brain tumors using awake craniotomy. Clin Neurol Neurosurg 2017;157:25-30. [ Links ]
14. Beez T, Boge K, Wager M, et al. Tolerance of awake surgery for glioma: a prospective European Low Grade Glioma Network multicenter study. Acta Neurochir 2013;155:1301-1308. [ Links ]
15. Milian M, Tatagiba M, Feigl GC. Patient response to awake craniotomy-a summary overview. Acta Neurochir 2014;156: 1063-1070. [ Links ]
16. Meng L, Berger MS, Gelb AW. The potential benefits of awake craniotomy for brain tumor resection: an anesthesiologist’s perspective. J Neurosurg Anesthesiol 2015;27:310-317. [ Links ]
17. Howe KL, Zhou G, July J, et al. Teaching and sustainably implementing awake craniotomy in resource-poor settings. World Neurosurg 2013;80:e171-e174. [ Links ]
18. Conte V, L’Acqua C, Rotelli S, et al. Bispectral index during asleep-awake craniotomies. J Neurosurg Anesthesiol 2013;25:279-284. [ Links ]
19. Rajan S, Cata JP, Nada E, et al. Asleep-awake-asleep craniotomy: a comparison with general anesthesia for resection of supratentorial tumors. J Clin Neurosci 2013;20:1068-1073. [ Links ]
20. Lin N, Han R, Zhou J, et al. Mild sedation exacerbates or unmasks focal neurologic dysfunction in neurosurgical patients with supratentorial brain mass lesions in a drug-specific manner. Anesthesiology 2016;124:598-607. [ Links ]
21. Kulikov AS, Kobyakov GL, Gavrilov AG, et al. Awake craniotomy: analysis of complicated cases. Zh Vopr Neirokhir ImNNBurdenko 2015;79:15-21. [ Links ]
22. Sivasankar C, Schlichter RA, Baranov D, et al. Awake craniotomy: a new airway approach. Anesth Analg 2016;122:509-511. [ Links ]
23. Deras P, Moulinie G, Maldonado IL, et al. Intermittent general anesthesia with controlled ventilation for asleep-awake-asleep brain surgery: a prospective series of 140 gliomas in eloquent areas. Neurosurgery 2012;71:764-771. [ Links ]
24. Potters JW, Klimek M. Awake craniotomy: improving the patient's experience. Curr Opin Anaesthesiol 2015;28:511-516. [ Links ]
25. Breshears JD, Molinaro AM, Chang EF. A probabilistic map of the human ventral sensorimotor cortex using electrical stimulation. J Neurosurg 2015;123:340-349. [ Links ]
26. Roux FE, Miskin K, Durand JB, et al. Electrostimulation mapping of comprehension of auditory and visual words. Cortex 2015;71:398-408. [ Links ]
27. Gras-Combe G, Moritz-Gasser S, Herbet G, et al. Intraoperative subcortical electrical mapping of optic radiations in awake surgery for glioma involving visual pathways. J Neurosurg 2012;117:466-473. [ Links ]
28. Talacchi A, Santini B, Casartelli M, et al. Awake surgery between art and science. Part II: Language and cognitive mapping. Funct Neurol 2013;28:223-239. [ Links ]
29. Sokhal N, Rath GP, Chaturvedi A, et al. Anaesthesia for awake craniotomy: a retrospective study of 54 cases. Indian J Anaesth 2015;59:300-305. [ Links ]
30. Nossek E, Matot I, Shahar T, et al. Intraoperative seizures during awake craniotomy: incidence and consequences: analysis of 477 patients. Neurosurgery 2013;73:135-140. [ Links ]
31. Nossek E, Matot I, Shahar T, et al. Failed awake craniotomy: a retrospective analysis in 424 patients undergoing craniotomy for brain tumor. J Neurosurg 2013;118:243-249. [ Links ]
32. Flexman AM, Ng JL, Gelb AW. Acute and chronic pain following craniotomy. Curr Opin Anaesthesiol 2010;23:551-557. [ Links ]
33. Flexman AM, Meng L, Gelb AW. Outcomes in neuroanesthesia: what matters most? Can J Anaesth 2016;63:205-211. [ Links ]
34. Gruenbaum SE, Meng L, Bilotta F. Recent trends in the anesthetic management of craniotomy for supratentorial tumor resection. Curr Opin Anaesthesiol 2016;29:552-557. [ Links ]
35. Wigmore TJ, Mohammed K, Jhanji S. Long-term survival for patients undergoing volatile versus IV anesthesia for cancer surgery: a retrospective analysis. Anesthesiology 2016;124:69-79. [ Links ]











 texto en
texto en