Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.47 no.1 Bogotá Jan./Mar. 2019
https://doi.org/10.1097/cj9.0000000000000086
Reporte de caso
Plexopatía braquial prolongada después de un bloqueo interescalénico en cirugía de hombro
a Departamento de Anestesia y Cuidado Crítico, Hospital del Mar, Parc de Salut Mar. Barcelona, España.
b Departamento de Traumatología y Ortopedia, Hospital del Mar. Barcelona, España.
El bloqueo Interescalénico (BIE) es el abordaje al plexo braquial usado con mayor frecuencia en cirugía de hombro, que permite una mejor analgesia postoperatoria y reduce la necesidad de morfina de rescate, en comparación con la anestesia general. Si bien es cierto que se considera un bloqueo seguro, se ha asociado a una tasa de complicaciones relativamente alta, siendo la complicación más seria los síntomas neurológicos postoperatorios (SNPO), tales como parestesia, disestesia, y pérdida de la sensibilidad. Presentamos el caso de un paciente con déficit neurológico prolongado de 4 meses de duración, luego de BIE guiado por neuroestimulación. Debido a la naturaleza multifactorial de las lesiones neurológicas postoperatorias, puede ser difícil determinar su etiología. En nuestro caso, la plexopatía braquial se debió posiblemente a la administración de anestésico local (AL) a través del perineuro. Hacemos referencia a las posible causas y la opción de ultrasonido asociado a la neuroestimulación cuando se realiza un bloqueo interescalénico, a fin de reducir la incidencia de punción del nervio.
Palabras clave: Neuropatías del Plexo Braquial; Bloqueo Nervioso; Artroplastia; Analgesia; Ultrasonido
Interscalene block (ISB) is the brachial plexus approach most frequently used in shoulder surgery, providing better postoperative analgesia and reducing the need for rescue morphine compared to general anesthesia. While it is considered a safe block, it has been associated with a relatively high rate of complications, the most serious of which are postoperative neurologic symptoms, such as paresthesia, dysesthesia, and reduced sensitivity. We present the case of a patient with prolonged neurological deficit lasting 4 months following nerve stimulation-guided ISB. Due to the multifactorial nature of postoperative neurological lesions, it can be difficult to determine their etiology. In our case, the brachial plexopathy was probably due to the administration of local anesthetic through the perineurium. We discuss possible causes and argue for the use of ultrasound associated with nerve stimulation when an ISB is performed in order to reduce the incidence of nerve puncture.
Keywords: Brachial Plexus Neuropathies; Nerve Block; Arthroplasty; Analgesia; Ultrasonics
Introducción
El bloqueo interescalénico (BIE) es la técnica anestésica y analgésica más efectiva para la cirugía de hombro.1 Sin embargo, se asocia a un porcentaje relativamente elevado de síntomas neurológicos postoperatorios (SNPO).2 Durante el período postoperatorio, dichos síntomas pueden aparecer luego de practicar un bloqueo periférico, hasta en un 15% de pacientes,3 con una incidencia reportada de lesiones nerviosas severas en 2,4 de cada 10.000 bloqueos del nervio periférico realizados.4 Debido a la escasez de publicaciones sobre el tema, se desconoce la incidencia exacta de tales lesiones, pero se cree que oscila entre 4% y 6%.3,4 La mayoría de los casos se resuelven en cuestión de semanas o meses, y la persistencia más allá de un año es excepcional (1%). Describimos aquí el caso de una paciente con polineuropatía diabética, quien presentó un déficit neurológico severo luego de un BIE. La paciente autorizó por escrito a los autores para la publicación del informe.
Reporte de caso
Se trata de una paciente de 63 años de edad, con antecedentes de diabetes mellitus tipo 2 insulinodependiente, con retinopatía diabética y síntomas consistentes con neuropatía diabética en ambos pies (disestesias en distribución de media, especialmente durante la noche); hipertensión arterial y dislipidemia. La paciente se programó para la implantación de una prótesis reversa de hombro derecho.
En la sala de operaciones se inició monitoreo no invasivo de la presión arterial, electrocardiograma, y saturación de oxígeno determinada por oximetría de pulso. La paciente se pre-medicó con midazolam (1mg) y fentanil (100 mcg) por vía endovenosa. El bloqueo interescalénico con neuroestimulación se realizó mediante el abordaje de Winnie (a nivel del cartílago cricoides o C6, avanzando una aguja entre el musculo escaleno anterior y medio), sin parestesia ni molestia en absoluto (obteniendo respuesta de abducción del hombro con flexión del codo [nervios axilares y musculo-cutáneos a 0,5 mA). Se inyectaron 10 mL de bupivacaína al 0,25% con adrenalina y 10 mL de mepivacaína al 1,5% sin coadyuvante. Veinticinco minutos después de la administración del anestésico, se hizo la exploración del nivel del bloqueo sensorial, determinando ausencia de sensación (frío) y dolor (presión) a nivel del segmento C5-C6 y bloqueo motor por la incapacidad para levantar el brazo o el antebrazo. La inducción de la anestesia general se hizo luego con propofol (100 mg), fentanil (150 mcg) y rocuronio (40 mg). Se practicó tanto ventilación manual como intubación endotraqueal sin dificultad (Cormack-Lehane grado II). La cirugía se realizó con el paciente en posición de silla de playa. Se utilizó un abordaje deltopectoral estándar y se implantó la prótesis (Delta Xtend; DePuy, Warsaw, IN, USA) sin complicaciones. Luego de reposicionar los componentes, se probó la estabilidad antes de la reinserción del subescapular. El brazo se aseguró en rotación interna con un cabestrillo. La paciente se extubó al final de la cirugía en la sala de operaciones, y posteriormente se trasladó a la unidad de recuperación post-anestesia (UCPA). Se administraron dexquetaprofeno (50mg/12h), paracetamol (1g/6h) y morfina subcutánea (3 mg) por demanda, como analgesia postoperatoria. La salida de la paciente de la UCPA se retrasó debido a la dificultad para controlar la glicemia. Durante el postoperatorio inmediato, la paciente presentó dolor ocasional en el área quirúrgica, el cual se alivió con los analgésicos administrados, y una sensación progresiva de menor sensibilidad y función motora en la extremidad superior derecha. La paciente fue dada de alta del hospital 48 horas más tarde. La epicrisis indica que la paciente tenía un buen control del dolor y trofismo neurovascular distal preservado. Durante la consulta de seguimiento del cirujano ortopedista, 3 semanas más tarde, la paciente dijo presentar una sensación de menor sensibilidad y función motora de la extremidad superior derecha en el período postoperatorio, pero sin más explicaciones. En ese momento describió una pérdida de fuerza en toda la extremidad superior derecha, incapacidad para doblar los dedos excepto el pulgar, el índice y el del corazón, con adormecimiento predominante del anular y el meñique y alodinia dinámica en la región cubital distal, con cambio de coloración y de temperatura en la mano derecha, en contraste con la mano izquierda. Estos síntomas eran lo suficientemente severos como para interferir con el sueño. La paciente fue evaluada por el neurólogo, quien solicitó una resonancia magnética (RM) de la columna cervical y del hombro, sin signos de hematomas u otras lesiones que produjeran compresión del plexo braquial. Puesto que la actividad de desenervación de los músculos distales no aparece sino hasta 3 o 4 semanas más tarde, se realizó una electromiografía (EMG) 4 semanas después, la cual mostró signos de desenervación de todos los músculos examinados, con ausencia de unidades motoras durante la contracción voluntaria de C5 a C8, excepto por una unidad motora en el bíceps y en el primer musculo interóseo. Estos signos indicaron una plexopatía braquial derecha parcial pero severa, a nivel postganglionar, asociada a axonotmesis del nervio axilar derecho. Debido a su inicio tardío y al predominio del dolor en comparación con la pérdida motora, se descartó una neuritis braquial tipo síndrome de Parsonage-Turner, reportado algunas veces después de cirugía. A pesar de la ausencia de dolor durante la inyección, se sospechó inyección intraneural durante el BIE. La paciente se remitió entonces a clínica del dolor para seguimiento y tratamiento, que se inició con pregabalina (25mg/12h), duloxetina (30 mg en la noche) y paracetamol (1g/8h), junto con fisioterapia 3 veces por semana. Después de 4 meses la paciente había recuperado la fuerza y la sensibilidad en toda la extremidad. La EMG realizada a los 4 meses de seguimiento mostró signos claros de reinervación del deltoides, bíceps sin la secuelas esperadas de una lesión al nervio axilar o del tronco primario superior, y sugirió un buen pronóstico de la lesión del tronco inferior.
Discusión
Este caso es un ejemplo de una complicación severa posterior al BIE. El retraso en la aparición de los síntomas se puede explicar por un mecanismo de compresión nerviosa secundario a inflamación, edema y micro hematomas. La mayoría de las lesiones neurológicas en el período postoperatorio son multifactoriales y por ende suele ser difícil determinar su etiología con precisión. Entre las posibles causas están factores relacionados con la anestesia, relacionados con el paciente y factores quirúrgicos. Entre los factores relacionados con la anestesia, algunos estudios describen una relación entre una presión de inyección de apertura alta y una colocación intraneural de la aguja, lo cual puede generar lesión fascicular severa y déficit neurológico. Los síntomas neurológicos postoperatorios pueden ser el resultado de inyección directa de la anestesia local y de la lesión directa producida por la aguja o el catéter. Pudiera haber relación con el nivel de sedación; recientemente, la Sociedad Americana de Anestesia Regional y Medicina del Dolor (ASRA) publicó sus recomendaciones para realizar una anestesia regional periférica, recomendando no utilizar el BIE en pacientes bajo anestesia general o sedación profunda.5 Entre los factores relacionados con el paciente, algunos estudios concluyen que los pacientes con neuropatía preoperatoria, como en nuestro caso (secundaria a diabetes mellitus, enfermedad vascular periférica, etc.) tienen mayor riesgo de presentar síntomas neurológicos postoperatorios. De hecho, la realización de bloqueos del nervio periférico en pacientes con déficits neurológicos preoperatorios, o historia de complicaciones neurológicas luego de anestesia regional es controversial. Entre los factores quirúrgicos encontramos que el trauma y el mal posicionamiento del paciente, contribuyen a la aparición de lesiones neurológicas debido a daño mecánico (tracción, compresión, o laceración de estructuras nerviosas), daño isquémico (torniquetes no aplicados con la presión correcta y/o durante el tiempo adecuado), y compresión extrínseca (hematoma o edema secundario a trauma quirúrgico). En nuestro caso descartamos mediante pruebas de imágenes la excesiva tracción durante la cirugía. La lesión de los nervios por compresión es relativamente común,6 bien sea extraneural (compresión crónica por estructuras vecinas, uso de un torniquete con alta presión), intraneural (alta presión de inyección intraneural) o debido al síndrome compartimental. En el contexto de cirugía de hombro, el posicionamiento correcto del paciente es importante. El paciente debe estar o bien en posición de silla de playa, o en decubito lateral y debe evitarse la rotación o flexión excesiva de la cabeza hacia el lado contralateral del hombro afectado, pues esto pudiera producir tracción del plexo braquial y lesionar los troncos primarios. En nuestro caso, la cabeza se colocó en posición neutral, sin exceso de rotación ni flexión.
Es importante conocer la posición de la aguja para un bloqueo periférico seguro y efectivo. X Sala et al7 describieron la anatomía del nervio periférico, el cual está compuesto por fascículos. Cada fascículo está recubierto por el endoneurio, una capa de tejido conjuntivo laxo. El perineurio es una vaina que rodea a los fascículos individuales, de los cuales hay 3 patrones posibles: monofascicular (que consiste en un solo fascículo grande), como en el caso del interescalénico del plexo braquial, el cual expone al paciente a un alto riesgo de lesión cuando se produce una inyección intraneural; oligofascicular (algunos fascículos de diferentes tamaños), y polifascicular (muchos fascículos, algunos de diversos tamaños). Finalmente, cada uno de los fascículos rodeado por el perineuro está a su vez rodeado de tejido conjuntivo a todo lo largo del nervio, el epineuro, clasificado bien sea como epineuro interfascicular o externo, que guarda el contenido de los nervios periféricos y conecta al nervio con sus estructuras vecinas. Estos autores diferencian entre la colocación de la aguja dentro del epineuro, que no viola el perineuro (subepineural), y la colocación dentro del fascículo (intrafascicular).7 Se cree que la colocación de la aguja intraneural que viola al perineuro y la colocación intrafascicular directa con la posterior inyección de AL, se asocian con lesión neurológica. En nuestro caso, creemos que la inyección intraneural con la infiltración de AL a nivel de las raíces nerviosas en C5-C6-C7, fueron los principales factores que contribuyeron a la lesión nerviosa aquí descrita.
La diferencia en la composición de los nervios periféricos entre las regiones proximales, con más parénquima y un patrón oligofascicular, y las regiones distales con una configuración más diseminada y polifascicular, además de un aumento del tejido estromal, también influyen. La disminución del tejido conjuntivo de las partes más proximales del plexo braquial, pudiera ser en parte responsable de su vulnerabilidad.
Antes de existir el ultrasonido, teníamos poca información sobre la posición de la aguja para realizar un bloqueo nervioso seguro y exitoso. Con la introducción de la guía por ultrasonido, fue posible seguirla colocación de la aguja y la propagación del anestésico local con mayor precisión y se identificaron las señales sugestivas de punción intraneural en el ultrasonido.8 El ultrasonido ha contribuido a nuestra comprensión de muchos aspectos del bloqueo periférico, aun cuando su uso por parte de personal no capacitado debidamente, pudiera generar desenlaces más pobres.
Estamos de acuerdo con el algoritmo propuesto por X. Sala et al9 (Fig. 1) para la realización de un bloqueo del nervio periférico. Este algoritmo incluye la evaluación del paciente, la estimulación del nervio, el monitoreo de la presión de inyección, y la visualización de la propagación del anestésico local. La estimulación a intensidades de < 0,3 mA (con una frecuencia de 2 Hz, y una duración de la pulsación de 100 msec) y una presión de inyección de >15 psi (medida con un manómetro en la línea, colocado antes de la jeringa) es señal de punción intraneural, muy cerca o dentro del fascículo.9
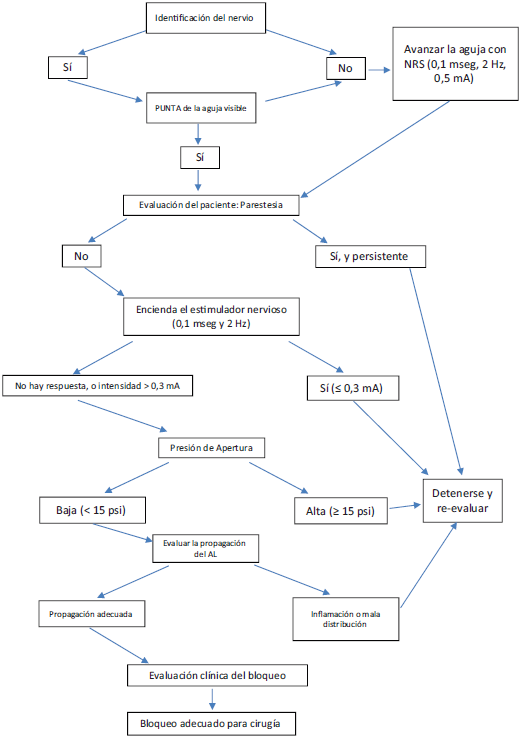
Fuente: Algoritmo modificado de X. Sala et al.9
Figura 1 Procedimiento seguro para bloqueo del nervio guiado por ultrasonido.
En conclusión, creemos que aplicando algoritmos en la práctica de la anestesia, podemos reducir las complicaciones asociadas a los bloqueos de nervio periférico, aun cuando no podemos eliminarlas por completo.
Responsabilidades éticas
Protección de sujetos humanos y animales. Los autores declaran que no se realizaron experimentos en humanos ni en animales para el presente estudio.
Confidencialidad de la Información. Los autores declaran que han acatado los protocolos de su centro de trabajo sobre la publicación de los datos de pacientes.
Derecho a la privacidad y el consentimiento informado. Los autores declaran que en el presente artículo no aparecen datos de pacientes. La paciente autorizó por escrito a los autores para publicar el informe.
REFERENCIAS
1. Wu CL, Rouse LM, Chen JM, et al. Comparison of postoperative pain in patients receiving interscalene block or general anesthesia for shoulder surgery. Orthopedics 2002;25:45-48. [ Links ]
2. Brull R, McCartney CJ, Chan VW, et al. Neurological complications after regional anesthesia: contemporary estimates of risk. Anesth Analg 2007;104:965-974. [ Links ]
3. Borgeat A, Ekatodramis G, Kalberer F, et al. Acute and nonacute complications associated with interscalene block and shoulder surgery: a prospective study. Anesthesiology 2001;95:875-880. [ Links ]
4. Liguori GA. Complications of regional anesthesia: nerve injury and peripheral nerve blockade. J Neurosurg Anesthesiol 2004;16:84-86. [ Links ]
5. Neal JM, Bernards CM, Hadzic A, et al. ASRA practice advisory on neurologic complications in regional anesthesia and pain medicine. Reg Anesth and Pain Med 2008;33:404-415. [ Links ]
6. Hogan QH. Pathophysiology of peripheral nerve injury during regional anesthesia. Reg Anesth Pain Med 2008;33:435-441. [ Links ]
7. Sala X, Vandepitte C, Laur JJ, et al. A practical review of perineural versus intraneural injections: a call for standard nomenclature. Int Anesthesiol Clin 2011;49:1-12. [ Links ]
8. Gerrero-Domínguez R, López-Herrera-Rodríguez D, Fernández-López J, et al. Anaesthetic management for emergent upper limb trauma surgery in a 23-week pregnant woman: role ofultrasound-guided infraclavicular brachial plexus block. Case report. Rev Colomb Anestesiol 2014;42:234-237. [ Links ]
9. Sala-Blanch X, Lopez A, Vandepitte C. Safety algorithms for ultrasound-guided blocks: the next challenge. Rev Esp Anestesiol Reanim 2015;62:116-117. [ Links ]











 text in
text in 


