Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.47 no.3 Bogotá July/Sept. 2019 Epub Aug 06, 2019
https://doi.org/10.1097/cj9.0000000000000120
Breves de la academia
Cuarta definición de infarto agudo de miocardio. Consideraciones anestésicas perioperatorias
a Departamento de Anestesiología y Reanimación, Hospital Virgen de la Concha. Zamora, España.
En la Cuarta Definición Universal del Infarto de Miocardio se propone que el término infarto agudo de miocardio (IAM) debería emplearse Únicamente cuando existe un daño miocárdico agudo con evidencia clínica de isquemia miocárdica aguda.1 Para el diagnóstico del IAM debe haber elevación o descenso de los valores de troponina cardiaca y, al menos, uno de los siguientes criterios: 1) síntomas de isquemia miocárdica aguda, 2) cambios isquémicos nuevos en el electrocardiograma (ECG), 3) desarrollo de nuevas ondas Q patológicas, 4) imágenes que evidencien pérdida de miocardio viable o movilidad anormal de alguna pared por causa isquémica o 5) identificación de algún trombo coronario por angiografía. En caso contrario, tan solo debería hablarse de daño miocárdico.1
El IAM perioperatorio es una de las complicaciones más importantes y una de las mayores causas de morbimortalidad en pacientes sometidos a cirugía no cardiaca; presenta su máxima incidencia durante el postoperatorio.2 Aun más raro es el IAM intraoperatorio, el cual cursa con mayor morbilidad y un riesgo muy alto de mortalidad. Cerca de 230 millones de intervenciones de cirugía mayor se realizan cada año en el mundo entero, lo cual representa un gran reto para el anestesiólogo, por las múltiples complicaciones que pueden acontecer dentro del quirófano3; de estos casos, más de 10 millones experimentan eventos cardiacos durante elperioperatorio.4
El diagnóstico y el manejo del IAM durante la cirugía se encuentran muy poco descritos en la literatura, dado que los cambios del segmento ST son extremadamente raros durante este periodo. La rápida detección y el tratamiento pueden garantizar un mejor pronóstico de supervivencia de los pacientes, siendo esta una entidad que tiene una altísima morbimortalidad durante todo ingreso.
Con la nueva clasificación del IAM son cinco las causas isiopatológicas implicadas en el desarrollo del IAM; el IAM tipo 1 es el causado por enfermedad coronaria aterotrombótica, y, normalmente, es precipitado por rotura o erosión de la placa ateroesclerótica. El IAM tipo 2 se debe al desequilibrio entre el aporte y el consumo de oxígeno. El IAM tipo 3 se da en los pacientes con síntomas típicos de IAM, pero que mueren antes de poder determinarse las troponinas o antes de que estas se eleven. Existen también el IAM de tipo 4 y el IAM 5, que se asocian a tratamientos de cirugía cardiaca.1
El mecanismo isiopatológico del IAM perioperatorio es objeto de debate. Se sabe que este periodo se caracteriza por un incremento de las demandas metabólicas del miocardio que pueden llevar a un paciente con enfermedad coronaria estable a un IAM, y si bien las investigaciones angiográficas han demostrado que la etiología principal del IAM perioperatorio es esta que, junto con la elevación o el descenso de troponinas cardiacas indican un IAM tipo 2, el mecanismo tipo 1 también ha sido identificado en hasta en el 50% de los IAM perioperatorios.1
Los cambios repentinos en el ST suelen ser manifestaciones de lo ya descrito, pero tienden también a ser cambios transitorios, sin que deriven en un daño miocárdico definitivo; a pesar de que el IAM debe ser la principal entidad por descartar, no deben olvidarse otras patologías, como el vasoespasmo coronario, la miocardiopatía de Takotsubo, el síndrome de Brugada o la angina de Prinzmetal.
La edad avanzada y ser varón son los dos factores de riesgo más importantes para el desarrollo de un IAM; a ello le siguen los factores de riesgo cardiovasculares típicos (hipertensión, obesidad, hipercolesterolemia o tabaquismo, entre otros).2 El hecho de someterse a una intervención quirúrgica y los cambios en la presión arterial que durante ella se producen, junto con la hipotermia o la anemia, pueden ser responsables de inestabilidad coronaria.
En el paciente despierto, la isquemia miocárdica puede cursar con clínica neurovegetativa, así como con dolor torácico o mandibular. El reto para el anestesiólogo proviene de aquellos bajo anestesia general, quienes tan solo manifestarán inestabilidad hemodinámica y cambios en el ECG. A pesar de ello, la mortalidad a los 30 días del IAM asintomático es similar a la del sintomático.2 El estudio POISE reveló que, aproximadamente, el 65% de los pacientes que sufrieron un IAM no tuvieron síntomas isquémicos típicos.
Sería interesante también conocer en los pacientes con alto riesgo cardiaco los valores de troponinas cardiacas basales, para saber si unos determinados valores perioperatorios elevados ya lo estaban previamente o son de reciente comienzo: cuanto mayores sean los valores basales, mayor es el riesgo perioperatorio.5
Finalmente, el infarto intraoperatorio es una emergencia médica para la cual el anestesiólogo debe estar preparado y alerta. Gracias a la monitorización básica que se realiza en toda intervención quirúrgica, se puede detectar isquemia miocárdica, pese a tener al paciente sometido a anestesia general. Sabiendo que el objetivo es mantener la estabilidad hemodinámica del paciente, se deben evitar factores precipitantes y garantizar un diagnóstico y un tratamiento correctos; se deben conocer también los diferentes manejos según el tipo de IAM que se produzca (Figura 1) para prevenir un mayor daño miocárdico o la muerte del paciente.
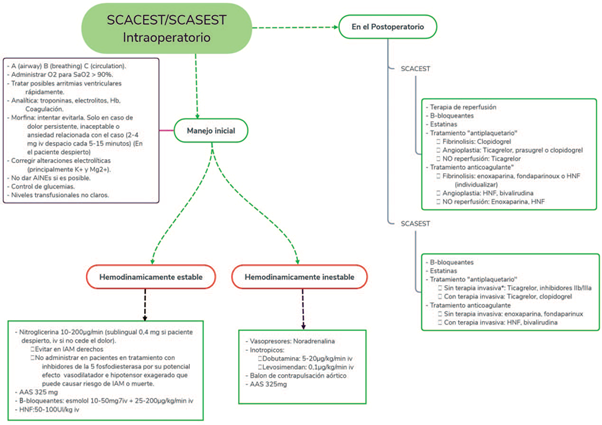
Fuente: Yaiza Beatriz Molero-Díez.
Figura 1 Tratamiento simplificado del IAM (*terapia invasiva: cateterismo o angiografía). SCACEST: síndrome coronario agudo con elevación del ST; SCASEST: síndrome coronario agudo sin elevación del ST.
El empleo de fármacos vasoactivos e inotrópicos para mantener una presión diastólica adecuada que asegure una correcta perfusión coronaria, junto con la administración de antiagregantes, de heparina, de p-bloqueantes o de nitroglicerina pueden remontar al paciente durante el momento agudo del cuadro. Aparte de ello, administrar analgésicos para disminuir la demanda miocárdica puede ayudar a mantener al paciente estable hasta la realización del cateterismo cardiaco para la reperfusión. La clásica indicación de suplementar con oxígeno con una FiO2 de 1 está actualmente contraindicada, pues se ha visto que los pacientes normoxémicos con IAM a quienes se les administra oxígeno a dosis altas experimentan más recurrencias a los 6 meses que aquellos a quienes no se les administra, por lo cual iniciar oxigenoterapia está indicado únicamente en casos en los que la persona presente hipoxemia (SatO2 < 90-92%).6 El empleo de terapia de reperfusión, o fibrinólisis postoperatoria, debe valorarse individualmente, tomando en cuenta que dentro de las contraindicaciones de esta última está el IAM postoperatorio, dado el posible riesgo de aumento de sangrado del sitio quirúrgico; a pesar de ello, recientes artículos avalan su beneficio en pacientes seleccionados,7 pero el tema aun es objeto de bastante controversia.
REFERENCIAS
1. Thygesen K, Alpert JS, Jaffe AS, et al. Fourth universal definition of myocardial infarction. J Am College Cardiol 2018;72:2231-2264. [ Links ]
2. Devereaux PJ, Xavier D, Pogue J, et al. Characteristics and short-term prognosis of perioperative myocardial infarction in patients undergoing noncardiac surgery: a cohort study. Ann Int Med 2011; 154:523-528. [ Links ]
3. Weiser TG, Regenbogen SE, Thompson KD, et al. An estimation of the global volume of surgery: a modelling strategy based on available data. Lancet 2008;372:139-144. [ Links ]
4. Devereaux PJ, Sessler DI. Cardiac complications in patients undergoing major noncardiac surgery. New Eng J Med 2015;373:2258-2269. [ Links ]
5. Puelacher C, Buse GL, Seeberger D, et al. Perioperative myocardial injury after noncardiac surgery. Circulation 2018;137:1221-1232. [ Links ]
6. Siemieniuk RAC, Chu DK, Kim LH-Y, et al. Oxygen therapy for acutely ill medical patients: a clinical practice guideline. BMJ 2018;363:k4169. [ Links ]
7. Voelkel N, Hubert ND, Backhaus R, et al. Thrombolysis in postoperative stroke. Stroke 2017;48:3034-3039. [ Links ]
Cómo citar este artículo: Molero-Díez YB, Sánchez-Tabernero Á, Ruiz-Simón FA, Sanchis-Dux R. Fourth universal definition of myocardial infarction: perioperative anesthetic considerations. Colombian Journal of Anesthesiology. 2019;47:175-177.
Copyright © 2019 Sociedad Colombiana de Anestesiología y Reanimación (S.C.A.R.E.). Published by Wolters Kluwer. This is an open access article under the CC BY-NC-ND license (https://creativecommons.org/licenses/by-nc-nd/4.0/).











 text in
text in 


