Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.48 no.1 Bogotá Jan./Mar. 2020 Epub Feb 28, 2020
https://doi.org/10.1097/cj9.0000000000000118
Reporte de casos
Anestesia espinal para cesárea en paciente con deficiencia de proteína S: informe de caso y revisión de la literatura
a Residente de primer año de Anestesia, Analgesia y Reanimación del Instituto Nacional Materno Perinatal. Lima, Perú.
b Anestesia, Analgesia y Reanimación del Instituto Nacional Materno Perinatal. Lima, Perú.
Introducción:
La deficiencia congénita de proteína S es una enfermedad muy rara en la población. En gestantes está asociada a aborto espontáneo y muerte fetal, entre otras complicaciones.
Presentación del caso:
Presentamos el caso de una multigesta de 32 años con embarazo de 36 semanas, con tromboprofilaxis con enoxaparina desde la semana cuarta de gestación y con diagnóstico de trombofilia -por deficiencia de proteína S funcional-, la cual fue intervenida con cesárea electiva bajo anestesia espinal. Además, se realizó revisión de la literatura al respecto.
Discusión:
El riesgo de tromboembolismo venoso es aproximadamente 4 a 5 veces mayor durante la gestación, y la recomendación de tromboprofilaxis en trombofilias de bajo riesgo se basa en la presencia de factores de riesgo asociados. En pacientes que reciben Heparinas de Bajo Peso Molecular (HBPM) como tromboprofilaxis, se recomienda un intervalo de al menos 12 horas después de la última dosis de HBPM antes de la punción del neuroeje, y reiniciar la siguiente dosis después de al menos 4 horas de uso de la técnica espinal.
Conclusión:
Las técnicas neuroaxiales deben ser individualizadas y recibir tromboprofilaxis pre y posparto. Además, se deben tener en cuenta las medidas de tromboprofilaxis no farmacológicas en el periodo perioperatorio. La anestesia espinal fue efectiva y segura en esta paciente.
Palabras clave: Déficit de Proteína S; Mujeres embarazadas; Anestesia Raquídea; Trombosis; Enoxaparina
Introduction:
Congenital protein S deficiency is a very rare disease in the population. In pregnant women it is associated with spontaneous abortion and fetal death, among other complications.
Case presentation:
We present the case of a 32-year-old multigravida with a 36-week pregnancy, with thromboprophylaxis with enoxaparin from the 4th week of gestation and with a diagnosis of thrombophilia-due to functional protein S deficiency-which was intervened with elective c-section under spinal anesthesia. In addition, a review of the relevant literature was conducted.
Discussion:
The risk of venous thromboembolism is approximately 4 to 5 times greater during gestation, and the recommendation of thromboprophylaxis in low-risk thrombophilia is based on the presence of associated risk factors. In patients receiving low molecular weight heparin (LMWH) as thromboprophylaxis, an interval of at least 12 hours after the last dose of LMWH before neuropsy and restarting the next dose after at least 4hours of spinal technique use is recommended.
Conclusion:
Neuroaxial techniques should be individualized and receive pre and postpartum thromboprophylaxis. In addition, non-pharmacological thromboprophylaxis measures in the perioperative period should be considered. Spinal anesthesia was effective and safe in this patient.
Keywords: Protein S Deficiency; Pregnant Women; Anesthesia; Spinal; Thrombosis; Enoxaparin
Introducción
La proteína S es un cofactor dependiente de la vitamina K y de la proteína C. La proteína C actúa inhibiendo los factores Va y VIIIa de la cascada de coagulación. La fracción libre de la proteína S actúa como cofactor de la proteína C. Y la deficiencia de ambas proteínas deriva en un estado de hipercoagulabilidad que se trata con anticoagulación.1
La deficiencia congénita de proteína S es una enfermedad autosómica dominante, muy rara en la población no portadora del gen, con una frecuencia de aproximadamente 1 en 700 individuos de la población general, según extrapolaciones de un estudio realizado en más de 9000 donantes. La incidencia de proteína S aumenta a 3-6% en pacientes con antecedentes de trombosis o trombosis recurrente. Asimismo, está descrita una alta frecuencia en pacientes japoneses, aproximadamente el 12.7%. El tromboembolismo venoso (TEV) se desarrolla en un 60 a 80% de los pacientes que son heterocigotos para la deficiencia de proteína S; sin embargo, los pacientes restantes son asintomáticos y algunos nunca desarrollan TEV.2
La deficiencia de proteína S en gestantes está asociada a aborto espontáneo, muerte fetal, restricción del crecimiento intrauterino fetal, desprendimiento de placenta e hipertensión inducida por el embarazo, y además puede inducir trombosis en vasos deciduales y afectar la placentación a través de hipercoagulabilidad e inflamación. Los cambios ocurridos en el sistema de coagulación durante la gestación son mecanismos compensatorios de la hemostasia que se deberá producir después del parto; la gestante presenta un estado de hipercoagulabilidad fisiológica donde las concentraciones de factores de coagulación, como el VII, IX y X, se incrementan, así como los niveles de fibrinógeno aumentan un 50%, a cuyos cambios se suma una disminución de la respuesta fibrinolítica. Sin embargo, los anticoagulantes como la antitrombina y proteína S disminuyen y, porconsiguiente, el embarazo altera el estado de equilibrio del sistema de coagulación, lo que conlleva que tanto la gestante como la puérpera estén predispuestas a desarrollar procesos trombóticos.3
Cabe resaltar que los mayores riesgos de desarrollar estos problemas se presentan en el primer trimestre y hasta las 12 semanas después del parto. El riesgo de tromboembolismo venoso es aproximadamente 4 a 5 veces mayor durante la gestación, teniendo como manifestaciones clínicas más frecuentes la trombosis venosa profunda y la embolia pulmonar.4
Descripción del caso
Presentamos el caso de una multigesta de 32 años con embarazo de 36 semanas y diagnóstico de trombofilia: deficiencia de proteína S funcional (Tabla 1) desde semanas antes de la gestación actual.
Tabla 1 Exámenes de laboratorio.

IgG=inmunoglobulina G; IgM=inmunoglobulina M; MPL = unidades de inmunoglobulina M; TORCH=prueba de detección para toxoplasmosis, rubeola, citomegalovirus, herpes y VIH; VN=valores normales.
Fuente: Autores.
La paciente fue programada para cesárea categoría 4 de Lucas et al. Presenta antecedentes obstétricos: cuatro abortos incompletos, una gestación a término hace cuatro años concluida por cesárea (presentación anormal), aparentemente sin complicaciones. No presenta antecedentes de eventos tromboembólicos. En regular estado general, zonas de punción venosa accesibles, ausencia de várices en miembros inferiores, presencia de edema +/+++, pupilas fotorreactivas isocóricas. Examen físico: score de Mallampati II, distancia tiromentoniana de 6.5 cm, apertura bucal mayor a 4 cm y subluxación mandibular mayor a 0 grados, adecuado movimiento cervical, tráquea central y dentadura sin alteraciones, apófisis espinosas palpables, no escoliosis, y resto de examen físico aparentemente normal. Escala de estado físico American Society of Anesthesiologists (ASA) II y exámenes auxiliares de laboratorio prequirúrgicos en rangos de normalidad (Tabla 2).
Tabla 2 Exámenes prequirúrgicos.
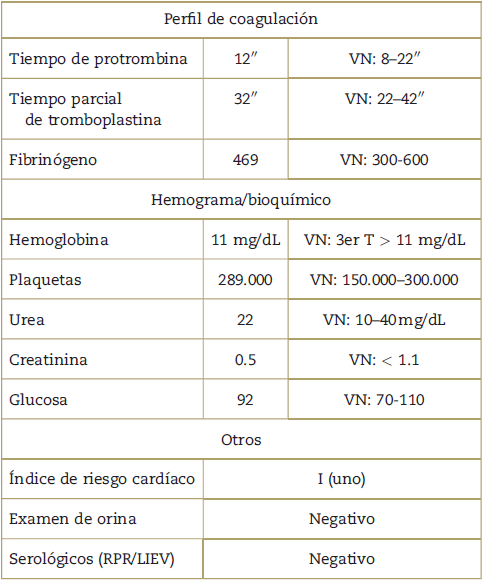
LIEV=laboratorio de investigación de enfermedades venéreas; RPR= reagina plasmática rápida.
Fuente: Autores.
La paciente está bajo tromboprofilaxis farmacológica desde la semana cuarta de gestación, con enoxaparina 40 mg cada 24 horas vía subcutánea. Se le suspende la enoxaparina 24 horas previas a la intervención quirúrgica y se recomiendan medidas mecánicas de tromboprofilaxis en el periodo perioperatorio. Se le explican a la paciente las opciones anestésicas y se decide realizar la técnica espinal para brindarle mayor seguridad. Se realizó monitorización ASA básica. Previa antisepsia, se realizó la técnica raquídea con aguja espinal punta de lápiz N°.27 G y bupivacaína hiperbárica al 0.5% 10 mg más fentanilo 20 ug en el espacio intervertebral L3-L4, sin ninguna complicación durante el acto anestésico; no contamos con ultrasonido en el servicio para ubicar el espacio intervertebral para la punción.
La paciente estuvo hemodinámicamente estable antes, durante y después del acto quirúrgico. El nacimiento ocurrió a las 12:43 p.m., con un recién nacido sano. Se cuantificó el sangrado intraoperatorio de 500 mL. Se administró tramadol 100mg y metamizol 2g por vía endovenosa treinta minutos antes del final de la cirugía para el manejo de analgesia posoperatoria. La paciente se trasladó a la Unidad de Recuperación Posanestésica con funciones vitales estables, donde estuvo monitorizada por 3 horas; durante la evolución posanestésica al alta, según escala de Aldrete, tuvo 10 puntos, y según escala de Bromage, 0 puntos. Luego fue trasladada a hospitalización para su posterior alta del nosocomio al tercer día. No presentó eventos tromboembólicos en los 15 días posoperatorios.
Discusión
Se recomienda estratificar el riesgo de tromboembolismo al inicio del embarazo, durante la evaluación preanestésica, así como en el intra y posparto inmediato (Tabla 3).
Tabla 3 Factores de riesgo para tromboembolismo venoso.

Puntaje ≥ 4 anteparto, considerar tromboprofilaxis en el primer trimestre. Puntaje de 3, considerar tromboprofilaxis a partir de la semana 28 de gestación. Puntaje ≥ 2 posparto, considerar tromboprofilaxis 10 días después. Considerar en el periodo antenatal la tromboprofilaxis. Estancia prolongada (≥ 3 días) o reingreso durante el puerperio, considerar tromboprofilaxis.
Para los pacientes con riesgo de sangrado, el balance entre este riesgo y el de trombosis debería ser evaluado por un hematólogo experto en trombosis y sangrado en gestantes.
IMC=Índice de Masa Corporal; TEV=Tromboembolismo venoso.
Fuente: Adaptado del apéndice III: "Risk assessment for venous thromboembolism (VTE)" de Royal College of Obstetricians & Gynaecologists.5
En relación con trombofilias de bajo riesgo, como la deficiencia de proteína S, la recomendación de tromboprofilaxis se basa en la presencia de factores de riesgo asociados. En esta paciente se estratificó el riesgo con un puntaje de 3 (1 punto por trombofilia de bajo riesgo, 1 punto por cesárea electiva, 1 punto por embarazo menor de 36 semanas).5 En relación con profilaxis farmacológica, el agente de elección es la heparina de bajo peso molecular (HBPM) tanto antenatal como posnatal, y las dosis se basan en el peso materno. La HBPM es segura durante la lactancia materna; la monitorización del factor Xa como seguimiento no es necesaria cuando se usa esta como profilaxis. Las heparinas no fraccionadas pueden ser útiles en el periparto, ya que tienen un tiempo de acción menor, pero su uso de forma crónica genera trombocitopenia inducida por heparina y osteoporosis.5
Una de las ventajas de la HBPM en obstetricia es el tiempo de vida media prolongado y la mayor biodisponibilidad, y por ello se usa una vez al día como profilaxis. Los pacientes que reciben profilaxis con heparina se pueden beneficiar de las técnicas neuroaxiales; sin embargo, su aplicación debe ser personalizada. En pacientes que reciben HBPM por tromboprofilaxis, se recomienda un intervalo de 12 horas después de la última dosis y 24 horas después de su uso como tratamiento, antes del inicio de un procedimiento neuroaxial; y reiniciar después de cuatro horas del uso de una técnica espinal o del retiro del catéter epidural, además de que este no debe retirarse dentro de las 12 horas después de la última dosis de HBPM.
Al margen de la técnica anestésica que se elija, se debe dar prioridad a la monitorización y evitar la disminución del gasto cardiaco, hipotermia, hipovolemia intraoperatoria y hemorragias, ya que esto se asocia a mayor riesgo de trombosis en pacientes con déficit de proteína S. La profilaxis posparto debe mantenerse por lo menos durante seis semanas con HBPM.5-7
Se decidió realizar la técnica espinal en esta paciente debido a su sencillez, a la calidad anestésica y al pequeño calibre de la aguja utilizada. Sin embargo, al alta se debió considerar continuar con tromboprofilaxis, dado el riesgo de desarrollar algún evento tromboembólico durante el estado puerperal.1,5
Conclusión
En el embarazo ocurren cambios de la hemostasia, como la hipercoagulabilidad por incremento de los factores de coagulación y la reducción de la actividad fibrinolítica. Las técnicas neuroaxiales deben ser individualizadas durante el acto quirúrgico y, según la estratificación de riesgo de tromboembolismo, se debe aplicar tromboprofilaxis anteparto y posparto. La anestesia espinal fue efectiva y segura para esta paciente.
Recomendaciones
Se recomienda evaluación preanestésica días antes de la cirugía para el manejo anestésico en gestantes con déficit de proteína S, previa estratificación de riesgo tromboembólico, y según ello realizar la tromboprofilaxis correspondiente, sin olvidar la importancia del monitoreo hemodinámico estricto durante y después del acto quirúrgico, así como el uso de medidas de tromboprofilaxis no farmacológicas en el periodo perioperatorio, como las medias antitromboembólicas, una analgesia efectiva, la deambulación precoz y evitar la deshidratación.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de la paciente.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de la paciente y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Agradecimientos
A todas las personas que hicieron posible la realización y culminación del presente reporte de caso clínico.
REFERENCIAS
1. Patil AD, Sabu J, D’Souza O. Anesthesia management of the parturient with protein S and C deficiency for cesarean section. J Anaesth Crit Care Case Rep 2017;3:14-15. [ Links ]
2. Muhsin Chisti M, Chinta S, Talavera F, et al. Protein S deficiency [Internet]. 2018; Medscape, New York: [cited 2018 Sep 23]. Available from: https://emedicine.medscape.com/article/205582-overview. [ Links ]
3. Soma-Pillay P, Catherine NP, Tolppanen H, et al. Physiological changes in pregnancy. Cardiovasc J Afr 2016;27:89-94. [ Links ]
4. Springel EH, Ramus RM. Thromboembolism in pregnancy [Internet]. 2018; Medscape, New York: [cited September 26, 2018]. Available from: https://emedicine.medscape.com/article/2056380-overview. [ Links ]
5. Royal College of Obstetricians & Gynaecologists. Thrombosis and Embolism during Pregnancy and the Puerperium, Reducing the Risk (Green-top Guideline No. 37a) [Internet]. 2018; Royal College of Obstetricians and Gynaecologists, London: [cited November 23, 2018]. Available from: https://www.rcog.org.uk/en/guidelines-research-services/guidelines/gtg37a/. [ Links ]
6. Gupta B, Prakash S, Gujral K. Anaesthetic management of the parturient with protein S deficiency and lumboperitoneal shunt. Anaesth Intensive Care 2003;31:3. [ Links ]
7. Shinozaki N, Ebina Y, Deguchi M, et al. Protein S deficiency complicated pregnancy in women with recurrent pregnancy loss. Gynecol Endocrinol 2016;32:672-674. [ Links ]
Cómo citar este artículo: Carrillo-Aybar YN, Moreno-Gonzales R, Quispe-Gómez MV. Spinal anesthesia for c-section in patients with protein S deficiency: case report and literature review. Colombian Journal of Anesthesiology. 2020;48:45-49.
Copyright © 2019 Sociedad Colombiana de Anestesiología y Reanimación (S.C.A.R.E.). Published by Wolters Kluwer. This is an open access article under the CC BY-NC-ND license (https://creativecommons.org/licenses/by-nc-nd/4.0/).











 text in
text in 


