Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Colombian Journal of Anestesiology
versão impressa ISSN 0120-3347versão On-line ISSN 2256-2087
Rev. colomb. anestesiol. vol.48 no.3 Bogotá jul./set. 2020 Epub 15-Out-2020
https://doi.org/10.1097/cj9.0000000000000104
Reporte de casos
Miotoxicidad inducida por bupivacaína durante un bloqueo continuo del nervio femoral: reporte de caso
a Fundación Valle del Lili, Cali, Colombia
b Universidad Icesi, Cali, Colombia.
Introducción:
La anestesia regional es ampliamente usada para la analgesia posoperatoria en la Artroplastia de Reemplazo de Rodilla (ARR). Aunque son procedimientos seguros y efectivos, la posibilidad de complicaciones graves existe. Ante una evolución inusual o tórpida se debe sospechar la posibilidad de miotoxicidad inducida por anestésicos locales.
Presentación del caso:
En un paciente de 54 años, American Society of Anesthesiologists (ASA) II, se llevó a cabo ARR por gonartrosis primaria. Como técnica analgésica se usó el bloqueo de nervio femoral asociado a infusión continua perineural. 24 horas después el paciente presenta deterioro clínico dado por dolor, edema y limitación funcional en muslo de extremidad operada. Ante síntomas sugestivos de miotoxicidad confirmada por imágenes diagnósticas, el catéter fue retirado. Posteriormente, presentó una mejoría significa tiva y egresó del hospital al quinto día posoperatorio.
Conclusiones:
El diagnóstico de miotoxicidad por anestésicos locales es poco frecuente debido a que sus manifestaciones pueden estar enmascaradas por los síntomas habituales durante el periodo posoperatorio. Su identificación temprana es funda mental para disminuir el efecto negativo sobre la recuperación y la satisfacción del paciente. Dado que la magnitud del daño depende especialmente de la concentración y la duración de la exposición al anestésico local, es necesario implementar proto colos que permitan lograr un bloqueo efectivo con la menor concentración y volumen posible del medicamento.
Palabras clave: Analgesia; Artroplastia; Bupivacaína; Toxicidad
Introduction:
Regional anesthesia is widely used for postopera tive analgesia in total knee arthroplasty (TKA). Although it is a safe and effective procedure, serious complications may still develop. In the event of an unusual or torpid evolution, the possibility of local anesthetic-induced myotoxicity should be suspected.
Case presentation:
A 54-year old patient, American Society of Anesthesiologists (ASA) II, underwent TKA due to primary gonarthrosis.. The analgesic technique used was a femoral nerve block associated with continuous perineural infusion. 24 hours later, the patient's medical condition deteriorated presenting pain, edema, and functional limitation of the thigh of the operated extremity. The symptoms were suggestive of myotoxicity, confirmed with diagnostic images leading to the removal of the catheter. The patient experienced then a significant improvement and was discharged 5 days after surgery.
Conclusion:
The diagnosis of myotoxicity from local anes thetics is rare, since its manifestations may be masked by the usual symptoms of the postoperative period. Early identification of the condition is fundamental to reduce its negative impact on the patient's recovery and satisfaction. Since the scope of the damage depends particularly on the concentration and duration of the exposure to the local anesthetic agent, there is a need to implement protocols that enable an effective block with the lowest concentration and volume of the medication.
Keywords: Analgesia; Arthro plasty; Bupivacaine; Toxicity
Introducción
La miotoxicidad inducida por el uso de anestésicos locales inyectados directamente dentro o cerca del musculo esquelético en humanos, es una entidad reconocida en cirugía oftálmica, pero poco reportada y estudiada en el posoperatorio de una cirugía mayor.1 Sin embargo, ante el advenimiento de nuevas técnicas y la realización más frecuente de procedimientos de anestesia regional, el interés sobre esta, hasta ahora, inusual entidad ha sido creciente, ya que en ocasiones puede tener consecuencias importantes en la recuperación de la funcionalidad del paciente.
La anestesia regional es ampliamente usada para la analgesia posoperatoria en la Artroplastia de Reemplazo de Rodilla (ARR). Comúnmente se usa el bloqueo del canal de aductores (BCA) o del nervio femoral, ambos con igual eficacia analgésica y presencia de efectos adversos.2 A continuación, se describe un caso de miotoxicidad inducida por anestésicos locales (AL) asociada al bloqueo continuo de nervio femoral para el manejo de dolor posoperatorio en cirugía de ARR. Se discutirá la preva lencia, las manifestaciones clínicas y las estrategias de reducción de riesgos de la enfermedad.
Descripción del caso
Hombre de 54 años, 82 kg, American Society of Anesthesiol ogists (ASA) II, con antecedente de mielopatía cervical manejada con esteroides meses antes, y osteotomía cupuliforme desvarizante en tibia proximal derecha hace 2 años, con diagnóstico de gonartrosis primaria derecha grado IV, con marcada restricción funcional (Escala de Oxford 15/ 48), quien fue llevado a ARR. Como técnica analgésica se insertó, bajo guía ultrasonográfica y neuroestimulación con transductor lineal de alta frecuencia, un catéter femoral perineural (CFP) a través de aguja Touhy num. 18 con técnica fuera de plano, después de realizar hidrodisección de la vaina perineural con 15 ml de bupivacaína 0.5% más epinefrina 5 μ g/ml. Adicionalmente se realizó bloqueo del nervio ciático, dosis unica, en abordaje subgluteo con bupivacaína 0.5% 20 ml sinepinefrina, con guía ultrasonográfica y neuroestimulación con transductor curvo de baja frecuencia, mediante técnica en plano usando aguja estimulable de 100 mm. No se reportaron complicaciones durante el procedimiento anes tésico. La cirugía se completó después de 70 minutos bajo anestesia general, sin eventualidades. No se utilizó torni quete en el muslo del miembro inferior operado en el transoperatorio.
En la unidad de cuidado posanestésico (UCPA) se inició por el CFP, infusión de bupivacaína 0.125% a 6ml/h más 4 ml de bolo, con bloqueo de 30 minutos administrados a demanda por el paciente mediante un dispositivo de PCA (Patient Controlled Analgesia: analgesia controlada por el paciente). La evolución posoperatoria inmediata fue adecuada. Dur ante la evaluación en la mañana del primer día posoperatorio, la intensidad máxima del dolor fue de 4/10 en la Escala Verbal Numérica (EVN), y el consumo de la mezcla analgésica por la PCA fue de 118 ml. En la tarde del mismo día, 24 horas después de la cirugía, hubo aumento del dolor a nivel proximal del muslo de la extremidad operada asociado a edema progresivo y debilidad, que no mejoraba con el uso de la PCA. Durante la evaluación física se evidenció bloqueo motor proximal (fuerza del muslo 1/5 y pantorrilla 3/5 [escala de 5 puntos: 0 más débil, 5 más fuerte]), asociado a induración y dolor a la palpación de región proximal y media anterior del muslo. No se evidenciaron anomalías neurovasculares distales en la extremidad operada. Ante la severidad del cuadro se realizó una Resonancia Magnética Nuclear (RMN), donde se identificó extensa infiltración inflamatoria y hemática sobre el mu sculo vasto intermedio y burbujas de aire disecando los haces musculares, hallazgos compatibles conmiositis (Figuras 1 y 2).
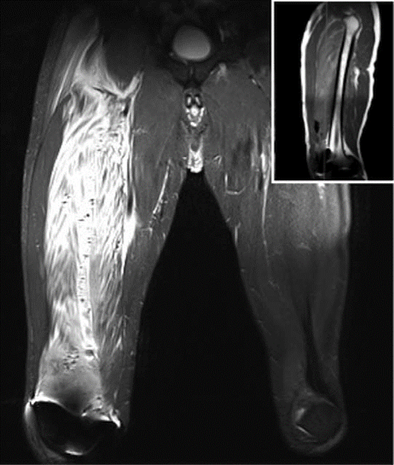
Fuente: Autores.
Figura 1 Vista coronal RNM STIR T2, aumento de señal sobre el mu sculo vasto intermedio (VIM). Vasto lateral y mu sculos aductores no están comprometidos. La imagen borrosa se ve sobre la rodilla derecha debido a la interferencia magnética.
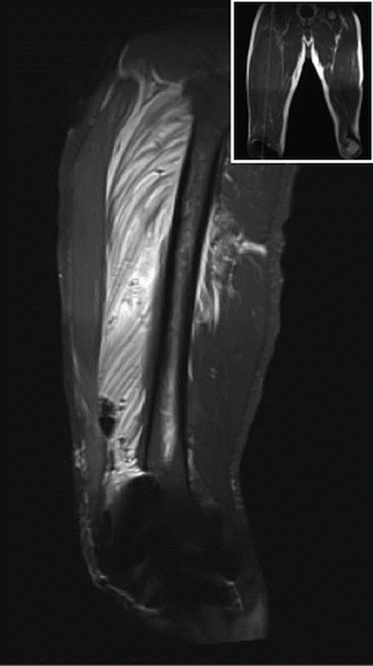
Fuente: Autores.
Figura 2 Vista sagital MRI STIR T2, señal intensa específica para VIM desde su origen a través de cuádriceps / tendón patelar. Burbujas de aire e infiltración diseccionan haces musculares.
Dada la sospecha de miotoxicidad inducida por el AL, el CPF fue retirado. El manejo analgésico se continuó con opioides fuertes. Luego de 24 horas el paciente presentó mejoría del 80% de los síntomas iniciales, con menor bloqueo motor y dolor, aunque persistía la induración y la limitación funcional. A las 48 horas se obtuvo una medición elevada de niveles séricos de Creatin-Fosfo Kinasa (CPK) 423UI/L sin insuficiencia renal. La disminución de la intensidad del dolor y del consumo de opioides fue progresiva. La fuerza del musculo cuádriceps mejoró gradualmente. El paciente fue dado de alta el quinto día posoperatorio con asistencia para caminar. 15 días después asistió a control sin dolor, con los arcos de movilidad de la rodilla conservados, sin cambios inflamatorios y sin limit aciones para la marcha. Un año después de la cirugía se realizó RMN de control, sin evidenciarse cambios por miositis u otras alteraciones musculo-tendinosas.
Discusión
El bloqueo del nervio femoral y del canal de aductores son técnicas analgésicas comúnmente usadas para la ARR, porque se consideran procedimientos seguros y con baja tasa de complicaciones. Sin embargo, la miotoxicidad por anestésicos locales en humanos es un fenómeno que ha tomado importancia en los últimos años. En la revisión sistemática realizada por Hussain et al., encontraron que los AL utilizados en concentraciones terapéuticas inducen daño miotóxico en estudios in vitro, ex vivo, in vivo yen humanos.3 Esta entidad fue reconocida y descrita desde 1959 por Brun, quien logró demostrar en modelos animales experimentales que la infiltración local de lidocaína a concentraciones del 0.25 al 2% en el musculo cutáneo máximo de ratones y conejos, producía regularmente inflamación y necrosis tisular.4 Benoit et al.5 identificaron que los modelos de injuria tisular son cualitativamente similares en animales y en humanos, y que el patrón de necrosis producido por la inyección intramuscular está directamente correlacionado con la concentración efectiva del anestésico al cual el mu sculo está expuesto, lo que, a su vez, depende de factores como el volumen y la concentra ción del anestésico local, la presencia de vasoconstrictor y el tamaño del mu sculo que recibe la inyección.
Los cambios histológicos documentados en estudios subsecuentes incluyen degeneración lítica del retículo sarcoplasmático y de la mitocondria de las células del mu sculo estriado, seguida de necrosis tisular y fagocito sis.6 El papel más importante en la fisiopatología de la enfermedad lo tienen las alteraciones de la bioenergética mitocondrial, el estrés oxidativo y la mitofagia.7 Las alteraciones funcionales y estructurales de las mitocondrias presentes en el tejido muscular están estrechamente relacionadas con la interacción de los AL.
En estudios realizados en ratas, encontraron que las inyecciones de alta concentración de bupivacaína (16mg/kg) en el mu sculo producía fibras inconexas, edema intersticial y células infiltrantes.8 En estudios más recientes se demostró que, con dosis más bajas inyectadas por un catéter del nervio femoral (2.5mg/kg), la bupivacaína inducía agregados sub-sarcolemales de mitocondrias edematizadas y pérdida parcial de mitocondrias interfibrilares, lo que resulta en inhibición significativa de la producción de Adenosin Tri fosfato (ATP). En cuanto a la mitofagia, en este mismo estudio encontraron que las mitocondrias intactas o degradadas son rodeadas por membranas que se consider aban autofagosomas, por lo que se sugirió la inducción de la mitofagia por bupivacaína.9
Los AL alteran la homeostasis del calcio, con efectos presentes en la entrada y en la movilización intracelular del mismo.10 Primero, inhiben la liberación temprana de Ca2+ (calcio) del retículo sarcoplásmico, regulada por el receptor de ryanodina (RyR), lo que causa limitación en los acoples actina-miosina; segundo, inducen liberación tardía de calcio del retículo sarcoplásmico al citosol,11,12 y por ultimo, inhiben el intercambiador Na+(sodio)/Ca2+ dependiente del gradiente y la bomba Na+/K+ (postasio) ATPasa, llevando a un aumento del calcio intracelular.3,7 Lo anterior genera contracción continua del musculo, daño celular, desacoplamiento mitocondrial y muerte celular por apoptosis, independiente de la concentración del anestésico local,11,12 posiblemente por alteración de la cadena de fosforilación y producción de ATP.
El grado de toxicidad de los AL en orden creciente es: lidocaína, ropivacaína y bupivacaína.13 Los dos factores más importantes que agravan los efectos miotóxicos son el aumento en la concentración y la duración de la exposición.14 Dentro de los factores de riesgo de severidad de la enfermedad se encuentran alteraciones previas del metabolismo mitocondrial con producción de energía comprometida, como por ejemplo en pacientes con hipoxia crónica, diabetes mellitus tipo 2, anemia, obesi dad, artropatía obliterante de miembros inferiores y tratamiento con estatinas.15,16
La miotoxicidad por AL en humanos fue inicialmente descrita en cirugía oftálmica con el uso de varias técnicas de anestesia regional,17 siendo la diplopía posoperatoria el síntoma más común.18 En una revisión sistemática reciente, se identificaron 234 de 44 478 pacientes (0.53%) con diplopía luego de cirugía oftálmica. También, en cirugía ortopédica se identificaron 9 pacientes de 6121 (0.14%) con debilidad y dolor como los síntomas de presentación más común de miotoxicidad luego de procedimientos de anestesia regional.3 Las manifestaciones clínicas de la enfermedad son inespecíficas y aparecen uno o dos días después de la inyección del AL.
El diagnóstico puede ser difícil de realizar, ya que es posible que en muchos de los pacientes que presentan algún grado de miotoxicidad los síntomas sean enmascarados por la debilidad y el dolor esperados por el procedimiento;2 sin embargo, la vigilancia, la sospecha y el juicio clínico son necesarios para identificar los casos en que la debilidad muscular y el dolor se extiende más allá del tiempo de recuperación de la cirugía. Esto motivaría el uso de ayudas diagnósticas, entre las cuales se encuentra la CPK sérica, que se eleva después del daño miotóxico. Sin embargo, su sensibilidad y especificidad aun no han sido determinadas.6 En cuanto al uso de imágenes, la RMN sin contraste se considera útil en el diagnóstico. Los hallazgos oscilan entre edema localizado, cambios inflamatorios y aumento de la intensidad de la señal ponderada en T2.19 No obstante, el diagnóstico definitivo es realizado con biopsia muscular.3
El tratamiento de la miotoxicidad por AL puede ser expectante, acompañado de terapia física dirigida, ya que la regeneración muscular puede ser completa dentro de 3 a 4 semanas,2 aunque existen casos en los cuales la recuperación no es total. Según Hussain et al., de 206 pacientes, 80 (38%) presentaron recuperación total y 126 (62%) presentaron recuperación parcial o ninguna, requir iendo intervenciones quirúrgicas o mecánicas.3 Estudios recientes sugieren que algunos fármacos antioxidantes reducen la miotoxicidad. Nouette-Gaulain et al. encon traron que el tratamiento previo con 5000UI/kg de eritropoyetina evitó parcialmente la miotoxicidad tanto en ratas como en mioblastos humanos cultivados. La dosis usada fue mayor a las utilizadas en la práctica clínica, y por ello requiere seguimiento estricto y evaluación continua, razón por la cual se limita su uso.12 La administración de N-acetil cisteína con bupivacaína también ha sido estudiada, especialmente en la inhibición de la producción de especies reactivas de oxígeno. Sin embargo, su impacto aún no ha sido medido en la práctica clínica. Estos medicamentos permanecen en el campo de investigación y aun se necesitan muchos estudios antes del uso clínico.20
La prevención de la toxicidad inducida por AL tiene como objetivo disminuir la incidencia y severidad de la enferme dad. Entre las principales medidas se encuentran: usar la mínima concentración de AL requerida para lograr el efecto deseado; limitar la duración de la exposición; usar otras alternativas para prolongar la duración del bloqueo; hacer una evaluación juiciosa e individualizada de los pacientes con factores de riesgo para miotoxicidad, y limitar el uso de bupivacaína en estos pacientes.14 Así mismo, el uso del ultrasonido como guía para el bloqueo del nervio periférico contribuye con la disminución de los volúmenes del anestésico local administrado.21,22 Es necesario que estas medidas sean adaptadas a los protocolos de analgesia posoperatoria para prevenir la enfermedad.
Para retomar el caso, la presentación clínica del paciente fue coherente con miotoxicidad inducida por AL por la evolución satisfactoria en el primer día del posoperatorio, seguida de debilidad, dolor a la palpación en el tercio proximal del muslo y edema. Por la alta sospecha de esta entidad, se realizó la medición de CPK, que resultó elevada. Adicionalmente, se obtuvo RMN compatible con miositis, por lo cual se decidió retirar el catéter. La biopsia muscular se descartó porque la evolución clínica del paciente fue satisfactoria. 12 horas después del retiro del catéter la mejoría de los síntomas iniciales fue de alrededor del 80%. El seguimiento se realizó a los 15 días, al mes y al año del posoperatorio, y se encontró recuperación completa gracias al diagnóstico oportuno. El cuadro fue compatible con lo reportado en una serie de casos1 luego del uso de bloqueo continuo de canal de aductores en ARR, donde se evidenciaron cambios similares en la RMN. Llamativa mente, solo 1 de los 3 casos reportados logró recuperación completa en los primeros 30 días.
La identificación reciente de estos casos hace sospechar una posible relación con el uso del BCA en los últimos años, a pesar de múltiples décadas previas en las que se usó la anestesia regional con altas dosis de AL para cirugía de miembro inferior.3 En contraste, este caso se presentó con el uso de bloqueo de nervio femoral en infusión continua, con gran compromiso del mu sculo vasto intermedio y un impacto importante en la recuperación del paciente.
La identificación oportuna del cuadro permite un abordaje específico hacia la disminución de la noxa y la facilitación de la recuperación funcional. Como diagnós tico diferencial, se consideró un síndrome compartimental posoperatorio23 del muslo debido a que comparte car acterísticas clínicas, como la presencia de parálisis, dolor y edema en el posoperatorio. Sin embargo, el dolor fuera de proporción predominante al estiramiento pasivo es la característica principal para la sospecha diagnóstica, siendo este caso diferente ante el predominio de ubicación de los síntomas en el área de inserción del catéter yregión proximal del muslo, y no en la región distal proximal a la herida quirúrgica. Adicionalmente, la ausencia de com promiso neurovascular distal desestimó esta posibilidad. La identificación del síndrome compartimental y su manejo posterior es indispensable, porque a pesar de la baja incidencia, es una complicación importante que potencialmente amenaza la vida y la extremidad,24 por la necesidad imperiosa de descompresión quinurgica en las primeras 6 horas para contrarrestar el daño muscular por isquemia y disminuir la severidad de la lesión.
Conclusión
La miotoxicidad inducida por anestésicos locales está comprobada en estudios en células animales y humanas. La dimensión del daño depende especialmente de la concentración y la duración de la exposición al anestésico local, así como la presencia de factores de riesgo individuales. A pesar de que es una patología poco frecuente, se debe tener en cuenta como una posible complicación después de bloqueos regionales para la ARR, porque influye de manera negativa en la recuperación y satisfacción del paciente. Por esto se deben adoptar protocolos que permitan lograr un bloqueo efectivo con la menor concentración y volumen posible del medica mento. El uso de agentes antioxidantes durante el protocolo de anestesia debe ser estudiado en la práctica clínica.
REFERENCIAS
1. Neal JM, Salinas FV, Choi DS. Local anesthetic-induced myotoxicity after continuous adductor canal block. Reg Anesth Pain Med 2016;41:723-727. [ Links ]
2. Hussain N, Ferreri TG, Prusick PJ, et al. Adductor canal block versus femoral canal block for total knee arthroplasty: a meta-analysis: what does the evidence suggest? Reg Anesth Pain Med 2016;41: 314-320. [ Links ]
3. Hussain N, McCartney CJL, Neal JM, et al. Local anaesthetic-induced myotoxicity in regional anaesthesia: a systematic review and empirical analysis. Br J Anaesth 2018;121:822-841. [ Links ]
4. Brun A. Effect of procaine, carbocain and xylocaine on cutaneous muscle in rabbits and mice. Acta Anaesthesiol Scand 1959;3:59-73. [ Links ]
5. Benoit PW, Yagiela A, Fort NF. Pharmacologic correlation between local anesthetic-induced myotoxicity and disturbances of intra-cellular calcium distribution. Toxicol Appl Pharmacol 1980;52:187-198. [ Links ]
6. Yagiela JA, Benoit PW, Buoncristiani RD, et al. Comparison of myotoxic effects of lidocaine with epinephrine in rats and humans. Anesth Analg 1981;60:471-480. [ Links ]
7. Nouette-Gaulain K, Jose C, Capdevila X, et al. From analgesia to myopathy: when local anesthetics impair the mitochondrion. Int J Biochem Cell Biol 2011;43:14-19. [ Links ]
8. Duguez S, Feasson L, Denis C, et al. Mitochondrial biogenesis during skeletal muscle regeneration. Am J Physiol Endocrinol Metab 2002;282:E802-E809. [ Links ]
9. Nouette-Gaulain K, Sirvent P, Canal-Raffin M, et al. Effects of intermittent femoral nerve injections of bupivacaine, levobupivacaine, and ropivacaine on mitochondrial energy metabolism and intracellular calcium homeostasis in rat psoas muscle. Anesthesiology 2007;106:1026-1034. [ Links ]
10. Nouette-Gaulain K, Capdevila X, Rossignol R. Local anesthetic "in-situ" toxicity during peripheral nerve blocks: update on mechanisms and prevention. Curr Opin Anaesthesiol 2012;25:589-595. [ Links ]
11. Irwin W, Fontaine E, Agnolucci L, et al. Bupivacaine myotoxicity is mediated by mitochondria. J Biol Chem 2002;277:12221-12227. [ Links ]
12. Nouette-Gaulain K, Bellance N, Prevost B, et al. Erythropoietin protects against local anesthetic myotoxicity during continuous regional analgesia. Anesthesiology 2009;110:648-659. [ Links ]
13. Cereda CMS, Tofoli GR, Maturana LG, et al. Local neurotoxicity and myotoxicity evaluation of cyclodextrin complexes of bupivacaine and ropivacaine. Anesth Analg 2012;115:1234-1241. [ Links ]
14. Werdehausen R, Braun S, Essmann F, et al. Lidocaine induces apoptosis via the mitochondrial pathway independently of death receptor signaling. Anesthesiology 2007;107:136-143. [ Links ]
15. Zink W, Graf BM. Local anesthetic myotoxicity. Reg Anesth Pain Med 2004;29:333-340. [ Links ]
16. Nouette-Gaulain K, Forestier F, Malgat M, et al. Effects of bupivacaine on mitochondrial energy metabolism in heart of rats following exposure to chronic hypoxia. Anesthesiology 2002;97:1507-1511. [ Links ]
17. Gomez-Arnau JI, Yanguela J, Gonzalez A, et al. Anaesthesia-related diplopia after cataract surgery. Br J Anaesth 2003;90:189-193. [ Links ]
18. Jeng CL, Torrillo TM, Rosenblatt MA. Complications of peripheral nerve blocks. Br J Anaesth 2010;05 suppl:i97-i107. [ Links ]
19. Hogan Q, Dotson R, Erickson S, et al. Local anesthetic myotoxicity: a case and review. Anesthesiology 1994;80:942-947. [ Links ]
20. Galbes O, Bourret A, Nouette-Gaulain K, et al. N-Acetylcysteine protects against bupivacaine-induced myotoxicity caused by oxidative and sarcoplasmic reticulum stress in human skeletal myotubes. Anesthesiology 2010;113:560-569. [ Links ]
21. Marhofer P, Harrop-Griffiths W, Kettner SC, et al. Fifteen years of ultrasound guidance in regional anaesthesia: Part 1. Br J Anaesth 2010;104:538-546. [ Links ]
22. Rojas-Gómez MF, Bonilla RAJ. Perioperative ultrasound: the challenge of applying an old technology in new clinical settings. Colombian Journal of Anesthesiology 2016;44:267-269. [ Links ]
23. Vegari DN, Rangavajjula AV, DiIorio TM, et al. Fasciotomy following total knee arthroplasty: beware of terrible outcome. J Arthroplast 2014;29:355-359. [ Links ]
24. Shaath M, Sukeik M, Mortada S, et al. Compartment syndrome following total knee replacement: a case report and literature review. World J Orthop 2016;7:618-622. [ Links ]
Cómo citar este artículo: Dorado-Velasco FC, Loaiza-Ruiz DM, Llinás-Hernández PJ, Huependo GAH. Miotoxicidad inducida por bupivacaína durante un bloqueo continuo del nervio femoral: reporte de caso. Case-control study. Colombian Journal of Anesthesiology. 2020;48:169-173.
Copyright © 2020 Sociedad Colombiana de Anestesiología y Reanimación (S.C.A.R.E.). Published by Wolters Kluwer. This is an open access article under the CC BY-NC-ND license (https://creativecommons.org/licenses/by-nc-nd/4.0/).











 texto em
texto em 


