Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347On-line version ISSN 2256-2087
Rev. colomb. anestesiol. vol.50 no.2 Bogotá Jan./June 2022 Epub May 24, 2022
https://doi.org/10.5554/22562087.e971
REVISIÓN NARRATIVA
Ventilación mecánica en pacientes con SARS - CoV-2: estado del arte
a Grupo de Investigación en Medicina Crítica y Cuidados Intensivos (GIMCCI), Universidad Tecnológica de Pereira. Pereira, Colombia.
b Programa de posgrado en Medicina Crítica y Cuidados Intensivos, Universidad Tecnológica de Pereira. Pereira, Colombia.
c Facultad de Ciencias de la Salud, Programa de Medicina. Universidad Tecnológica de Pereira. Pereira, Colombia.
La infección asociada a COVID-19 produce una patología de comportamiento aún desconocido, planteándole diversos desafíos al clínico. Para esta revisión narrativa se llevó a cabo una extensa búsqueda basada en artículos de revisión sobre la infección por SARS-CoV-2 y estudios que incluían estrategias de manejo con ventilación mecánica. El tratamiento basado en evidencia para la infección por SARS-CoV2 todavía está en desarrollo. Tenemos algunas herramientas basadas en nuestros conocimientos de experiencias en el pasado que indican que se debe usar un abordaje escalonado, sin descuidar otras medidas terapéuticas conjuntas para mejorar los desenlaces clínicos de una condición con una elevada mortalidad. Las actuales recomendaciones indican que los pacientes con falla respiratoria aguda por SARS-CoV-2 deben manejarse con medidas de protección con ventilación mecánica. Aún no tenemos una sólida evidencia sobre la individualización del tratamiento con ventilación mecánica, de acuerdo a los distintos fenotipos.
Palabras clave: SARS-CoV-2; Coronavirus; Síndrome de dificultad respiratoria aguda; Cuidado crítico; Ventilación mecánica; SARS
CoVID-19-associated infection leads to a pathology of yet unknown clinical behavior, confronting the clinician with various challenges. An extensive search was conducted based on review articles on SARS-CoV-2 infection and studies including mechanical ventilation management strategies in order to complete this narrative review. Evidenced-based treatment for SARS-CoV2 infection is still in the works. We have some tools from our knowledge from past experiences indicating that a step-wise management approach should be used, without neglecting other joint therapeutic measures for improved clinical outcomes of a condition with a high mortality. The current recommendations indicate that patients with severe acute respiratory failure due to SARS-CoV-2 should be managed with protective mechanical ventilation measures. No strong evidence is yet available on the individualization of mechanical ventilation therapy according to phenotypes.
Keywords: SARS-CoV-2; Coronavirus; Acute respiratory distress syndrome; Critical care; Mechanical ventilation; SARS
INTRODUCCIÓN
La infección por SARS-CoV-2 es responsable de la actual pandemia que ha causado muchas muertes en el mundo 1 en virtud de su alto nivel de contagio. 2 Aproximadamente un 14% desarrolla una enfermedad severa que requiere hospitalización y soporte con oxígeno 3; el diagnóstico más frecuente en los pacientes severos es la neumonía severa, con progresión hacia el Síndrome de Dificultad Respiratoria Aguda (SDRA) hasta en un 30% de los casos 4, el cual ha requerido manejo con ventilación mecánica en las unidades de cuidados intensivos (UCI). 5
La enfermedad severa por SARS-CoV-2 se describió inicialmente en China 6, donde se identificaron 1099 pacientes, de los cuales un pequeño porcentaje desarrolló el síndrome de dificultad respiratoria aguda (SDRA), choque séptico y falla multiorgánica. A estos pacientes se les trató con ventilación mecánica invasiva y no invasiva, y oxigenación por membrana extracorpórea (ECMO). El estudio de cohorte7 evidenció una alta carga de la enfermedad y los pacientes requirieron manejo en la UCI en virtud de su edad (> 60 años), por la presencia de comorbilidades tales como hipertensión (31,2% de los casos), enfermedad cardiovascular (14,5%), diabetes (10,1%), entre otras. El puntaje SOFA indica una disfunción fisiológica aguda significativa, con función pulmonar comprometida y PAO2/FIO2 moderado a severo, de acuerdo con la clasificación del SDRA de Berlín. Sin embargo, el comportamiento del SDRA en pacientes con SARS-CoV-2 es desconcertante (Imagen 1), y difiere de la definición establecida. 8 El comportamiento es atípico para el día 8 después del inicio de la infección y hasta un 50% de los casos presentan distensibilidad pulmonar normal, lo cual ha generado duda razonable sobre si estamos frente a un SDRA atípico, que es cada vez más frecuente en pacientes jóvenes. 9-13
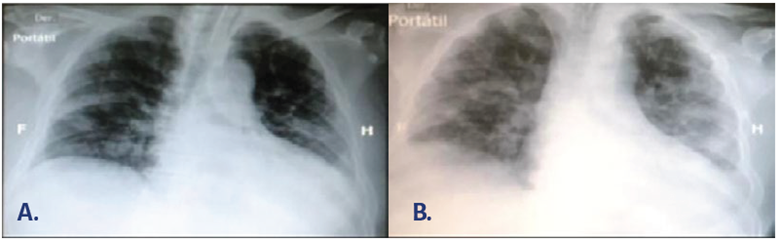
FUENTE: Autores.
IMAGEN 1 Pacientes con falla respiratoria hipoxémica aguda confirmatoria de infección por SARS-CoV2. A. Fenotipo L. B. Fenotipo H.
Desde el punto de vista histopatológico, el SDRA es una condición heterogénea. 14,15 Se ha descrito daño alveolar difuso durante la fase de organización en el caso de la infección por SARS-CoV-2 16, además de fenómenos de micro y macro trombosis asociados al proceso respiratorio producido por el virus, que lleva a una fisiopatología hipoxémica. Esto también pudiera relacionarse con la descripción de los fenotipos, fenómenos multisitémicos y procesos pro-inflamatorios probablemente asociados al síndrome de disfunción multiorgánica y desenlaces fatales. 17 El Dr. Gattinoni describe 2 fenotipos diferentes que pueden presentarse dinámicamente en el mismo paciente: un fenotipo bajo, que representa entre el 70- al 80% de los casos, caracterizado por un bajo índice V / Q, pocas opacidades en las imágenes del tórax, bajo peso pulmonar y baja elastancia / alta distensibilidad. El otro fenotipo alto menos frecuente es exactamente lo contrario, caracterizado por cortocircuito de derecha a izquierda, opacidades en los cuatro cuadrantes en las imágenes del tórax - el llamado "pulmón blanco" -, alta elastancia / baja distensibilidad, y alto peso del pulmón. A pesar de que el comportamiento clínico y los fenómenos fisiopatológicos responsables de cada fenotipo son diferentes, ambos pueden presentar hipoxemia severa y por ende requerir un abordaje terapéutico diferente. 18,19
¿CUÁLES ESTRATEGIAS DE VENTILACIÓN MECÁNICA ESTÁN DISPONIBLES PARA LOS PACIENTES CON SARS-COV-2?
La infección por SARS-CoV-2 es una nueva patología, por lo cual apenas se está desarrollando la evidencia y aún no contamos con un abordaje terapéutico correcto. Los principios de la ventilación mecánica son mejorar el intercambio gaseoso, disminuir el trabajo respiratorio del paciente y ganar tiempo mientras se reestablece la fisiología respiratoria y sistémica. La decisión acerca de ventilar el paciente dependerá de múltiples factores que los clínicos deben sopesar en un determinado momento, y de la condición clínica actual del paciente 20 (GRADO - Bajo nivel de evidencia; recomendación condicionada). Los pacientes con infección por SARS-CoV-2, y en general todos los pacientes críticos, padecen de una condición dinámica que puede cambiar abruptamente; por lo tanto, cualquier intervención y decisión cambia constantemente.
Ventilación mecánica no invasiva (VNI) y cánula nasal de alto flujo (CNAF)
Durante una pandemia se describen estrategias adicionales a la ventilación mecánica. 21 No se recomienda la ventilación mecánica no invasiva en las guías de manejo para pacientes con COVID-19, hipoxémicos y en falla respiratoria, debido al alto riesgo de transmisión y dispersión de partículas 22,23; no obstante, un documento basado en la experiencia con el brote de COVID-19 en China resalta el uso de ventilación mecánica no invasiva, en pacientes con SDRA y PAO2/FIO2 > 150 mmHg. 24 Este abordaje se debe restringir a las unidades en donde estén hospitalizados solamente pacientes sospechosos o confirmados de COVID-19, siempre y cuando haya adecuada ventilación o presión negativa, no haya fugas en la interface (es obligatorio el uso de una mascarilla facial completa) y el personal del área debe utilizar medidas de protección adecuadas contra aerosoles. Cuando esto no sea posible, es preferible el uso de la ventilación mecánica con intubación orotraqueal. 25
Algunos estudios reportan el uso de cánulas de alto flujo (60L/min) para pacientes con neumonía severa, utilizando una máscara quirúrgica sobre la interface para evitar la aerosolización. Algunos artículos describen un bajo riesgo de aerosolización y sugieren su uso en casos seleccionados. 26
Varios reportes en la literatura indican el uso de la posición prona despierto, en pacientes con SDRA leve a moderada y los resultados han sido alentadores en términos de mejora en los parámetros de oxigenación y menores tasas de intubación 27; sin embargo, la evidencia a la fecha no es concluyente para apoyar estas estrategias en un manejo generalizado. Lo que está claro es que los pacientes que no necesitan intubación, no deben intubarse precozmente 28, pero tampoco debe demorarse la intubación en aquellos pacientes con la posibilidad de desarrollar complicaciones. 29
En ciertas circunstancias, la cánula nasal de alto flujo (CNAF) y la ventilación no invasiva (VNI) pueden fallar, y entonces deberá considerarse la intubación temprana: 24
Ventilación mecánica invasiva
Las indicaciones para intubación orotraqueal son las mismas que para los pacientes con falla respiratoria por otras causas 30; en particular, en el paciente con SARS-CoV2, la decisión dependerá en gran medida de sus síntomas clínicos. Ha habido casos de hipoxemia silente 31, hipoxemia rápida y manejo refractario con oxígeno de alto flujo, sin manifestaciones adicionales. Es importante mencionar que una de las indicaciones más importantes para iniciar la ventilación mecánica es el aumento del trabajo respiratorio, puesto que el esfuerzo respiratorio vigoroso en un paciente con una lesión pulmonar establecida, puede llevar al desarrollo de autolesión pulmonar o P-SILI (por sus siglas en inglés). 32
Considere la intubación traqueal si el paciente presenta:
Aumento del trabajo respiratorio
Taquipnea persistente > 30 rpm
Hipoxemia refractaria: saturación de O2 <90% a pesar de suplementación con oxígeno (FiO2 ≥50%)
Falla respiratoria aguda
Criterios de shock
Estado de conciencia alterado
Si se considera que la suplementación es una opción, deberá realizarse lo antes posible, de lo contrario el paciente puede deteriorarse rápidamente. 24,33
La ventilación mecánica no es un tratamiento como tal; se considera una estrategia terapéutica dirigida a ganar tiempo hasta que los síntomas se resuelvan y es parte de las herramientas de manejo que incluyen una estrategia individualizada y conservadora de líquidos, el uso de bloqueadores neuromusculares, sedación, nutrición, control de la glucemia, uso de esteroides, y terapias farmacológicas experimentales. 29 Se recomienda el uso de una estrategia de ventilación mecánica individualizada. 34,35 El estudio del Dr. Gattinoni recomienda iniciar con una estrategia individualizada de ventilación mecánica, de acuerdo con el fenotipo. El fenotipo bajo pudiera exigir una estrategia de volumen corriente de 8-9 mL / Kg del peso ideal, PEEP 8-10 cmH2O, uso de la maniobra de pronación de rescate, uso de monitoreo hemodinámico y ventilatorio, sin olvidarse de los pacientes con metas de bajo reclutamiento y oxigenación entre 92-96%. Por el contrario, el fenotipo alto puede beneficiarse de un volumen corriente de 6 mL / Kg, PEEP > 10cmH2O, pronación obligatoria; estos son pacientes con una alta probabilidad de reclutamiento y su compromiso pulmonar genera una menor saturación de oxígeno, que oscila entre 88-92%. 18 Estas son apenas algunas recomendaciones de los expertos en el mencionado estudio, pero la evidencia no es lo suficientemente sólida. Un estudio publicado en Lancet en 2019 concluyó que la estrategia de ventilación mecánica personalizada, de acuerdo con el tipo de SDRA, focal o difuso, no marcaba ninguna diferencia en mortalidad. Personalizar la ventilación mecánica no disminuyó la mortalidad en SDRA, posiblemente debido a la clasificación equivocada de un 21% de los pacientes en el estudio. Por lo tanto, es necesario llevar a cabo otros estudios en esta área. 36 El manejo del SDRA en el paciente con infección por SARS-CoV-2 se extrapola de las guías de manejo para el SDRA por otras causas. 37,38
¿CUÁLES ESTRATEGIAS TERAPÉUTICAS TIENEN LA EVIDENCIA MÁS SÓLIDA EN PACIENTES CON COVID-19 SDRA ("CSDRA")?
El conocimiento de las estrategias de ventilación para la infección por SARS-COV2 se extrapola fundamentalmente de la evidencia acumulada en SDRA.
El tratamiento basado en evidencia para la infección por SARS-COV2 aún está siendo dilucidado.
Ventilación mecánica de protección
La ventilación mecánica de protección se define como ventilación en la cual el volumen corriente es bajo, es decir 6 mL / Kg del peso ideal, para mantener una presión meseta (Pplat) <28 cmH20 y una presión de conducción (PC) <15 cmH2O39, (GRADO; recomendación fuerte; nivel de evidencia moderado 1B), que impacta la mortalidad en este escenario clínico. 40 El punto de partida debe ser FIO2 100% y disminuir cada 20-30 minutos de 5 en 5%, monitoreando la condición clínica del paciente, evitando la hiperoxia por sus efectos tóxico y perjudiciales. 41,42 El volumen corriente debe calcularse en base al peso ideal; la fórmula para hombres es 50 + 0,91 (talla -152,4); y para mujeres es de 45,5 + 0,91 (talla -152,4). 43
El objetivo de la ventilación de protección no es corregir el trastorno de los gases en sangre, sino reducir el riesgo de lesión pulmonar inducida por el ventilador (VILI por sus siglas en inglés). Los pacientes generalmente no toleran esos volúmenes tan bajos, así que en general, es necesario el uso de sedación y bloqueadores neuromusculares para evitar asincronía del ventilador, que puede empeorar el daño pulmonar. 44
La recomendación es fijar la frecuencia respiratoria en 20-25 respiraciones / min, el tiempo de inspiración en el modo controlado por volumen debe ser de 0,7 - 0,8 segundos para evitar disminuir el flujo inspiratorio, puesto que son inversamente proporcionales (Flujo = Volumen/tiempo); no obstante, en el modo controlado por presión, debe ser de alrededor de 1 segundo, para garantizar que la presión alveolar al final de la inspiración llegue a la presión programada y se entregue un volumen corriente de 6 ml / Kg, permitiendo un llenado y vaciado alveolar adecuado, tomando en consideración las constantes de tiempo para evitar la auto-PEEP.45
Ventilación controlada por presión vs. Ventilación controlada por volumen
No se han reportado diferencias entre la ventilación mecánica controlada por volumen versus controlada por presión. 46,47 En el contexto de la infección por SARS-CoV-2, se recomienda monitorear la ventilación mecánica para evaluar el mejor modo y la mejor estrategia de ventilación. 48, 49 Dada la necesidad de monitorear la ventilación mecánica, es preferible el modo controlado por volumen con onda de flujo constante o cuadrada.
No se encontraron diferencias entre los modos controlado por presión o controlado por volumen en términos de distensibilidad, intercambio gaseoso, variables hemodinámicas, trabajo respiratorio, mortalidad o permanencia en la UCI, en pacientes ventilados con síndrome de dificultad respiratoria aguda. 46
La falta de grandes estudios aleatorizados en SARS-CoV-2 limita nuestros conocimientos para decidir cuál modo de ventilación debe usarse y la evidencia aún está en proceso de desarrollo. Inicialmente, los pacientes con hipoxemia severa y distensibilidad promedio llamaron nuestra atención y sugirieron diferentes fenotipos. Más tarde, a medida que progresó la enfermedad, se identificó su similitud con el síndrome de dificultad respiratoria aguda típico, con distintas características mecánicas que se explican por la evolución natural de la enfermedad. La recomendación es adherirse a la evidencia que muestra buenos resultados en pacientes con SDRA, proporcionando ventilación de protección y presión positiva al final de inspiración individualizada, independientemente del modo de ventilación seleccionado. 50
Considerando que la literatura no reporta superioridad de un modo de ventilación sobre el otro, la decisión deberá tomarse en base a diferentes consideraciones, tales como la condición del paciente a lo largo de la evolución de la enfermedad y las características específicas del sistema respiratorio (que son dinámicas); la experiencia del personal de salud con un determinado modo de ventilación, que permita la adecuada sincronización paciente - ventilador, hasta que se recupere el pulmón, con el menor daño posible asociado a la programación de la ventilación mecánica invasiva.
Posición prona
No se recomienda la pronación en todos los pacientes con SDRA. Las guías recomiendan el uso de la posición prona durante al menos 12 horas al día en casos de SDRA moderada a severa (Pao2/Fio2 <150 mmHg GRADO: fuerte recomendación; evidencia modera a alta 1A-B) 51
El estudio PROSEVA mostró una reducción en la mortalidad con 16 horas consecutivas de pronación durante 4 días, en SDRA moderado / severo. 52 Varios meta-análisis apoyan la pronación es este contexto clínico, especialmente por más de 12 horas y asociado a estrategias de ventilación mecánica de protección. 53,54
Debe considerarse su beneficio sustancial en el contexto de un riesgo significativo de desarrollar eventos adversos (desplazamiento de la sonda endotraqueal, úlceras por presión y pérdida del acceso venoso), a pesar de que la evidencia fue baja o muy baja, para respaldar estos hallazgos. 55
La terapia prona empieza con un protocolo específico, idealmente de 12 a 16 horas y su continuidad dependerá de la respuesta del paciente. No existe una duración estándar para la pronación, puesto que los estudios tienen diferentes períodos de duración que van desde 4 a 7 días. Otros sugieren su descontinuación de acuerdo con la respuesta al número de sesiones, que suele ser variable. 55,56 De acuerdo con la literatura, una respuesta favorable a la pronación en las primeras horas es un predictor de éxito, pero la falta de respuesta inicial no descarta el éxito de la intervención. 56
Se descontinúa la posición prona en caso de una respuesta favorable definida por PAO2/FIO2 > 150mmHg durante al menos 4 horas en posición supina, después de una sesión de pronación con un PEEP < 10cmH2O y FIO2 <60%. 52 En el estudio PROSEVA, se debe considerar descontinuar la terapia de pronación cuando el paciente presenta un deterioro de la oxigenación (disminución en PAO2/FIO2 > 20% en posición supina, si se presenta una extubación accidental, disminución sostenida de la oxigenación durante 5 minutos (SatO2 < 85% o PaO2 < 55mmHg con FIO2 100 %), inestabilidad hemodinámica o paro cardio-respiratorio en posición prona; no existen recomendaciones específicas sobre reanimación cardiopulmonar-cerebral, aún cuando algunos reportes de casos indican que es posible iniciarla en posición prona durante los primero ciclos y luego proceder a colocar al paciente en posición supina para continuar con la reanimación. 57
La falta de estudios aleatorizados grandes en SARS-CoV-2 limita nuestro conocimiento sobre la pronación. Algunos estudios retrospectivos confirman los beneficios de la pronación en este subgrupo de pacientes, pero se necesita más evidencia. 58-59
Alto peep versus bajo peep.
La ausencia de grandes estudios aleatorizados en SARS-CoV-2 restringe el conocimiento sobre el PEEP. La evidencia es de baja calidad para respaldar el uso de estrategias con un PEEP más alto en SDRA moderado a severo (condicionada). Hay inconsistencias debido a diferencias en los resultados de los estudios en términos de la heterogeneidad de la estrategia para establecer el nivel de PEEP, mientras que algunos estudios compararon la ventilación con volumen corriente más bajo como parte de una estrategia del ventilador que incluía menores niveles y alto PEEP. La recomendación de considerar un PEEP más alto en SDRA moderado se basa en datos de pacientes individuales y de subgrupos. El riesgo de barotrauma no puede descartarse porque no se ha cuantificado en esta población. 51 Un estudio reciente concluyó que en el caso de pacientes con SDRA que respondían a un incremento del PEEP con mejor oxigenación, podría reducirse la mortalidad hospitalaria y en la UCI a los 28 días, sin incrementar el riesgo de barotrauma documentado clínicamente. 51 Un nuevo documento de opinión de expertos indicó que para pacientes con SARS-CoV-2, debían limitarse los niveles de PEEP a 8-10 cmH2O, puesto que niveles más altos no aumentarían la distensibilidad pulmonar e impactan negativamente el retorno venoso, produciendo más daño que beneficio. El ecocardiograma a la cabecera del paciente pudiera ser útil para evaluar la función cardiaca derecha, a la vez que se manejan los aumentos del PEEP. 61
De acuerdo con el consenso colombiano de SDRA, el abordaje inicial para el PEEP debe guiarse por la tabla PEEP / FIO2 (GRADO: fuerte recomendación; nivel de evidencia moderado 1B). 62,63 Otros métodos de titulación del PEEP incluyen la curva de volumen - presión, la mejor distensibilidad, el índice de estrés (=1), la presión transpulmonar, o la mejor presión de conducción guiada por imágenes (CT, ultrasonido). (61) El consenso sugiere el uso de la presión de conducción para la titulación del PEEP (GRADO: nivel de evidencia moderado; recomendación débil 2B). El PEEP no debe ser ni demasiado alto (produce sobredistensión y aumento del espacio muerto), ni demasiado bajo (produce des-reclutamiento y atelectrauma). La titulación del PEEP debe evitar los aumentos de la presión meseta, garantizando así la disminución de la presión de conducción. 24
Si está disponible, se sugiere el uso de capnografía volumétrica para la titulación del PEEP en SDRA moderado a severo (GRADO: bajo nivel de evidencia; recomendación muy débil 2C). 63 No hay evidencia concluyente sobre la capnografía volumétrica en COVID-19.
Maniobras de reclutamiento
Hay poco conocimiento sobre las maniobras de reclutamiento debido a la falta de grandes estudios aleatorizados en SARS-CoV-2. Las maniobras de reclutamiento alveolar (MRA) no deben usarse de rutina en el SDRA (GRADO; fuerte recomendación en contra). 37 En casos de des-reclutamiento (debido a aspiración endotraqueal, desconexión) o hipoxemia refractaria, a pesar de optimizar el tratamiento, pueden realizarse maniobras de reclutamiento alveolar. 64 Existen múltiples maniobras de reclutamiento alveolar; sin embargo, la evidencia indica que no hay una sola maniobra que sea superior a otra. 65 No todos los pacientes con SDRA son potencialmente reclutables, ni responden al reclutamiento; esta variabilidad se debe a diferentes factores 66, tales como la causa del SDRA (más alta en SDRA secundario o de origen extrapulmonar) 67, la fase evolutiva (temprana)68, la posición del paciente (más alta en pronación debido al aumento de la presión transpulmonar en la región dorsal y mejor intercambio gaseoso) 67, manejo vasoactivo 69 (los cambios en el gasto cardiaco y en la distribución del flujo sanguíneo pulmonar teóricamente afectan la respuesta a la maniobra), capacidad de expansión torácica (no son efectivas en pacientes con una capacidad de expansión torácica reducida), y parámetros del ventilador previamente programados70,71 (bajo volumen corriente, alto PEEP; puesto que las MRA probablemente comienzan a partir de un pulmón reclutado). Los estudios no establecen criterios específicos para definir una respuesta positiva de las MRA. De acuerdo con Grasso 68, los respondedores a las maniobras son pacientes en quienes el PAO2/ FIO2 aumenta al menos 50% después de la maniobras, mientras que Villagrá70 y Girgis72 definen a los respondedores como pacientes con un incremento del 20% del PAO2/ FIO2 . Borges 73 reporta una respuesta positiva cuando PaO2 / FiO2 > 350, con una masa tisular pulmonar colapsada de menos del 5%. Los estudios definen la respuesta en términos de mecánica pulmonar, analizando el efecto de la maniobra sobre parámetros tales como distensibilidad pulmonar. 66
La evidencia en términos de mejoramiento de los desenlaces clínicos de las MRA es controversial. Un meta-análisis reciente concluyó que las MRA pueden mejorar la oxigenación, pero pareciera que no mejoran la sobrevida. 65
El reclutamiento pulmonar en SARS-CoV-2 puede evaluarse a la cabecera del paciente, incluso en escenarios muy restringidos. Un estudio observacional afirma que la reclutabilidad del pulmón fue baja en 12 pacientes con COVID-19 y SDRA, y el alternar la posición corporal mejoró la reclutabilidad. Un nuevo índice basado en la mecánica para cuantificar directamente el potencial de reclutamiento del pulmón es el índice de reclutamiento a inflación (R/I) que oscila entre 0 a 2,0; entre más alto en índice R/I, mayor el potencial de reclutamiento pulmonar. Un índice R/I de 1,0 sugiere una alta probabilidad de reclutamiento. Estos hallazgos no implican que todos los pacientes con SDRA asociada a SARS-CoV-2 tengan pobre reclutabilidad y tanto la severidad como el manejo de estos pacientes puede variar notablemente, dependiendo de la región. 74
Los clínicos en Wuhan decidieron utilizar sistemáticamente esta medida de reclutamiento en una serie de pacientes con CoV-2 asociado a SDRA, y evaluar el efecto de posicionamiento corporal. 74 Se necesitan más estudios aleatorizados con muestras más grandes para definir la mejor maniobra de reclutamiento y las indicaciones específicas en este grupo de pacientes.
Bloqueadores neuromusculares
El estudio ACURASYS 75 mostró una menor mortalidad en SDRA con un PaO2 / FIO2 < 150 mmHg con el uso temprano de una infusión de 48 horas de cisatracurio y sedación profunda versus sedación solamente. No está claro por qué el mecanismo del bloqueo neuromuscular resulta beneficioso. La falta de estudios aleatorizados grandes en SARS-CoV-2 es una limitación para nuestro entendimiento de los bloqueos neuromusculares.
El estudio ROSE 76 encontró que no había diferencia significativa en la mortalidad a 90 días entre los pacientes que recibían infusión temprana y continua de cisatracurio. Las guías no sugieren el uso de bloqueadores neuromusculares para todos los pacientes con SDRA (GRADO: recomendación débil en contra). Se sugiere el uso de una infusión continua de belisato de cisatracurio por 48 horas en SDRA temprano moderado a severo (PAO2/FIO2 <150 mmHg GRADO: recomendación débil a favor)37. Los bloqueadores neuromus-culares pueden disminuir el barotrauma y la estancia hospitalaria. 77,78 Una revisión de 2018 79 encontró que no había diferencia entre los agentes de bloqueo neuromuscular vecuronio versus cisatracurio. Su uso es especialmente notorio en asincronía paciente-ventilador y PAO2/FIO2 <120mmHg80.
Un estudio observacional multicéntrico con 407 pacientes con COVID-19 y SDRA moderado a severo, encontró que se con frecuencia utilizaban los agentes de bloqueo neuromuscular, más allá de los tiempos recomendados; sin embargo, luego de hacer los ajustes por factores de confusión, no hubo diferencia porcentual en las tasas de extubación de acuerdo con la duración del bloqueo. 81
¿CUÁLES ESTRATEGIAS DE RESCATE SE HAN ESTUDIADO?
Los pacientes con SDRA según una estrategia de ventilación mecánica de protección pueden desarrollar hipercapnia e impactar los desenlaces clínicos y aumentar la mortalidad. 82-85 El conocimiento sobre las estrategias ventilatorias en infección por SARS-COV2 se extrapola de la evidencia acumulada en SDRA. El manejo es individualizado y las estrategias pueden incluir aumentar el volumen o la frecuencia respiratoria, de acuerdo con la tolerancia y los dispositivos extracorpóreos para eliminación del CO2 (ECCO2R) en el contexto clínico del paciente. 86
ECMO
La oxigenación con membrana extracorpórea veno-venosa es una terapia de rescate en SDRA severo, con hipoxemia potencialmente reversible, pero refractaria a terapias convencionales. 37,87,88 La falta de estudios aleatorizados grandes en SARS-CoV-2 limita el conocimiento sobre ECMO.
El estudio CESAR 89 concluyó que la terapia con ECMO en centros con experiencia puede mejorar la sobrevida, sin aumentar la discapacidad. Un nuevo estudio EOLIA90 publicado en 2018 concluyó que la mortalidad no disminuía significativamente con ECMO en comparación con una estrategia de ventilación mecánica convencional. Un meta-análisis 87 comparativo entre ventilación mecánica convencional versus ECMO veno-venoso, concluyó que ECMO se asociaba con una reducción de la mortalidad a 60 días. Sin embargo, el ECMO veno-venoso también se asociaba a un riesgo moderado de hemorragia significativa. Particularmente, en el contexto de la infección por SARS-CoV-2, la evidencia es escasa, pero la experiencia en pandemias en el pasado ha brindado orientación preliminar para el uso de ECMO y la recomendación es indicar su uso en pacientes selectos con hipoxemia refractaria y recuperación potencial con un PAO2/FIO2 <80mmHg, sin contraindicaciones y en instituciones con amplia experiencia en ECMO.
Los datos de 213 hospitales alrededor del mundo, con 1035 pacientes con COVID-19, quienes recibieron soporte ECMO, ofrecen un estimado general de la mortalidad con ECMO en el contexto de COVID-19. El Registro de la Organización de Soporte Vital Extracorpóreo (ELSO por sus siglas in inglés) concluyó que en pacientes con COVID-19 tratados con ECMO, tanto la mortalidad estimada a 90 días después de ECMO, como la mortalidad de pacientes con alto riesgo de muerte o de alta, fue menor al 40%. 91
Es necesario llevar a cabo más estudios para determinar el riesgo - beneficio de la terapia con ECMO en pacientes con infección severa por SARS-Cov-2.92
Eliminación extracorpórea de CO2
Los dispositivos de eliminación extracorpórea de CO2 (ECCO2R) permiten extraer el CO2 de la sangre venosa, pasándola por una membrana similar a la utilizada en ECMO, pero con tasas de flujo sanguíneo mucho más bajas y por ende, las cánulas arteriales y venosas con más pequeñas. 93 La falta de estudios aleatorizados grandes en SARS-CoV-2 limita el conocimiento sobre ECCO2T.
El estudio Xtravent (94) comparó la ventilación mecánica de protección y la ventilación mecánica de ultraprotección + EC-CO2R. En un análisis post hoc del subgrupo de pacientes con PaO2 / FiO2 <150 mmHg, el tratamiento con ventilación mecánica de ultraprotección + ECCO2R redujo significativamente el número de días sin ventilación mecánica. Una revisión sistemática 95 no encontró diferencias en general en términos de mortalidad, días de estancia en la UCI, o días sin ventilación mecánica. De acuerdo con la literatura, el papel de EC-CO2R en la práctica clínica podría ser en el subgrupo de pacientes con SDRA con PaO2 / FiO2 > 80mmHg y <150 mmHg, en quienes el tratamiento de soporte convencional y la ventilación se han optimizado al máximo, sin obtener respuesta, así como en pacientes en los que es necesario minimizar la distensión pulmonar y/o mitigar los efectos de la hipercapnia y la acidosis. 93 En el contexto de infección por SARS-Cov-2, no hay evidencia suficiente. Actualmente hay un estudio en fase de reclutamiento, para investigar la eficacia de la eliminación extracorpórea de CO2 para la corrección de la hipercapnia en SDRA, asociado a COVID-19 (SARS-CoV-2). Los resultados de dicho estudio ofrecerán nuevos conocimientos en este particular. 96
Un estudio de caso destaca el uso de ECCO2R en SDRA severo e hipercapnia refractaria asociada a COVID19. Se necesitan más estudios para investigar más a fondo su seguridad y su eficacia. 97,98
¿Cuál es el manejo basado en evidencia y el abordaje clínico más apropiado?
El manejo del SDRA asociado a SARS-CoV-2 requiere la pericia del clínico y una toma de decisiones rápida, con un abordaje individualizado para garantizar los mejores desenlaces.99 Se requieren diferentes abordajes ventilatorios, dependiendo de la fisiología subyacente de la infección por SARS-CoV2. 100
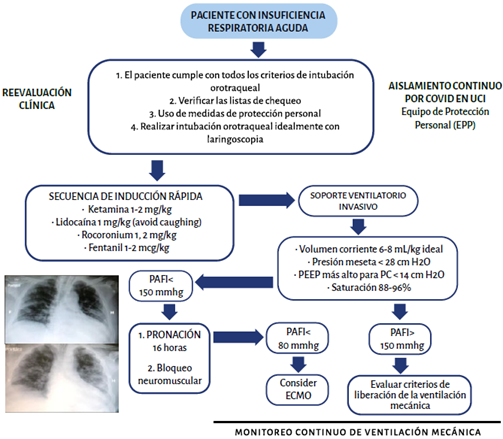
La Tabla 1 resume la evidencia disponible para el manejo del SDRA asociado a infección por SARS-Cov2. En la Figura 1 se describe un abordaje sistemático para el manejo del paciente con falla respiratoria aguda con SARS-CoV-2.
TABLA 1 Resumen de las intervenciones basadas en evidencia.
| Intervención | Severidad SDRA | Calidad grado de evidencia | Nivel de recomendación | Referencias |
|---|---|---|---|---|
| Ventilación pulmonar protectora | Todos los pacientes con SDRA COVID-19* | Moderada | Fuerte | Aoyama et al 2019 39
*Marini et al 2020 100 |
| Posición prona | SDRA Severa COVID-19* | Moderada-alta | Fuerte | Guerin et al 2013 52
Fan et al 2017 54 *Elharrar et al 2020 58 *Weiss et al 2020 59 |
| Peep alto | SDRA moderada -severa | Moderada | Condicionada | Guo et al 2018 60
Ortiz et al 2020 63 |
| Maniobras de reclutamiento | SDRA moderada-severa COVID-19* | Baja-moderada | Condicionada | Furyk et al 2017 64
Kang et al 2019 65 *Pan C 2020 74 |
| Bloqueadores neuromusculares | SDRS Severa COVID-19* | Moderada | Débil | Papazian 2010 75
PETAL STUDY 2019 76 Hua Y et al 2020 77 Zheng et al 2020 78 *Courcelle et al 2020 81 |
| Ventilación mecánica no invasiva y cánula de alto flujo | Pacientes con falla respiratoria leve en COVID19 | Baja | Condicionada | Patel et al 2020 21 |
| Ecmo | SDRA severo COVID-19* | No aplica | No aplica | Munshi et al 2019 87
*Barbaro et al 2020 91 *Cho et al 2020 92 |
FUENTE: Adaptado de Fan et al 54.
CONCLUSIONES
La infección por SARS-CoV-2 genera una patología cuyo comportamiento clínico aún se desconoce, desafiando al clínico en el contexto de la pandemia. El SDRA presenta características clínicas e histopatológicas heterogéneas y desafía a los intensivistas a momento de implementar estrategias terapéuticas. La ventilación mecánica es parte del espectro de medidas terapéuticas para "ganar tiempo", mientras se normalizan los procesos fisiopatológicos. Se necesita un mejor entendimiento de los fenotipos y de la fisiología subyacente, para ayudar a definir los parámetros del ventilador.
El tratamiento basado en evidencia de la infección por SARS-CoV-2 todavía está siendo estudiado; sin embargo, nuestro conocimiento basado en experiencias pasadas favorece un abordaje para un manejo escalonado, sin descuidar otras medidas terapéuticas conjuntas para mejorar los resultados clínicos de una condición con un alto riesgo de mortalidad.
Las actuales recomendaciones indican que los pacientes con falla respiratoria aguda por SARS-CoV-2 deben manejarse con medidas de ventilación mecánica de protección. Todavía no se cuenta con una evidencia sólida sobre la individualización de la ventilación mecánica de acuerdo con los fenotipos.
Contribuciones de los autores
DAR: Concepción y diseño del estudio. Adquisición, análisis e interpretación de los datos. Redacción del manuscrito. Revisión crítica del manuscrito para un contenido intelectual importante. Material original y construcción de las imágenes y tablas.
Soporte administrativo, técnico y material. Supervisión del estudio.
BDGP: Adquisición, análisis e interpretación de los datos. Redacción del manuscrito, supervisión del estudio.
GS: Conceptualización y diseño del estudio. Redacción del manuscrito, revisión crítica del manuscrito para un contenido intelectual importante. Material original y construcción de las imágenes y tablas. Supervisión del estudio.
JFGG: Concepción y diseño del estudio. Redacción del manuscrito, revisión crítica del manuscrito para un contenido intelectual importante. Material original y construcción de las imágenes y tablas, Soporte administrativo, técnico y material. Supervisión del estudio.
DREP: Concepción y diseño del estudio. Supervisión del estudio.
JCGM: Concepción y diseño del estudio. Revisión crítica del manuscrito para un contenido intelectual importante. Material original y construcción de las imágenes y tablas. Supervisión del estudio.
MAF: Adquisición, análisis e interpretación de los datos. Redacción del manuscrito; soporte administrativo, técnico y material. Supervisión del estudio, traducción al inglés.
Todos los autores aprobaron el manuscrito final como se les presentó y acordaron asumir la responsabilidad por todos los aspectos del trabajo.
REFERENCIAS
1. Spina S, Marrazzo F, Migliari M, et al. The response of Milan's Emergency Medical System to the COVID-19 outbreak in Italy. Lancet. 2020;395:e49-50. doi: http://dx.doi.org/10.1016/s0140-6736(20)30493-1. [ Links ]
2. Team NCPERE. Vital surveillances: the epidemiological characteristics of an outbreak of 2019 novel coronavirus diseases (COVID-19) - China. China CDC Weekly. 2020;2(8):113-22. doi: https://doi.org/10.3760/cma.j.issn.0254-6450.2020.02.003. [ Links ]
3. Rothan HA, Byrareddy SN. The epidemio-logy and pathogenesis of coronavirus disease (COVID-19) outbreak. J Autoimmun. 2020:102433. doi: https://doi.org/10.1016/j.jaut.2020.102433. [ Links ]
4. Wax R, Christian M. Practical Recommendations for Critical Care and Anesthesiology Teams Caring for Novel Coronavirus (2019-nCoV) Patients. Can J Anaesth. 2020;67(5):568-76. doi: https://doi.org/10.1007/s12630-020-01591-x. [ Links ]
5. Mo P Xing Y, Xiao Y, et al. Clinical characte-ristics of refractory COVID-19 pneumonia in Wuhan, China. Clin Infect Dis Off Publ Infect Dis Soc Am. 2020. doi: https://doi.org/10.1093/cid/ciaa270. [ Links ]
6. Wei-jie Guan, Zheng-yi Ni, Yu Hu, et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020;382:1708-20. doi: https://doi.org/10.1056/NEJMoa2002032. [ Links ]
7. Wang D, Hu B, Hu C, et al. Clinical Characteristics of 138 Hospitalized Patients with 2019 Novel Coronavirus-Infected Pneumonia in Wuhan. China. JAMA. 2020;323:1061-9. doi: https://doi.org/10.1001/jama.2020.1585. [ Links ]
8. Ranieri VM, Rubenfeld G, Thompson T, et al. Acute respiratory distress syndrome: the Berlin Definition. JAMA. 2012;307(23):2526-33. doi: https://doi.org/10.1001/jama.2012.5669. [ Links ]
9. Gattinoni L, Chiumello D, Rossi S. COVID-19 pneumonia: ARDS or not?. Critical Care 2020;24:154. doi: https://doi.org/10.1186/s13054-020-02880-z. [ Links ]
10. Hassan K, Mandeep R Mehra. COVID-19 illness in native and immunosuppressed states: A clinical-therapeutic staging proposal. J Heart Lung Transplant. 2020;39(5):405-7. doi: https://doi.org/10.1016/j.healun.2020.03.012. [ Links ]
11. Copin MC, Parmentier E, Duburcq T, et al. Time to consider histologic pattern of lung injury to treat critically ill patients with COVID-19 infection. Intensive Care Med. 2020;46(6):1124-6. doi: https://doi.org/10.1007/s00134-020-06057-8. [ Links ]
12. Bellani G, Laffey J, Pham T, et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 2016;315(8):788-800. doi: https://doi.org/10.1001/jama.2016.0291 [ Links ]
13. Wu C, Chen X, Cai Y, et al. Risk Factors Associated Wi.th Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern Med. 2020;180(7):934-43. doi: https://doi.org/10.1001/jamaintern-med.2020.0994. [ Links ]
14. Katzenstein AL, Bloor C, Leibow A. Diffuse Alveolar Damage- The Role of Oxygen, Shock, and Related Factors. Am J Pathol. 1976;85(1):209-28. [ Links ]
15. Lorente J, Cardinal P Muñoz D, et al. Acute respiratory distress syndrome in patients with and without diffuse alveolar damage: an autopsy study. Intensive Care Med . 2015;41(11):1921-30. doi: doi: https://doi.org/10.1007/s00134-015-4046-0 . Epub 2015 Sep 18. [ Links ]
16. Zang H, Zhou P, Wei Y, et al. Histopathologic Changes and SARS-CoV-2 Immunostaining in the Lung of a Patient With COVID-19. Annals of Internal Medicine. 2020;172(9):629-632. doi: https://doi.org/10.7326/M20-0533. [ Links ]
17. Joly B, Siguret V, Veyradier. Understanding pathophysiology of hemostasis disorders in critically ill patients with COVID-19. Intensive Care Med . 2020;46:1603-6. doi: https://doi.org/10.1007/s00134-020-06088-1. [ Links ]
18. Gattinoni L, Chiumello D, Caironi P, et al. COVID-19 pneumonia: different respiratory treatments for different phenotypes?. Intensive Care Medicine. 2020;46:1099-1102. doi: https://doi.org/10.1007/s00134-020-06033-2. [ Links ]
19. Jain A, Doyle J. Stages or phenotypes? A critical look at COVID-19 pathophysiology. Intensive Care Med . 2020;46:1494-5. doi: https://doi.org/10.1007/s00134-020-06083-6. [ Links ]
20. Vincent JL, Taccone F. Understanding pathways to death in patients with COVID-19. Lancet. 2020;8(5):430-2. doi: https://doi.org/10.1016/S2213-2600(20)30165-X. [ Links ]
21. Patel B, Kress J, Hall J. Alternatives to Invasive Ventilation in the COVID-19 Pandemic. JAMA. 2020;324(1):43-44. doi: https://doi.org/10.1001/jama.2020.9611. [ Links ]
22. Consenso colombiano de atención, diagnóstico y manejo de la infección por SARS-COV-2/ COVID-19 en establecimientos de atención de la salud. Recomendaciones basadas en consenso de expertos e informadas en la evidencia. Infectio. 2020;24:3. [ Links ]
23. Gómez C, Peñuelas O. Lujan M, el al. Documento de consenso. Recomendaciones de consenso respecto al soporte respiratorio no invasivo en el paciente adulto con insuficiencia respiratoria aguda secundaria a infección por SARS-CoV-2. Medintensiva. 2020;44(7):429-38. doi: https://doi.or-g/10.1016/j.medin.2020.03.005. [ Links ]
24. Shang Y, Pan Chun, Yang X. Management of critically ill patients with COVID-19 in ICU: statement from front-line intensive care experts in Wuhan, China. Ann Intensive Care. 2020;10:73. doi: https://doi.org/10.1186/s13613-020-00689-1. [ Links ]
25. Guía de la OPS para el cuidado crítico de pacientes adultos graves con coronavirus (COVID-19) en las Américas. 2020. [Citado 23 Agosto 2020]. Disponible en: Disponible en: https://www.paho.org/col/index.php?option=comdoc-man&view=download&alias=2295-guias-co-vid-19-cuidado-critico-abril-2020-abril-ver-sion-larga-v1&xategoryslug=covid-19&Ite-mid=688 . [ Links ]
26. Li J, Fink JB, Ehrmann S. High-flow nasal cannula for COVID-19 patients: low risk of bio-aerosol dispersion. Eur Respir J. 2020;55:2000892. doi: https://doi.org/10.1183/13993003.00892-2020. [ Links ]
27. Thompson A, Ranard B, Wei Y, et al. Prone Positioning in Awake, Nonintubated Patients With COVID-19 Hypoxemic Respiratory Failure. JAMA Intern Med . 2020;180(11):1537-9. doi: https://doi.org/10.1001/jamaintern-med.2020.3030. [ Links ]
28. Tobin M, Laghi F, Jubran A. Caution about early intubation and mechanical ventilation in COVID-19. Ann Intensive Care . 2020;10:78 https://doi.org/10.1186/s13613-020-00692-6. [ Links ]
29. Phua J, Weng L, Ling L, et al. Intensive care management of coronavirus disease 2019 (COVID-19): challenges and recommendations. Lancet . 2020;8(5):506-17. doi: https://doi.org/10.1016/S2213-2600(20)30161-2. [ Links ]
30. Cook TM, Boghdadly K, McGuire B, et al. Consensus guidelines for managing the airway in patients with COVID-19: Guidelines from the Difficult Airway Society, the Association of Anaesthetists the Intensive Care Society, the Faculty of Intensive Care Med icine and the Royal College of Anaesthetists. Anaesthesia. 2020;75(6):785-99. doi: https://doi.org/10.1111/anae.15054. [ Links ]
31. Goldowitz I. Unusual characteristics of COVID-19: "happy hypoxemics". 2020. [Citado 23 agosto, 2020]. Disponible en: Disponible en: https://www.researchgate.net/post/UnusualcharacteristicsofCOVID-19happyhypoxemics . [ Links ]
32. Yoshida T, Grieco D, Brochard L, et al. Patient self-inflicted lung injury and positive end- expiratory pressure for safe spontaneous breathing. Curr Opin Crit Care. 2020;26(1):59-65. doi: https://doi.org/10.1097/MCC.0000000000000691. [ Links ]
33. Manejo clínico del COVID-19: atención hospitalaria. Gobierno de España, Ministerio de Sanidad. 2020. Disponible https://www.mscbs.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov-China/documentos/ProtocolomanejoclinicoahCOVID-19.pdf. [ Links ]
34. Murthy S. Gomersall C, Fowler R, et al. Care for Critically Ill Patients With COVID-19. JAMA. 2020;323(15):1499-500. doi: https://doi.org/10.1001/jama.2020.3633. [ Links ]
35. Wunsch H. Mechanical Ventilation in COVID-19: Interpreting the Current Epidemiology. Am J Respir Crit Care Med. 2020;202(1):1-21. doi: https://doi.org/10.1164/rccm.202004-1385ED. [ Links ]
36. Constatin JM, Jabaudon M, Lefrant JY, et al. Personalised mechanical ventilation tailored to lung morphology versus low positive end-expiratory pressure for patients with acute respiratory distress syndrome in France (the LIVE study): a multicentre, single-blind, randomised controlled trial. Lancet . 2019. doi: https://doi.org/10.1016/S2213-2600(19)30138-9. [ Links ]
37. Papazian L, Aubron C, Brochard L, et al. Formal guidelines: management of acute respiratory distress syndrome. Ann. Intensive Care. 2019;9:69. doi: https://doi.org/10.1186/s13613-019-0540-9. [ Links ]
38. Silvio A Ñamendys-Silva. Respiratory support for patients with COVID-19 infection. Lancet . 2020;8(4):E18. doi: https://doi.org/10.1016/S2213-2600(20)30110-7. [ Links ]
39. Aoyama H, Uchida K, Aoyama K, et al. Assessment of Therapeutic Interventions and Lung Protective Ventilation in Patients With Moderate to Severe Acute Respiratory Distress Syndrome: A Systematic Review and Network Meta-analysis. JAMA Netw Open. 2019;2(7):e198116. doi: https://doi.org/10.1001/jamanetworkopen.2019.8116. [ Links ]
40. Weiss CH, M.cSparron J, Chatterjee R, et al. Summary for clinicians: mechanical ventilation in adult patients with acute respiratory distress syndrome clinical practice guideline. Ann Am Thorac Soc. 2017;14(8):1235-8. doi: https://doi.org/10.1513/AnnalsATS.201704-332CME. [ Links ]
41. Girardis M, B.usani S, Damiani E, et al. Effect of conservative vs conventional oxygen therapy on mortality among patients in an intensive care unit: the Oxygen-ICU randomized clinical trial. JAMA. 2016;18;316(15):1583-9. doi: https://doi.org/10.1001/jama.2016.11993. [ Links ]
42. Walkey AJ, Del Sorbo L, Hodgson C, et al. Higher PEEP versus lower PEEP strategies for patients with acute respiratory distress syndrome: a systematic review and meta-analysis. Ann Am Thorac Soc . 2017;14(Supp 4):S297-303. doi: https://doi.org/10.1513/AnnalsATS.201704-338OT. [ Links ]
43. Durante G, Turco M, Rustichini L, et al. ARDS-Net lower tidal volume ventilatory strategy may generate intrinsic positive end-expiratory pressure in patients with acute respiratory distress syndrome. Am J Resp Critc Care Med. 2002;165:1271-4. doi: http://dx.doi.org/10.1164/rccm.2105050. [ Links ]
44. Carrasco R, Villamizar G, Fernández M. Ventilator-Induced Lung Injury (VILI) in Acute Respiratory Distress Syndrome (ARDS): Volutrauma and Molecular Effects. Open Respir Med J. 2015;9:112-9. doi: https://doi.org/10.2174/1874306401509010112. [ Links ]
45. Bein T, Grasso S, Moerer O, et al. The standard of care of patients with ARDS: ventilatory settings and rescue therapies for refractory hypoxemia. Intensive Care Med . 2016;42:699-711. doi: https://doi.org/10.1007/s00134-016-4325-4. [ Links ]
46. Rittayamai N, Katsios C, Beloncle F, et al. Pressure-Controlled vs Volume-Controlled Ventilation in Acute Respiratory Failure: A Physiology-Based Narrative and Systematic Review. Chest. 2015;148(2):340-55. doi: https://doi.org/10.1378/chest.14-3169. [ Links ]
47. Chacko B, Peter J, Tharyan P, et al. Pressure-controlled versus volume-controlled ventilation for acute respiratory failure due to acute lung injury (ALI) or acute respiratory distress syndrome (ARDS). Cochrane Systematic Review. 2015. doi: https://doi.org/10.1002/14651858.CD008807.pub2. [ Links ]
48. Chica-Meza C. Peña L, Villamarín H, et al. Cuidado respiratorio en COVID-19. Acta Colomb Cuid Intensivo. 2020;20(2):108-17. doi: https://doi.org/10.1016/j.acci.2020.04.001. [ Links ]
49. Carter C. Osborn M, Agagah G, et al. COVID-19 Disease: invasive ventilation. Clinics in Integrated Care. 2020;1:100004. doi: https://doi.org/10.1016/j.intcar.2020.100004. [ Links ]
50. Fan E. Beitler J, Brochard L, et al. COVID-19-as-sociated acute respiratory distress syndrome: is a different approach to management warranted?. The Lancet Respiratory Medicine. 2020;8(8):816-21. doi: https://doi.org/10.1016/S2213-2600(20)30304-0. [ Links ]
51. Griffiths M. McAuley D, Perkins G, et al. Guidelines on the management of acute respiratory distress syndrome. BMJ Open Resp Res. 2019;6:e000420. doi: https://doi.org/10.1136/bmjresp-2019-000420. [ Links ]
52. Guerin C, Reignier J, Richard JC, et al. PRO-SEVA Study Group. Prone positioning in severe acute respiratory distress syndrome. N Engl J Med . 2013;368:2159-68. doi: https://doi.org/10.1056/NEJMoa1214103. [ Links ]
53. Park SY, Kim H, Yoo K, et al. The efficacy and safety of prone positioning in adults patients with acute respiratory distress syndrome: a meta-analysis of randomized controlled trials. J Thorac Dis. 2015;7(3)356-67. doi: https://doi.org/10.3978/j.issn.2072-1439.2014.12.49. [ Links ]
54. Fan, E, Del Sorbo L, Goligher E, et al. An Official American Thoracic Society/European Society of intensive Care Medicine/Society of Critical Care Medicine Clinical practice Guideline: Mechanical Ventilation in Adult Patients with Acute Respiratory Distress Syndrome. Am J Respir Crit Care Med . 2017;195(9):1253-63. doi: https://doi.org/10.1164/rccm.201703-0548ST. [ Links ]
55. Gattinoni L, Taccone P, Carlesso E, et al. Prone Position in Acute Respiratory Distress Syndrome. Rationale, Indications, and Limits. Am J Respir Crit Care Med . 2013;188(11):1286-93. doi: https://doi.org/10.1164/rccm.201308-1532CI. [ Links ]
56. Rodríguez R, Ordoñez S, Gómez J, et al. Prone position in the Acute Respiratory Distress Syndrome, physiology to clinical practice. Medicas UIS 2016;29(2). doi: http://dx.doi.org/10.18273/revmed.v29n2-2016008. [ Links ]
57. Bhatnagar V, Jinjil K, Dwivedi D, et al. Cardiopulmonary Resuscitation: Unusual Techniques for Unusual Situations. J Emerg Trauma Shock. 2018;11(1):31-7. doi: https://doi.org/10.4103/JETS.JETS5817. [ Links ]
58. Elharrar X, Trigui Y, Dols A, et al. Use of Prone Positioning in Nonintubated Patients With COVID-19 and Hypoxemic Acute Respiratory Failure. JAMA. 2020;323(22):2336-8. doi: https://doi.org/10.1001/jama.2020.8255. [ Links ]
59. Weiss T, Cerda F, Scott B, et al. Positioning for patients intubated for severe acute respiratory distress syndrome (ARDS) secondary to COVID-19: a retrospective observational cohort study. British Journal of Anaesthesia. 2021;126(1):48-55. doi: https://doi.org/10.1016/j.bja.2020.09.042. [ Links ]
60. Guo L, Xie J, Huang Y, et al. Higher PEEP improves outcomes in ARDS patients with clinically objective positive oxygenation response to PEEP: a systematic review and meta-analysis. BMC Anesthesiology. 2018;18:172. doi: https://doi.org/10.1186/s12871-018-0631-4. [ Links ]
61. Gattinoni L. Preliminary observations on the ventilatory management of ICU COVID-19 patients. 2020. [Citado 23 agosto, 2020]. Disponible en: Disponible en: https://www.pedsanesthesia.org/wp-content/uploads/2020/03/Ventilator-ManagementCovid-19-ICU-EXPERT-OPI-NION-Gattinoni.pdf . [ Links ]
62. Taylor B, Bernard G. Lower Tidal Volume / Higher PEEP Reference Card for ARMA and ALVEOLI Studies. Crit Care Clin. 2011;27(3):459-68. doi: https://doi.org/10.1016/j.ccc.2011.05.011. [ Links ]
63. Ortiz G, Dueñas C, Garay M, et al. Consenso Colombiano de SDRA. Acta Colomb Cuid Intensivo . 2020; 20:200-52. doi: https://doi.org/10.1016/j.acci.2020.03.001. [ Links ]
64. Furyk, J. What are the effects of recruitment maneuvers for adults with acute respiratory distress syndrome receiving mechanical ventilation?. Cochrane Clinical Answers. 2017. doi: https://doi.org/10.1002/cca.1606. [ Links ]
65. Kang H, Yang H, Tong Z. Recruitment maneuvers for adults with acute respiratory distress syndrome receiving mechanical ventilation: a systematic review and meta-analysis. J Crit Care. 2019;50:1-10. doi: https://doi.org/10.1016/j.jcrc.2018.10.033. [ Links ]
66. Algaba A, Nin N, GT-IRA of the SEMICYUC, et al. Alveolar recruitment maneuvers in respiratory distress syndrome. Med Intensiva. 2013;37(5):355-62. doi: https://doi.org/10.1016/j.medine.2013.01.006. [ Links ]
67. Pelosi P, Gama de Abreu M, Rocco PR. New and conventional strategies for lung recruitment in acute respiratory distress syndrome. Crit Care. 2010;14:210. doi: https://doi.org/10.1186/cc8851. [ Links ]
68. Grasso S, Mascia L, Del Turco M, et al. Effects of recruiting maneuvers in patients with acute respiratory distress syndrome ventilated with protective ventilatory strategy. Anesthesiology. 2002;96:795-802. [ Links ]
69. Guerin C , Debord S, Leray V, et al. Efficacy and safety of recruitment maneuvers in acute respiratory distress syndrome. Ann Intensive Care . 2011;1:9. doi: https://doi.org/10.1186/2110-5820-1-9. [ Links ]
70. Villagrá A, Ochagavía A, Vatua S, et al. Recruitment maneuvers during lung protective ventilation in acute respiratory distress syndrome. Am J Respir Crit Care Med . 2002;165:165-70. doi: https://doi.org/10.1164/ajrccm.165.2.2104092. [ Links ]
71. Kacmarek RM, Villar J. Lung recruitment maneuvers during acute respiratory distress syndrome: is it useful. Minerva Anestesiol. 2011;77:85-9. [ Links ]
72. Girgis K, Hamed H, Khater Y, et al. A decremental PEEP trial identifies the PEEP level that maintains oxygenation after lung recruitment. Respir Care. 2006;51:1132-9. [ Links ]
73. Borges JB, Okamoto VN, Matos GF, et al. Reversibility of lung collapse and hypoxemia in early acute respiratory distress syndrome. Am J Respir Crit Care Med . 2006;174:268-78. [ Links ]
74. Pan C. Lung Recruitability in COVID-19-associated Acute Respiratory Distress Syndrome: A Single-Center Observational Study. Am J Respi Crit Care Med. 2020;201(10):1294-7. doi: https://doi.org/10.1164/rccm.202003-0527LE. [ Links ]
75. Papazian L, Forel JM, Gacouin A, et al. ACU-RASYS Study Investigators. Neuromuscular blockers in early acute respiratory distress syndrome. N Engl J Med . 2010; 6; 363(12):1107-16. doi: https://doi.org/10.1056/NEJMoa1005372. [ Links ]
76. Moss M, Huang D, Browe R, The National Heart, Lung, and Blood Institute PETAL Clinical Trials Network. Early Neuromuscular Blockade in the Acute Respiratory Distress Syndrome. N Engl J Med . 2019;380:1997-2008. doi: https://doi.org/10.1056/NEJMoa1901686. [ Links ]
77. Hua, Y, Ou X, Li Q, et al. Neuromuscular blockers in the acute respiratory distress syndrome: A meta-analysis. PlosO-NE. 2020;15(1):e0227664. doi: https://doi.org/10.1371/journal.pone.0227664. [ Links ]
78. Zheng Z, Jiang L, Zhang S, et al. Neuromuscular blocking agents for acute respiratory distress syndrome: an updated meta-analysis of randomized controlled trials. Respir Res. 2020;21(1):23. doi: https://doi.org/10.1186/s12931-020-1287-4. [ Links ]
79. Torbic H, Krishnan S, Duggal A. Neuromuscular blocking agents for acute respiratory distress syndrome: how did we get conflicting results? Crit Care . 2019;23:305. doi: https://doi.org/10.1186/s13054-019-2586-3. [ Links ]
80. Matthay M, Aldrich J, Gotts J. Treatment for severe acute respiratory distress syndrome from COVID-19. Lancet . 2020;8(5):433-4. doi: https://doi.org/10.1016/S2213-2600(20)30127-2. [ Links ]
81. Courcelle R, Gaundry S, Serck N, et al. Neuromuscular blocking agents (NMBA) for COVID-19 acute respiratory distress syndrome: a multicenter observational study. Crit Care . 2020;24:446. doi: https://doi.org/10.1186/s13054-020-03164-2. [ Links ]
82. Nin N , Muriel A, Peñuelas O , et al. Severe hypercapnia and outcome of mechanically ventilated patients with moderate or severe acute respiratory distress syndrome. Intensive Care Med . 2017;43(2):200-8. doi: doi: https://doi.org/10.1007/s00134-016-4611-1 . Epub 2017 Jan 20. [ Links ]
83. Morales-Quinteros, Camprubí M, Bringué J, et al. The role of hypercapnia in acute respiratory failure. ICMx 2019;7(Suppl 1)39. doi: https://doi.org/10.1186/s40635-019-0239-0. [ Links ]
84. Crystal GJ. Carbon Dioxide and the Heart: Physiology and Clinical Implications. Anesth Analg. 2015;121(3):610-23. doi: https://doi.org/10.1213/ANE.0000000000000820. [ Links ]
85. Tiruvoipati R, Pilcher D, Buscher H, et al. Effects of hypercapnia and hypercapnic acidosis on hospital mortality inmechanically ventilated patients. Crit Care Med. 2017;45(7):e649-56. doi: https://doi.org/10.1097/ccm.0000000000002332. [ Links ]
86. Wiersinga J, Rhodes A, Cheng A, et al. Pathophysiology, Transmission, Diagnosis, and Treatment of Coronavirus Disease 2019 (COVID-19): A Review. JAMA. 2020;324(8)782-93. doi: https://doi.org/10.1001/jama.2020.12839. [ Links ]
87. Munshi L, Walkey A, Goligher E , et al. Venovenous extracorporeal membrane oxygenation for acute respiratory distress syndrome: a systematic review and meta-analysis. Lancet Respir Med. 2019;7(2):163-72. doi: https://doi.org/10.1016/S2213-2600(18)30452-1. [ Links ]
88. Vincent JL. Annual Uptodate in Intensive Care and Emergency Medicine. Extracorporeal Membrane Oxygenation. Springer. 2020. [ Links ]
89. Peek G, Mugford M, Tiruvoipati R, et al. Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial. Lancet . 2009;374(9698):1351-63. doi: https://doi.org/10.1016/S0140-6736(09)61069-2. [ Links ]
90. Combes A, Hajage D, Capellier G, et al. Extracorporeal Membrane Oxygenation for Severe Acute Respiratory Distress Syndrome. N Engl J Med . 2018;378:1965-75. doi: https://doi.org/10.1056/NEJMoa1800385. [ Links ]
91. Barbaro R, Mad.aren G, Boonstra P, et al. Extracorporeal membrane oxygenation support in COVID-19: an international cohort study of the Extracorporeal Life Support Organization registry. Lancet . 2020;396(10257):1071-8. doi: https://doi.org/10.1016/S0140-6736(20)32008-0. [ Links ]
92. Cho H, Heinsar S, Jeong I, et al. ECMO use in COVID-19: lessons from past respiratory virus outbreaks-a narrative Review. Critical Care . 2020;24:301. doi: https://doi.org/10.1186/s13054-020-02979-3. [ Links ]
93. Romay E, Ferrer R. Extracorporeal CO2 removal: Technical and physiological fundaments and principal indications. Med Intensiva . 2016;40(1):33-8. doi: https://doi.org/10.1016/j.medine.2015.12.002. [ Links ]
94. Bein T, Weber-Carstens S, Goldmann A, et al. Lower tidal volume strategy (approximately 3 ml/kg) combined with extracorporeal CO2 removal versus 'conventional' protective ventilation (6 ml/kg) in severe ARDS: the prospective randomized Xtravent-study. Intensiv Care Med. 2013;39(5):847-56. doi: https://doi.org/10.1007/s00134-012-2787-6. [ Links ]
95. Fitzgerald M, Millar J, Blackwood B, et al. Extracorporeal carbon dioxide removal for patients with acute respiratory failure secondary to the acute respiratory distress syndrome: a systematic review. Crit Care . 2014;15;18(3):222. doi: https://doi.org/10.1186/cc13875. [ Links ]
96. Low-flow Extracorporeal Carbon Dioxide Removal in COVID-19-associated Acute Respiratory Distress Syndrome. ClinicalTrials.gov. Identifier: NCT04351906. [ Links ]
97. Boparai S, Steven K, Motayar N. Extra-corporeal carbon dioxide removal in COVID-19 ARDS. Chest. 2020;158(4):A1029. doi: http://dx.doi.org/10.1016/j.chest.2020.08.956. [ Links ]
98. Tully R, Hopley N, Lawrence G. The successful use of extracorporeal carbon dioxide removal as a rescue therapy in a patient with severe COVID-19 pneumonitis. Anaesthesia Reports. 2020;8:113-5. doi: https://doi.org/10.1002/anr3.12072. [ Links ]
99. Accini J, Beltrán N, Nieto V, et al. Documento de consenso. Declaration of consensus in critical medicine for multidisciplinary care of the patient with a suspected or confirmed diagnosis of COVID-19. Acta Colombiana de Cuidado Intensivo. 2020;20(4):287-333. doi: https://doi.org/10.1016/j.acci.2020.04.003. [ Links ]
100. Marini J, Gattinoni L. Management of COVID-19 Respiratory Distress. JAMA. 2020;323(22):2329-30. doi: https://doi.org/10.1001/jama.2020.6825. [ Links ]
Recibido: 29 de Septiembre de 2020; Aprobado: 08 de Enero de 2021; : 10 de Marzo de 2021











 text in
text in