Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347On-line version ISSN 2256-2087
Rev. colomb. anestesiol. vol.51 no.3 Bogotá July/Sept. 2023 Epub Sep 01, 2023
https://doi.org/10.5554/22562087.e1064
Artículo original
Diferencia en los niveles de cuerpos cetónicos entre el ayuno diurno y nocturno en niños: estudio observacional
a Departamento de Cirugía, Facultad de Ciencias de la Salud, Universidad de Caldas. Manizales, Colombia.
b Facultad de Ciencias de la Salud, Universidad de Manizales. Manizales, Colombia.
c Doctorado en Ciencias de la Salud, Universidad de Caldas. Manizales, Colombia.
Introducción
Los niños son susceptibles a desarrollar cetonemia preoperatoria que puede verse afectada por cambios en el ritmo circadiano y las hormonas contrarreguladoras. No está claro si la cetonemia depende de la hora del ayuno.
Objetivo
Evaluar el efecto del momento del ayuno preoperatorio (diurno vs. nocturno) sobre la concentración preoperatoria de los cuerpos cetónicos en niños.
Métodos
Llevamos a cabo un estudio clínico observacional entre septiembre de 2020 y marzo de 2021, en niños menores de 48 meses, programados para cirugía electiva. Se identificaron dos grupos basados en la hora del ayuno, como sigue: ayuno diurno (grupo A, n = 40) y ayuno nocturno (grupo B, n = 52). En ambos grupos se analizaron los datos demográficos, la duración del ayuno, el tiempo excesivo de ayuno, el tipo de ingesta de alimentos, la concentración de cuerpos cetónicos, la glicemia capilar, el nivel de ansiedad y la deshidratación.
Resultados
El ayuno diurno se asocio con una mayor incidencia de cenotemia en comparación con el ayuno nocturno (Grupo A: 62,5% (IC 95% 48,1-82,0); grupo B: 38,5% (95% CI 26.5-52.5), P=0.02). La mayoría de los pacientes excedieron el tiempo de ayuno recomendado según las guías de ayuno preoperatorio (95,6%). El tipo de alimentos ingeridos antes de la cirugía se asoció de manera importante con la presencia de cetonemia (P=0,01).
Conclusiones
La cetonemia preoperatoria es relativamente común en pacientes menores de 48 meses de edad, especialmente entre quienes se someten a ayuno diurno en comparación con ayuno nocturno.
Palabras clave: Niños; Anestesia; Cetonemia; Ayuno; Reloj circadiano; Anestesiología
Introduction
Children are susceptible to developing preoperative ketonemia, which can be affected by changes in the circadian rhythm and counter-regulatory hormones. It is unclear whether ketonemia depends on the timing of fasting.
Objective
To assess the effect of preoperative fasting time (diurnal vs. night) on the preoperative concentration of ketone bodies in children.
Methods
We conducted a prospective-observational clinical study between September 2020 and March 2021, including children under 48 months of age scheduled for elective surgery. Two groups were identified based on fasting time, as follows: diurnal fasting (group A, n = 40) and nocturnal fasting (group B, n = 52). Demographic data, duration of fasting, time of excess fasting, type of food intake, the concentration of ketone bodies and capillary blood glucose, level of anxiety, and dehydration were analyzed in both groups.
Results
Diurnal fasting was associated with higher incidence of ketonemia compared with nocturnal fasting (Group A: 62.5% (95% CI 48.1-82.0); group B: 38,5% (95% CI 26.5-52.5), P=0.02). Most of the patients exceeded the duration of fasting recommended by preoperative fasting guidelines (95.6%). The type of food eaten before surgery was significantly associated with the presence of ketonemia (P=0.01).
Conclusions
Preoperative ketonemia is relatively common in patients under 48 months of age, especially among those who undergo diurnal fasting compared to nocturnal fasting.
Keywords: Children; Anesthesia; Ketonemia; Fasting; Circadian clock; Anesthesiology
¿Qué sabemos acerca de este problema?
El exceso de ayuno produce catabolismo, deshidratación e irritabilidad en los niños.
El aumento de los cuerpos cetónicos en sangre refleja el estado catabólico producido por el ayuno en niños.
A pesar de la recomendaciones de las guías de ayuno preoperatorio de las diferentes sociedades científicas para reducir las horas de ayuno, el tiempo de ayuno preoperatorio sigue siendo prolongado.
INTRODUCCIÓN
El organismo tiene mecanismos regulatorios diseñados para satisfacer las demandas de energía durante períodos de ayuno prolongados. Grandes cantidades de ácidos grasos se transforman en cuerpos cetónicos a través de la lipólisis en el hígado y la glucogenólisis muscular, que son usados posteriormente como fuente de energía. 1 Sin embargo, los pequeños depósitos de glucógeno en el hígado -y la alta demanda de energía de los lactantes y recién nacidos-lleva al desarrollo de una respuesta catabólica precoz y más intensa que en adultos, aún durante cortos períodos de ayuno, que se manifiesta a través del aumento de cuerpos cetónicos en la sangre. 2
Adicionalmente, el metabolismo de los carbohidratos, los lípidos y las proteínas se ve afectado por la liberación de hormonas contrarreguladoras durante el ciclo circadiano. Durante el día, la ingesta de alimentos viene acompañada de un aumento en los niveles de insulina, creando un efecto anabólico y produciendo glucogénesis y lipogénesis. Durante la noche, los niveles de insulina circulantes caen y los niveles de las hormonas contrarreguladoras aumentan (principalmente la hormona de crecimiento, la leptina y el glucagón), lo cual, junto con la falta de ingesta de alimentos, favorece el catabolismo sistémico: glucogenólisis, gluconeogénesis, y lipólisis.3
En el escenario perioperatorio, la hora de la cirugía determina el tipo de ayuno (día o noche) al que se someterá el paciente. Sin embargo, las consecuencias metabólicas y el grado de catabolismo, con respecto al ciclo circadiano de liberación de la insulina y las hormonas contrarreguladoras descritas, no se conocen a cabalidad en la población pediátrica. Por lo tanto, el objetivo principal de este estudio fue evaluar el efecto del tiempo de ayuno preoperatorio (diurno o nocturno) sobre la concentración preoperatoria de los cuerpos cetónicos en niños menores de 48 meses programados para cirugía ambulatoria. El objetivo secundario fue determinar la relación entre cetonemia y el tipo de alimentos consumidos, los niveles de glucosa y el nivel de ansiedad y deshidratación preoperatorias.
MATERIALES Y MÉTODOS
El estudio fue aprobado por el comité de ética del Hospital Infantil Rafael Henao Toro en Manizales, Colombia (IRB número CBCS-091). Los procedimientos se cumplieron de acuerdo con la Declaración de Helsinki -2013. Entre septiembre de 2020 a marzo de 2021 se realizó un estudio prospectivo. Se incluyeron pacientes menores de 48 meses, ASA (American Society of Anesthesiologists) I y II programados para cirugía ambulatoria. Se excluyeron todos los pacientes que recibieron líquidos endovenosos durante el período de ayuno, los pacientes diabéticos, con uso de esteroides crónico o reciente (dentro de la semana antes de la cirugía), casos de urgencias y hospitalizados antes del procedimiento.
Se dieron recomendaciones para el ayuno a los padres de acuerdo con las guías de ayuno preoperatorio de la ASA (6 horas para alimentos sólidos, 4 horas para leche materna y 2 horas para líquidos claros). Los pacientes con ayuno diurno programados para cirugía en la tarde (cirugías realizadas después de las 12:00 m) se asignaron al grupo A y los pacientes con ayuno nocturno programados para cirugía en la mañana (realizada entre las 7 am y las 11:59 am) se asignaron al grupo B.
En el área de admisiones preoperatoria, el anestesiólogo entrevistó a los padres de los pacientes y / o a sus representantes legales y registró la siguiente información del paciente: edad (meses), sexo (masculino, femenino), peso (kilogramos), hora de la última comida (horas y minutos) y el tipo de alimento consumido (líquido claro, leche materna, leche de fórmula o sólidos) y evaluó el grado de ansiedad utilizando una escala análoga visual sobre una línea de 100-mm. Un valor de > 30 mm era indicativo de ansiedad preoperatoria. 4 La presencia de uno de los siguientes signos: moco seco, llenado capilar > 2 segundos, o llanto sin lágrimas se consideró deshidratación. 5 Adicionalmente, se tomó una muestra de sangre capilar de 5 uL para medir la concentración de Beta-Hidroxibutirato y glucosa, utilizando el equipo Freestyle Precision Neo H (Abbott Laboratories, GB). Un valor superior a 0,5 mmol/L de Beta-Hidroxibutirato se consideró positivo para cetonemia y menos de 70 mg/ dL para hipoglicemia en todos los rangos de edad.
Los pacientes se asignaron a los grupos A o B, de acuerdo con la hora de la cirugía, como ya se mencionó. El tamaño de muestra calculado para un nivel de significancia del 95% y un poder de 80% fue de 74 pacientes, de acuerdo con las siguientes variables de desenlace: ansiedad preoperatoria, deshidratación y cuerpos cetónicos, con factor de corrección Fleiss. Los datos se presentaron utilizando la mediana y los rangos intercuartílico dada la distribución no normal estimada utilizando la prueba de Kolmogorov Smirnov. El peso tuvo una distribución normal, por lo cual se utilizó la desviación media y estándar. Se utilizó o bien la prueba de chi-cuadrado (x2) o la prueba exacta de Fisher para comparar las variables categóricas, según correspondiera, de acuerdo con el tipo de ayuno y la presencia de cetonemia elevada. Para el análisis univariado de cuerpos cetónicos respecto a edad y peso, se utilizó la prueba T de Student, mientras que para las horas de ayuno, se usó la prueba de Kruskal-Wallis. Se hizo un análisis de regresión logística para detectar las variables asociadas a cuerpos cetónicos elevados (ayuno diurno o nocturno, tipo de alimentos y glucosa). El nivel de significancia se estableció con un valor P de < 0,05. Todos los análisis se realizaron en Stata 16,1 (StataCorp, Tx USA).
RESULTADOS
Información sociodemográfica
Se incluyeron 92 pacientes en total, 40 en el grupo A y 52 en el grupo B (Figura 1). La media de edad fue de 24 meses para el grupo A (RIC 12,5 - 33,5) y 31 meses para el grupo B (RIC 21 - 38,5). No se encontraron diferencias entre los dos grupos en términos de sexo, género y tipo de cirugía. Las características de los pacientes se resumen en la Tabla 1.
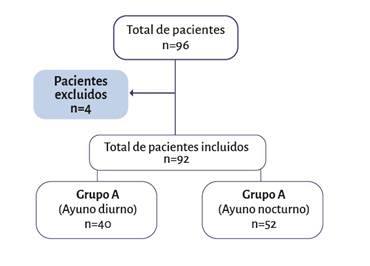
Cuatro pacientes se excluyeron por pérdida de datos. Se incluyeron 92 pacientes en total. Fuente. Autores.
Figura 1 Flujogramadel reclutamiento de pacientes.
Tabla 1 Características clínicas y demográficas.
| Grupo A Ayuno diurno (n=40) | Grupo B Ayuno nocturno (n=52) | P | |||
|---|---|---|---|---|---|
| n | % | n | % | ||
| Edad (Meses) | 0,02 a | ||||
| Mediana | 24 | 31 | |||
| Rango Intercuartílico | 12,5 - 33,5 | 21 - 38,5 | |||
| Grupo etario (Meses) | 0,005 b | ||||
| <12 | 9 | 22,5 | 1 | 1,9 | |
| 12 - 23 | 11 | 27,5 | 14 | 26,9 | |
| ≥ 24 | 20 | 50,0 | 37 | 71,2 | |
| Género | 0,38 c | ||||
| Mujer | 15 | 37,5 | 15 | 28,8 | |
| Hombre | 25 | 62,5 | 37 | 71,2 | |
| Peso (kg) | 0,01 d | ||||
| Media/SD | 11,4 ± 0,46 | 12,9 ± 0,39 | |||
| Cirugía | 0,47 b | ||||
| Cirugía Pediátrica | 19 | 47,5 | 36 | 69,2 | |
| Cirugía Plástica | 7 | 17,5 | 4 | 7,7 | |
| Gastroenterología | 2 | 5,0 | 1 | 1,9 | |
| Neurocirugía | 1 | 2,5 | 1 | 1,9 | |
| Odontología | 2 | 5,0 | 2 | 3,8 | |
| Ortopedia | 5 | 12,5 | 5 | 9,7 | |
| Otorrinolaringología | 4 | 10,0 | 3 | 5,8 | |
| Tipo de alimento | 0,000 b | ||||
| Líquidos claros | 27 | 67,5 | 4 | 7,7 | |
| Solidos | 2 | 5,0 | 26 | 50,0 | |
| Leche materna | 9 | 22,5 | 4 | 7,7 | |
| Leche de Formula | 2 | 5,0 | 18 | 34,6 | |
| Horas de Ayuno | |||||
| Mediana | 5,2 | 11,2 | 0,000 a | ||
| Rango intercuartílico | 4,3 - 6 | 10 - 13 | |||
a Prueba de Kruskal-Wallis; b Prueba exacta de Fisher; c x2 ; d Prueba t de Student. DE: Desviación estándar.
Fuente: Autores.
Tiempos de ayuno y la adherencia a las guías de ayuno preoperatorio
Hubo una diferencia estadísticamente significativa entre el ayuno nocturno y el diurno, con una mediana de 11,2 horas (RIC: 10 -13) y 5,2 horas (RIC: 4,3-6), respectivamente (P < 0,0000). Los subgrupos por tipo de alimentos y sus medianas correspondientes de los tiempos de ayuno preoperatorio se ilustran en la Tabla 1.
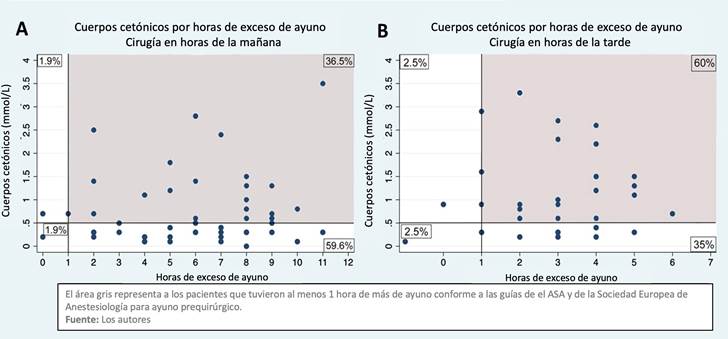
El análisis de número total de pacientes mostró que 9,6% (88 pacientes) tuvieron al menos una hora de exceso de ayuno de acuerdo con las guías de ayuno preoperatorio, sin diferencia entre los grupos (Grupo A: 95%, IC 95% 89,2-99,1 y Grupo B 96,1%, IC 95% 80,2 - 98,7, P = 0,58). En total, 48,9% se presentaron a la cirugía con cetonemia (Figura 2y 3).
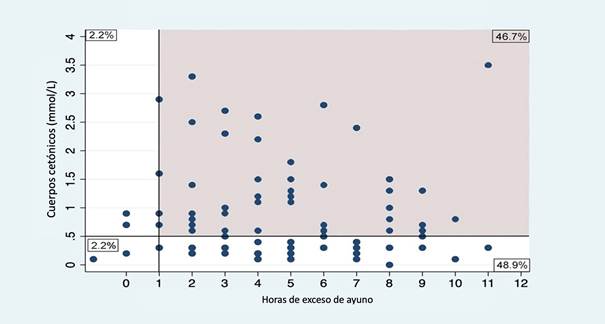
El área gris representa los pacientes con al menos 1 hora más de ayuno en relación con las guías de ayuno prequirúrgico de la Sociedad Americana de Anestesiología. Fuente. Autores.
Figura 2 Cuerpos cetónicos por horas de exceso de ayuno entre todos los pacientes (n:92).
Cuerpos cetónicos y niveles de glicemia
La media de niveles de cetona en el grupo A fue de 0,85 mmol/L (RIC: 0,3-1,5), mientras que en el grupo B fue de 0,35 mmol/L (RIC: 0,2 - 0,7), sin diferencias estadísticamente significativas (P: 0,07). Al comparar la incidencia de cetonemia hubo una diferencia estadísticamente significativa en la concentración de cuerpos cetónicos con respecto al tiempo de ayuno preoperatorio (ayuno diurno vs nocturno), reflejado en una mayor incidencia de cetonemia en el grupo A (62,5%; IC 95%: 48,1 - 82) en comparación con el grupo B (38,5%; IC 95% 26,5-52,5) P: 0,02. (Tabla 2).
Tabla 2 Comparación de cetonemia y desenlaces secundarios entre el grupo A y el B.
| Grupo A Ayuno diurno (n=40) | Grupo B Ayuno nocturno (n=52) | P | |||
|---|---|---|---|---|---|
| n | % | n | % | ||
| Cuerpos cetónicos (mmol/L) Mediana Rango intercuartílico |
0.85 0.3 - 1.5 |
0.35 0.2 - 0.7 |
0,06 a | ||
| Cetonemia ≤ 0.5 > 0.5 |
15 25 |
37.5 62.5 |
32 20 |
61.5 38.5 |
0,02 b |
| Concentración de glucosa (mg/dL) | 0,08 a | ||||
| Media (SD) | 78,6 (± 1,79) | 82,3 (± 1,28) | |||
| Hipoglicemia | 0,09 b | ||||
| Si | 10 | 25,0 | 6 | 11,5 | |
| No | 30 | 75,0 | 46 | 88,5 | |
| Deshidratación | 0,45 b | ||||
| Si | 5 | 12,5 | 5 | 50,0 | |
| No | 35 | 87,5 | 47 | 48,0 | |
| Ansiedad | 0,38 d | ||||
| Si | 19 | 47,5 | 20 | 38,5 | |
| No | 21 | 52,5 | 32 | 61,5 | |
a Prueba t Student de; b Prueba exacta de Fisher; c Prueba de x2; d Prueba de Kruskal-Wallis. DE: Desviación estándar.
Fuente: Autores.
Hubo diferencias significativas en la distribución del tipo de alimentos y su relación con el nivel de cuerpos cetónicos, especialmente en términos de líquidos claros versus otros tipos de alimentos (leche materna, leche de fórmula o dieta regular), (OR: 3,23; IC 95%: 1,19-9,03, P=0,01). Esto no estaba relacionado con el tiempo de ayuno (diurno o nocturno), (Tabla 3).
Tabla 3 Comparación entre niveles elevados y normales.
| Cuerpos cetónicos > 0,5 | Cuerpos cetónicos ≤ 0,5 | P | |||
|---|---|---|---|---|---|
| n | % | n | % | ||
| Edad (Meses) | 0,49 a | ||||
| Media (SD) | 26,5 ± 1,6 | 28,2 ±1,8 | |||
| Edad Grupo (Meses) | 1,0 b | ||||
| <12 | 5 | 11,1 | 5 | 10,6 | |
| 12 - 23 | 12 | 26,7 | 13 | 27,7 | |
| ≥ 24 | 28 | 62,2 | 29 | 61,7 | |
| Género | 0,45 c | ||||
| Mujeres | 13 | 28,9 | 17 | 36,2 | |
| Hombres | 32 | 71,1 | 30 | 63,8 | |
| Peso (kg) | 0,99 a | ||||
| Media/SD | 12,3 ± 0,42 | 12,3 ± 0,45 | |||
| Cirugía | 0,64 b | ||||
| Cirugía pediátrica | 28 | 50,9 | 26 | 49,1 | |
| Cirugía Plástica | 5 | 36,7 | 7 | 63,6 | |
| Gastroenterología | 2 | 66,7 | 1 | 33,3 | |
| Neurocirugía | 2 | 100,0 | 0 | 0,0 | |
| Odontología | 1 | 25,0 | 3 | 75,0 | |
| Ortopedia | 5 | 50,0 | 5 | 50,0 | |
| Otorrinolaringología | 4 | 57,1 | 3 | 42,9 | |
| Tipo de alimento | 0,01 b | ||||
| Líquidos claros | 21 | 46,7 | 10 | 21,3 | |
| Sólidos | 8 | 17,8 | 20 | 42,5 | |
| Leche materna | 5 | 11,1 | 8 | 17,0 | |
| Leche de fórmula | 11 | 24,4 | 9 | 19,2 | |
| Horas de ayunos | 0,18 d | ||||
| Mediana | 6,4 | 10 | |||
| Rango intercuartílico | 5,3 - 11,3 | 6 - 11,4 | |||
a Prueba t de Student; b Prueba exacta de Fisher; c2 Prueba de x2; d Prueba de Kruskal-Wallis. DE: Desviación estándar.
Fuente: Autores.
Los niveles de glucosa en sangre no difirieron significativamente entre ambos grupos (grupo A: 78,6 mg/dL; IC 95% 74,9 -82,2 - grupo B: 82,3 mg/dL; IC 95% 79,8 -84,9; P: 0,09, Tabla 2). Solo 16 pacientes se presentaron al área preoperatoria con niveles de glicemia por debajo de 70 mg/dL (17,4%). No hubo ninguna relación entre la edad y la presencia de hipoglicemia. En el modelo de regresión logística, una glicemia por encima de 70 mg/dL fue un factor de protección para el desarrollo de cetosis, reduciendo el riesgo en un 83% (OR 0,16 IC 95% 0,04 - 0,69).
Ansiedad preoperatoria y deshidratación
Diez pacientes presentaron niveles significativos de ansiedad (11%). Hubo una diferencia estadísticamente significativa en los niveles de ansiedad entre los grupos (P: 0,75). Se encontraron niveles de ansiedad significativos en 41,3% de los pacientes con exceso de ayuno de más de 1 hora. Diez pacientes (10,9%) tuvieron deshidratación sin una diferencia estadísticamente significativa entre los grupos (P = 0,48) (grupo A: 8,4%; IC 95% 2,8 - 18,6 - grupo B: 15,1%; IC 95% 5,1 - 31,8).
DISCUSIÓN
Este estudio mostró una mayor incidencia de cetonemia entre los pacientes menores de 48 meses de edad sometidos a ayuno diurno versus pacientes sometidos a ayuno nocturno. No hubo diferencia en la incidencia de deshidratación, ansiedad, o glicemia entre ambos grupos. En un análisis de subgrupos, un nivel de glucosa superior a 70 mg/dL representó un factor de protección contra el desarrollo de cetonemia, mientras que se encontró que los líquidos claros eran un factor de riesgo de cetonemia.
Los cuerpos cetónicos se producen en las mitocondrias, incluyendo el B-hodroxibutirato, el acetoacetato, y acetona. Durante cetosis, la elevación de cada tipo de cuerpo cetónico es variable y el índice de cuerpos cetónicos cambia (la proporción entre las concentraciones de beta-hidroxibutirato y acetoacetato). Un valor normal de 1:1 aumenta a un índice de 6:1 con el ayuno. 6 Por lo tanto, el beta-hidroxibutirato es el cuerpo cetónico predominante en la mayoría de los estados metabólicos anormales. El valor de referencia se ha descrito en 0,3 mmol/L; sin embargo, los niveles por encima de 0,5 mmol/L son más aceptados de manera general en estudios en adultos y niños. 1,7
Estudios anteriores han documentado elevación de los niveles de cuerpos con tiempos de ayuno preoperatorio prolongados. Dennhardt y Col. en su estudio mostraron una correlación entre cuerpos cetónicos elevados y las horas de ayuno preoperatorio en una población pediátrica. 8) Este efecto podría explicarse por una menor concentración de glucógeno en hígado, lo cual significa que cortos periodos de ayuno están acompañados por concentraciones significativas de cuerpos cetónicos a niveles similares a los que se encuentran en la población adulta después de varios días de ayuno. 2,9
Este estudio muestra un nivel significativamente elevado de cuerpos cetónicos en el grupo de ayuno diurno en comparación con el grupo de ayuno nocturno. Morimoto y Col., observó un efecto similar, identificando que la programación diurna para procedimientos quirúrgicos es un factor de riesgo para el desarrollo de cetonemia (OR 4,16; IC 95% 1,29 - 12,76). 10 Esto pudiera deberse al tipo de comida ingerida antes de la cirugía. En este trabajo, la concentración de cuerpos cetónicos fue mayor entre los pacientes que tomaron líquidos claros antes del ayuno en comparación con otros tipos de comida. Por lo tanto, a pesar de que los pacientes que se sometieron a cirugía en la tarde tuvieron menos horas de ayuno, la ingesta de energía podría ser insuficiente para estimular la liberación de insulina, inhibiendo así la producción acelerada de cuerpos cetónicos, como lo muestran Niiya y Col., 11
Vale la pena resaltar que la proporción de pacientes menores a 12 meses fue significativamente menor que la de otros grupos etarios, lo cual pudiera asociarse con la ausencia de una diferencia estadísticamente significativa en la concentración de cuerpos cetónicos entre el ayuno diurno y el nocturno en este rango de población.
Este hallazgo subraya la necesidad de determinar la cantidad de calorías incluidas en los líquidos claros que deberá recomendarse a los pacientes. Además, el consumo de energía durante el día es significativamente mayor debido a los altos niveles de actividad física y mental que durante la noche 12, lo cual produce un consumo prematuro de los depósitos de glucógeno en el hígado, el cual es escaso en pacientes jóvenes. 2 La insulina se rige por un comportamiento circadiano, mostrando niveles elevados durante las horas del día. No obstante, se ha identificado una mayor resistencia a la insulina en horas de la tarde. 13 La combinación de todos estos factores promueve la cetosis y el catabolismo durante el ayuno diurno.
El uso de terapia oral de carbohidratos durante el preoperatorio ha demostrado que limita el catabolismo y la cetogénesis postoperatoria, al aumentar la resistencia a la insulina en un 50%, reduciendo los niveles de deshidratación y mejorando la satisfacción global en la población adulta. 14 Los estudios en pacientes pediátricos son escasos. La administración de solo 5 mL/kg de una solución de glucosa de 0,5 kcal/mL 2 horas antes de la cirugía, disminuyó el volumen gástrico y la incidencia de nausea y vómito postoperatorio, en comparación con las recomendaciones de ayuno usuales. 15
De manera similar a lo que se ha reportado en otros estudios 8,16, los niveles de glicemia se mantuvieron dentro de rangos normales a pesar de períodos de ayuno prolongados. No hubo ninguna asociación entre edad, horas de ayuno y tiempo del ayuno (día o noche) e hipoglicemia. El impacto de valores normales de glicemia para prevenir la cetonemia y la importancia de una ingesta calórica adecuada antes de la cirugía, está respaldad por nuestros resultados.
El ayuno preoperatorio es una estrategia emergente para reducir el riesgo de broncoaspiración. Sin embargo, estudios recientes muestran una baja incidencia (9,3/10.000) 17 y menor mortalidad por broncoaspiración en la población pediátrica. 18 El ayuno preoperatorio prolongado no produce beneficios adicionales en términos de disminución del volumen gástrico y niveles de pH. 19 Un intervalo de ayuno completo no garantiza la ausencia de contenidos gástricos, puesto que hasta un 6,2% de los pacientes tienen hallazgos de estómago lleno en la ecografía gástrica. 20 Por lo tanto, no está justificado un ayuno preoperatorio prolongado en la población pediátrica.
Un estudio prospectivo similar 21 también reportó tiempos prolongados de ayuno hasta en un 88% de los casos. En esta investigación, el exceso de ayuno de una o más horas iba acompañado de cetonemia significativa en 48,9% de los pacientes, resaltando así la necesidad de mantener los tiempo mínimos de ayuno para evitar el catabolismo preoperatorio.
A pesar de haber informado a los padres acerca de las recomendaciones de ayuno preoperatorio durante la visita preanestesia, el nivel de adherencia encontrado en nuestro estudio fue muy bajo. La falta de comprensión y el temor a las complicaciones derivadas de un ayuno corto, se han identificado como factores causales importantes. 22 Los estudios intervencionistas se han enfocado en mejorar la educación y la calidad de la información a través de instrucciones por escrito y llamadas telefónicas antes del procedimiento quirúrgico, lo cual ha tenido un impacto positivo sobre la adherencia a las recomendaciones sobre ayuno prequirúrgico. 23 Adicionalmente, los hallazgos reflejan la necesidad de adoptar esquemas de ayuno más cortos en nuestro medio. Anderson y Col. describen en su estudio un tiempo medio de ayuno de líquidos claros de 4 horas, con un 33% de incidencia de ayuno de más de 6 horas cuando se usa el esquema 6-4-2. 24 La introducción del esquema de ayuno 6-4-1 recomendado por la Sociedad Europea de Anestesia Pediátrica 25, permite la ingesta de líquidos claros de hasta 3 mL/kg una hora antes de cirugía electiva y no se ha correlacionado con aumentos en la incidencia de broncoaspiración en pacientes pediátricos. 26 Por otra parte, recientemente se ha recomendado una reducción en los tiempos de ayuno de leche materna. 27
El impacto del ayuno prolongado afecta negativamente la experiencia del paciente y de la familia durante el período perioperatorio. El sentir más hambre y sed produce ansiedad y tristeza en los pacientes y sus familias. 28 En este estudio, no se encontró ninguna relación entre las horas de ayuno y el momento del ayuno (diurno o nocturno) con estos desenlaces clínicos. Se observó un resultado contrario en el estudio clínico realizado por Zamora y Col. 16, donde se describe aumento de la irritabilidad y des-hidratación en el grupo de pacientes con ayuno nocturno dentro de un rango etario de 2 a 8 años.
Los autores reconocen ciertas limitación en este trabajo. Debido a la dinámica de los horarios de cirugía durante el período de estudio, tuvimos una menor proporción de pacientes menores de 12 meses de edad en el grupo de ayuno diurno, lo cual pudiera haber afectado el análisis de este grupo etario. Más aun, no se midieron las calorías ingeridas antes de la cirugía, factor que pudiera haber afectado los niveles resultantes de cuerpos cetónicos y de glucosa. La no aleatorización y el tipo de estudio observacional, son factores limitantes para llegar a conclusiones y extrapolar los resultados. No obstante, nuestros resultados destacan la importancia de acortar los tiempos de ayuno y de recomendaciones futuras acerca de los requisitos de ingesta calórica antes de cirugía para contrarrestar los efectos negativos del catabolismo.
CONCLUSIONES
Existe un mayor riesgo de cetonemia preoperatoria en pacientes menores de 48 meses de edad que se someten a ayuno diurno, en comparación con ayuno nocturno. Se necesitan más estudios para determinar la ingesta calórica óptima antes de cirugía y reducir el riesgo de cetonemia. Es necesario mejorar las estrategias para reducir el número de horas de ayuno preoperatorio, de acuerdo con las guías de ayuno prequirúrgico.
DECLARACIONES ÉTICAS
Aprobación del Comité de Ética
El estudio recibió la aprobación del comité de ética del Hospital Infantil Rafael Henao Toro en Manizales, Colombia (IRB número CBCS-091). Los padres o los representantes legales entregaron su consentimiento informado.
Protección de sujetos humanos y animales
Los autores declaran que no se realizaron experimentos en humanos ni en animales para el presente estudio. Los autores declaran que los procedimientos seguidos estuvieron de acuerdo con las disposiciones del comité de ética pertinente y con las del Código de Ética de la Asociación Médica Mundial (Declaración de Helsinki).
Confidencialidad de la información
Los autores declaran que han seguido los protocolos de su centro de trabajo con respecto a la publicación de datos de los pacientes.
Derecho a la privacidad y consentimiento informado
Los autores declaran que no se divulgaron datos de pacientes en el presente artículo.
Los autores obtuvieron los consentimientos informados de los pacientes o sujetos mencionados en el presente artículo. El autor para correspondencia está en posesión del documento.
AGRADECIMIENTOS
Contribuciones de los autores
AT: Concepción del proyecto original; planeación del estudio y recolección de datos, interpretación de los resultados y redacción final y aprobación del manuscrito.
AR: Plan de estudio, recolección de datos, interpretación de los resultados, análisis de los datos y redacción inicial y aprobación del manuscrito.
FA: Plan de estudio, interpretación de los resultados, redacción final y aprobación del manuscrito.
Agradecimiento
Los autores agradecen a todo el personal médico y de enfermería del Hospital Infantil de la Cruz Roja en Manizales, Colombia, quienes contribuyeron a la realización de la presente investigación durante la pandemia de la covid-19.
REFERENCIAS
1. Laffel L. Ketone bodies: a review of physiology, pathophysiology and application of monitoring to diabetes. Diabetes Metab Res Rev. 1999;15:412-26. doi: https://doi.org/10.1002/(sici)1520-7560(199911/12)15:6<412::aid-dmrr72>3.0.co;2-8 [ Links ]
2. Chaussain JL, Georges P, Olive G, Job JC. Glycemic response to 24-hour fast in normal children and children with ketotic hypoglycemia: II. Hormonal and metabolic changes. J Pediatr. 1974;85(6):776-81. doi: https://doi.org/10.1016/s0022-3476(74)80339-2 [ Links ]
3. Poggiogalle E, Jamshed H, Peterson CM. Circadian regulation of glucose, lipid, and energy metabolism in humans. Metabolism. 2018;84:11-27. doi: https://doi.org/10.1016/j.metabol.2017.11.017 [ Links ]
4. Berghmans JM, Poley MJ, van der Ende J, Weber F, Van de Velde M, Adriaenssens P et al. A Visual Analog Scale to assess anxiety in children during anesthesia induction (VAS-I): Results supporting its validity in a sample of daycare surgery patients. Paediatr Anaesth. 2017;27(9):955-61. doi: https://doi.org/10.1111/pan.13206 [ Links ]
5. Steiner MJ, Dewalt D a. Is this child dehydrated ? JAMA. 2004;291(22):2746-54. doi: https://doi.org/10.1001/jama.291.22.2746 [ Links ]
6. Chiu RW, Ho CS, Tong SF, Ng KF, Lam CW. Evaluation of a new handheld biosensor for point-of-care testing of whole blood beta-hydroxybutyrate concentration. Hong Kong Med J. 2002;8(3):172-6. PMID: 12055361. [ Links ]
7. Donohoe PB, Kessler R, Beattie TF. Exploring the clinical utility of blood ketone levels in the emergency department assessment of paediatric patients. Emerg Med J. 2006;23(10):783-7. doi: https://doi.org/10.1136/emj.2006.035758 [ Links ]
8. Dennhardt N, Beck C, Huber D, Nickel K, Sander B, Witt LH, et al. Impact of preoperative fasting times on blood glucose concentration, ketone bodies and acid-base balance in children younger than 36 months: A prospective observational study. Eur J Anaesthesiol. 2015; doi: https://doi.org/10.1097/EJA.0000000000000330 [ Links ]
9. Bougneres PF, Lemmel C, Ferre P, Bier DM. Ketone body transport in the human neonate and infant. J Clin Invest. 1986;77(1):42-8. doi: https://doi.org/10.1172/JCI112299 [ Links ]
10. Morimoto Y, Sugimura M, Hanamoto H, Niwa H. Risk factors for hyperketonemia in cleft lip and palate infants during general anesthesia. J Oral Maxillofac Surg. 2012;70(6):1449-55. doi: http://dx.doi.org/10.1016/j.joms.2011.03.049 [ Links ]
11. S Niiya 1, T Nakamura, T Hara, M Miyako MF. The effect of calories of preoperative oral intake on the glucose metabolic response in children. Masui Japanese J Anesthesiol. 1999;48(4):362-7. PMID: 10339932 [ Links ]
12. Krauchi K, Wirz-Justice A. Circadian rhythm of heat production, heart rate, and skin and core temperature under unmasking conditions in men. Am J Physiol - Regul Integr Comp Physiol. 1994;267(3 36-3). doi: https://doi.org/10.1152/ajpregu.1994.267.3.R819 [ Links ]
13. Bass J, Takahashi JS. Circadian integration of metabolism and energetics. Science. 2010;330(60 09):1349-54. doi: https://doi.org/10.1126/science.1195027 [ Links ]
14. Nygren J, Thorell A, Ljungqvist O. Preoperative oral carbohydrate therapy. Curr Opin Anaesthesiol. 2015;28(3):364-9. doi: https://doi.org/10.1097/ACO.0000000000000192 [ Links ]
15. Tudor-Drobjewski BA, Marhofer P, Kimberger O, Huber WD, Roth G, Triffterer L. Randomised controlled trial comparing preoperative carbohydrate loading with standard fasting in paediatric anaesthesia. Br J Anaesth. 2018;121(3):656-61. doi: https://doi.org/10.1016/j.bja.2018.04.040 [ Links ]
16. Castillo-Zamora C, Castillo-Peralta LA, Nava-Ocampo AA. Randomized trial comparing overnight preoperative fasting period Vs oral administration of apple juice at 06:00-06:30 AM in pediatric orthopedic surgical patients. Paediatr Anaesth . 2005;15(8):638-42. doi: https://doi.org/10.1111/j.1460-9592.2005.01517.x [ Links ]
17. Habre W, Disma N, Virag K, Becke K, Hansen TG, Jöhr M, et al. Incidence of severe critical events in paediatric anaesthesia (APRICOT): a prospective multicentre observational study in 261 hospitals in Europe. Lancet Respir Med. 2017;5(5):412-25. doi: http://dx.doi.org/10.1016/S2213-2600(17)30116-9 [ Links ]
18. Beach ML, Cohen DM, Gallagher SM, Cravero JP. Major Adverse Events and Relationship to Nil per Os Status in Pediatric Sedation/Anesthesia Outside the Operating Room: A Report of the Pediatric Sedation Research Consortium. Anesthesiology. 2016;124(1):80-8. doi: https://doi.org/10.1097/ALN.0000000000000933 [ Links ]
19. Brady MC, Kinn S, Ness V, O'Rourke K, Randhawa N, Stuart P. Preoperative fasting for pre-venting perioperative complications in children. Cochrane Database Syst Rev. 2009;(4). doi: http://doi.wiley.com/10.1002/14651858.CD005285.pub2 [ Links ]
20. Van De Putte P, Vernieuwe L, Jerjir A, Vers-chueren L, Tacken M, Perlas A. When fasted is not empty: A retrospective cohort study of gastric content in fasted surgical patients. Br J Anaesth . 2017;118(3):363-71. doi: https://doi.org/10.1093/bja/aew435 [ Links ]
21. Beck CE, Rudolp D, Becke-Jakob K, Schindler E, Etspüler A, Trapp A, et al. Real fasting times and incidence of pulmonary aspiration in children: Results of a German prospective multicenter observational study. Paediatr Anaesth . 2019;29(10):1040-5. doi: https://doi.org/10.1111/pan.13725 [ Links ]
22. Karan S, Indu B, Divya J. Parent's perception and factors affecting compliance with preoperative fasting instructions in children undergoing day care surgery: A prospective observational study. Indian J Anaesth. 2019;49(4):257-62. doi: https://doi.org/10.4103/ija.IJA_794_19 [ Links ]
23. Newton RJG, Stuart GM, Willdridge DJ, Thomas M. Using quality improvement methods to reduce clear fluid fasting times in children on a preoperative ward. Paediatr Anaesth . 2017;27(8):793-800. doi: https://doi.org/10.1111/pan.13174 [ Links ]
24. Andersson H, Hellstrõm PM, Frykholm P. Introducing the 6-4-0 fasting regimen and the incidence of prolonged preoperative fasting in children. Paediatr Anaesth . 2018;28(1):46-52. doi: https://doi.org/10.1111/pan.13282 [ Links ]
25. Thomas M, Morrison C, Newton R, Schindler E. Consensus statement on clear fluids fasting for elective pediatirc general anesthesia. Paediatric Anaesthesia. 2018. doi: https://doi.org/10.1111/pan.13370 [ Links ]
26. Beck CE, Rudolph D, Mahn C, Etspüler A, Korf M, Lüthke M, et al. Impact of clear fluid fasting on pulmonary aspiration in children undergoing general anesthesia: Results of the German prospective multicenter observational (NiKs) study. Paediatr Anaesth . 2020;30(8):892-9. doi: https://doi.org/10.1111/pan.13948 [ Links ]
27. Frykholm P, Disma N, Andersson H, Beck C, Bouvet L, Cercueil E, et al. Pre-operative fasting in children: A guideline from the European Society of Anaesthesiology and Intensive Care. Eur J Anaesthesiol . 2022;39(1):4-25. doi: https://doi.org/10.1097/EJA.0000000000001599. [ Links ]
28. Al-Robeye AM, Barnard AN, Bew S. Thirsty work: Exploring children's experiences of preoperative fasting. Paediatr Anaesth . 2020;30(1):43-9. doi: https://doi.org/10.1111/pan.13759 [ Links ]
Recibido: 27 de Marzo de 2022; Aprobado: 11 de Junio de 2022; Aprobado: 09 de Marzo de 2023











 text in
text in