Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347On-line version ISSN 2256-2087
Rev. colomb. anestesiol. vol.51 no.4 Bogotá Oct./Dec. 2023 Epub Dec 01, 2023
https://doi.org/10.5554/22562087.e1086
Artículo original
Profilaxis de náuseas y vómito posoperatorio: una metarrevisión de revisiones sistemáticas y metaanálisis
a Institución Universitaria Visión de las Américas. Pereira, Colombia.
b Grupo de Investigación Biomedicina, Fundación Universitaria Autónoma de las Américas. Pereira, Colombia.
c Programa de Maestría en Epidemiología, Facultad de Ciencias de la Salud y del Deporte, Fundación Universitaria del Área Andina. Bogotá, Colombia.
Introducción:
Las náuseas y el vómito posoperatorios (NVPO) son comunes en pacientes quirúrgicos bajo anestesia general y se han planteado múltiples estrategias para prevenirlos.
Objetivo:
Describir la evidencia disponible sobre la efectividad de las estrategias farmacológicas y no farmacológicas para prevenir las NVPO en adultos sometidos a cirugía bajo anestesia general, según lo descrito en metaanálisis y revisiones sistemáticas previas.
Metodología:
Se realizó una metarrevisión de revisiones sistemáticas y metaanálisis. Se ejecutaron búsquedas en PubMed, EBSCO, Embase, Cochrane Database, ScienceDirect y Scopus, sin restricción por sexo, condición clínica ni fecha de publicación, solo de artículos en español, francés e inglés. Dos revisores llevaron a cabo tamizaje, extracción de datos, evaluación de calidad y riesgo de sesgo según AMSTAR-2, de manera independiente y en duplicado. Se siguieron las declaraciones PRISMA y PRIOR para el reporte, previo registro en Prospero CRD42021251999.
Resultados:
De 80 artículos candidatos, se seleccionaron tres viables para realización de metaanálisis. La dexametasona entre 1,5 mg y 18 mg mostró un RR=0,48 (IC95 % [0,41-0,57]; p<0,001), I2=63 % (p=0,07) y un NNTc 5 y 7. Otras estrategias efectivas incluyen el uso de acuestimulación/acupuntura/acupresión, antagonistas 5HT3, antagonistas NK1, gabapentinoides, haloperidol, droperidol, metoclopramida, midazolam, mirtazapina, entre otras. El riesgo de sesgo de las publicaciones fue bajo.
Conclusión:
Diferentes estrategias son efectivas para profilaxis NVPO en cirugías con anestesia general. Dexametasona presenta la mejor evidencia disponible al momento. La calidad metodológica documentada sugiere la necesidad de realizar mejores trabajos para determinar la efectividad de las estrategias.
Palabras clave: Náusea y vómito posoperatorios; Anestesia general; Antieméticos; Revisión sistemática; Metaanálisis; Cuidados posoperatorios; Anestesiología
Introduction:
Postoperative nausea and vomiting (PONV) are common complications in surgical patients undergoing general anesthesia, and multiple strategies have been suggested to prevent them.
Objective:
To describe the available evidence on the effectiveness of pharmacological and non-pharmacological strategies for preventing PONV in adults undergoing surgery under general anesthesia, as reported in previous meta-analyses and systematic reviews.
Methodology:
An overview of systematic reviews and meta-analyses was conducted. Searches were performed in PubMed, EBSCO, EMBASE, Cochrane Database, Science Direct, and Scopus, without restrictions as to gender, clinical condition, or date of publication, including articles in Spanish, French, and English only. Two reviewers independently and in duplicate did the screening, data extraction, quality evaluation, and risk of bias assessment according to AMSTAR-2. The PRISMA and PRIOR statements were followed for reporting. PROSPERO registration number CRD42021251999.
Results:
Out of 80 candidate articles, three were viable for meta-analysis. 1.5 mg to 18 mg doses of Dexamethasone showed a significant reduction in the risk of PONV, with a RR of 0.48 (95 % CI 0.41-0.57; p<0.001), I2=63 % (p=0.07), and a NNTc of 5 and 7. Other effective strategies included the use of acoustic stimulation/acupuncture/acupressure, 5HT3 antagonists, NK1 antagonists, gabapentinoids, haloperidol, droperidol, metoclopramide, midazolam, mirtazapine, among others. The risk of publication bias was low.
Conclusion:
Different strategies are effective for PONV prophylaxis in surgeries under general anesthesia. Dexamethasone shows the best available evidence at the moment. The documented methodological quality suggests the need for better studies to establish the effectiveness of the strategies.
Keywords: Postoperative nausea and vomiting; Anesthesia, general; Antiemetics; Systematic review; Meta-analysis; Postoperative care; Anesthesiology
¿Qué aporta este estudio de nuevo?
La única estrategia con evidencia proveniente de revisiones sistemáticas con metaanálisis -con reporte de calidad alta- es la dexametasona.
En pacientes adultos sometidos a procedimientos quirúrgicos con anestesia general, la dexametasona en dosis de 1,5 mg a 18 mg ha mostrado ser efectiva para la profilaxis de NVPO.
A pesar de la baja calidad de reporte de los estudios publicados, otras estrategias muestran efectividad para la profilaxis de NVPO.
INTRODUCCIÓN
Las náuseas y el vómito posoperatorio (NVPO) son una de las complicaciones perioperatorias más frecuentes en la unidad de cuidados posanestésicos descritas en la literatura 1-3. Puede presentarse como náuseas posoperatorias (NPO), vómito posoperatorio (VPO) o juntas (NVPO), en las diferentes fases de la recuperación posanestésica 1-3. Esta complicación, junto con el dolor, es percibida por los pacientes como uno de los síntomas menos tolerables en el periodo posoperatorio y causa un alto impacto en la satisfacción y en la calidad de la atención. Se relaciona con incremento en los costos de la atención y mayor tiempo de recuperación posoperatoria en unidad de cuidados posanestésicos (UCPA) 2,4. Asimismo, Smith et al. 5 determinaron este fenómeno como la complicación aguda posoperatoria con mayor valor económico relativo según los pacientes.
Un amplio número de revisiones sistemáticas sobre el tema dificulta tanto el manejo de la información como llegar a conclusiones rápidas y prácticas en la prevención clínica de NVPO; sumado al descubrimiento de problemas ético-metodológicos en varias publicaciones del Dr. Fujii, lo que cuestiona la efectividad de determinadas estrategias farmacológicas en campos del cuidado perioperatorio 6-8. En este contexto, hay diferentes revisiones sistemáticas, con o sin metaanálisis, sobre el uso de múltiples opciones de tratamiento farmacológicas y no farmacológicas para profilaxis de NVPO, que han mostrado ser efectivas 9.
El presente documento aborda y sintetiza la información disponible en la evidencia recolectada de revisiones sistemáticas de la literatura y metaanálisis sobre la efectividad de las estrategias farmacológicas y no farmacológicas para la prevención de NVPO evaluadas en pacientes adultos, sin distinción de edad, sexo u otros factores sociodemográficos, sometidos a procedimientos quirúrgicos bajo anestesia general.
MÉTODOS
Se llevó a cabo una metarrevisión de revisiones sistemáticas con metaanálisis (en inglés overview of systematic reviews and meta-analysis o umbrella review). Se siguieron los pasos recomendados en la guía PRISMA 10 y en la lista de chequeo PRIOR. Se estableció como estructura PICO, población: pacientes adultos en estado posoperatorio inmediato que recibieron anestesia general. Como intervención: administración de medicamentos y medidas no farmacológicas para la profilaxis de NVPO. Como comparador: medicamentos antieméticos o profilácticos para NVPO, o placebo. Como outcome o desenlace: efectividad de la intervención en términos de reducción de la cantidad de eventos NVPO.
El protocolo de investigación con registro Prospero CRD42021251999 fue sometido a aprobación por el Comité Curricular de la Facultad de Ciencias de la Salud y el Deporte de la Fundación Universitaria del Área Andina. Dada su naturaleza, se estableció en la categoría de "investigación sin riesgo", según la Resolución 8430 de 1993 del Ministerio de Salud de Colombia 11, por lo que no se hizo necesaria una aprobación por parte de comité de ética en investigación.
Se realizaron búsquedas avanzadas y sistemáticas en PubMed, EBSCO, Embase, Cochrane Database of Systematic Reviews, ScienceDirect y Scopus. La búsqueda inicial se realizó hasta marzo de 2021 y la última actualización de la búsqueda se hizo en septiembre de 2021. No hubo restricción en la fecha original de publicación del artículo. Se incluyeron todas las revisiones sistemáticas con metaanálisis de ensayos clínicos que evaluaron la efectividad de las estrategias farmacológicas y no farmacológicas disponibles para la prevención de NVPO, en pacientes adultos sin restricción de sexo o condición clínica del paciente. Se limitó la búsqueda a artículos en español, inglés y francés. Las estructuras de búsqueda pueden ser consultadas en el Contenido complementario 1.
Uno de los autores buscó de forma simultánea en todas las bases de datos aplicando los términos y estrategias establecidos en el protocolo, y exportó resultados a tablas de Excel®. Luego, de manera independiente y en duplicado, dos de los autores tamizaron los artículos según los criterios de elegibilidad predefinidos. Se registraron las razones de exclusión. Posteriormente, se obtuvieron los textos completos y se tamizaron nuevamente de acuerdo con los criterios de elegibilidad, también se registraron las razones de exclusión. Las diferencias entre revisores se resolvieron por consenso. En caso de no lograrlo, el tercer autor dirimió la decisión. Se realizó una síntesis cualitativa de los resultados, y siempre que fuera posible por calidad de los artículos y metodología apropiada, se incluyeron en la síntesis cuantitativa de la evidencia.
El proceso de extracción de datos se realizó de manera independiente y por duplicado en matrices de Excel®. Como desenlace primario, se evaluaron náuseas y emesis posoperatorias en términos de incidencia del evento en los diferentes grupos de intervención entre las 0 y 24 horas posoperatorias según lo describieran los autores de las revisiones previas. La evaluación de calidad metodológica de los estudios incluidos se realizó mediante la herramienta AMSTAR-2 12,13. Para la revisión se tomaron todas las medidas de resumen presentadas en los artículos publicados, y se buscó convertir las medidas de efecto en risk ratio (RR) para hacer comparaciones. Se incluyeron intervalos de confianza (IC) al 95 %.
Los resultados se organizaron de acuerdo con el tipo de intervención (farmacológica y no farmacológica), incidencia de NVPO para fases 1 y 2 del posoperatorio (POP) según reporte en las revisiones previas y calidad del metaanálisis incluido. Para cada revisión y metaanálisis se registraron PMID/DOI, primeros autores, año de publicación, número de estudios incluidos, población específica con la estrategia de búsqueda utilizada, grupo de comparación, definición clara de la estrategia profiláctica usada en términos de dosis, frecuencia y vía de administración y desenlace primario evaluado. Si se reportaban análisis por subgrupos, se incluyeron esos datos.
El grado de heterogeneidad entre estudios se estimó con el valor de I2, teniendo como punto de corte para heterogeneidad alta un valor de >50 %, heterogeneidad muy alta >75 %, acompañado de una evaluación sobre la incertidumbre en la estimación de heterogeneidad mediante el cálculo de IC 95 %. La significancia estadística se determinó según la prueba Q basada en X2 y se consideró significativo con un valor p<0,05.
Se planteó inicialmente en el protocolo realizar evaluación de sesgos de publicación en los estudios mediante diagramas de embudo (funnel plot) para evaluación de la asimetría en las publicaciones, así como metarregresiones y análisis de sensibilidad por subgrupos. Dado que solamente se seleccionaron tres trabajos para la síntesis cuantitativa, no se presenta este tipo de resultados, puesto que supondría un error estadístico por el diseño de las pruebas. La información fue analizada con el software estadístico RevMan v5.0 de The Cochrane Colaboration, con licencia libre.
Como valoración adicional al metaanálisis, se estimó el número necesario a tratar (NNT) como medida de comparación clínica entre las estrategias 14. Esta aproximación ha sido discutida en términos de confiabilidad, dado que puede estar sometida a sesgos en presencia de factores como la heterogeneidad de los participantes en los diferentes estudios, los tiempos de observación variados en el seguimiento y las diferencias en la aleatorización 15,16. La presente revisión incluyó el NNT calculado por dos metodologías, una clásica tratando como "un único ensayo" (del inglés, treat-as-one-trial) los resultados de la medida de resumen (pooled) y una contemplada como corregida en el Manual Cochrane para revisiones sistemáticas de intervenciones 17, descrita en el texto como NNTc. Se presentaron ambas metodologías con el fin de permitir el contraste entre los resultados.
El análisis de solapamiento (del inglés overlap) es una estrategia recomendada en diversas fuentes de literatura para mitigar posibles sobreestimaciones de efectos para estudios de literatura secundaria 18,19. Se contempla también en el capítulo 15 de Cochrane Handbook for Systematic reviews of interventions 20. En el presente trabajo se realizó análisis de solapamiento para apreciar posibles sesgos de interpretación o de sobreestimación para aquellos trabajos incluidos en la síntesis cuantitativa.
Se determinaron en todo momento las posibles fuentes de plagio para evitar incurrir en alguna de ellas. Los autores declaran no tener conflictos de intereses.
RESULTADOS
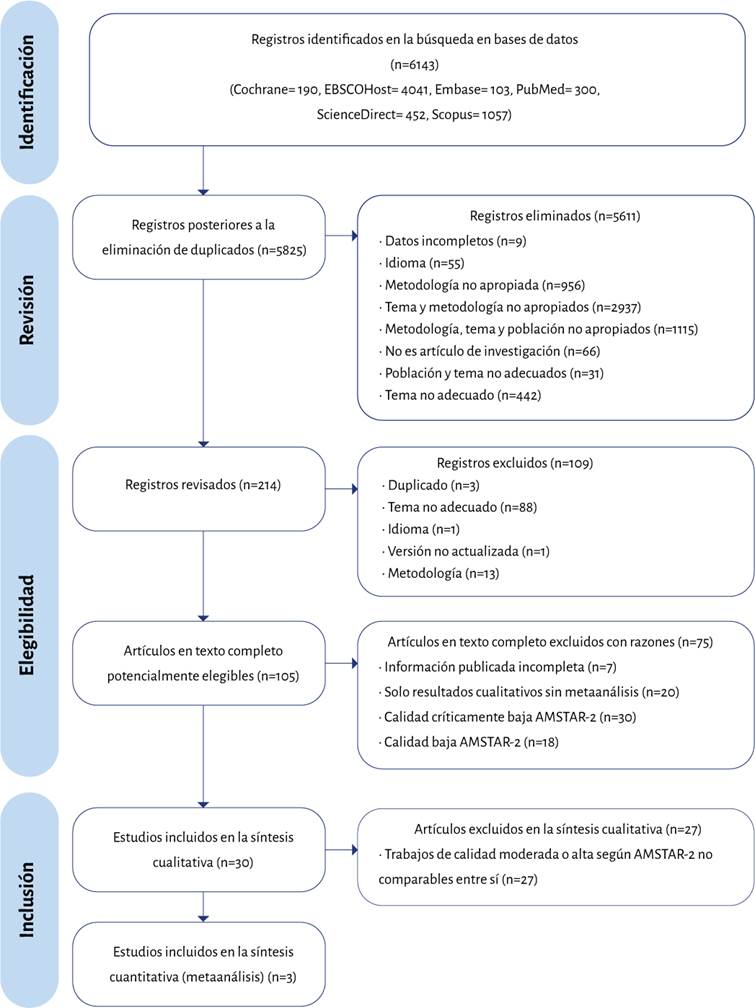
En la Figura 1 se presenta el diagrama de flujo PRISMA del proceso de identificación, selección e inclusión de los estudios. En aras de revisar con mayor sustento la bibliografía disponible, los autores decidieron incluir en la evaluación aquellos artículos que tuvieron calificación moderada y alta.
La aplicación de la guía AMSTAR-2 a los 80 estudios incluidos en la revisión evidenció que el 3,8 % (n=3) tenían calidad alta, el 30,0 % (n=24), moderada, el 23,8 % (n=19), calidad baja y el 42,5 % (n=34), críticamente baja. Ocho de las 16 preguntas planteadas por la herramienta no alcanzaron una puntuación superior al 50 % de cumplimiento en el grupo de investigaciones incluidas. Estas fueron las preguntas 2, 3, 4, 7, 8, 9, 10 y 15.
Con esto se podría establecer que las áreas de mayor debilidad son:
1. Falta de reporte de las fuentes de financiación de los estudios incluidos en las revisiones sistemáticas y metaanálisis.
2. Falta de explicación clara sobre los motivos para elegir diseños metodológicos específicos por incluir en las revisiones sistemáticas y metaanálisis.
3. Falta de exhaustividad al momento de establecer estrategias de búsqueda, esto implica búsquedas en al menos dos bases de datos (relevantes para la pregunta de investigación), proporcionar en el trabajo escrito las palabras clave empleadas o estrategias de búsqueda usadas, describir claramente las restricciones aplicadas y sus justificaciones, búsqueda en listas de referencias de los estudios incluidos, búsqueda en registros de ensayos clínicos o estudios, consulta de expertos en el campo de estudio, búsqueda de literatura gris en caso de aplicar, todo en un periodo inferior a los 24 meses de finalizada la revisión.
4. La falta de declaración explícita en el texto final de que los métodos de la revisión fueron establecidos con anterioridad a su realización con la justificación, en caso de que aplique, sobre cualquier desviación significativa del protocolo.
5. Debilidades para evaluar de manera satisfactoria el riesgo de sesgo de los estudios incluidos en la revisión, principalmente por el uso de escalas no estandarizadas o que no incluyen los orígenes de sesgo descritos en la herramienta. Estas fuentes de sesgo usualmente están incluidas en la escala de riesgo de sesgo de la Colaboración Cochrane para estudios aleatorizados, ROBINS-I para estudios no aleatorizados de intervenciones, New-castle-Ottawa para estudios observacionales, entre otros.
Descripción de los hallazgos
Los hallazgos de cada subgrupo de estrategias están consignados en la Tabla 1. Veintisiete trabajos se clasificaron con calidad moderada o alta según AMSTAR-2, los cuales describen los hallazgos de acetaminofén, acupuntura y acupresión, antagonistas 5HT3, antagonistas NK1, dexametasona y corticosteroides, dexmedetomidina, gabapentinoides, jengibre, líquidos, metoclopramida, midazolam, mirtazapina, naloxona, medidas no farmacológicas no desagregadas, anestesia totalmente intravenosa (TIVA, por las iniciales en inglés de total intravenous anesthesia).
Tabla 1 Descripción cualitativa de los subgrupos de estrategias.
| Estrategia | Autores | Año | Desenlace de interés | Número de estudios incluidos | Contexto clínico de la cirugía | Intervención | Comparador | Modelo de efectos empleado | Medida de efecto reportada | Valor de la medida de efecto con IC | Heterogeneidad I2 % (valor de p) | AMSTAR 2 | Patrocinadores |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Acetaminofén | Doleman B, Read D, Lund JN, Williams JP. | 2015 | VPO | 5 | Múltiples | Acetaminofén preventivo | Acetaminofén posincisión. | Aleatorios | RR | 0,5 (0,31-0,83) | 0 % (0,96) | Moderada | Declaran no tener conflictos. |
| Acupuntura y acupresión | Chen J, Tu Q, Miao S, Zhou Z, Hu S. | 2020 | VPO | 7 | Múltiples | Estimulación eléctrica en punto de acupresión | Placebo | Fijos | RR | 0,59 (0,49-0,71) | 27 % (0,22) | Moderada | Declaran no tener conflictos. |
| NVPO | 7 | 0,46 (0,33-0,65) | 46 % (0,09) | ||||||||||
| NPO | 7 | 0,54 (0,42 -0,69) | 0 % (0,8) | ||||||||||
| Acupuntura y acupresión | Cheong K.B., Zhang J.P., Huang Y., Zhang Z.-J. | 2013 | VPO | 3 | Múltiples | Acupuntura PC6 | No intervención | 0,36 (0,19-0,71) | 0 % (0,63) | Moderada | Declarados en el documento. | ||
| VPO | 4 | Acupuntura PC6 | No intervención | 0,82 (0,48-1,38) | 0 % (0,79) | ||||||||
| VPO | 6 | Acupresión PC6 | Simulada | 0,62 (0,49-0,8) | 29 % (0,22) | ||||||||
| VPO | 5 | Electroestimulación PC6 | Simulada | 0,5 (0,36-0,7) | 0 % (0,57) | ||||||||
| NVPO | 6 | Acupresión PC6 y otros | No intervención, impostor | 0,29 (0,17-0,49) | 0 % (0,73) | ||||||||
| VPO | 4 | Acupresión en puntos diferentes a PC6 | No intervención, impostor | 0,32 (0,17-0,61) | 0 % (0,83) | ||||||||
| NVPO | 5 | Acupresión en puntos diferentes a PC6 | No intervención, impostor | 0,63 (0,49-0,81) | 44 % (0,13) | ||||||||
| NPO | 3 | Acupuntura PC6 | No intervención | 0,64 (0,34-1,19) | 74 % (0,15) | ||||||||
| NPO | 3 | Acupuntura PC6 | No intervención | 0,25 (0,10-0,61) | 0 % (0,41) | ||||||||
| NPO | 6 | Acupresión PC6 | Simulada | 0,71 (0,57-0,87) | 13 % (0,33) | ||||||||
| NPO | 5 | Electroestimulación PC6 | Simulada | 0,49 (0,38-0,63) | 0 % (0,75) | ||||||||
| NPO | 3 | Acupresión en puntos diferentes a PC6 | No intervención, impostor | 0,41 (0,24-0,69) | 0 % (0,59Mo-derada | ||||||||
| Antagonistas 5HT3 | Ahn E, Choi G, Kang H, Baek C, Jung Y, Woo Y, Lee S, Chang Y. | 2016 | NPO | 4 | Múltiples | Palonosetrón | Ramosetrón | Fijos | RR | 0,66 (0,45-0,96) | 0 % (0,66) | Moderada | Declarados en el documento. |
| VPO | 8 | 0,66 (0,42-1,03) | 28 % (0,22) | ||||||||||
| NVPO | 4 | 1,66 (1,27-2,18) | 0 % (0,93) | ||||||||||
| Antagonistas 5HT3 | Mihara T, Tojo K, Uchimoto K, Morita S, Goto T. | 2013 | VPO | 7 | Múltiples | Ramosetrón | Placebo | Fijos | RR | 0,48 (0,31-0,74) | 0 % (0,55) | Moderada | Declaran no tener conflictos. |
| VPO | 7 | Ramosetrón | Placebo | Fijos | 0,5 (0,35-0,73) | 0 % (0,5) | |||||||
| VPO | 6 | Ramosetrón | Ondansetrón | Fijos | 0,5 (0,28-0,9) | 7,5 % (0,37) | |||||||
| VPO | 6 | Ramosetrón | Ondansetrón | Fijos | 0,53 (0,34-0,81) | 0 % (0,93) | |||||||
| NPO | 7 | Ramosetrón | Placebo | Fijos | 0,59 (0,47-0,73) | 0 % (0,51) | |||||||
| NPO | 7 | Ramosetrón | Placebo | Aleatorios | 0,65 (0,49-0,85) | 32 % (0,18) | |||||||
| NPO | 6 | Ramosetrón | Ondansetrón | Aleatorios | 0,79 (0,51-1,23) | 71,1 % (0,004) | |||||||
| NPO | 6 | Ramosetrón | Ondansetrón | Aleatorios | 0,78 (0,6-1,02) | 32,8 % (0,19) | |||||||
| Antagonistas NK1 | Liu M, Zhang H, Du BX, Xu FY, Zou Z, Sui B, Shi XY. | 2015 | VPO | 3 | Múltiples | Aprepitant 80 mg | Placebo | Fijos | RR | 0,13 (0,04-0,37) | 0 % (0,79) | Moderada | Declaran no tener conflictos. |
| VPO | 3 | Aprepitant 40 mg | Ondansetrón 4 mg | Fijos | 0,47 (0,37-0,6) | 0 % (0,38) | |||||||
| VPO | 2 | Aprepitant 125 mg | Ondansetrón 4 mg | Aleatorios | 0,32 (0,13-0,78) | 86 % (0,008) | |||||||
| VPO | 2 | Casopitant 50 mg | Placebo | Fijos | 0,38 (0,26-0,53) | 0 % (0,53) | |||||||
| NPO | 3 | Aprepitant 80 mg | Placebo | Fijos | 0,6 (0,47-0,75) | 0 % (0,96) | |||||||
| Antagonistas NK1 | Singh, Preet Mohinder | 2015 | VPO | 15 | Múltiples | Aprepitant 40, 80, 125 | Medicación y placebo | Fijos | RR | 0,48 (0,34-0,67) | 63,4 % (NR) | Moderada | Declaran no tener conflictos. |
| VPO | 7 | 0,54 (0,4-0,72) | 71,5 % (NR) | ||||||||||
| NVPO | 7 | 1,37 (1,1-1,7) | 67,9 % (NR) | ||||||||||
| Dexametasona y corticosteroides | Chen CC, Siddiqui FJ, Chen TL, Chan ES, Tam KW. | 2012 | NVPO | 5 | Tiroidectomía total | Dexametasona 5-8 mg | Placebo o droperidol | Fijos | RR | 0,38 (0,30-0,49) | 30 % (0,22) | Moderada | Declarados en el documento. |
| Dexametasona y corticosteroides | Chen P, Li X, Sang L, Huang J. | 2017 | NVPO | 9 | Artroplastia total de articulación | Dexametesona o equivalentes a 4-40 mg | Placebo/salina | Fijos | NNT | 0,56 (0,44-0,73) | 33,1 % (<0,001) | Moderada | Declaran no tener conflictos. |
| Dexametasona y corticosteroides | Fan Z, Ma J, Kuang M, Zhang L, Han B, Yang B, Wang Y, Ma X. | 2018 | NPO | 6 | Artroplastia de rodilla | Dexametasona IV | Placebo/control | Fijos | OR | 0,33 (0,23-0,47) | 0 % (0,47) | Moderada | Declara-dos en el documento. |
| Dexametosona y corticosteroides | Li B, Wang H. | 2014 | NVPO | 7 | Cirugía de tiroides | Dexametasona 4-10 mg IV | Placebo | Aleatorios | OR | 0,23 (0,13-0,41) | 66 % (0,002) | Moderada | Declaran no tener conflictos. |
| Dexametasona y corticosteroides | Yang Q, Zhang Z, Xin W, Li A. | 2017 | NVPO | 6 | Artroplastia de cadera | Dexametasona IV | Control | Fijos | RR | 0,41 (0,30-0,57) | 0 % (0,550) | Moderada | Declaran no tener conflictos. |
| Dexametasona y corticosteroides | Zou Z, Jiang Y, Xiao M, Zhou R. | 2014 | NVPO | 11 | Tiroidectomía | Dexametasona entre 1,5 18 mg IV | Placebo | Aleatorios | RR | 0,52 (0,43-0,63) | 56 % (0,003) | Moderada | Declaran no tener conflictos. |
| Dexmedetomidina | Wang G, Zhang L, Lou S, Chen Y, Cao Y, Wang R, Zhang L, Tang P. | 2016 | VPO | 5 | Cirugías laparoscópicas | Dexmedetomidina infusión de 0,2-1 µg.kg.min | Placebo | Fijos | RR | 0,36 (0,18-0.72) | 0 % (0,62) | Alta | Declaran no tener conflictos. |
| NPO | 6 | 0,43 (0,28-0.66) | 9 % (0,36) | ||||||||||
| Gabapentinoides | Alayed N, Alghanaim N, Tan X, Tulandi T. | 2014 | NPO | 11 | Histerectomía abdominal | Gabapentina (300 a 1200 mg) | Placebo | Aleatorios | RR | 0,76 (0,66-0,88) | NR | Moderada | Declarados en el documento. |
| VPO | 11 | 0,67 (0,52-0,87) | |||||||||||
| Jengibre | Tóth B, Lantos T, Hegyi P, Viola R, Vasas A, Benkő R, Gyöngyi Z, Vincze Á, Csécsei P, Mikó A, Hegyi D, Szentesi A, Matuz M, Csupor D. | 2018 | VPO | 11 | Múltiples | Jengibre (todas las dosis) | NR | Aleatorios | Log RR | -0,194 (-0,492 0,104) | NR | Moderada | Declarados en el documento |
| VPO | Jengibre (más de 1 g) | -0,360 (-0,744 0,023) | |||||||||||
| NPO | 11 | Jengibre (todas las dosis) | -0,151 (-0,351 0,048) | ||||||||||
| NPO | 6 | Jengibre (más de 1 g) | -0,256 (-0,518 0,007) | ||||||||||
| Líquidos | Jewer, JK; Wong, MJ; Bird, SJ; Habib, AS; Parker, R; George, RB | 2019 | NPO | 18 | Múltiples | 10-30 mL/kg cristaloides IV | No tratamiento | Aleatorios | RR | 0,62 (0,51-0,75) | 56,76 % (0) | Alta | Declaran no tener conflictos |
| NPO | 20 | 0,67 (0,58-0,78) | 9,01 % (0,34) | ||||||||||
| NPO | 17 | 0,47 (0,32-0,69) | 38,27 % (0,05) | ||||||||||
| VPO | 20 | 0,50 (0,40-0,63) | 30,88 % (0,08) | ||||||||||
| VPO | 19 | 0,56 (0,41-0,76) | 0 % (0,92) | ||||||||||
| VPO | 15 | 0,48 (0,29-0,79) | 0 % (0,9) | ||||||||||
| Líquidos | Lee, Myeong Jong; Lee, Cheol; Kang, Hyun; Kim, Hyungtae | 2019 | NVPO | 7 | Múltiples | Cristaloides | Coloides | Aleatorios | RR | 0,802 (0,561-1,145) | NR | Moderada | Declaran no tener conflictos. |
| Líquidos | Yokoyama C, Mihara T, Kashiwagi S, Koga M, Goto T. | 2020 | NPO | 10 | Múltiples | Dextrosa | Cristaloides | Aleatorios | RR | 0,76 (0,59-0,99) | 28 % (NR) | Alta | Declaran no tener conflictos. |
| NPO | 9 | 0,65 (0,48-0,89) | 0 % (NR) | ||||||||||
| VPO | 9 | 1,00 (0,81-1,25) | 0 % (NR) | ||||||||||
| Metoclopramida | De Oliveira GS Jr, Castro-Alves LJ, Chang R, Yaghmour E, McCarthy RJ. | 2012 | NPO | 10 | Múltiples | Metoclopramida 10 mg | Placebo o No tratamiento | Aleatorios | OR | 0,51 (0,38-0,68) | 8 % (0,03) | Moderada | Declarados en el documento. |
| NPO | 13 | 0,49 (0,35-0,68) | 7 % (0,001) | ||||||||||
| NVPO | 13 | 0,58 (0,43-0,78) | 0 % (0,38) | ||||||||||
| NVPO | 11 | 0,52 (0,36-0,75) | 24 % (0,08) | ||||||||||
| VPO | 10 | 0,51 (0,40-0,66) | 0 % (0,07) | ||||||||||
| VPO | 12 | 0,44 (0,29-0,65) | 5 % (0,03) | ||||||||||
| Midazolam | Ahn EJ, Kang H, Choi GJ, Baek CW, Jung YH, Woo YC. | 2016 | NPO | 10 | Múltiples | Midazolam (0,04-5 mg IV) | Placebo | Fijos | RR | 0,53 (0,39-0,71) | 31 % (0,16) | Moderada | Declarados en el documento. |
| VPO | 12 | 0,46 (0,33-0,65) | 0 % (0,87) | ||||||||||
| NVPO | 10 | 0,46 (0,36-0,57) | 31 % (0,16) | ||||||||||
| Midazolam | Grant M.C., Kim J., Page A.J., Hobson D., Wick E., Wu C.L. | 2016 | NPO | 5 | Múltiples | Midazolam (0.035-0.075 mg/kg IV) | Solución salina, Haloperidol, Dexametasona, Ondansetrón o Ramosetrón | Aleatorios | RR | 0,62 (0,40-0,94) | 16 % (0,32) | Moderada | Recursos propios. |
| NVPO | 8 | 0,55 (0,43-0,70) | 15 % (0,31) | ||||||||||
| VPO | 8 | 0,61 (0,45-0,82) | 1 % (0,42) | ||||||||||
| Mirtazapina | Bhattacharjee, Debamita; Doleman, Brett; Lund, Jonathan; Williams, John | 2018 | NVPO | 3 | Múltiples | Mirtazapina 30 mg tableta vía oral, 1 hora antes de cirugía. | Placebo | Aleatorios | RR | 0,44 (0,32-0,62) | 0 % (0,933) | Moderada | Recursos propios. |
| Naloxona | Barrons RW, Woods JA. | 2017 | NPO | 8 | Múltiples | Nalxona (Infusión endovenosa o PCA) | Controles (no claro contra que) | Aleatorios | RR | 0,80 (0,67-0,95) | 61 % (0,01) | Moderada | Recursos propios. |
| VPO | 9 | 0,83 (0,63-1,09) | 34 % (0,15) | ||||||||||
| No farmacológicas | Lee A, Done ML. | 1999 | NPO | 5 | Múltiples | Diferentes formas de acupresión, acupuntura, electrocupuntura, estimulación nerviosa periférica transcutánea | Placebo o antieméticos (metoclopramida, droperidol, proclorperzina) | Aleatorios | RR | 0,47 (0,34-0,64) | NR | Moderada | Declarados en el documento. |
| VPO | 13 | 1,13 (0,95-1,35) | |||||||||||
| TIVA | Schaefer M.S., Kranke P., Weibel S., Kreysing R., Kienbaum P. | 2016 | NPO | 9 | Múltiples tipos | Anestesia total endovenosa | Anestesia balanceada | Aleatorios | RR | 1,17 (0,78-1,76) | 60 % (0,01) | Moderada | Declarados en el documento. |
| NVPO | 12 | 1,06 (0,85-1,32) | 54 % (0,01) |
Fuente: Autores.
Acetaminofén
El uso de acetaminofén vía endovenosa como estrategia para la profilaxis de NVPO fue descrito en el trabajo de Doleman et al. 21 con resultado de la evaluación de calidad según AMSTAR-2 moderada. Doleman et al. obtuvieron RR=0,5 (IC95 % [0,310,83]; p=0,96) para la incidencia de vómito en el posoperatorio (VOP), sin mención del tiempo exacto de observación. Esta investigación se centró en la dinámica del dolor, pero el análisis de la incidencia de VPO fue secundario.
Acuestimulación, acupuntura y acupresión
La investigación realizada por Chen et al. 22 incluyó siete metaanálisis cuyos resultados muestran electroestimulación trans-cutánea como medida profiláctica para NVPO versus placebo. Presentó resultados para náuseas con RR=0,54 (IC95 % [0,420,69]; p<0,001), para la prevención de vómito RR= 0,59 (IC95 % [0,49-0,71]; p=0<0,001) y para la prevención de NVPO un RR=0,46 (IC95 % [0,33-0,65]; p<0,001).
Cheong et al. 23 evaluaron la efectividad de la acupuntura y acupresión en diferentes puntos, con diferentes técnicas, comparadas con medicación, placebo o de operador impostor. Revisaron diferentes estrategias de electroestimulación -acupuntura en punto PC6, acupresión en punto PC6, electroestimulación en PC6, acupresión en PC6 más otros puntos, acupresión en puntos diferentes a PC6-, en sumatoria (agrupados), en los 30 estudios clínicos aleatorizados (ECA) incluidos. Encontraron que realizar acupuntura en el punto PC6 para la profilaxis de náuseas en las primeras 6 horas no es efectivo (RR=0,64; IC95 % [0,341,19]; p=0,150) ni tampoco para la profilaxis de vómito posoperatorio en las primeras 24 horas (RR=0,82, IC95 % [0,48-1,38]; p=0,450). Sin embargo, realizar acupuntura en PC6 para náuseas tempranas y tardías sí mostró efectividad (RR=0,36; IC95 % [0,190,71]; p=0,003 y RR=0,25; IC95 % [0,10-0,61]; p=0,002, respectivamente).
Este mismo trabajo de Cheong mostró que la acupresión en punto PC6 redujo la aparición de náuseas y vómito en las primeras 24 horas del posoperatorio (RR=0,71; IC95 % [0,57-0,87]; p=0,001 y RR=0,62, IC95 % [0,49-0,80]; p<0,001, respectivamente). La electroestimulación en punto PC6 funcionó como profiláctico para náuseas y vómito en el mismo periodo posoperatorio (RR=0,49; IC95 % [0,38-0,63]; p<0,001 para NPO y RR=0,50, IC95 % [0,36-0,70]; p<0,001 para VPO). La estimulación simultánea de PC6 más otros puntos de acupuntura sirvió como profiláctico para la aparición en 24 horas posoperatorias de NVPO (RR=0,29; IC95 % [0,17-0,49]; p<0,001). La estimulación de otros puntos de acupuntura diferentes a PC6 fue útil para la profilaxis para NVPO en las primeras 24 horas (RR=0,63; IC95 % [0,49-0,81]; p<0,001). A pesar de los resultados presentados, los autores declaran una baja calidad de los estudios incluidos con alta posibilidad de sesgo, por lo que recomiendan tomar con precaución los resultados.
Antagonistas 5HT3
Ahn et al. 24 resumieron la evidencia respecto al uso de palonosetrón versus ramo-setrón como estrategia para la profilaxis de NVPO, sin encontrar diferencias estadísticamente significativas (RR=1,07; IC95 % [0,601,92]; p=0,03). Declararon limitación de los datos de artículos incluidos en el análisis dada la naturaleza de los estudios incluidos y la baja confiabilidad que debe tenerse sobre los resultados, puesto que los estudios tuvieron poblaciones poco numerosas.
Mihara et al. 25 realizaron una revisión sistemática con metaanálisis declarando la no inclusión de los datos reportados por Fujii, debido al sesgo que ello podría implicar. Evaluaron el efecto de aplicar ramosetrón versus ondansetrón u otras estrategias farmacológicas como comparadores en la prevención de NVPO, encontraron que es superior a placebo (RR= 0,59; IC95 % [0,470,73]; p<0,001), pero no mayor que en hallazgos de otros metaanálisis. Concluyeron que el ramosetrón puede ser más efectivo que el ondansetrón en la prevención del VPO, pero que su significado en la clínica es cuestionable dado el NNT alto en las intervenciones.
Antagonistas NK1
Liu et al. 26 describieron de manera sistemática la evidencia revisada hasta el 2014 respecto al uso de aprepitant y otros antagonistas NK1 en el efecto sobre NVPO. Concluyeron que el uso de este grupo de medicamentos, en especial el aprepitant -con mayor evidencia disponible en la literatura médica al momento-, fueron efectivos para el control de NVPO en comparación con placebo (para náuseas RR=0,6; IC95 % [0,47-0,75]; p<0,001; y para vómito RR=0,13; IC95 % [0,04-0,37]; p<0,001).
Singh et al. 27, en la evaluación de aprepitant en profilaxis para NVPO, encontraron que reduce la incidencia de vómito en el primer día del posoperatorio (OR=0,48; IC95 % [0,34-0,67]; sin reporte de valor p), aunque dicho hallazgo implica heterogeneidad difícil de explicar, según declararon los autores, aspecto que disminuye la fuerza de la evidencia. Reportaron también que su utilización reduce el uso de medicación de rescate y que la administración oral del medicamento es equivalente a la administración vía parenteral.
Dexametasona y corticosteroides
Chen et al. 28 sintetizaron los resultados de cinco estudios que evaluaron el uso de dexametasona como profiláctico para NVPO en pacientes sometidos a tiroidectomía. Encontraron que dicho medicamento redujo la incidencia de NVPO (RR=0;38; IC95 % [0,30-0,49]; sin reporte de valor p) y los requerimientos analgésicos posoperatorios.
Fan et al. 29 recopilaron información acerca de los desenlaces posoperatorios de la dexametasona en pacientes sometidos a artroplastia total de rodilla, evaluaron como desenlace dolor y NVPO y encontraron que redujo la incidencia de NVPO (OR=0,33; IC95 % [0,23-0,47]; p<0,001). Los investigadores recomiendan aumentar el número de estudios para mejorar la confianza en los resultados.
Li y Wang 30 realizaron un metaanálisis sobre la evidencia disponible en 2014 respecto al uso de dexametasona en la prevención de NVPO en pacientes con cirugías de tiroides. Incluyeron los estudios de Fujii y encontraron inclusive que uno de ellos puede ser un factor confusor y es de menor calidad que otros. Concluyeron que el uso de una dosis de dexametasona preoperatoria reduce la incidencia y severidad de NVPO en pacientes sometidos a tiroidectomía (SMD=0,23; IC95 % [0,13-0,41]; p<0,001).
Yang et al. 31 resumieron la evidencia científica disponible sobre el uso de corticoides -dexametasona, metilprednisolona o hidrocortisona, tomando dosis equivalentes con dexametasona como referente- versus controles para la prevención de NVPO y dolor en el posoperatorio; concluyeron que la incidencia de NVPO y dolor se ve reducida en el posoperatorio de la artroplastia total de cadera con el uso de corticoides (RR=0,41; IC95 % [0,30-0,57]; p<0,001); sin embargo, recomiendan que sus resultados sean tomados con cautela dada la variación de las dosis, la calidad metodológica y la dimensión de los estudios en cuanto a cantidad de pacientes incluidos.
Zou et al. 32 realizaron en un metaanálisis sobre el uso de dexametasona en el preoperatorio de tiroidectomía para reducir la incidencia de NVPO. Encontraron que administrar dosis de 8 a 10 mg antes de la inducción de anestesia es una estrategia segura y efectiva para reducir la incidencia de NVPO (RR=0,52; IC95 % [0,43-0,63]; p<0,001), reducción del uso de antieméticos de rescate, dolor posoperatorio y la necesidad de uso de medicación analgésica de rescate.
Dexmedetomidina
Quince estudios previos sirvieron a Wang et al. (33) para determinar que el uso de dexmedetomidina es efectivo como profiláctico para NVPO (para náuseas, RR=0,43; IC95 % [0,28-0,66]; p<0,001; y para vómito RR=0,36; IC95 % [0,18-0,72]; p=0,004), así como para reducir el temblor posoperatorio y disminuir la necesidad de antieméticos de rescate en pacientes llevados a cirugía laparoscópica.
Gabapentinoides
A pesar de tener otro resultado primario para la evaluación del uso de gabapentina en medicina perioperatoria, Alayed et al. (34) encontraron que la administración de gabapentina versus placebo es efectiva como profiláctica para náuseas (RR= 0,76; IC95 % [0,66-0,88]; sin reporte de valor p).
Jengibre
Chaiyakunapruk et al. 35 realizaron un metaanálisis de cinco trabajos que evaluaron el uso de jengibre como profiláctico para NVPO. Describieron que la administración de 1 gr de jengibre resultó ser efectiva en comparación con placebo (para náuseas RR=0,69; IC95 % [0,54-0,89]; sin reporte de p. Para vómito RR=0,61; IC95 % [0,45-0,84]; sin reporte de valor p). Contrariamente, Tóth et al. 36 evaluaron 10 investigaciones sobre el uso de jengibre como profiláctico para NVPO versus placebo y no encontraron diferencias estadísticamente significativas, principalmente por la alta heterogeneidad de las investigaciones originales.
Líquidos
Jewer et al. 37 analizaron estadísticamente la información de 41 trabajos originales que evaluaron el uso de cristaloides y encontraron que su uso en cirugías electivas redujo la incidencia de NVPO, sin tener claro el desenlace en cirugías de urgencias por la variabilidad en las mediciones de los trabajos primarios.
Lee et al. 38 revisaron la evidencia disponible de nueve ensayos clínicos que evaluaron la incidencia de NVPO en grupos de intervención con coloides comparados con cristaloides como estrategia. Encontraron que la administración perioperatoria de coloides no reduce la incidencia de NVPO (RR=0,8; IC95 % [0,56- 1,15]; p=0,224) comparado con cristaloides en cirugías sin diferencia de tiempo de duración, pero que había diferencia en aquellas cirugías mayores con duración superior a 3 horas y en las que se usó infusión de coloides (RR=0,63; IC95 % [0,44- 0,89]; p=0,009) comparado con el grupo de infusión de cristaloides (RR=1,24; IC95 % [0,74-2,09]; p=0,408). A pesar de este hallazgo estadístico, refieren la necesidad de tener mejores modelos metodológicos con mayor cantidad de pacientes para comprobar esta asociación.
Yokohama et al. 39 analizaron la información de 11 investigaciones previas y encontraron que la administración de dextrosa disminuye la incidencia de náuseas comparada con placebo (para náuseas tempranas RR=0,76; IC95 % [0,59-0,99]; sin reporte de valor p. Para náuseas tardías RR=0,65; IC95 % [0,48-0,89]; sin reporte de valor p), pero no encuentran diferencias en la incidencia de vómito.
Metoclopramida
De Oliveira et al. 40 evaluaron 30 artículos originales sobre el uso de metoclopramida para la profilaxis de NVPO. Encontraron que la dosis de 10 mg vía endovenosa es efectiva para la prevención de NVPO en comparación con placebo (RR=0,58; IC95 % [0,43-0,78], sin reporte de valor p). Tuvieron en cuenta realizar subanálisis de tres artículos publicados por Fujii, dado el riesgo de sesgo que representaba, sin encontrar alteraciones en los resultados finales.
Midazolam
Ahn et al. 41 sintetizaron la evidencia disponible para el uso de midazolam vía intravenosa como estrategia para profilaxis NVPO. Encontraron que la dosis entre 0,04 y 5 mg resulta efectiva para la disminución de eventos en el posoperatorio (RR= 0,45; IC95 % [0,36-0,57]; p<0,001).
Grant et al. 42 evaluaron la eficacia del midazolam en el pre o intraoperatorio para prevenir la incidencia de NVPO, el cual mostró ser efectivo en la incidencia de NVPO (RR=0,55; IC95 % [0,43-0,70]; sin reporte de valor p) hasta por 24 horas en comparación con administración de placebo.
Mirtazapina
Dado que la mirtazapina es un antidepresivo con diversos mecanismos de acción, que incluyen el antagonismo de los receptores de serotonina 5HT3, se ha descrito como profiláctico en NVPO. El trabajo de Bhattacharjee et al. 43 encontró en tres de siete estudios incluidos en su revisión que la administración de 30 mg vía oral de mirtazapina 1 a 2 horas antes de cirugía redujo significativamente las NVPO, con un RR=0,44 IC95 % [0,320,62], I2 0 %), resultados confirmados con un análisis secuencial de ensayos (TSA, por las iniciales en inglés de trial sequential analysis). En un único estudio, de baja calidad, hallaron una comparación del fármaco con ondansetrón, cuyos hallazgos lo postulan como equiefectivo. Como ventajas del fármaco, basados en estudios de baja calidad, mencionan la reducción de ansiedad preoperatoria; sin embargo, esto se reflejó también en mayor sedación durante el posoperatorio.
Naloxona
Un único estudio sobre este fármaco llevado a cabo por Barrons et al. 44 publicado en 2017, planteó la importancia de la administración de opioides en el perioperatorio como fuente de NVPO. Propusieron que la administración de dosis bajas de naloxona puede tener un efecto dosis-dependiente frente a desenlaces específicos, en este caso NVPO. El estudio describió un beneficio en la administración de naloxona en el perio-peratorio en estudios con un mínimo de 24 horas de observación para el desenlace NPO con un RR=0,80 (IC95 % [0,67-0,95]; p=0,01); sin embargo, dicho beneficio no se presentó en el caso del vómito posoperatorio, reportó un RR=0,83 (IC95 % [0,63-1,09]; p=0,18).
Medidas no farmacológicas
Lee y Done 45, en 1999, documentaron un metaanálisis y revisión sistemática de moderada calidad en la que sintetizaron la evidencia científica sobre las técnicas no farmacológicas para NVPO, entre las que se incluyeron la acupuntura, la electroacupuntura, la estimulación nerviosa eléctrica transcutánea, la estimulación de acupuntos y la acupresión. Concluyeron que estas técnicas son efectivas en la prevención de náuseas tempranas, lo cual no ocurre en el caso de vómito temprano o tardío. No evaluaron el desenlace compuesto de NVPO. Este artículo se describe separadamente de los de acupuntura previamente mencionados, dado que no se realizó una separación de los grupos de intervención como sucedió en el apartado Acuestimulación, acupuntura y acupresión.
Anestesia total intravenosa (TIVA)
Según los hallazgos en 2016 de Schaefer et al. 46, la anestesia total intravenosa comparada con una técnica anestésica general balanceada más una intervención farmacológica única (anti 5HT3 o droperidol) son igualmente efectivas para prevenir episodios de NVPO con un RR=1,06 (IC95 % [0,85-1,32]) para NVPO y RR=1,17 IC95 % [0,78-1,76] para náuseas. La calidad de la evidencia de este estudio fue moderada, en comparación con la evaluación críticamente baja del estudio de Tramer 47, por lo que sus resultados no fueron tenidos en cuenta.
Análisis cualitativo
En la Tabla 2 se expresan los NNT para los trabajos incluidos con calidad moderada o alta, mediante la metodología de tratar como "un solo ensayo" (del inglés treat-as-one-trial) y el NNT corregido (NNTc) según la metodología expresada en el Manual Co-chrane de revisiones sistemáticas de intervenciones versión 6.3 de 2022. Se describen los resultados de NPO, VPO y NVPO según el reporte original de los autores citados.
Tabla 2 Número Necesario a Tratar y Número Necesario a Tratar Corregido con método Cochrane para los estudios incluidos potencialmente en el metaanálisis.
| Autor, año | Estrategia evaluada | Vómito | Náuseas | NVPO |
|---|---|---|---|---|
| Acupuntura y acupresión | ||||
| Chen J, Tu Q, Miao S, 2020 (22) | Estimulación eléctrica en punto de acupresión (P6, L14, LU7, LI11, ST36, SP6, BL13, SP9, BL23) | NNT=7; IC95 % [6,52-7,33] NNTc=8 | NNT=13; IC95 % [11,87-13,46] NNTc=7 | NNT=6; IC95 % [5,88-6,55] NNTc=6 |
| Cheong et al., 2013 (23) | Acupuntura PC6. | (6h) NNT=7; IC95 % [6,53-7,89]. NNTc=5 (0-24h) NNT=35; IC95 % [31,86-37,62] NNTc=19 | (6h) NNT=13; IC95 % [11,30-13,98].NNTc=9 (0-24h) NNT=7; IC95 % [6,33-7,44].NNTc=4 | - |
| Antagonistas 5HT3 | ||||
| Mihara et al., 2013 (25) | Ramosetrón | (6h) NNT=13; IC95 % [12,30-13,45].NNTc=6 (24h) NNT=11; IC95 % [10,15-11,21] NNTc=7 | (6h) NNT=6; IC95 % [5,67-6,47].NNTc=8 (24h) NNT=7; IC95 % [6,65-7,61].NNTc=10 | - |
| Antagonistas NK1 | ||||
| Liu et al., 2015 (26) | Aprepitant 80 mg. | NNT=5; IC95 % [4,30-5,10] NNTc=4 | NNT=3; IC95 % [2,94-3,75] NNTc=8 | - |
| Casopitant 50 mg. | NNT=6; IC95 % [5,76-6,41] NNTc=5 | - | - | |
| Dexametasona y corticosteroides | ||||
| Fan Z et al., 2018 (29) | Dexametasona 8-10 mg IV | - | NNT=5; IC95 % [4,68-5,31] NNTc=7 | - |
| Li Wang, 2014 (30) | Dexametasona 4-10 mg IV | - | - | NNT=3; IC95 % [2,65-3,04] NNTc=5 |
| Zou et al., 2014 (32) | Dexametasona 1,5-18 mg IV | - | - | NNT=5; IC95 % [4,65-5,06] NNTc=7 |
| Dexmedetomidina | ||||
| Wang G. et al., 2016 (33) | Dexmedetomidina infusión de 0,2-1 µg/kg/min. | NNT=10; IC95 % [9,24-10,53] NNTc=5 | NNT=7; IC95 % [6,65-7,68] NNTc=6 | - |
| Gabapentinoides | ||||
| Alayed et al., 2014 (34) | Gabapentina 300 a 1200 mg. | NNT=11; IC95 % [9,78-11,65] NNTc=10 | NNT=8; IC95 % [7,78-8,95] NNTc=14 | - |
| Jengibre | ||||
| Chaiyakunapruk N et al., 2006 (35) | Jengibre | NNT=13; IC95 % [11,60-13,70] NNTc=13 | - | NNT=7; IC95 % [6,21-7,57] NNTc=13 |
| Líquidos | ||||
| Jewer JK et al., 2019 (37) | 10-30 mL/kg cristaloides IV. | (6h) NNT=20; IC95 % [19,40-20,34].NNTc=8 (24h) NNT=7; IC95 % [6,49-6,97] NNTc=7 | (6h) NNT=10; IC95 % [9,31-9,99]. NNTc=10 (24h) NNT=6; IC95 % [5,43-5,94] NNTc=9 | |
| Metoclopramida | ||||
| De Oliveira et al., 2012 (40) | De Oliveira et al., 2012 (40) | (6h) NNT=10; IC95 % [9,33-10,13] NNTc=15 | (6h) NNT=7; IC95 % 7,15-7,89] NNTc=29 | (6h) NNT=7; IC95 % [6,76- 7,67].NNTc=76 (24h) NNT=8; IC95 % [7,39-8,45] NNTc=-32 |
| Midazolam | ||||
| Ahn et al., 2016(2) (41) | Midazolam 0,04-5 mg IV. | NNT=8; IC95 % [7,74-8,55] NNTc=6 | NNT=7; IC95 % [6,82-7,79] NNTc=7 | NNT=3; IC95 % [2,96-3,49] NNTc=6 |
NNT= Número necesario a tratar. IC95 %= Intervalo de confianza 95 %. NNTc= Número necesario a tratar corregido con método Cochrane. ND= No determinado en el estudio.
Fuente: Autores.
Análisis cuantitativo
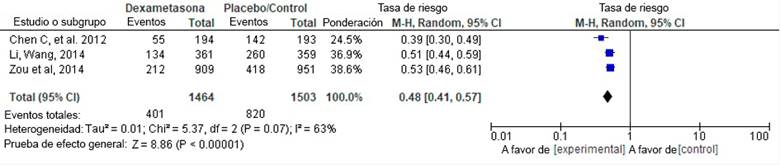
Teniendo en cuenta que las poblaciones eran comparables, así como las intervenciones evaluadas en los estudios, se procedió a realizar el metaanálisis de tres artículos científicos: Chen (2012), Li (2014) y Zou (2014). La Tabla 3 presenta la información de los artículos incluidos.
Tabla 3 Estudios incluidos en el metaanálisis.
| Autores | Chen et al. (2012) | Li, Wang (2014) | Zou et al. (2014) |
|---|---|---|---|
| Estudios incluidos | 5 | 7 | 11 |
| Intervención | Dexametasona 5-8 mg IV | Dexametasona 4-10 mg IV | Dexametasona 1,5-18 mg IV |
| Comparador | Placebo o droperidol | Placebo | Placebo |
| Análisis por peso de las muestras | Sí | Sí | Sí |
| Tamaño de la muestra | 387 | 720 | 1860 |
| Modelo de efectos empleado | Fijos | Aleatorios | Aleatorios |
| I2 % (p) | 30 % (0,22) | 66 % (0,002) | 56 % (0,003) |
| Medida de efecto reportada | RR | OR | RR |
| Valor de la medida de efecto con IC | 0,38 (0,30-0,49) | 0,23 (0,13-0,41) | 0,52 (0,43-0,63) |
| AMSTAR 2 | Moderada | Moderada | Moderada |
| Patrocinadores | Recursos propios | Declaran no tener conflictos | Declaran no tener conflictos |
Fuente: Autores.
Náuseas y vómito posoperatorio manejado profilácticamente con dexametasona
El gráfico de árbol de la Figura 2 muestra un RR=0,48 (IC95 % [0,41-0,57]; p<0,001), con heterogeneidad del 63 % (p=0,07). El análisis de solapamiento de los tres estudios que evaluaron dexametasona se presenta en la Tabla 4, el cálculo del área cubierta corregida (ACC) fue del 50 %, que según Pieper et al. 48. corresponde a solapamiento muy alto, lo que indicó que los estudios tuvieron como fuente de análisis varios ensayos clínicos en común, situación que podría deri varse en sobreestimación del RR. El trabajo que más contó con trabajos originales fue el de Zou et al. (2014). La Tabla 4 presenta la matriz de solapamiento para evaluación visual del mismo. Con esta se procedió a calcular el área cubierta corregida (CCA, por sus siglas en inglés). Se encontró un CCA para los estudios de dexametasona del 50 %. Dicho valor, según los puntos de corte propuestos por Pieper et al. 48, se interpretaría como un solapamiento muy alto.
Fuente: Autores.
Figura 2 Valoración por ítems de la herramienta AMSTAR-2 de los artículos incluidos en el estudio.
Tabla 4 Análisis de solapamiento de estudios originales en las revisiones incluidas.
| Estudio secundario | Feroci (2011) | Fujii (2007) | Lee (2001) | Wang (1999) | Worni (2008) | Barros (2013) | Doks-rod (2012) | Song (2013) | Bononi (2010) | Zhou (2012) | Fujii (2000) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Chen et al. (2012) | X | X | X | X | X | ||||||
| Li, Wang (2014) | X | X | X | X | X | X | X | ||||
| Zou et al. (2014) | X | X | X | X | X | X | X | X | X | X |
Fuente: Autores.
Dado el riesgo de sesgo por el dato de heterogeneidad y por la naturaleza de los estudios, el ajuste según sensibilidad se realizó desagregando una a una las revisiones incluidas en el presente estudio, sin que se hubieran encontrado diferencias en los resultados.
No se realizó metarregresión, dados los hallazgos en un solo tipo de resultado sin subgrupos de análisis ni covariables 49,50.
DISCUSIÓN
La evidencia disponible en revisiones sistemáticas de la literatura y metaanálisis sobre la profilaxis para NVPO con estrategias farmacológicas y no farmacológicas es clínicamente heterogénea, de calidad variable y con limitaciones respecto a los resultados y su comparación. A pesar de ello, los estudios de Li y Wang 30, Zou et al. 32 y Fan et al. 29, incluidos en metaanálisis, sugieren una disminución en la cantidad de eventos NVPO (RR=0,48; IC95 % [0,41-0,57]; p<0,001; I2=63 % - p=0,07) con NNTc 5 y 7 para las 0-6 horas POP y 6-24 horas POP.
Se mencionó en los resultados la valoración por AMSTAR-2 y si cumplían o no los estándares de calidad de la misma. Esta condición de la evaluación de los trabajos y el impacto sobre la calificación de calidad podría tener varias explicaciones. Entre ellas, diferentes grupos editoriales tienen limitantes respecto a la longitud de los reportes de investigación, factor determinante al momento de plasmar en un artículo los detalles que se consideren más pertinentes por parte del grupo investigador. Esto podría omitir detalles que, al momento de calificar con la herramienta AMSTAR-2, podrían demeritar la apreciación final, dependiendo del dominio afectado.
Además de este factor, los cambios en las recomendaciones de reporte para trabajos tipo revisión sistemática con metaanálisis y la exigencia con los mismos hace que aquellas publicaciones más antiguas tengan peor calificación. La herramienta AMSTAR-2 es estricta, creada posterior a la publicación de varios de los trabajos, por lo que en muchas ocasiones la calidad resultante de dicha evaluación fue baja o críticamente baja.
Procurando incrementar la cantidad de trabajos disponibles para realizar una síntesis cuantitativa en el presente trabajo, se incluyeron también trabajos de calidad moderada, y se evaluó junto con los trabajos de calidad alta, la posibilidad de realizar metaanálisis. Dada la heterogeneidad clínica mostrada por los diferentes estudios, no fue posible realizar metaanálisis en la mayoría de los escenarios, solamente dejando la opción en el uso de dexametasona profiláctica.
Como hallazgo frecuente en los trabajos incluidos, resalta la necesidad expresada por los autores de incrementar la calidad y completitud de los estudios que evalúan el desenlace.
Esta metodología, que se supone debería ayudar a compendiar la evidencia disponible sobre diferentes opciones terapéuticas en un mismo desenlace, se ve limitada toda vez que los estudios primarios, en este caso, metaanálisis, no exploran desde un principio las interacciones entre las diferentes estrategias. A pesar de encontrar muchos registros en la búsqueda inicial, existe una variabilidad significativa en las definiciones de náuseas, emesis y náuseas y emesis en el tiempo.
Otra limitación subyace en la ausencia de trabajos que evalúen el impacto de diferentes estrategias administradas simultáneamente para prevenir la presentación de los desenlaces de interés (NPO, VPO, NVPO). Esta limitante hace que evaluar el efecto acumulativo de las estrategias no sea posible, dado que se desconoce la sinergia o antagonismo que puedan ejercer entre sí los fármacos o medidas no farmacológicas, desde el punto de vista clínico.
En cuanto a la plausibilidad biológica de los resultados encontrados, en referencia al mecanismo de acción de los fármacos y la fisiopatología conocida de las NVPO, no se encuentran discrepancias en los resultados. En general, los fármacos con efecto antiemético por vías directas o mecanismos indirectos tienen, aunque de baja calidad en la mayoría de los casos, evidencia que soporta su uso en el perioperatorio.
Resalta entre las estrategias empleadas, el uso de naloxona para la disminución de náuseas en el posoperatorio, probablemente como consecuencia del antagonismo que ejerce sobre los efectos de fármacos opioides administrados durante el intraoperatorio. Sin embargo, no es claro el efecto que este fármaco pueda tener sobre desenlaces que motivan la administración de opioides en el intraoperatorio, como el control de dolor agudo posquirúrgico en el marco de una estrategia analgésica multimodal.
Debe tenerse en cuenta que, a pesar de tener la posibilidad estadística de realizar síntesis cuantitativa sobre la intervención con dexametasona, hay una heterogeneidad clínica que puede tener repercusiones en las conclusiones derivadas de las pruebas estadísticas. Esto, por la diferencia de dosis aplicadas a los participantes de los ensayos incluidos en las revisiones originales.
A manera de conclusión, en cuanto a prevención de náuseas y emesis posoperatoria mediante estrategias farmacológicas, el clínico cuenta con una variedad amplia de herramientas que le pueden permitir disminuir el riesgo de presentación de estas complicaciones posanestésicas. Entre estas estrategias, el uso de dexametasona en el intraoperatorio es la opción con estudios de mejor calidad disponible y mayor soporte, para usar en dosis de 4 a 18 miligramos. Sin embargo, en el grupo de estudios de calidad baja o moderada, otros fármacos, como los antagonistas NK1, antagonistas del receptor 5HT3, metoclopramida, midazolam, dexmedetomidina y gabapentinoides, también tuvieron resultados prometedores en sus respectivos metaanálisis.
Para la prevención del desenlace compuesto náuseas y vómito posoperatorio, la estrategia que los incluyó y permitió el cálculo de NNT más bajo fue la dexametasona por vía endovenosa con una dosis entre 4 y 10 mg (NNT corregido=5) y midazolam vía endovenosa con dosis entre 0,04-5 mg (NNT corregido=6). En el caso de los antagonistas 5HT3, uno de los grupos farmacológicos más empleados en profilaxis de NVPO, solo se encontraron estudios comparativos entre miembros del mismo grupo y, en el caso de contrastes contra placebo, el único fármaco incluido fue ramosetrón. En ese caso, el NNT corregido para vómito fue de 6-7 y en el caso de náuseas fue de 8-10.
Entre las estrategias no farmacológicas, la más estudiada fue acupuntura del punto P6, con un NNT corregido de 6, cercano a las estrategias mencionadas arriba (dexametasona, ramosetrón y midazolam).
Aunque la calidad de la evidencia en general es baja, o críticamente baja, los resultados de los trabajos sugieren efectividad en la prevención de los desenlaces individuales y el desenlace compuesto con fármacos tan diferentes como: acetaminofén, amisulprida, ondansetrón, aprepitant, dexametasona, dexmedetomidina, escopolamina, gabapentina, pregabalina, metoclopramida, midazolam, mirtazapina, naloxona y perfenacina.
Fármacos como haloperidol, droperidol, dimenhidrinato, cuyos mecanismos de acción tienen plausibilidad biológica, cuyos costos son reducidos y el perfil de seguridad es bueno, merecen una mayor atención en los estudios futuros.
A pesar de que los estudios hechos después de la divulgación de la estrategia AMSTAR-2 presentan un porcentaje de cumplimiento ligeramente mayor a sus contrapartes publicadas antes del instrumento (34,3 % vs 38,8 %), en general la falta de cumplimiento en sus criterios de calidad es alta. Es ideal hacer una mayor divulgación de esta estrategia para permitir una producción científica con mayores estándares de calidad.
RESPONSABILIDADES ÉTICAS
Aval de comité de ética
El protocolo de investigación con registro Prospero CRD42021251999 fue sometido a aprobación por el Comité Curricular de la Facultad de Ciencias de la Salud y el Deporte de la Fundación Universitaria del Área Andina. Dada su naturaleza, se estableció en la categoría de "investigación sin riesgo", según la Resolución 8430 de 1993 del Ministerio de Salud de Colombia (11), por lo que no se hizo necesaria una aprobación por parte de comité de ética en investigación.
Protección de personas y animales
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
RECONOCIMIENTOS
Contribución de los autores
Todos los autores contribuyeron sustancialmente a la concepción o diseño del trabajo, la adquisición, análisis o interpretación de los datos para el trabajo; realizaron el diseño del trabajo o revisión crítica del mismo para contenido intelectual importante, y han aprobado la versión final que va a ser publicada.
Agradecimientos
Ninguno declarado.
REFERENCIAS
1. Teunkens A, Vanhaecht K, Vermeulen K, Fieuws S, Van de Velde M, Rex S, et al. Measuring satisfaction and anesthesia related outcomes in a surgical day care centre: A three-year single-centre observational study. J Clin Anesth. 2017;43:15-23. doi: https://doi.org/10.1016/j.iclinane.2017.09.007. [ Links ]
2. Parra-Sánchez I, Abdallah R, You J, Fu AZ, Gr-ady M, Cummings K, et al. A time-motion economic analysis of postoperative nausea and vomiting in ambulatory surgery. Canadian J Anesthesia. 2012;59(4)366-75. doi: https://doi.org/10.1007/s12630-011-9660-x. [ Links ]
3. Óbrink E, Jildenstãl P, Oddby E, Jakobsson JG. Post-operative nausea and vomiting: Update on predicting the probability and ways to minimize its occurrence, with focus on ambulatory surgery. International Journal of Surgery. 2015;15:100-6. doi: https://doi.org/10.1016/J.IJSU.2015.01.024. [ Links ]
4. Look X, Mok MUS, Tay YS, Abdullah HR. How do Singapore patients view post-anaesthesia adverse outcomes? A single-centre willingness-to-pay study. Singapore Med J. 2018;59(5):264-70. doi: https://doi.org/10.11622/smedi.2017078. [ Links ]
5. Smith HS, Smith EJ, Smith BR. Postoperative nausea and vomiting. Ann Palliat Med. 2012;1(2):94-102. doi: https://doi.org/10.3978/i.issn.2224-5820.2012.07.05. [ Links ]
6. Carlisle JB. A meta-analysis of prevention of postoperative nausea and vomiting: Randomised controlled trials by Fujii et al. compared with other authors. Anaesthesia. 2012;67(10):1076-90. doi: https://doi.org/10.1111/j.1365-2044.2012.07232.x. [ Links ]
7. Carlisle JB. False individual patient data and zombie randomised controlled trials submitted o Anaesthesia. Anaesthesia . 2021;76(4):472-9. doi: https://doi.org/10.1111/anae.15263. [ Links ]
8. Carlisle JB. Data fabrication and other reasons for non-random sampling in 5087 randomised, controlled trials in anaesthetic and general medical journals. Anaesthesia . 2017;72(8):944-52. doi: https://doi.org/10.1111/anae.13938. [ Links ]
9. Gan TJ, Belani KG, Bergese S, Chung F, Diemunsch P, Habib AS, et al. Fourth Consensus Guidelines for the Management of Postoperative Nausea and Vomiting. Anesth Analg. 2020;131(2):411-48. doi: https://doi.org/10.1213/ANE.0000000000004833. [ Links ]
10. Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, et al. The PRISMA 2020 statement: An updated guideline for reporting systematic reviews. The BMJ. 2021;372. doi: https://doi.org/10.1136/bmj.n71. [ Links ]
11. Ministerio de Salud - República de Colombia. Resolución 8430 de 1993. 1993:1-19. [ Links ]
12. Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: A critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. BMJ (Online). 2017;358:1-9. doi: https://doi.org/10.1136/bmj.j4008. [ Links ]
13. Gates M, Gates A, Duarte G, Cary M, Becker M, Prediger B, et al. Quality and risk of bias appraisals of systematic reviews are inconsistent across reviewers and centers. J Clin Epidemiol. 2020;125:9-15. doi: https://doi.org/10.1016/j.jclinepi.2020.04.026. [ Links ]
14. Marx A. Numbers needed to treat derived from meta-analysis: a word of caution. Evid Based Med. 2003;8(2):36-7. doi: https://doi.org/10.1136/ebm.8.2.36. [ Links ]
15. Altman DG, Deeks JJ. Meta-analysis, Simpson's paradox, and the number needed to treat. BMC Med Res Methodol. 2002;2:1-5. doi: https://doi.org/10.1186/1471-2288-2-3. [ Links ]
16. Moore RA, Gavaghan DJ, Edwards JE, Wiffen P, McQuay HJ. Pooling data for number needed to treat: No problems for apples. BMC Med Res Methodol . 2002;2:1-4. doi: https://doi.org/10.1186/1471-2288-2-2. [ Links ]
17. The Cochrane Collaboration. Cochrane Hand-book for Systematic Reviews of Interventions | Cochrane Training. [cited: 2022 May 30]. Available at: Available at: https://training.cochrane.org/hand-book/current . [ Links ]
18. Munder T, Brütsch O, Leonhart R, Gerger H, Barth J. Researcher allegiance in psychotherapy outcome research: An overview of reviews. Clin Psychol Rev. 2013;33(4):501-11. doi: https://doi.org/10.1016/j.cpr.2013.02.002. [ Links ]
19. Cooper H, Koenka AC. Unique challenges and opportunities when research syntheses are the principal elements of new integrative scholarship. American Psychologist. 2012;67(6):446-62. doi: https://doi.org/10.1037/A0027119. [ Links ]
20. The Cochrane Collaboration. Chapter 15: Interpreting results and drawing conclusions | Cochrane Training. [cited: 2022 Jun 29]. Available at: Available at: https://training.cochrane.org/hand-book/current/chapter-15 . [ Links ]
21. Doleman B, Read D, Lund JN, Williams JP. Preventive acetaminophen reduces postoperative opioid consumption, vomiting, and pain scores after surgery: Systematic review and meta-analysis. Reg Anesth Pain Med. 2015:706-12. doi: https://doi.org/10.1097/AAP.0000000000000311. [ Links ]
22. Chen J, Tu Q, Miao S, Zhou Z, Hu S. Transcutaneous electrical acupoint stimulation for preventing postoperative nausea and vomiting after general anesthesia: A meta-analysis of randomized controlled trials. International J Surg. 2020;73:57-64. doi: https://doi.org/10.1016/Í.iÍsu.2019.10.036. [ Links ]
23. Cheong KB, Zhang J, Huang Y, Zhang Z. The effectiveness of acupuncture in prevention and treatment of postoperative nausea and vomiting - A systematic review and meta-analysis. PLoS One. 2013;8(12):e82474. doi: https://doi.org/10.1371/iournal.pone.0082474. [ Links ]
24. Ahn E, Choi G, Kang H, Baek C, Jung Y, Woo Y, et al. Palonosetron and ramosetron compared for effectiveness in preventing postoperative nausea and vomiting: A systematic review and meta-analysis. PLoS One . 2016;11(12):e0168509. doi: https://doi.org/10.1371/journal.pone.0168509. [ Links ]
25. Mihara T, Tojo K, Uchimoto K, Morita S, Goto T. Reevaluation of the effectiveness of ramosetron for preventing postoperative nausea and vomiting: a systematic review and meta-analysis. Anesth Analg . 2013; 117 (2)329-39. doi: https://doi.org/10.1213/ANE.0b013e31829847a1. [ Links ]
26. Liu M, Zhang H, Du BX, Xu FY, Zou Z, Sui B, et al. Neurokinin-1 receptor antagonists in preventing postoperative nausea and vomiting. Medicine (United States). 2015;94(19):1-15. doi: https://doi.org/10.1097/MD.0000000000000762. [ Links ]
27. Singh PM, Borle A, Rewari V, Makkar JK, Trikha A, Sinha AC, et al. Aprepitant for postoperative nausea and vomiting: A systematic review and meta-analysis. Postgrad Med J. 2016;92(1084):87-98. doi: https://doi.org/10.1136/postgradmedj-2015-133515. [ Links ]
28. Chen CC, Siddiqui FJ, Chen TL, Chan ESY, Tam KW. Dexamethasone for prevention of postoperative nausea and vomiting in patients undergoing thyroidectomy: Meta-analysis of randomized controlled trials. World J Surg. 2012;36(1):61-8. doi: https://doi.org/10.1007/s00268-011-1343-9. [ Links ]
29. Fan Z, Ma J, Kuang M, Zhang L, Han B, Yang B, et al. The efficacy of dexamethasone reducing postoperative pain and emesis after total knee arthroplasty: A systematic review and meta-analysis. International Journal of Surgery . 2018;52:149-55. doi: https://doi.org/10.1016/j.ijsu.2018.02.043. [ Links ]
30. Li B, Wang H. Dexamethasone reduces nausea and vomiting but not pain after thyroid surgery: A meta-analysis of randomized controlled trials. Medical Science Monitor. 2014;20:2837-45. doi: https://doi.org/10.12659/MSM.891390. [ Links ]
31. Yang Q Zhang Z, Xin W, Li A. Preoperative intravenous glucocorticoids can decrease acute pain and postoperative nausea and vomiting after total hip arthroplasty: A PRISMA-compliant meta-analysis. Medicine (United States) . 2017;96(47):1-8. doi: https://doi.org/10.1097/MD.0000000000008804. [ Links ]
32. Zou Z, Jiang Y, Xiao M, Zhou R. The impact of prophylactic dexamethasone on nausea and vomiting after thyroidectomy: A systematic review and meta-analysis. PLoS One . 2014;9(10):e109582. doi: https://doi.org/10.1371/journal.pone.0109582. [ Links ]
33. Wang G, Zhang L, Lou S, Chen Y, Cao Y, Wang R, et al. Effect of dexmedetomidine in preventing postoperative side effects for laparoscopic surgery: A meta-analysis of randomized controlled trials and trial sequential analysis. Medicine (United States) . 2016;95(10):1-10. doi: https://doi.org/10.1097/MD.0000000000002927. [ Links ]
34. Alayed N, Alghanaim N, Tan X, Tulandi T. Preemptive use of gabapentin in abdominal hysterectomy: A systematic review and meta-analysis. Obstetrics and Gynecology. 2014:1221-9. doi: https://doi.org/10.1097/AOG.0000000000000289. [ Links ]
35. Chaiyakunapruk N, Kitikannakorn N, Na-thisuwan S, Leeprakobboon K, Leelasettagool C. The efficacy of ginger for the prevention of postoperative nausea and vomiting: A meta-analysis. Am J Obstet Gynecol. 2006;194(1):95-9. doi: https://doi.org/10.1016/j.ajog.2005.06.046. [ Links ]
36. Tóth B, Lantos T, Hegyi P, Viola R, Vasas A, Benkõ R, et al. Ginger (Zingiber officinale): An alternative for the prevention of postoperative nausea and vomiting. A meta-analysis. Phytomedicine. 2018;50(April):8-18. doi: https://doi.org/10.1016/i.phymed.2018.09.007. [ Links ]
37. Jewer JK, Wong MJ, Bird SJ, Habib AS, Parker R, George RB. Supplemental perioperative intravenous crystalloids for postoperative nausea and vomiting. Cochrane Database of Systematic Reviews. 2019. doi: https://doi.org/10.1002/14651858.CD012212.pub2. [ Links ]
38. Lee MJ, Lee C, Kang H, Kim H. The impact of crystalloid versus colloid fluids on postoperative nausea and vomiting: A systematic review and meta-analysis of randomized controlled trials. J Clin Anesth . 2020;62. doi: https://doi.org/10.1016/j.jclinane.2019.109695. [ Links ]
39. Yokoyama C, Mihara T, Kashiwagi S, Koga M, Goto T. Effects of intravenous dextrose on preventing postoperative nausea and vomiting: A systematic review and meta-analysis with trial sequential analysis. PLoS One . 2020;15(4):e0231958. doi: https://doi.org/10.1371/iournal.pone.0231958. [ Links ]
40. De Oliveira GS, Castro-Alves LJ, Chang R, Yaghmour E, McCarthy RJ. Systemic metoclopramide to prevent postoperative nausea and vomiting: A meta-analysis without Fujii's studies. Br J Anaesth. 2012:688-97. doi: https://doi.org/10.1093/bja/aes325. [ Links ]
41. Ahn EJ, Kang H, Choi GJ, Baek CW, Jung YH, Woo YC. The effectiveness of midazolam for preventing postoperative nausea and vomiting: A systematic review and meta-analysis. Anesth Analg . 2016;122(3):664-76. doi: https://doi.org/10.1213/ANE.0000000000001062. [ Links ]
42. Grant MC, Kim J, Page AJ, Hobson D, Wick E, Wu CL. The effect of intravenous midazolam on postoperative nausea and vomiting: A meta-analysis. Anesth Analg . 2016;122(3):656-63. doi: https://doi.org/10.1213/ANE.0000000000000941. [ Links ]
43. Bhattachariee D, Doleman B, Lund J, Williams J. Mirtazapine for postoperative nausea and vomiting: systematic review, meta-analysis, and trial sequential analysis. J PeriAnesthesia Nursing. 2019;34(4):680-90. doi: https://doi.org/10.1016/j.jopan.2018.11.006. [ Links ]
44. Barrons RW, Woods JA. Lowdose naloxone for prophylaxis of postoperative nausea and vomiting: A systematic review and meta-analysis. Pharmacotherapy. 2017;37(5)546-54, https://doi.org/10.1002/phar.1930. [ Links ]
45. Lee A, Done ML. The use of nonpharmacologic techniques to prevent postoperative nausea and vomiting: A meta-analysis. Anesth Analg . 1999;88:1362-9. [ Links ]
46. Schaefer MS, Kranke P, Weibel S, Kreysing R, Kienbaum P. Total intravenous anaesthesia versus single-drug pharmacological antiemetic prophylaxis in adults: A systematic review and meta-analysis. Eur J Anaesthesiol. 2016;33(10):750-60. doi: https://doi.org/10.1097/EJA.0000000000000520. [ Links ]
47. Tramèr M, Moore A, McQuay H. Propofol anaesthesia and postoperative nausea and vomiting: Quantitative systematic review of randomized controlled studies. Br J Anaesth . 1997;78(3):247-55. doi: https://doi.org/10.1093/bia/78.3.247. [ Links ]
48. Pieper D, Antoine SL, Mathes T, Neugebauer EAM, Eikermann M. Systematic review finds overlapping reviews were not mentioned in every other overview. J Clin Epidemiol . 2014. doi: https://doi.org/10.1016/j.jclinepi.2013.11.007. [ Links ]
49. Baker WL, White CM, Cappelleri JC, Kluger J, Coleman CI. Understanding heterogeneity in meta-analysis: the role of meta-regression. Int J Clin Pract. 2009;63(10):1426-34. doi: https://doi.org/10.1111/i.1742-1241.2009.02168.x. [ Links ]
50. Ioannidis JPA, Trikalinos TA. The appropriateness of asymmetry tests for publication bias in meta-analyses: A large survey. CMAJ. 2007;176(8):1091-6. doi: https://doi.org/10.1503/cmaj.060410. [ Links ]
Recibido: 08 de Septiembre de 2022; Aprobado: 25 de Abril de 2023; : 12 de Septiembre de 2023











 text in
text in