Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Ciencias de la Tierra
Print version ISSN 0120-3630
Bol. cienc. tierra no.23 Medellín May/Aug. 2008
FORAMINÍFEROS EN LOS SEDIMENTOS SUPERFICIALES DEL SISTEMA LAGUNAR DE CISPATÁ Y LA INTERACCIÓN RÍO SINÚ-MAR CARIBE COLOMBIANO
FORAMINIFERS IN SURFACE SEDIMENTS FROM CISPATÁ COASTAL LAGOON SYSTEM AND SINÚ RIVER – COLOMBIAN CARIBBEAN INTERACTION
Gladys Bernal
PhD. Profesora, Escuela de Geociencias y Medio Ambiente
Facultad de Minas, Universidad Nacional de Colombia, sede Medellín
gbernal@unal.edu.co
Mauricio A. Ruiz-Ochoa
MSc. Estudiante de doctorado, Escuela de Geociencias y Medio Ambiente
Facultad de Minas, Universidad Nacional de Colombia, sede Medellín
María Teresa Piedrahita
Estudiantes Ingeniería Geológica, Escuela de Geociencias y Medio Ambiente
Facultad de Minas, Universidad Nacional de Colombia, sede Medellín
Evanaam Restrepo
Estudiantes Ingeniería Geológica, Escuela de Geociencias y Medio Ambiente
Facultad de Minas, Universidad Nacional de Colombia, sede Medellín
Recibido para evaluación: 22 de Agosto de 2007 / Aceptación: 18 de Junio de 2008 / Recibida versión final: 20 de Junio de 2008
RESUMEN
El sistema lagunar de Cispatá es una importante zona de manglar en el Caribe colombiano. Se formó durante la evolución del delta del río Sinú y su dinámica depende del río y el mar. Se hizo un estudio de los foraminíferos bentónicos en los sedimentos superficiales como bioindicadores de la interacción fluviomarina. Se estableció la abundancia de foraminíferos y las asociaciones de especies de la epifauna. Se identificaron 82 especies. Las más abundantes fueron Trochammina inflata, Arenoparrella mexicana, Trochammina squamata y Haplophragmoides canariensis. Los foraminíferos aglutinados predominaron en los sectores donde la influencia fluvial es mayor y en la bahía en sitios de descarga de los canales, mientras que los calcáreos se encontraron principalmente en áreas de influencia marina. El análisis multivariado de las especies de foraminíferos indica una zonación que se explica por la respuesta de éstos a la salinidad y el contenido de materia orgánica en los sedimentos. La especie más abundante y mejor distribuida, T. inflata, se propone como bioindicadora para interpretaciones de ambientes de manglar. Otras especies estuvieron restringidas a un solo cuerpo de agua, y Cyclammina trullissata parece ser la especie más adaptada a condiciones de cultivo de camarón.
PALABRAS CLAVES: Manglar, Foraminíferos, Caribe colombiano, Cispatá, Interacción fluviomarina.
ABSTRACT
Cispatá lagoon system is an important mangrove swamp in the Colombian Caribbean. It was formed during the evolution of the Sinú river delta and is affected by the present changes that occur in the river and the sea level. A study of the benthic foraminifera in the superficial sediments as bioindicators of the fluvialmarine interaction was performed. The abundance and species assemblages of epifauna foraminifera were established. 82 species were identified. The most abundant species were Trochammina inflata, Arenoparrella mexicana, Trochammina squamata and Haplophragmoides canariensis. Agglutinated foraminifera dominated in the sectors where the river influence is greater, or at the Cispatá bay, where channel discharge is present, while calcareous foraminifera were found in areas of marine influence. The multivariate analysis of foraminifera shows a distribution explained by their response to salinity and organic matter content in sediments. T. inflata, the most abundant and well distributed specie, is proposed as an indicator for mangrove swamp environments. Other species were restricted to a unique water body and Cyclammina trullissata seems to be adapted to shrimp farming.
KEY WORDS: Mangrove, Foraminifera, Colombian Caribbean, Cispatá, luvialmarine interaction.
1. INTRODUCCIÓN
La evolución del delta del río Sinú durante el Cuaternario permitió la formación de un sistema lagunar en el margen oriental de la desembocadura actual conformado por lagunas interconectadas con el río y el mar. Hacia el mar, el sistema está protegido por una barra en el norte ( la flecha Mestizos) y conectado con la bahía de Cispatá en el oriente. En estas lagunas se ha establecido uno de los sistemas de manglar más importantes del Caribe colombiano por su extensión y conservación (Sánchez-Páez et al., 2005).
Los complejos mangláricos han sido reconocidos internacionalmente como áreas de gran importancia ambiental debido a los recursos naturales que ofrecen, a su diversidad, y a su papel en la productividad primaria costera y en la protección de la línea de costa (Cintrón y Schaeffer-Novelli, 1983; Álvarez-León y Polanía, 1996). Asimismo los pantanos de manglar son ambientes sedimentarios de importancia en el registro geológico. El conocimiento de las dinámicas hidrológicas y sedimentarias en ambientes actuales es necesario para la interpretación de los ambientes antiguos.
En la actualidad el sistema lagunar de Cispatá está sometido a cambios intensos en los intercambios fluviales y marinos, debido a la puesta en funcionamiento de la represa de Urrá aguas arriba del río Sinú (Márquez y Guillot, 2001), y a la elevación del nivel del mar causada por el calentamiento global (Bernal et al., 2006; Ruiz-Ochoa, 2006). Para entender y manejar el ecosistema, así como para establecer su permanencia y evolución, es necesario conocer la dinámica de interacción fluvio-marina y la respuesta del sistema a los cambios de largo plazo. Esta respuesta se verá reflejada, entre otros, en las características del sedimento de fondo y en los bioindicadores contenidos en él (Cintrón y Schaeffer-Novelli, 1983; Field, 1999; Marchand et al., 2003; Yulianto et al., 2004).
Los foraminíferos se han reconocido como bioindicadores de condiciones ambientales en ambientes recientes y antiguos (Debenay et al., 2000, 2002, 2003; Alve, 2003; Debenay y Bui, 2006). Se han utilizado como bioindicadores de contaminación en ambientes parálicos (Debenay et al., 2000). Por ejemplo, Alve (2003) utilizó las especies de foraminíferos como indicadores para evaluar la respuesta de los ambientes por cambios antrópicos. Debenay et al. (2003), estudiaron un estuario pequeño en Vendée (Francia) a través de los foraminíferos como multibioindicadores. Bergin et al. (2006) usaron los foraminíferos bentónicos como bioindicadores para evaluar ambientes contaminados, debido a la sensibilidad, que se refleja en la estructura y en los cambio de las asociaciones típicas. A su vez, Debenay y Bui (2006) utilizaron las asociaciones de foraminíferos como herramienta para evaluar la intrusión salina y los impactos humanos en el delta del Mekong y las áreas vecinas (Vietnam).
En Colombia se han realizado caracterizaciones de foraminíferos bentónicos en ambientes costeros y arrecifales (Boltovskoy e Hincapié de Martínez, 1983; Parada y Londoño de Hoyos, 1983; Parada y Pinto, 1986; Parada, 1996). Asimismo, en estudios paleoceanográficos se han utilizado foraminíferos como indicadores de productividad y oxigenación (p.e. Betancur y Martínez, 2003). Sin embargo, los estudios colombianos de foraminíferos en ambientes de manglar son escasos. Conocemos relativamente poco de las especies de foraminíferos en manglares, su distribución, ecología y preservación. Este trabajo tiene como objetivo conocer las especies de foraminíferos bentónicos presentes en el sistema lagunar de Cispatá, su distribución espacial, su relación con la dinámica de interacción fluvio-marina y su potencial como bioindicadores ambientales.
Los manglares del sistema lagunar de Cispatá han sido estudiados por diversos autores, especialmente desde el punto de vista ecológico y ambiental (Olaya et al., 1991; Patiño y Flórez, 1993; CVS, 1994; Sánchez-Páez et al., 2004, 2005; entre otros). Existen también estudios de la evolución geomorfológica del delta (Robertson y Chaparro, 1998; Serrano, 2004) y un estudio geomorfológico de la zona costera en el área (Molina et al., 1994).
En el marco del proyecto de investigación "Evaluación del impacto del cambio en los niveles de inundación por efectos antrópicos y naturales sobre los manglares del antiguo delta del río Sinú" se estudió la dinámica fluvio-marina del sistema lagunar de Cispatá (Ruiz-Ochoa, 2006). Este estudio incluyó un análisis de las series de tiempo fluviales y marinas en el sistema (Ruiz-Ochoa et al., 2008), un estudio de los cambios espacio temporales de los cuerpos de agua, un estudio de los sedimentos superficiales del sistema como indicadores de condiciones hidrológicas y una discusión de los procesos fluvio-marinos en respuesta a los cambios ocasionados por el represamiento del río Sinú y el ascenso del nivel del mar.
Dentro del estudio sedimentológico realizado en el proyecto se estudiaron los foraminíferos como bioindicadores de la interacción fluvio-marina. Aquí se presentan los resultados más relevantes encontrados en cuanto a las asociaciones de foraminíferos bentónicos del área. Este trabajo amplía y completa los resultados parciales presentados por Restrepo et al. (2006).
2. ÁREA DE ESTUDIO
El sistema lagunar de Cispatá corresponde al antiguo delta del río Sinú y está localizado en la costa Caribe colombiana, en el extremo suroccidental del golfo de Morrosquillo (Figura 1). El río Sinú está limitado por el cinturón San Jacinto al este y por el cinturón Sinú al oeste. La geología del área está dominada por un sinclinal que abarca estos cinturones y parte de la zona costera occidental de Colombia. El cinturón Sinú comprende sedimentos de edad Mioceno a Reciente y está afectado por el fenómeno de diapirismo de lodo. En cambio el cinturón San Jacinto contiene sedimentos del Paleoceno al Reciente no afectados por diapirismo. Se cree que el basamento de ambos cinturones es corteza oceánica. Durante el Pleistoceno-Holoceno ocurrió un evento geológico de gran magnitud que generó el levantamiento del valle del río Sinú. Se considera que la zona continúa emergiendo (Duque-Caro, 1979, en Serrano, 2004).
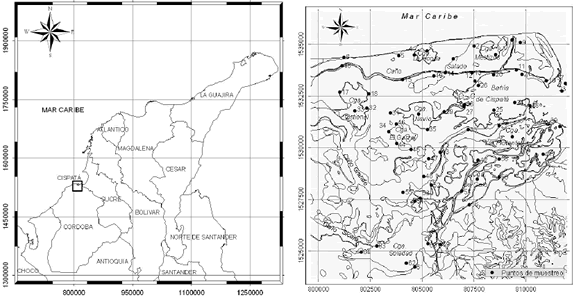
Figura 1. (a) Localización del área de estudio, (b) ubicación de los puntos de muestreo
Según Robertson y Chaparro (1998) el desarrollo del delta se ha dado en cuatro etapas: Los Venados (antes de 1762), Mestizos (1762-1849), Cispatá (1849-1938) y Tinajones (desde 1938 hasta la actualidad). Por Tinajones el río acortó su longitud de 17 km hacia la bahía de Cispatá a sólo 3 km, hecho que aumentó en más de cinco unidades el gradiente hidráulico del río. El abandono del antiguo delta del río Sinú en la bahía de Cispatá favoreció la intrusión de agua marina y el crecimiento de los manglares, que reemplazaron los cultivos de arroz en el área (Serrano, 2004).
Las comunicaciones actuales del río Sinú con el sistema lagunar se resumen en tres sistemas (Olaya et al., 1991): (1) Caño Salado, que está desconectado del río y sólo recibe agua en inundaciones muy fuertes, (2) Caño Grande, conectado con el río, atraviesa todo el estuario; llega a la bahía de Cispatá por un lado a través de las ciénagas Ostional y Navío y por otro a través de la ciénaga La Flotante, (3) Caño Sicará, que desemboca en la ciénaga Soledad y de allí se comunica con la bahía por el caño Palermo. Estos sistemas de comunicación se relacionan con las tres áreas en que
se divide la zona de acuerdo con los factores ambientales (Gil-Torres y Ulloa-Delgado, 2001): (1) Área litoral, (2) Área de estuario, (3) Área de piedemonte.
Según Olaya et al. (1991), CVS (1994), Gil-Torres y Ulloa-Delgado (2001) y Sánchez-Páez et al. (2005) en la bahía de Cispatá existen cinco especies florísticas de manglar: Rhizophora mangle (mangle rojo), Avicennia germinans (mangle negro), Laguncularia racemosa (mangle bobo), Pelliciera rhizophorae (mangle piñuelo) y Conocarpus erecta (mangle zaragoza).
3. METODOLOGÍA
En septiembre del 2005 se realizó un muestreo de sedimentos superficiales en el área, en 64 estaciones referenciadas con un GPS Garmin Mac 76S® (Figura 1). Las muestras fueron tomadas con un nucleador de PVC de 15 cm de diámetro y capacidad de penetración en los sedimentos de hasta 50 cm. Para los análisis sedimentológicos y de
foraminíferos se tomó el primer centímetro superficial del núcleo con el fin de que las características del sedimento representaran condiciones actuales e intervalos homogéneos de tiempo. Cada muestra superficial fue separada en fracciones para diferentes análisis sedimentológicos: %arenas, %materia orgánica (MO), %carbonatos y foraminíferos (Ruiz-Ochoa, 2006). De esta manera, los foraminíferos estudiados representan únicamente las especies de hábitos de vida superficiales, ya que los foraminíferos bentónicos pueden vivir hasta 15 cm de profundidad.
En la fracción para foraminíferos se hicieron separaciones y conteos de las distintas especies presentes. Aunque se adicionó rosa de bengala ningún foraminífero fue teñido, por lo que la biocenosis no fue determinada. Se calculó el número total de foraminíferos por cm 2 teniendo en cuenta el diámetro del nucleador y los pesos de las fracciones tomadas. Las abundancias fueron bajas, propio de ambientes parálicos y por tanto, para el análisis de asociaciones se seleccionaron 24 muestras, aquellas que tenían mas de 50 individuos (Figura 2). Este número no es significativo para establecer diversidad (Fatela y Taborda, 2002) pero resultó suficiente para conocer la variabilidad de las asociaciones en el área.
La identificación de las especies se hizo con la ayuda de un microscopio estereoscópico y la comparación con las guías de identificación de Barker (1960), Phleger (1960), Buzas et al. (1977), McCulloch (1977), Buzas y Severin (1982), Boltovskoy e Hincapié de Martínez (1983), Parada y Pinto (1986), Parada (1991), Parada (1996), Ruiz Muñoz
et al. (1996), Debenay et al. (2000, 2002, 2003), Bergin et al. (2006), Debenay y Bui (2006) y Webb y Strong (2006). Se consideró la clasificación supragenérica de Sen Gupta (1999a), así, los foraminíferos encontrados pertenecen a los grupos de aglutinados y calcáreos. Con los resultados obtenidos se realizaron mapas de distribución espacial en ArcGIS 9.0 utilizando el método krigging de interpolación. También se realizaron análisis de agrupación (cluster) para las 10 especies de foraminíferos principales utilizando distancias euclidianas y el método de agrupación de Ward.
4. RESULTADOS
El número total de foraminíferos en superficie por cm 2 (Figura 2) estuvo entre 0 y 374 individuos y muestra abundancias mayores hacia el este del sistema, en la zona con mayor influencia marina. Las mayores abundancias (>200 foraminíferos por cm2) se presentaron en las muestras de la ciénaga La Flotante, le siguieron las muestras de la bahía y algunos puntos aislados en el sistema SicaráPalermo (ciénagas Soledad y de Galo). El resto del sistema presentó abundancias menores a 50 individuos por cm 2.
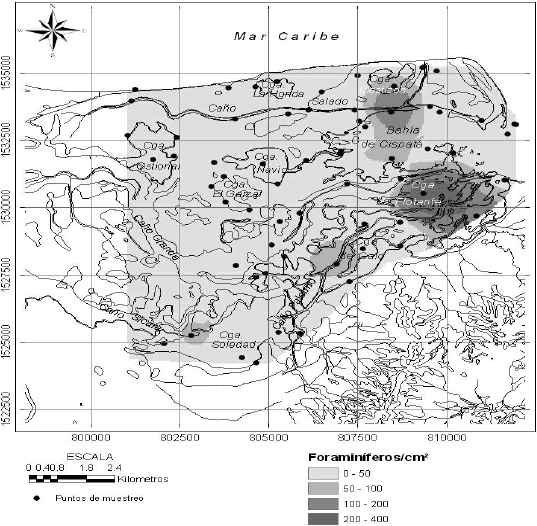
Figura 2. Abundancias de foraminíferos en los sedimentos superficiales
En la Tabla 1 y Figura 3 se presentan las 10 especies más representativas (con abundancias relativas promedio >2%) dentro del total de 82 que fueron identificadas en los 24 puntos de muestreo seleccionados. Entre estas, las cuatro especies principales (abundancias >6%) fueron: Trochammina inflata, Arenoparrella mexicana, Trochammina squamata, y Haplophragmoides canariensis.
Tabla 1. Principales especies de foraminíferos superficiales encontrados en la bahía de Cispatá.

T. inflata (Figura 4) se encontró en la mayoría de las muestras consideradas. La distribución de su abundancia relativa muestra una zonación desde el sector sur y este con valores menores a 30% hasta el sector noroeste con valores mayores a 60%. T. squamata presenta una distribución espacial diferente, con núcleos importantes (porcentajes > 30%) cerca de la ciénaga El Garzal y en dos localidades de la bahía de Cispatá, una de las cuales coincide con la salida del caño Grande. A.
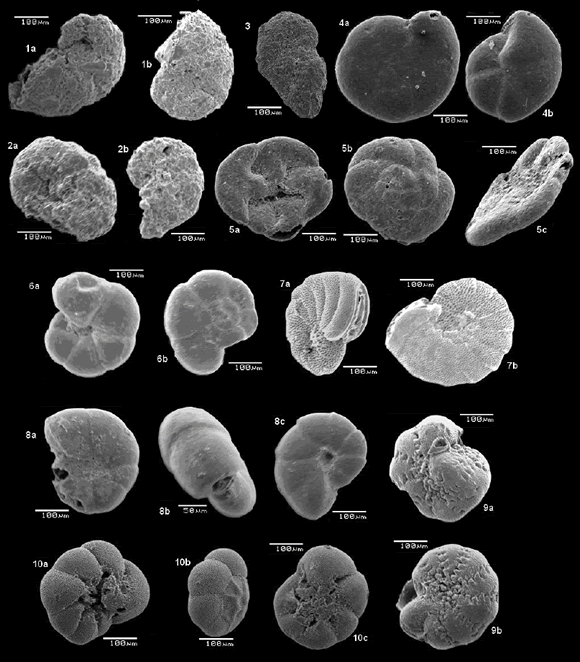
Figura 3. Imágenes de microscopio electrónico de las 10 especies principales presentes en el sistema de Cispatá: 1. Haplophragmoides canariensis (d'Orbigny); 2. Haplophragmoides sp. 3. Ammotium salsum (Cushman y Brönnimann) 4. Arenoparrella mexicana (Kornfeld) 5. Trochammina squamata (Jones y Parker) 6. Trochammina inflata (Montagu) 7. Palmerinella palmerae (Bermúdez) 8. Cyclammina trullissata (Brady) 9. Elphidium williamsoni (Hayes) 10. Eponides cf. Parantillarum (Galloway y Heminway).
mexicana se concentra en la ciénaga de Galo, ciénaga La Honda y en la bahía de Cispatá a la salida de los caños Salado y Grande. H. canariensis se concentró principalmente en la ciénaga de Galo. Las siguientes tres especies en abundancia (Figura 5) están limitadas a una sola localidad. Cyclammina trullissata ocurre en la ciénaga Soledad, Eponides cf. Parantillarum en el sector surcoccidental de la bahía de Cispatá y Ammotium salsum en la ciénaga La Flotante.
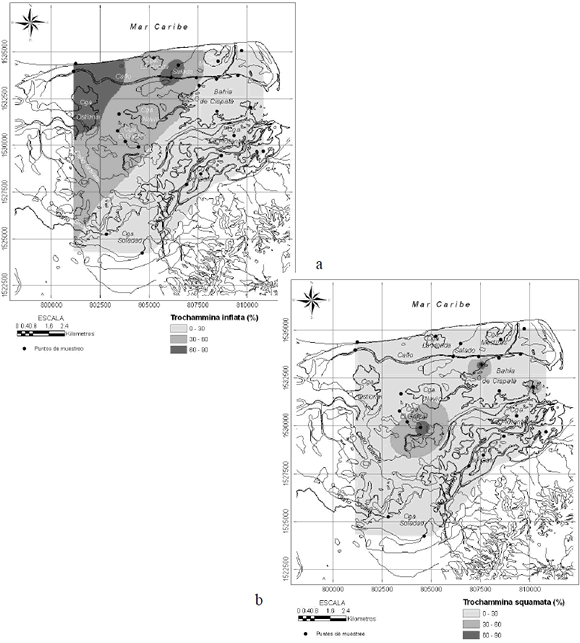
Figura 4. Distribución espacial de los foraminíferos (c) Arenoparrella mexicana, (d) Haplophragmoides canariensis
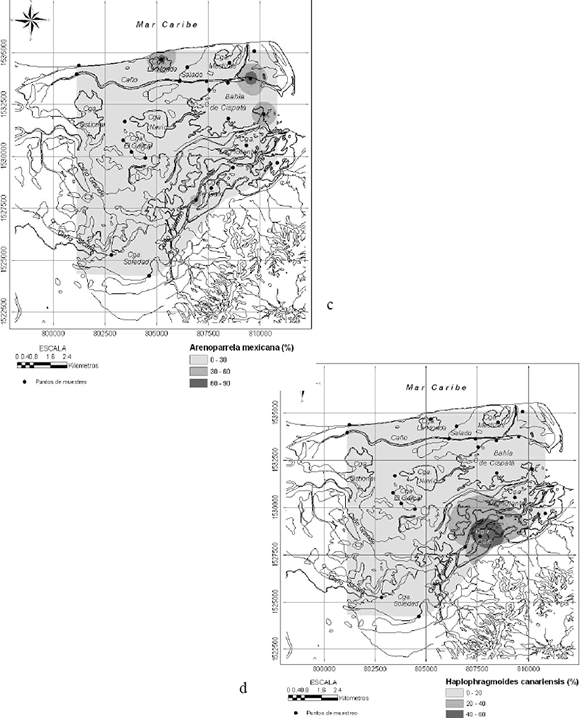
Figura 4. Distribución espacial de los foraminíferos (c) Arenoparrella mexicana, (d) Haplophragmoides canariensis
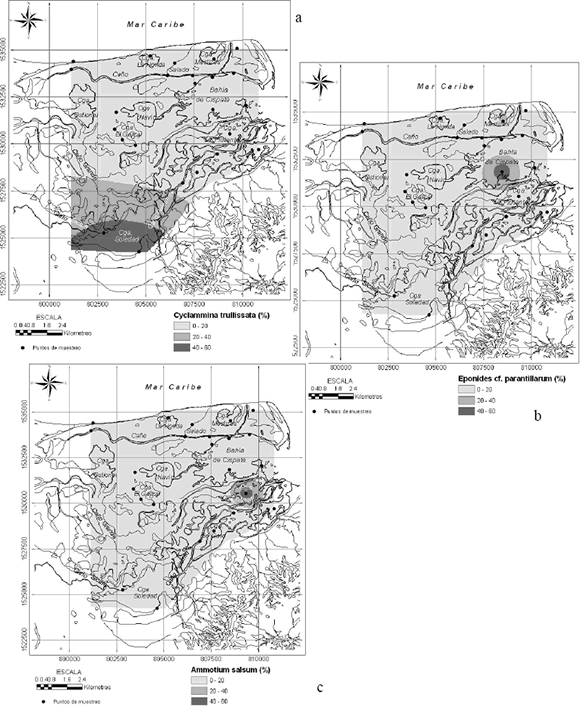
Figura 5. Distribución espacial de los foraminíferos (a) Cyclammina trullissata, (b) E Eponides cf. parantillarum, (c) Ammotium salsum
Prácticamente la totalidad de las especies encontradas pertenece a los grupos de aglutinados (79,7%) y calcáreos (19,1%). En la Figura 6 se presenta la distribución espacial por grupos. Es claro que los aglutinados dominan hacia el interior del sistema (influencia fluvial), mientras que los calcáreos hacia el exterior (influencia marina). En la bahía se presenta una zona exterior dominada por aglutinados que coincide con muestras ubicadas a la salida de los caños Salado y Grande.
Por último, en la Figura 7, se muestran los resultados del análisis de agrupación (cluster). Se seleccionó una distancia de corte que define 3 grupos principales. El primer grupo está dominado por los foraminíferos del género Trochammina (T. inflata y T. squamata) acompañados por A. mexicana; el segundo grupo está dominado por A. mexicana acompañada de T. inflata y T. squamata; mientras que el tercero carece por completo de estas tres especies, y en cambio contiene H. canariensis, A. salsum, E. cf. parantillarum, Elphidium williamsoni y Palmerinella palmerae.
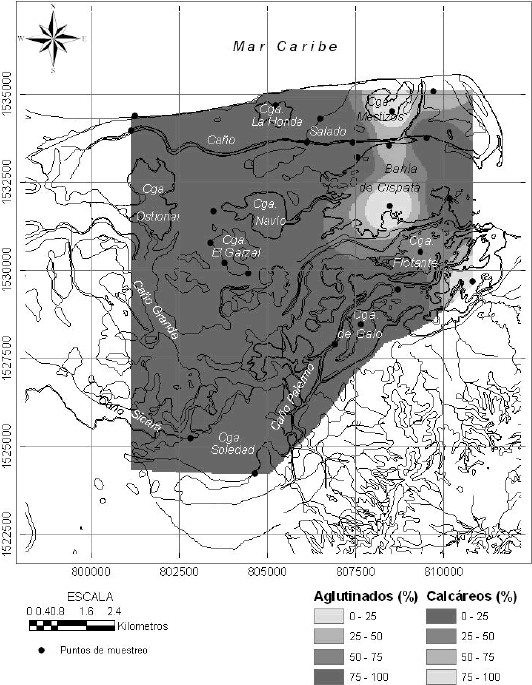
Figura 6. Distribución espacial de foraminíferos por grupos en el sistema lagunar de Cispatá
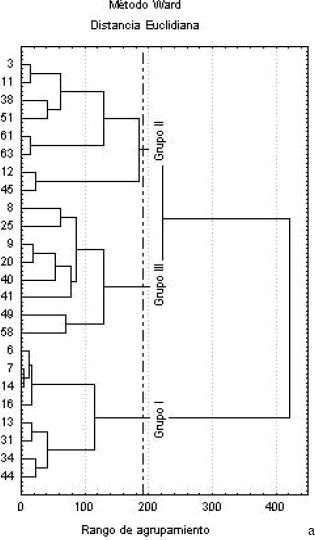
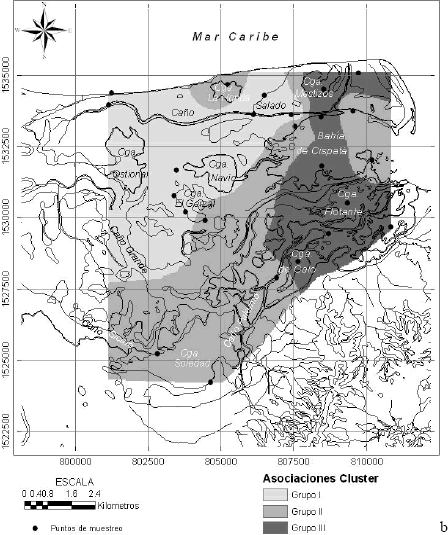
Figura 7. (a) Análisis de agrupación (cluster) de las 10 especies de foraminíferos dominantes en 25 puntos de muestreo, (b) distribución espacial de las asociaciones cluster
5. DISCUSIÓN
La abundancia de foraminíferos en las muestras estudiadas coincide con la reportada para otros sistemas similares. Debenay y Bui (2006) reportan entre 10 y 15000 foraminíferos por 50 cm 3 en las áreas vecinas al delta del Mekong en Vietnam. Esto significa entre 0,2 y 300 foraminíferos por cm 3 , una abundancia igual a la encontrada en Cispatá, 0-374 foraminíferos/cm 3 (los cm 2 son equivalentes a cm 3 pues la profundidad de las muestras fue de 1 cm). Asimismo, Debenay et al. (1998) encontraron entre 0 y 100 individuos/cm 3 en dos lagunas costeras de Brasil.
No se conocen estudios de especies de foraminíferos en ambientes estuarinos en Colombia, sin embargo, las especies importantes en Cispatá ocurren en estos ambientes de transición en otras partes del mundo. T. inflata y A. mexicana son típicas de ambientes de manglar, mientras que H. canariensis puede ocurrir en lagunas de baja salinidad y A. salsum en zonas de interacción fluviomarina (Phleger, 1960; Sen Gupta, 1999b; Javaux y Scott, 2003).
La abundancia de foraminíferos calcáreos hacia las zonas de influencia marina y de aglutinados hacia las zonas interiores de los estuarios ha sido explicada por Debenay et al. (2000) y Sen Gupta (1999b). Los foraminíferos están en capacidad de tolerar condiciones de salinidad de medias a altas, mientras que en aguas dulces sólo algunas de estas especies logran adaptarse. En las aguas dulces, el pH más ácido y poca disponibilidad de Ca inhibe la calcificación, por lo cual los únicos foraminíferos que pueden colonizar las zonas netamente fluviales son los aglutinados, mientras que en aguas marinas, más alcalinas, es posible la presencia de foraminíferos calcáreos. La ocurrencia de aglutinados en muestras de la bahía de Cispatá se explicaría por el transporte de conchas de foraminíferos a través de los caños Salado y Grande, ya que las muestras que marcan esta ocurrencia se presentan justamente a la salida de estos sistemas.
La distribución espacial de las especies reportada en este estudio corresponde únicamente al primer cm superficial delos sedimentos, es decir, debe ser considerada como una distribución de epifauna y no incluye especies infauna. Sobrela abundancia de foraminíferos hacia profundidad, en un núcleo extraído de la ciénaga La Flotante, Pérez (2006) encontró un máximo relativo de concentraciones de foraminíferos de 12 individuos por cm 3 entre 9 y 12cm de profundidad, donde las especies más abundantes fueron H. canariensis y A. salsum. Esta concentración subsuperficial es baja comparada con la superficial, que presenta más de 200 individuos por cm 3 en esta laguna. Si este patrón es común a todo el sistema, el uso del cm superficial puede ser suficientemente indicativo de la distribución de los foraminíferos bentónicos en relación con el ambiente.
No se conoce el motivo por el cual ningún organismo fue teñido con la rosa de bengala. Este hecho limita algunas de las conclusiones de este estudio. Por ejemplo, la separación de la biocenosis podría haber apoyado la hipótesis del transporte de los foraminíferos aglutinados encontrados en la bahía de Cispatá.
La distribución espacial de aglutinados vs. calcáreos, de la especie más abundante en las muestras (T. inflata) y de los grupos obtenidos por análisis multivariado (cluster) indican una zonación entre el sector noroccidental del sistema lagunar y los sectores este y sur del mismo. Este patrón estaría influenciado por los intercambios de agua dulce y salada en el sistema lagunar, así como por el contenido de MO de los sedimentos.
Existen datos de salinidad en ciénagas y caños del sistema tomados por la Corporación Autónoma Regional de los Valles del Sinú y del San Jorge (CVS) entre el 2002 y el 2005. El comportamiento medio de estos (promediado en la columna de agua hasta 1 m de profundidad) muestra una zonación de la salinidad desde el norte y el este hacia el suroeste, con aguas más saladas en la bahía de Cispatá y a lo largo del sistema del caño Salado (Figura 8). Hay un núcleo de baja salinidad concentrado en la ciénaga Ostional, con salinidades entre 12 y 22 en época de aguas bajas que varía a valores entre 7 y 19 durante aguas altas extendiéndose más al sur. En el otro extremo, la zona de condiciones dominantes marinas presenta salinidades mayores a 29.
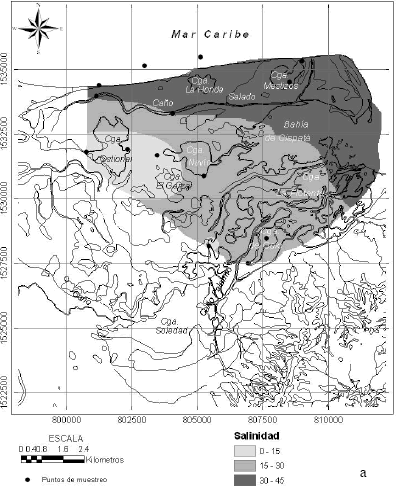
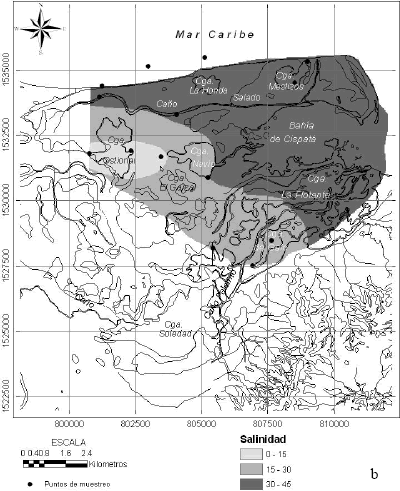
Figura 8. Condiciones promedias de salinidad durante condiciones de (a) alto caudal, (b) bajo caudal, del río Sinú entre el 2002y el 2005 (fuente de datos: CVS)
Los resultados obtenidos con foraminíferos no coinciden exactamente con este patrón y muestran condiciones similares a las marinas por el sistema Sicará-Palermo, al sur. Una posible explicación sería una cuña salina entrando por el sur. En la Tabla 2 se presenta un promedio de la salinidad a tres profundidades en sitios de los tres sistemas de circulación principales. En los datos se nota que existe una cuña salina hacia profundidad, pero no hay evidencias de que ésta sea más pronunciada por el sistema Sicará-Palermo. Otra explicación puede ser que además de la salinidad, el tipo de sustrato juega un papel importante en la distribución de los foraminíferos bentónicos del sistema lagunar de Cispatá. En la Figura 9 se presenta la distribución de MO en el sistema. Los sedimentos en la bahía de Cispatá y el sistema Sicará-Palermo presentan los contenidos más bajos de MO. Este parámetro es otro de los factores que puede influenciar la distribución de los foraminíferos bentónicos en pantanos de manglar (Sen Gupta, 1999b). Así, la distribución espacial de los foraminíferos en la zona responde a un efecto combinado entre la salinidad del agua y el contenido de MO del fondo.
Tabla 2. Valores promedio de salinidad en las ciénagas de Galo, Ostional, y Navío y en el caño Salado a distintas profundidades y condiciones de caudal del río Sinú
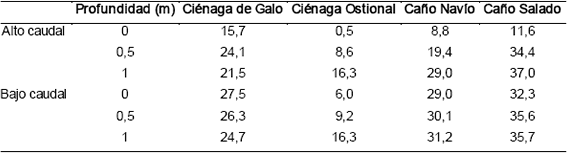
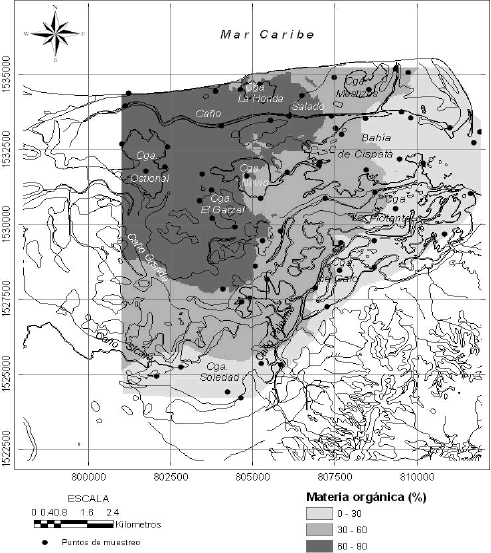
Figura 9. Contenido de materia orgánica en los sedimentos superficiales del sistema lagunar de Cispatá
Por último, el patrón de muchas de las especies de foraminíferos está restringido a zonas muy específicas. Así, T. squamata es típica de la ciénaga El Garzal, H. canariensis de la ciénaga de Galo, C. trullissata de la ciénaga Soledad, y A. salsum de la ciénaga La Flotante. Esto indicaría que hay una restricción para las especies y que sólo T. inflata ha colonizado todo el sistema. La ciénaga Soledad está utilizada para cultivo de camarón, por tanto C. trullissata puede ser una especie adaptada a estas condiciones.
6. CONCLUSIONES
Los foraminíferos presentes en los diversos cuerpos de agua del sistema lagunar de Cispatá están relacionados con la influencia fluvial y marina en el área, así como con el tipo de sustrato. En las muestras se encontró una predominancia de aglutinados sobre calcáreos, propia de ambientes de manglar. Existe una relación entre la salinidad y la distribución de foraminíferos. El grupo de aglutinados y la proporción de T. inflata fue más abundante en zonas de baja salinidad (entre 7 y 22). El grupo de calcáreos fue más abundante en zonas de alta salinidad (superiores a 29). Este patrón es consistente con estudios en otros estuarios del mundo y podría explicarse debido a la dificultad de calcificación para los foraminíferos en aguas dulces. Los análisis multivariados de especies de foraminíferos coinciden igualmente con este patrón que también indica un transporte de sedimentos desde las ciénagas interiores hasta la bahía.
Los foraminíferos también indicaron una afinidad entre la zona marina (bahía de Cispatá) y la zona sur oriental (sistema Sicará-Palermo), que ambientalmente está relacionada con la distribución espacial de la MO en los sedimentos superficiales. Así, la distribución espacial de los foraminíferos en la zona responde a un efecto combinado entre la salinidad del agua y el contenido de MO del fondo.
De las especies encontradas, se propone T. inflata como la mejor indicadora de condiciones fluviomarinas y flujo de MO en el sistema. Queda por explicar la restricción de especies a ciertas lagunas y si C. trullissata puede considerarse como indicadora del uso de las ciénagas para camaronicultura.
Los foraminíferos son buenos bioindicadores ambientales en sistemas de manglar, y constituyen una herramienta para su conocimiento y manejo. Este trabajo presenta el estado actual de estos bioindicadores en el sistema lagunar de Cispatá y sirve como una base para monitorear cambios ambientales e impactos antropogénicos futuros.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos al DINAIN-DIME (direcciones de Investigación de la Universidad Nacional de Colombia y de Investigación de la Sede Medellín) por el apoyo económico para la realización de este trabajo, así como al director del proyecto "Evaluación del impacto del cambio en los niveles de inundación por efectos antrópicos y naturales sobre los manglares del antiguo delta del río Sinú", doctor Jaime Polanía. A la Corporación Autónoma Regional de los Valles del Sinú y del San Jorge (CVS) y al Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM) por el apoyo logístico brindado durante el proyecto.
REFERENCIAS
[1] Álvarez-León, R. y Polanía, J., 1996. Los manglares del Caribe colombiano: síntesis de su conocimiento. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 20 (78): pp. 447-464. [ Links ]
[2] Alve, E., 2003. A common opportunistic foraminiferal species as an indicator of rapidly changing conditions in range of environments. Estuarine, Coastal and Shelf Science, 57: pp. 501-514. [ Links ]
[3] Barker, R., 1960. Taxonomic notes on the species figured by H. B. Brady in his report on the foraminifera dredged by H. M. S. challenger during the years 1873-1876.Special Publication. Society of Economy Paleontology and Mineralogy, 9: pp. 1-238. [ Links ]
[4] Bergin, F., Kucuksezgin, F., Uluturhan, E., Barut, I., Meric, E., Avsar, N. y Nazik, A., 2006. The response of benthic foraminifera and ostracoda to heavy metal pollution in Gulf of Izmir (Eastern Aegean Sea). Estuarine, Coastal and Shelf Science, 66: pp. 368-386. [ Links ]
[5] Bernal, G., Poveda, G., Roldán, P. y Andrade, C., 2006. Patrones de variabilidad de las temperaturas superficiales del mar en la costa Caribe Colombiana. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 30 (115): pp, 195-208. [ Links ]
[6] Betancur, M. y Martínez, I., 2003. Foraminíferos bentónicos recientes en sedimentos de fondo de la cuenca de Panamá (Pacífico colombiano), como indicadores de productividad y oxigenación. Boletín Investigaciones Marinas y Costeras, 32: pp. 93-123. [ Links ]
[7] Boltovskoy, E. y Hincapié de Martínez, S., 1983. Foraminíferos del manglar de Tesca, Cartagena, Colombia. Revista Española de Micropaleontología, 15 (2): pp. 205-220. [ Links ]
[8] Buzas, M., Smith, R. y Beem, K., 1977. Ecology and systematics of foraminifera in two Thalassia habitats, Jamaica, West Indies. Smithsonian Contributions to Paleobiology, No. 31. 139 P. [ Links ]
[9] Buzas, M. y Severin, K., 1982. Distribution and systematics of foraminifera in the Indian River, Florida. Smithsonian Contributions to Paleobiology, No. 16. 73 P. [ Links ]
[10] Cintrón, G. y SchaefferNovelli, Y., 1983. Introducción a la ecología de manglar. Oficina regional de ciencia y tecnología de la UNESCO para América Latina y el Caribe. Montevideo. 109 P. [ Links ]
[11] Corporación Autónoma Regional de los Valles del Sinú y del San Jorge (CVS), 1994. Estudio regeneración natural de mangle. Proyecto manejo silvicultural del bosque de mangle del antiguo delta del río Sinú. Informe final. 24 P. [ Links ]
[12] Debenay, J-P., Beck, B., Duleba, W., Bonetti, C. y EichlerCoelho, P., 1998. Water stratification in coastal lagoons: its influence on foraminiferal assemblages in two Brazilian lagoons. Marine Micropaleontology, 35 (1-2):pp. 67-89. [ Links ]
[13] Debenay, J-.P.,Guillou, J.J., Redois, F. y Geslin, E., 2000. Distribution trends of foraminiferal assemblages in paralic environments: A base for using foraminifera as bioindicators. pp. 39-67. En: Martin, R. (ed.). Environmental micropaleontology. Kluwer Academic Publishers. New York. 500 P. [ Links ]
[14] Debenay, J.-P., Guiral, D. y Parra, M., 2002. Ecological factors acting on the microfauna in mangrove swamps. The case of foraminiferal assemblages in French Guiana. Estuarine, Coastal and Shelf Science, 55: pp. 509-533. [ Links ]
[15] Debenay, J.-P., Carbonel, P., MorzadecKerfourn, M.-T., Cazaubon, A., Denèfle, M. y Lézine, A.-M., 2003. Multibioindicator study of a small estuary in Vendée (France). Estuarine, Coastal and Shelf Science, 58: pp. 843-860. [ Links ]
[16] Debenay, J.P. y Bui, T., 2006. Foraminiferal assemblages and the confinement index as tools for assessment of saline intrusion and human impact in the Mekong Delta and neighboring areas (Vietnam). Revue de micropaléntologie, 49 (2): pp.74-85. [ Links ]
[17] Fatela, F. y Taborda, R., 2002. Confidence limits of species proportions in microfossil assemblages. Marine Micropaleontology, 45: pp. 169-174. [ Links ]
[18] Field, C., 1999. Charter for mangroves. pp. 1-3. En: YáñezAncibia, A. y A. Lara-Domínguez (eds.). Ecosistemas de manglar en América tropical. Instituto de Ecología, A. C., Xalapa, México, UICN International Wetland Program, Costa Rica, NOAA/NMFS South East Fisheries Center. Beaufort, NC. USA. 380 P. [ Links ]
[19] Gil-Torres, W. y Ulloa-Delgado, G., 2001. Caracterización, diagnóstico de los manglares del departamento de Córdoba. Corporación Autónoma Regional de los Valles del Sinú y el San Jorge. Montería. 195 P. [ Links ]
[20] Javaux, E. y Scott, D., 2003. Illustration of modern benthic foraminifera from Bermuda and remarks on distribution in other subtropical/tropical areas. Paleontología Electrónica, 6 (4): 29 P. Disponible en: http://www.palaeoelectronica.org/ paleo/2003_1/benthic/issue1_03.htm. [ Links ]
[21] Marchand, C.; Lallier-Vergés,C. y Baltzer, F., 2003. The composition of sedimentary organic matter in relation to the dynamic features of a mangrove-fringed coast in French Guiana. Estuarine, Coastal and Shelf Science, 56: pp. 119-130. [ Links ]
[22] Márquez, G. y Guillot, G., 2001. Ecología y efecto ambiental de embalses. Aproximación con casos colombianos. 1era edición. Serie de publicaciones del posgrado en Gestión Ambiental. Universidad Nacional. Medellín. 218 P. [ Links ]
[23] McCulloch, I., 1977. Qualitative observations on recent foraminiferal tests with emphasis on the Eastern Pacific. University of Southern California, Los Angeles. 4 Volumes. [ Links ]
[24] Molina, A., Molina, C., Giraldo, L., Parra, C. y Chevillot, P., 1994. Dinámica marina y sus efectos sobre la geomorfología del golfo de Morrosquillo. Boletín Científico del CIOH, 15: pp. 93-113. [ Links ]
[25] Olaya, H., Centenaro, D., Leguizamo, I. y Pineda, F., 1991. Los bosques de mangle en el antiguo delta del río Sinú (Córdoba-Colombia). Universidad de Córdoba, ICFES, CVS. Forestales FVE Ltda. Montería. 30 P. [ Links ]
[26] Parada, C. y Londoño de Hoyos, C., 1983. Foraminíferos bentónicos recientes del norte de Cartagena. Editora Guadalupe. Bogotá D.C. 156 P. [ Links ]
[27] Parada, C. y Pinto, J., 1986. Foraminíferos bentónicos recientes de isla Barú. Fondo FEN Colombia. Bogotá D.C. 212 P. [ Links ]
[28] Parada, C., 1991. Claves de identificación para géneros de foraminíferos. Curso Universidad Nacional de Colombia. Bogotá D.C. 58 P. [ Links ]
[29] Parada, C., 1996. Foraminíferos del pleistoceno-holoceno en el Caribe colombiano. p. 9111. En: Pinto, P. (ed.). Instituto de Ciencias Naturales. Instituto de Historia Natural. Universidad Nacional de Colombia. Bogotá D.C. 392 P. [ Links ]
[30] Patiño, F. y Flórez, F., 1993. Estudio ecológico del golfo de Morrosquillo. Universidad Nacional de Colombia, Fondo FEN Colombia. Bogotá D.C. 109 P. [ Links ]
[31] Pérez, M., 2006. Caracterización sedimentológica de un núcleo del sistema lagunar del río Sinú. Trabajo de grado. Ingeniería Geológica. Facultad de Minas. Universidad Nacional de Colombia, Medellín. 30 P. [ Links ]
[32] Phleger, F., 1960. Ecology and distribution of recent foraminifera. The Johns Hopkins Press. Baltimore. 297 P. [ Links ]
[33] Restrepo, E., Piedrahita, M., Ruiz-Ochoa, M. y Bernal, G., 2006. Foraminíferos como bioindicadores de interacción fluvio-marina en manglares, bahía de Cispatá, Caribe colombiano. En: Memorias VII Semana Técnica de Geología e Ingeniería Geológica. Sogamoso Boyacá. [ Links ]
[34] Robertson, K. y Chaparro, J., 1998. Evolución histórica del río Sinú. Cuadernos de Geografía, 7 (12):pp.70-87. [ Links ]
[35] Ruiz-Muñoz, F., González-Regalado, M. y Morales-González, J., 1996. Distribución y ecología de los foraminíferos y ostrácodos actuales del estuario mesomareal del río Guadiana (SO España). Geobios, 29 (5): pp. 513-528. [ Links ]
[36] Ruiz-Ochoa, M., 2006. Dinámica fluvio-marina en los manglares de la bahía de Cispatá, Caribe colombiano. Tesis de maestría. Posgrado en Aprovechamiento de Recursos Hidráulicos. Facultad de Minas. Universidad Nacional de Colombia. Medellín. 143 P. [ Links ]
[37] Sánchez-Páez, H., Ulloa-Delgado, G. y Tavera-Escobar, H., 2004. Manejo integral de manglares por comunidades locales, Caribe de Colombia. Ministerio de Ambiente, Vivienda y Desarrollo Territorial. CONIF. OIMT. Bogotá D.C. 335 P. [ Links ]
[38] Sánchez-Páez, H., Ulloa-Delgado, G., Tavera-Escobar, H. y Gil-Torres, W., 2005. Plan de manejo integral de los manglares de la zona de uso sostenible sector estuarino de la bahía de Cispatá departamento de Córdoba. OIMT. CVS. CONIF. Ministerio de Ambiente, Vivienda y Desarrollo Territorial. Bogotá D.C. 202 P. [ Links ]
[39] Sen Gupta, B., 1999a. Systematics of modern foraminifera. pp. 7-36. En: Sen Gupta, B.(ed.). Modern foraminifera. Kluwer Academic Publishers. Great Britain. 371 P. [ Links ]
[40] Sen Gupta, B., 1999b. Foraminifera in marginal marine environments. pp. 141-160. En: Sen Gupta, B. (ed.). Modern foraminifera. Kluwer Academic Publishers. Great Britain. 371 P. [ Links ]
[41] Serrano, B., 2004. The Sinú River delta on the northwestern Caribbean coast of Colombia: Bay infilling associate with delta development. Journal of South American Earth Science, 16: pp. 623-631. [ Links ]
[42] Webb, P.-N. y Strong, C., 2006. Foraminiferal biostratigraphy and palaeoecology in upper Oligocene-lower Miocene glacial marine sequences 9, 10, and 11, CRP-2/2A drill hole, Victoria land basin, Antarctica. Palaeogeography, Palaeoclimatology, Palaeoecology, 231: pp. 71-100. [ Links ]
[43] Yulianto, E., Sukapti, W., Rahardjo, A., Noeradi, D., Siregar, D., Suparan, P. y Hirakaw, K., 2004. Mangrove shoreline responses to Holocene environmental change, Makassar Strait, Indonesia. Review of Palaeobotany and Palynology, 131: pp. 251-268. [ Links ]














