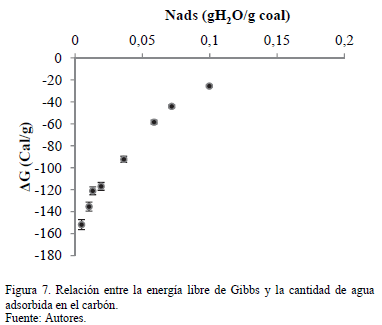Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Boletín de Ciencias de la Tierra
versão impressa ISSN 0120-3630
Bol. cienc. tierra no.39 Medellín jan./jun. 2016
https://doi.org/10.15446/rbct.n39.54127
DOI: http://dx.doi.org/10.15446/rbct.n39.54127
Effect of the temperature in adsorption phenomena of water onto Sub-Bituminous coal
Efecto de la temperatura en el proceso de adsorción de agua en Carbón sub-bituminoso colombiano
Esteban Alberto Taborda-Acevedo a, William J. Jurado b & Farid B. Cortés a*
a Facultad de Minas, Universidad Nacional de Colombia, Medellín, Colombia. *fbcortes@unal.edu.co
b Departamento de Optimización de Procesos, Grupo Argos S.A, Colombia. Medellín. wjurado@argos.com.co
Received: November 12th, 2015. Received in revised form: December 9th, 2015. Accepted: December 16th, 2015.
Abstract
The presence of water in coal presents a technological challenge for its industrial use in energetic processes. Therefore, this study aims to study the temperature effect on the water adsorption onto coals at 21, 30, 40 and 50°C. A Colombian bituminous coal was used as sample. The coal was characterized by nitrogen adsorption at 77 K (SBET), Scanning electron microscopy (SEM), Fourier transform infrared (FT-IR) spectroscopy, elemental analysis (C-H-N elemental). The results showed that the water uptake increased as the vapor pressure increased. The Talu and Meunier model [1] was used to fit the adsorption isotherms, and the mean square root error (MSRE%) was lower than 10%. Additionally, the Gibbs free energy was found to have negative values, which corroborates the spontaneous adsorption process.
Keywords: Adsorption; Coal; Isotherm; Water
Resumen
La presencia de agua en carbones presenta un reto tecnológico para su uso industrial en procesos energéticos. Por tal motivo, este estudio pretende analizar el efecto de temperatura en la adsorción de agua en carbones a 21, 30, 40 y 50°C. Un carbón sub-bituminoso Colombiano fue usado como muestra. El carbón fue caracterizado por adsorción de nitrógeno a 77K (SBET), Microscopía electrónica de barrido (SEM), Espectroscopia infrarroja por transformada de Fourier (FT-IR), análisis elemental (C-H-N). Los resultados muestran que la captura de agua se incrementa a medida que la presión de vapor aumenta. El modelo Talu & Meunier [1] fue utilizado para ajustar las isotermas de adsorción, presentando un buen ajuste. MSRE% menor al 10%. Adicionalmente, se calculó la energía libre de Gibbs obteniendo valores negativos, lo cual corrobora el proceso espontáneo de adsorción.
Palabras clave: Adsorción; Carbón; Isoterma; Agua
1. Introducción
El carbón es el combustible fósil más abundante en la tierra y es uno de las principales fuentes energéticas [2,3]. Se espera que la producción global de carbón se incremente un 30% y alcance un máximo entre el 2020 y 2050 [2, 3]. Colombia ha demostrado poseer las mayores reservas de carbón en Sudamérica y está calificado como número once a nivel mundial [2,4,5]. Cerca del 85% de las reservas globales de carbón corresponden a carbón sub-bituminoso y lignito [2,4,5]. Ambas clases de carbón presentan sitios activos resultando en altos contenidos de agua debido a su alta afinidad por moléculas polares [6,7]. La presencia de agua en carbones presenta retos severos para su aplicación como por ejemplo: 1) El riesgo de combustión espontánea se incrementa debido a la oxidación del material carbonoso en el carbón a temperatura ambiente. Esto ocurre cuando el carbón es expuesto al aire libre y desarrolla una adsorción química de oxígeno. Las grandes pilas de carbón, especialmente las almacenadas por largos periodos, pueden desarrollar puntos calientes de auto-calentamiento causado por la adsorción/desorción de agua en carbón [8-10]; 2) Los costos industriales por el transporte se incrementan; y 3) Una alta cantidad de energía es requerida para el secado del carbón vía procesos térmicos. En este sentido, muchos autores han estudiado el equilibrio de adsorción y los factores que lo afectan [11-14]: Se destacan los trabajos de: Salame & Bandosz [12], los cuales estudiaron las propiedades termodinámicas de carbones con diferentes grados de acidez superficial, mediante la construcción de isotermas de sorción de agua a tres temperaturas cercanas al ambiente (283-303K) utilizando el método termogravimétrico dinámico. Los resultados obtenidos indicaron que el calor isostérico solo es afectado por la heterogeneidad energética de la superficie. Nishino [15] realizó una investigación sobre la adsorción de vapor de agua en veinte muestras de carbón mineral, provenientes de países como Australia, Japón, Rusia, entre otros. En la experimentación se analizó la relación que existe entre la cantidad de oxígeno en el adsorbente y los grupos hidroxílicos presentes en su superficie, para así obtener isobaras que relacionen la cantidad adsorbida entre el número de grupos en la superficie del carbón. El autor observó que los sitios preferenciales en la superficie del adsorbente están compuestos, en mayor medida, por grupos carboxílicos funcionales. El estudio reveló que la cantidad adsorbida de vapor de agua es proporcional a la distribución de grupos carboxílicos. Allardyce et al. [16] caracterizaron la adsorción de agua en carbones lavados con ácido, y carbones secos con dos métodos a temperatura constante: 1) Altas coberturas o altas presiones de vapor de agua: el primer método usado fue el gravimétrico estático a partir de soluciones salinas saturadas que conservan la humedad relativa constante durante el tiempo de experimentación, y 2) Bajas coberturas o bajas presiones de vapor de agua: el segundo método utilizado es el gravimétrico dinámico (TGA) usando una termobalanza analítica . Se concluyó después de analizar los resultados que no existen diferencias significativas entre las isotermas de adsorción obtenidas por ambos métodos. Charrierre & Behra [17] reportaron las isotermas de adsorción - desorción en muestras de carbón bituminoso y en un carbón lignito. Las isotermas y las cinéticas de sorción de agua en carbón fueron estudiadas a una temperatura de 298K y un rango de presión relativa entre 0 y 0.95. Las isotermas obtenidas presentaron un comportamiento tipo II lo que sugiere que se trata da una adsorción multicapa creciente a medida que aumenta la presión relativa. En este sentido, el objetivo del presente trabajo es evaluar el efecto de la temperatura en la adsorción de agua en carbón sub-bituminoso Colombiano. Diferentes isotermas de adsorción de agua fueron obtenidas a 21, 30, 40, y 50°C. Las isotermas fueron descritas fenomenológicamente por el modelo de Talu & Meunier [1] para el entendimiento del comportamiento de moléculas autoasociativas como el agua en carbón. La muestra de carbón considerada en este estudio fue caracterizada utilizando análisis FT-IR, análisis elemental (C-H-N). Área superficial con el método BET mediante fisisorción de nitrógeno a 77 K y Poder calorífico neto (NHV). Adicionalmente se calcularon los valores de las propiedades termodinámicas de adsorción de agua en carbón.
2. Experimentos
2.1. Preparación Del Carbón
Una muestra de carbón fue obtenida de la región de Córdoba en el noroeste de Colombia y utilizada en este estudio. La preparación de la muestra de carbón fue realizada por separación y posterior cuarteo por cuatro veces. El tamaño de partícula fue subsecuentemente reducido a 250 mm aproximadamente, utilizando un cortador y un Molino de bolas de acuerdo a la norma ASTM D2013-01. Posteriormente, el carbón fue secado en una atmósfera de aire a 120ªC por 12 horas y fue transferido a un Sistema de desecado hasta alcanzar la temperatura ambiente.
2.2. Caracterización de la muestra.
La muestra de carbón fue caracterizada con análisis elemental realizado utilizando un 5000A TOC (CHN Shimadzu, Japan) para obtener los elementos C-H-N, el oxígeno fue obtenido calculando la diferencia. La fisisorción de nitrógeno a 77 K fue realizada utilizando un ASAP 2010 (Micromeritics, USA). El área superficial (SBET) fue obtenida después de desgasificar la muestra por 12 horas aproximadamente a 140°C bajo ultra vacío (10-6 mbar). SBET fue estimada utilizando el método Brunauer, Emmett y Teller (BET) [18-20]. El límite mínimo de confiabilidad del equipo detecta áreas superficiales de 1 m2/g. Para determinar los grupos funcionales presentes en el carbón, la muestra fue caracterizada por espectroscopía infrarroja (IRAffinity-1S Shimadzu, Japan) [21-23]. Microscopía electrónica de barrido (JSM-5910JL, JEOL Japón) fue utilizada para obtener imágenes de la muestra de carbón para confirmar que se trata de una muestra no porosa
2.3. Isotermas de Adsorción.
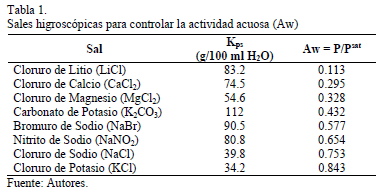
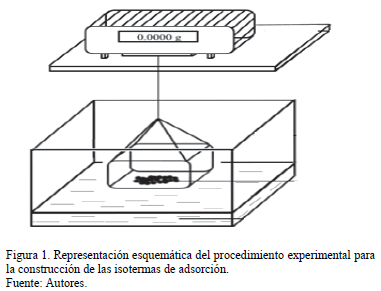
El método termogravimétrico estático fue utilizado para la construcción de las isotermas de adsorción a 21, 30, 40 y 50°C. Este método involucre la determinación del peso Ganado por una muestra de carbón sometido a varias ambientes con actividades de agua diferentes (Aw) a una temperatura definida. Ocho contenedores con soluciones salinas sobresaturadas determinaron un rango de actividad acuosa entre 0.113 y 0.842 (Tabla 1) fueron colocados en un horno para cada temperatura evaluada por 24 horas. Después de la preparación de las soluciones Salinas, la actividad fue medida continuamente hasta que alcanzara un valor constante. Después, 0.5 g de carbón fueron colocados en el interior de los contenedores hasta alcanzar el equilibrio. La muestra de carbón fue pesada cada 8 horas en una balanza analítica (OHAUS - precisión of 0.0001 g) hasta que el peso no variara más de 1%. Este procedimiento fue realizado por triplicado para confirmar la reproducibilidad, y su desviación estándar fue calculada y presentada en forma de barras de error en la figura de las isotermas. Finalmente, la cantidad de agua adsorbida fue estimada calculando la diferencia entre el valor en peso final e inicial de la muestra. La cantidad adsorbida (Nads) fue calculada como g de agua por g de carbón [15,20,24-30]. La Fig. 1 muestra una representación esquemática del procedimiento experimental. La Tabla 1 presenta las sales higroscópicas utilizadas para acondicionar cada sistema a la actividad acuosa deseada.
3. Resultados y Discusión
3.1. Caracterización de la muestra
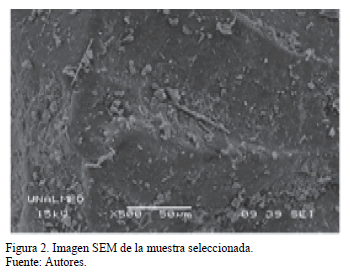
La Fig. 2 presenta las imágenes por espectroscopía electrónica de barrido (SEM) del carbón. De acuerdo con ella parece que el carbón tiene una estructura propia de un material no poroso. La Tabla 2 presenta el área superficial (SBET) del carbón. De hecho, el valor de (SBET) es bajo soportando la hipótesis que afirma que se trata de un material no poroso. La Tabla 2 también presenta el análisis elemental de la muestra.
3.2. Isotermas de Adsorción
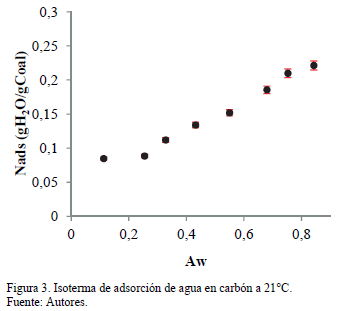
La Fig. 3 presenta la isoterma de adsorción de agua en carbón a 21°C para una actividad acuosa entre 0.1-0.9. La isoterma de adsorción exhibe un comportamiento Tipo III de acuerdo con la clasificación de la IUPAC [1, 6]. La adsorción se incrementa a medida que aumenta la actividad de agua. Este comportamiento está de acuerdo con los estudios disponibles de la pareja sortiva carbón/agua [11,15-17,31-34]. La cantidad de vapor de agua en los contenedores de adsorción se incrementa debido al aumento en la presión de vapor del sistema (actividad acuosa). Las colisiones entre la muestra de carbón y las moléculas de agua son altamente favorecidas, promoviendo un aumento en la cantidad adsorbida. La forma resultante de la isoterma de adsorción indica una baja afinidad entre el adsorbato y el adsorbente, lo cual ocurre principalmente a bajas humedades relativas (actividad acuosa). El comportamiento de la isoterma muestra diferentes interacciones, incluyendo la interacción del agua con los sitios activos, junto con el agua adsorbida multi-capas en la superficie del carbón. (Fig. 3).
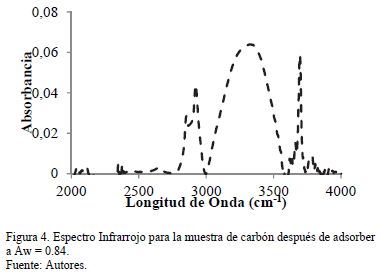
El análisis por espectroscopía infrarroja se presenta en la Fig. 4 para la muestra de carbón después de adsorber agua a una actividad de 0.84. Como se muestra en la gráfica, la señal cercana a 3300 cm-1 indica la presencia de agua. Esto es representativo de las condiciones ambientales en los cuales los cambios de humedad de la muestra reflejados en la intensidad de la señal son acordes a lo encontrado en la isoterma de adsorción.
La isoterma de adsorción fue modelada utilizando el modelo propuesto por Talu y Meunier [1]. Este modelo puede ser expresado como una teoría general para la adsorción de moléculas auto-asociativas sobre estructuras sólidas. La aproximación es similar a la interpretación "química" de fases no ideales de líquido y vapor. La teoría puede explicar el comportamiento de las isotermas Tipo I a Tipo V, incluyendo isotermas tipo III características de adsorbentes no porosos, como es el caso de este trabajo. Los datos de las isotermas son dependientes únicamente en tres parámetros: El inverso de la constante de Henry, la capacidad de saturación y la constante de reacción de formación de "clúster" [1]. El modelo es descrito a continuación:
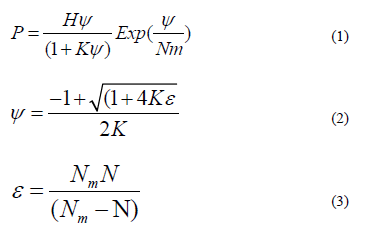
Donde, N (g/g) es la cantidad adsorbida, Nm (g/g) es la cantidad de saturación adsorbida por el monómero, K (g/g) es la constante de reacción relacionada con la agregación de las moléculas autoasociativas, P (kPa) es la presión de equilibrio del sistema, y H (kPa) es el inverso de la constante de la ley de Henry
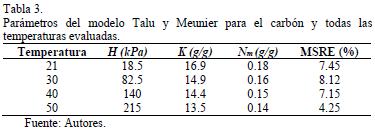
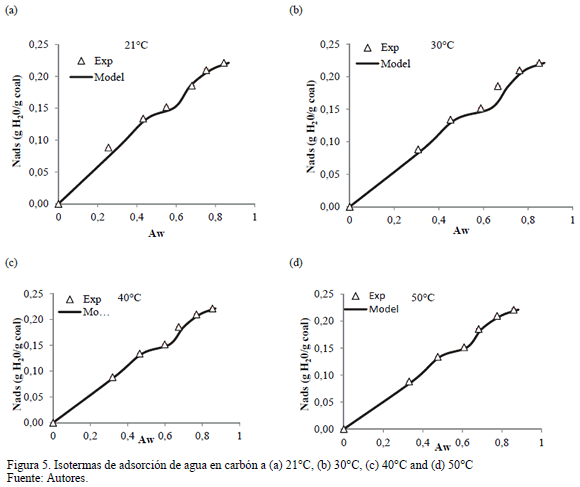
La Fig. 5 presenta la comparación entre los datos experimentales de las isotermas de adsorción a las temperaturas de 21, 30, 40 y 50°C y el ajuste con el modelo de Talu y Meunier. En la Tabla 3 se listan los valores obtenidos de los parámetros propios del modelo. Los valores de los parámetros concuerdan con las características del carbón, en el cual el valor de K es alto. Esto indica una rápida asociación de las moléculas de agua una vez los sitios primarios son ocupados y es similar al comportamiento descrito por las isotermas de adsorción. Por otro lado, el valor de H también es alto, indican que la afinidad en la isoterma de adsorción se disminuye. Altos valores del parámetro H indica menor afinidad de las moléculas de agua en la fase adsorbida. Los sitios activos están en lugares que no son de fácil acceso al agua, valores del parámetro K indican que los sitios primarios están en espacios muy diversos, resultando en un paso ampliado en la isoterma, que comienza a las presiones más bajas [1].
3.2.1. Efecto de Temperatura
La Fig. 5 presenta la cantidad de agua adsorbida en carbón a 21, 30, 40 y 50°C con el ajuste del modelo de Talu y Meunier. Se nota que la adsorción de agua es dependiente de la temperatura del sistema. Se exhibe una isoterma Tipo III de acuerdo a la clasificación de la IUPAC [35], lo que sugiere una adsorción multicapa para todas las temperaturas evaluadas. En una baja actividad de agua de menos de 0,3, el comportamiento es descrito por la adsorción de agua en los sitios de energía debido a la preferencia y la afinidad de las moléculas para estos sitios [6, 7]. A alta actividad, las moléculas de agua tienden a formar clústeres alrededor de los sitios de alta energía a través de asociaciones con puentes de hidrógeno [1]. Como era de esperar, el contenido de agua en el equilibrio aumenta con el aumento de la actividad de agua. Además, la cantidad de agua adsorbida disminuye con la temperatura debido a que la energía superior debilita las fuerzas de interacción entre el adsorbato y el adsorbente, lo que facilita la desorción de agua [20] . Con los datos obtenidos a través de las pruebas de equilibrio de sorción a diferentes temperaturas, es posible calcular las propiedades termodinámicas de sorción.
Los parámetros del modelo de Talu y Meunier [1] a diferentes temperaturas para el carbón se presentan en la Tabla 3. Se nota que el parámetro H es fuertemente dependiente de la temperatura, altos valores sugieren que hay baja afinidad entre el adsorbato y el adsorbente en la región de Henry [1].Cuando la temperatura aumenta, las interacciones entre el carbón y la molécula de agua son débiles. Por lo tanto, las fuerzas de interacción se reducen por la temperatura. El parámetro Nm está relacionado con la cantidad adsorbida máxima, un aumento de temperatura favorece la desorción, por esta razón este valor de parámetro disminuye a medida que aumenta la temperatura.
El parámetro K está relacionada con el grado de agregación de moléculas de agua en la superficie del adsorbente, por lo tanto, cuando menor es la cantidad adsorbida menos agregación en los sitios activos, por eso el parámetro K disminuye a medida que aumenta la temperatura.
3.3. Propiedades Termodinámicas
Para entender aún más el efecto de la temperatura sobre la adsorción, se calcularon las propiedades termodinámicas de sorción. El calor isostérico de adsorción es la cantidad de energía disipada durante el proceso de adsorción [7,36]. También se puede definir como la cantidad de energía requerida para la desorción. Esto se puede calcular a través de la ecuación de Clausius-Clapeyron [24,25,27,28,36-38]. El calor isostérico (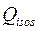 ) de adsorción en unidades de Cal/g se puede estimar sobre la base del equilibrio establecido entre la fase gas y la fase condensada [20]. Esto se muestra en eq. 4:
) de adsorción en unidades de Cal/g se puede estimar sobre la base del equilibrio establecido entre la fase gas y la fase condensada [20]. Esto se muestra en eq. 4:
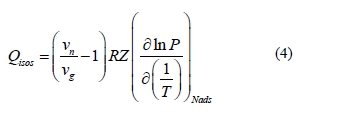
donde P (kPa) y T (K) son la presión y la temperatura de equilibrio, respectivamente. R es la constante universal de los gases, Z es el factor de compresibilidad Vn (m3/g) y Vg (m3/g) son el volumen parcial de las especies adsorbidas y de la fase de gas, respectivamente.
Suponiendo un caso del gas ideal, para un valor constante de Nads la eq. 4 se puede simplificar en la ecuación. 5 [32]:
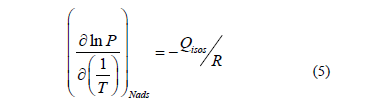
A partir de esta ecuación, el calor isostérico se puede calcular mediante la determinación de la pendiente de la línea de mejor ajuste cuando ln (P) se representa frente 1/T [20, 24]
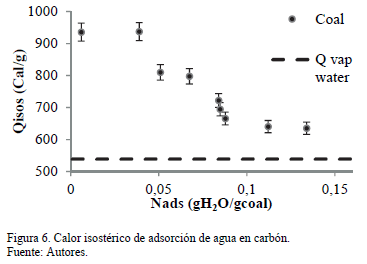
La Fig. 6 presenta el calor isostérico de adsorción de agua sobre el carbón el cual disminuye ligeramente en función de Nads y permanece casi constante en aproximadamente 600 Cal/g. Este valor es considerablemente más bajo que el calor isostérico para el carbón. Se sugiere que el calor isostérico varía con cargas de agua para revelar más baja energía heterogeneidad del adsorbente. Esto es porque los puntos de alta energía situados en la superficie del carbón reducen su intensidad energética, a continuación, la reducción de su afinidad al agua.
Este resultado muestra que la disminución muy ligeramente en la heterogeneidad de energía del adsorbente se debe a que 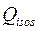 disminuye a medida que la cantidad de agua adsorbida aumenta. Esto indica que la superficie de carbón presenta sitios de alta energía y estrechamente relacionados con los compuestos polares, tales como agua. Esta información está de acuerdo con el equilibrio de adsorción en el que una cantidad más pequeña se adsorbe sobre la muestra de carbón; Por lo tanto, se requiere una menor cantidad de energía para desorber agua. La Fig. 6 muestra que la cantidad de energía requerida para secar la muestra a se conoce con el contenido de humedad deseado. Estos datos son importantes para el diseño de secadores a escala industrial.
disminuye a medida que la cantidad de agua adsorbida aumenta. Esto indica que la superficie de carbón presenta sitios de alta energía y estrechamente relacionados con los compuestos polares, tales como agua. Esta información está de acuerdo con el equilibrio de adsorción en el que una cantidad más pequeña se adsorbe sobre la muestra de carbón; Por lo tanto, se requiere una menor cantidad de energía para desorber agua. La Fig. 6 muestra que la cantidad de energía requerida para secar la muestra a se conoce con el contenido de humedad deseado. Estos datos son importantes para el diseño de secadores a escala industrial.
La energía libre de Gibbs de la adsorción es un criterio que define la viabilidad y la espontaneidad de la adsorción [19,36]. El comportamiento, descrito por la fase adsorbida, es la misma que la fase condensada. Esto también se conoce como el enfoque de condensación y se puede calcular utilizando eq. 6 [19,36]
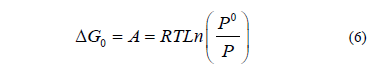
donde, A (Cal/g) es el potencial de adsorción molar, y T (K) y P (KPa) son la temperatura de equilibrio y la presión, respectivamente. La energía libre de Gibbs se calcula una presión normalizada "Po".
La Fig. 7 muestra el cambio en la energía libre de Gibbs que es función de la cantidad adsorbida de agua sobre muestras seleccionadas. Para el sistema, la energía libre de Gibbs aumenta desde un valor negativo a cero. Este resultado demuestra la consistencia termodinámica de los datos experimentales y confirma que la reacción es energéticamente espontánea y heterogénea. Los datos también muestran que el sistema está de acuerdo con las tendencias de calor isostérico, como se informa en la Fig. 6.
Valores más negativos de la energía libre de Gibbs indican un proceso de adsorción exotérmica; Por lo tanto, las moléculas de agua se enlazan más fuerte a la superficie del carbón. La energía libre de Gibbs tiende hacia cero en a cantidades adsorbidas superiores a 0,04 g H2O /g de carbón (porcentajes cercanos al 4% de humedad). Esto significa que el proceso es menos exotérmico y que las moléculas de agua adsorbidas están débilmente unidas a la superficie del carbón.
Esto es debido a la interacción de las moléculas de agua del ambiente con las moléculas de agua que ya están en la superficie del carbón. Por lo tanto, para reducir el contenido de humedad de la muestra tratada del 10% al 4%, se requiere una pequeña cantidad de energía para vaporizar el agua.
3.4. Calidad del carbón
El calor de combustión de un combustible se refiere comúnmente como el valor más alto de calentamiento (HHV) o el valor calórico. Se define como la cantidad de calor liberado cuando una cantidad unitaria del combustible se quema completamente. El poder calorífico es una característica única de cada tipo de combustible. El poder calorífico inferior (PCI) se define de manera similar, excepto que una cierta cantidad de agua de los productos de combustión no se condensa y se mantiene en forma de vapor. Por lo tanto, el LHV no incluye el calor de vaporización del agua producida [33]. La relación entre el HHV y de la LHV se puede expresar de la siguiente manera [39]:
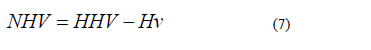
Para combustibles sólidos (por ejemplo, el carbón), se expresa normalmente de la siguiente manera [39]:
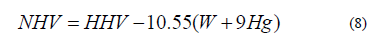
Dónde:
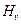 (Cal/g) es el calor de vaporización,
(Cal/g) es el calor de vaporización, 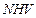 (Cal/g) es el poder calorífico neto del carbón,
(Cal/g) es el poder calorífico neto del carbón, 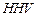 (Cal/g) es el poder calorífico superior del carbón en Cal/g,
(Cal/g) es el poder calorífico superior del carbón en Cal/g, 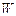 (% en peso) es la cantidad de agua en el carbón y
(% en peso) es la cantidad de agua en el carbón y 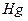 (% en peso) de hidrógeno en el carbon.
(% en peso) de hidrógeno en el carbon.
La Tabla 4 presenta el NHV del carbón:
4. Conclusiones
El equilibrio de adsorción de agua sobre una muestra de carbón sub-bituminoso colombiano se obtuvo a los 21, 30, 40 y 50 °C a través del método de adsorción estática. Los resultados mostraron que la adsorción de agua aumentó a medida que la presión de vapor iba en aumento y disminuye a medida que aumenta la temperatura, la máxima cantidad de adsorbida en la superficie del carbón fue encontrada a 21 °C. El modelo Talu y Meunier se utilizó para ajustar las isotermas de adsorción, mostrando un buen ajuste con el error de raíz cuadrada media (MSRE%) fue inferior al 10%. Además, la energía libre de Gibbs se encontró que tiene valores negativos, lo que corrobora el proceso de adsorción espontánea.
Las propiedades termodinámicas en valor calórico son parámetros importantes para controlar los procesos de transferencia de masa y energía relacionados con el uso de carbones. Es posible determinar la cantidad energética para el secado del carbón calculando el área bajo la curva de la Fig. 6 entre los valores de cantidad adsorbida deseadas.
Agradecimientos
Los autores agradecen a la Universidad Nacional de Colombia por el apoyo logístico y financiero y ARGOS SA
Referencias
[1] Talu, O. and Meunier, F., Adsorption of associating molecules in micropores and application to water on carbon, AIChE journal, 42, pp. 809-819, 1996. DOI: 10.1002/aic.690420319 [ Links ]
[2] Rutledge, D., Hubbert's peak, the coal question, and climate change, Excel Workbook (permission is given to copy this work provided that attribution is given and the following web link is included). [Online], 2007. Available at: http://rutledge.caltech.edu, [ Links ]
[3] Shafiee, S. and Topal, E., When will fossil fuel reserves be diminished?, Energy Policy, 37, pp. 181-189, 2009. DOI: 10.1016/j.enpol.2008.08.016 [ Links ]
[4] Castro, J., Perspectivas de la demanda energética global, Petrotecnia, pp. 54-70, 2011. [ Links ]
[5] Rempel, H., Schmidt, S. and Schwarz-Schampera, U., Reserves, resources and availability of energy resources, Hannover, Bundesanstalt für Geowissenschaften und Rohstoffe (BGR). [Online], 2009. Available at: www.bgr.bund.de. [ Links ]
[6] Dubinin, M., Inhomogeneous microporous structures of carbonaceous adsorbents, Carbon, 19, pp. 321-324, 1981. DOI: 10.1016/0008-6223(81)90079-8 [ Links ]
[7] Dubinin, M. and Serpinsky, V., Isotherm equation for water vapor adsorption by microporous carbonaceous adsorbents, Carbon, 19, pp. 402-403, 1981. [ Links ]
[8] Bowes, P., Self-heating: evaluating and controlling the hazards: Department of the Environment, Building Research Establishment, 1984. [ Links ]
[9] J. N. Carras and B. C. Young, Self-heating of coal and related materials: models, application and test methods, Progress in Energy and Combustion Science, 20, pp. 1-15, 1994. DOI: 10.1016/0360-1285(94)90004-3 [ Links ]
[10] Nalbandian, H., Propensity of coal to self-heat: IEA Clean Coal Centre London, 2010. [ Links ]
[11] Karthikeyan, M., Kuma, J.V., Hoe, C.S. and Ngo, D.L.Y., Factors affecting quality of dried low-rank coals, Drying Technology, 25, pp. 1601-1611, 2007. DOI: 10.1080/07373930701590608 [ Links ]
[12] Salame, I.I. and Bandosz, T.J., Study of water adsorption on activated carbons with different degrees of surface oxidation, Journal of colloid and interface science, 210, pp. 367-374, 1999. DOI: 10.1006/jcis.1998.5918 [ Links ]
[13] Slasli, A., Jorge, M., Stoeckli, F. and Seaton, N., Modelling of water adsorption by activated carbons: effects of microporous structure and oxygen content, Carbon, 42, pp. 1947-1952, 2004. DOI: 10.1016/j.carbon.2004.03.034 [ Links ]
[14] Xin, L. and Zhong, L., Adsorption of water vapor onto and its electrothermal desorption from activated carbons with different electric conductivities, Separation and Purification Technology,. 85, pp. 77-82, 2012. DOI: 10.1016/j.seppur.2011.09.048 [ Links ]
[15] Nishino, J., Adsorption of water vapor and carbon dioxide at carboxylic functional groups on the surface of coal, Fuel, 80, pp. 757-764, 2001. DOI: 10.1016/S0016-2361(00)00136-8 [ Links ]
[16] Allardice, D., Clemow, L., Favas, G., Jackson, W., Marshall, M. and Sakurovs, R., The characterisation of different forms of water in low rank coals and some hydrothermally dried products, Fuel, 82, pp. 661-667, 2003. DOI: 10.1016/S0016-2361(02)00339-3 [ Links ]
[17] Charrière, D. and Behra, P., Water sorption on coals, Journal of Colloid and Interface Science, 344, pp. 460-467, 2010. DOI: 10.1016/j.jcis.2009.11.064 [ Links ]
[18] Brunauer, S., Emmett, P.H. and Teller, E., Adsorption of gases in multimolecular layers, Journal of the American Chemical Society,. 60, pp. 309-319, 1938. [ Links ]
[19] Cortés, F., Chejne, F., Carrasco-Marín, F., Moreno-Castilla, C. and Pérez-Cadenas, A. Water adsorption on zeolite 13X: Comparison of the two methods based on mass spectrometry and thermogravimetry, Adsorption, 16, pp. 141-146, 2010. DOI: 10.1007/s10450-010-9206-5 [ Links ]
[20] Rouquerol, F., Rouquerol, J. and Sing, K., Adsorption by powders and porous Solid; Principles, methodology and applications, Academic Press, San Diego, 1999. [ Links ]
[21] Franco, C., Martínez, M., Benjumea, P., Patiño, E. and Cortés, F., Water remediation based on oil adsorption using nanosilicates functionalized with a petroleum vacuum residue, Adsorption Science & Technology, 32, pp. 197-208, 2014. DOI: 10.1260/0263-6174.32.2-3.197 [ Links ]
[22] Franco, C.A., Montoya, T., Nassar, N.N. Pereira-Almao, P. and Cortés, F.B., Adsorption and subsequent oxidation of colombian asphaltenes onto Nickel and/or Palladium oxide supported on fumed silica nanoparticles, Energy & Fuels. 27, pp. 7336-7347, 2013. DOI: 10.1021/ef4018543 [ Links ]
[23] Franco, C.A., Nassar, N.N. and Cortés, F.B., Removal of oil from oil-in-saltwater emulsions by adsorption onto nano-alumina functionalized with petroleum vacuum residue, Journal of Colloid and Interface Science, 433, pp. 58-67, 2014. DOI: 10.1016/j.jcis.2014.07.011 [ Links ]
[24] Comaposada, J., Gou, P. and Arnau, J., The effect of sodium chloride content and temperature on pork meat isotherms, Meat Science. 55, pp. 291-295, 2000. DOI: 10.1016/S0309-1740(99)00154-0 [ Links ]
[25] Vos P.T. and Labuza, T.P., Technique for measurement of water activity in the high aw range, Journal of Agricultural and Food Chemistry, 22, pp. 326-327, 1974. DOI: 10.1021/jf60192a016 [ Links ]
[26] Coleman, R., Irreversible drying of carbonaceous fuels such as low-rank coals, in Fuel and Energy Abstracts, 1996, pp. 85-85. [ Links ]
[27] Cortés, F.B., López, V. and Rojano, B.A., Sorption properties of cape gooseberry (Physalis peruviana L.), International Journal of Food Engineering, 8, 2012. DOI: 10.1515/1556-3758.2421 [ Links ]
[28] Davy, R., Johnston, B., Nicol, S., Stapleton, L. and Veal, C., Residual moisture reduction of coarse coal using air purging. 2. Pilot scale studies, Minerals Engineering, 14, pp. 671-680, 2001. DOI: 10.1016/S0892-6875(01)00059-0 [ Links ]
[29] Omaña, M., Cortés, F., Isáza, C. y García, A., Isotermas de sorción de agua en residuos de extracción de jugo de naranja, Biotecnología en el Sector Agropecuario y Agroindustrial, 8, pp. 61-67, 2010. [ Links ]
[30] Zapata, K., Rojano, B.A. and Cortés, F.B., Effect of relative humidity on the antioxidant activity of spray-dried banana passion fruit (Passiflora Mollisima Baley)-Coated pulp: Measurement of the Thermodynamic Properties of Sorption, Chemical Engineering Communications, 202, pp. 269-278, 2015. DOI: 10.1080/00986445.2013.840829 [ Links ]
[31] Chen, X.D., A new water sorption equilibrium isotherm model, Food Research International, 30, pp. 755-759, 1997. DOI: 10.1016/S0963-9969(98)00042-8 [ Links ]
[32] Marchessault, R., Application of infra-red spectroscopy to cellulose and wood polysaccharides, Pure and Applied Chemistry, 5, pp. 107-130, 1962. DOI: 10.1351/pac196205010107 [ Links ]
[33] McCain, W.D., The properties of petroleum fluids: PennWell Books, 1990. [ Links ]
[34] Shigehisa, T., Inoue, T. and Kumagai, H., Mathematical model of water sorption isotherms of UBC, Fuel Processing Technology, 131, pp. 133-141, 2015. DOI: 10.1016/j.fuproc.2014.11.023 [ Links ]
[35] Peinter, P., Starsinic, M. and Coleman, M., Determination of functional groups in coal by fourier transform interferometry, fourier transform infrared spectroscopy, Academic Press, New York, 4, 1985, 169 P. [ Links ]
[36] Soares, J.L., Desenvolvimento de novos adsorventes e processos híbridos em reforma catalítica por vapor de água, 2003. [ Links ]
[37] Cortes, F.B., Rojano, B. and Chejne-Janna, F., Advantages and thermodynamic limitations of the experimental sorption isosteric method, DYNA, 80, pp. 155-162, 2013. [ Links ]
[38] Seifert J., and Emig, G., Mikrostrukturuntersuchungen an porösen Feststoffen durch Physisorptionsmessungen, Chemie Ingenieur Technik. 59, pp. 475-484, 1987. DOI: 10.1002/cite.330590606 [ Links ]
[39] Gossman, D., Net heating values versus High Heating values, GCI Tech Notes, 16, 2011, 1 P. [ Links ]
E.A. Taborda-Acevedo, es Ing. Químico de la Universidad Nacional de Colombia en el año 2007. MSc. en Ingeniería Química de la Universidad Nacional de Colombia en el año 2014. Actualmente estudiante de doctorado en sistemas energéticos de la Universidad Nacional de Colombia, perteneciente al grupo de investigación en fenómenos de superficie - Michael Polanyi con experiencia en proyectos de investigación y extensión en el área de fenómenos de superficie como adsorción, humectabilidad, reología, entre otros. Código ORCID: 0000-0001-5920-0830
W.J. Jurado, es Ing. Químico de la Universidad Nacional de Colombia. MSc. en Ingeniería Química de la Universidad Nacional de Colombia en el año 2014. Actualmente, perteneciente al Departamento de optimización de procesos del grupo ARGOS. Experiencia como líder de proyectos de investigación en cementos ARGOS. ORCID: 0000-0001-9236-7042
F.B Cortes, es Ing. Químico egresado de la Universidad Nacional de Colombia. Dr. en Ingeniería: Sistemas energéticos de la Universidad Nacional de Colombia. Profesor asociado de la Universidad Nacional de Colombia sede Medellín en el Departamento de Química y Petróleos. Director del Grupo de Investigación en Fenómenos de Superficie - Michael Polanyi, Departamento de Química y Petróleos, Facultad de Minas, Universidad Nacional de Colombia, Sede Medellín, Colombia; con experiencia en proyectos de investigación y extensión en el área de fenómenos de superficie aplicados a la productividad de yacimientos y áreas afines. ORCID: 0000-0003-1207-3859