Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Salud Pública
Print version ISSN 0120-386X
Rev. Fac. Nac. Salud Pública vol.32 no.1 Medellín Jan./Apr. 2014
INVESTIGACIONES
Evaluación de la susceptibilidad antimicrobiana de cepas de Salmonella spp. aisladas del beneficio porcino en Colombia
Evaluation of Antimicrobial susceptibility of Salmonella spp. strains isolated from Pork Carcasseson Colombia
Paula M. Bermúdez D 1;Sandra M. Rincón G2;Martha C. Suárez A3
1 Estudiante de Medicina Veterinaria, internado de investigación Grupo Genética Molecular de Patógenos GEMPA. Correo Electrónico: pmbermudezd@unal.edu.co.
2 Bacterióloga y Laboratorista Clínica, Estudiante de la Maestría Interfacultades en Microbiología, Investigadora asociada grupo Genética Molecular de Patógenos GEMPA. Correo Electrónico: smrincong@unal.edu.co
3 Profesora Asociada de Microbiología, Coordinadora del Grupo Genética Molecular de Patógenos GEMPA. Laboratorio de Microbiología, Departamento de Ciencias para la Salud Animal, Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia. Correo Electrónico: mcsuarezal@unal.edu.co
Recibido: 01 de febrero de 2013. Aprobado: 09 de septiembre de 2013.
Marín YA, Chávez BM. Inconsistencias en la afiliación al Sistema General de Seguridad Social en Salud: Barrera administrativa para la atención integral de las urgencias médicas. Rev. Fac. Nac. Salud Pública 32(1): 88-94
RESUMEN
OBJETIVOS: el estudio buscó establecer patrones de resistencia antimicrobiana de 155 cepas de Salmonella spp., aisladas de la superficie de canales de cerdo, procedentes de plantas de beneficio en Colombia.
METODOLOGIA:mediante el método de difusión en disco (Bauer et. Kirby, 1966) se evaluaron nueve antimicrobianos: Amoxicilina y ácido clavulánico (30 ug), Ampicilina (10 ug), Ceftiofur (30 ug), Ciprofloxacina (5 ug), Cloranfenicol (30 ug), Florfenicol (30 ug), Gentamicina (10 ug), Sulfadiazina y Trimetoprim (25 ug) y Tetraciclina (30 ug).
RESULTADOS:los resultados confirmaron la presencia de cepas multiresistentes de Salmonella spp. de origen porcino, mostrando 30 patrones diferentes de multiresistencia; el más común fue Ampicilina, Amoxicilina, Cloranfenicol, Florfenicol y Tetraciclina en el 16,77% (n=26) de las cepas. Tetraciclina y Florfenicol fueron los antimicrobianos menos efectivos en el 94,84% (n=147) y 47,74% (n=74) de cepas resistentes, respectivamente.
DISCUSION:se deben consolidar los sistemas de monitoreo, y de vigilancia y control de las resistencias antimicrobianas para prevenir, con un enfoque de cadena productiva, la diseminación de cepas multiresistentes en alimentos de origen animal, como parte integral del sistema de gestión de inocuidad de los alimentos en Colombia.
Palabras clave: salmonelosis no tifoideabeneficio porcino, inocuidad, resistencia antimicrobiana,Bauer&Kirby
ABSTRACT
OBJECTIVE: this study was aimed to establish the patterns of antimicrobial resistance in 155 strains of Salmonella spp. isolated from pig carcasses in slaughter house in Colombia.
METHODOLOGY: using the disc diffusion method (Bauer & Kirby, 1966) we evaluated nine antibiotics: amoxicillin-clavulanic acid (30 ug), ampicillin (10 ug), ceftiofur (30 ug), ciprofloxacin (5 ug), chloramphenicol (30 ug), florfenicol (30 ug), gentamicin (10 ug), sulfadiazine / trimethoprim (25 ug) and tetracycline (30 ug).
RESULTS: the results confirm the presence of multiresistant strains of Salmonella spp. in pig slaughter house, showing 30 different patterns of multidrug resistance, the most common was ampicillin, amoxicillin, chloramphenicol, florfenicol and tetracycline in 16.77% (n = 26) strains. Tetracycline and florfenicol were less effective with 94.84% (n = 147) and 47.74% (n = 74) of the resistant strains, respectively.
DISCUSSION: it must consolidate monitoring programs and surveillance and control systems to prevent the spread of multiresistant strains in foods of animal origin, with an approach of supply chain of pork, as an essential element of food safety system in Colombia.
Key words: Nontyphoidal Salmonellosis, pigSlaughter, food safety, antimicrobial resistance, Bauer & Kirby
Introducción
La salmonelosis no tifoidea es una Enfermedad Transmitida por Alimentos (ETA) de distribución mundial, zoonótica, de gran impacto sobre la salud humana y animal y, por lo tanto, de gran importancia en el ámbito de la salud pública internacional [1]. Su transmisión a humanos se ha asociado al consumo de alimentos contaminados como carnes, leche y huevos [2], frutas y verduras [3].Varias serovariedades de Salmonella spp. pueden infectar a los porcinos y se han vinculado con brotes en humanos [4]. Las principales manifestaciones incluyen gastroenteritis, bacteremia, infección localizada o estado portador crónico asintomático.
La presencia del microorganismo y de la enfermedad en la producción primaria (la granja), la subdosificación, tiempos de administración menores al prescrito, así como el uso de antimicrobianos como promotores de crecimiento, se cree pueden contribuir a aumentar la presencia de cepas de Salmonella spp. resistentes y contaminar los alimentos o infectar a animales y humanos [5]. El surgimiento de cepas resistentes ha redundado en infecciones más duraderas y con mayor riesgo de hospitalización en humanos [6]. La capacidad de la Salmonella spp. para adquirir resistencia a determinados fármacos está dada por la captación de nuevo material genético, mutaciones en el cromosoma bacteriano o activación de bombas de flujo.
Organismos de referencia para el control agroalimentario y la salud pública internacional como la Food and Agriculture Organization (FAO), Organización Mundial de la Salud (OMS) y la Organización Mundial de Sanidad Animal (OIE) recomiendan el desarrollo y fortalecimiento de programas de vigilancia de las resistencias antimicrobianas, en especial, para las serovariedades no tifoideas de Salmonella spp. [7]. Por tanto, el monitoreo continuo es necesario para contribuir a programas de prevención y control de la diseminación de patógenos resistentes y que permitan maximizar la eficacia y disponibilidad de los antimicrobianos usados en veterinaria, en consonancia con los principios de uso prudente, según recomienda la OIE [8], sopesando que en los actuales sistemas de producción porcina, para el bienestar y salud de los cerdos, el uso de antimicrobianos es fundamental [9]. Por lo tanto, la ejecución correcta y continua de pruebas de susceptibilidad antimicrobiana es esencial para contribuir al monitoreo de fármaco-resistencias y compilar información que permita dirigir esfuerzos para mitigar sus efectos [10].
Se considera que el ingreso de cerdos portadores de Salmonella spp. a las plantas de beneficio es la mayor fuente de contaminación de canales y productos cárnicos [11]. Durante el faenado, los canales pueden contaminarse con Salmonella spp. a partir de tejidos como faringe (amígdalas), linfonodos y contenido intestinal, incluso cuando el proceso se realiza adecuadamente. Así, se puede favorecer la permanencia de cepas multiresistentes en las plantas de beneficio. Por tanto, este estudio buscó determinar la susceptibilidad antimicrobiana en cepas colombianas de Salmonella spp. aisladas del beneficio porcino, estableciendo patrones de multiresistencia y aportando información que contribuya a generar estrategias de contención de la diseminación de cepas multiresistentes.
Metodología
Aislamientos Bacterianos
En este estudio, de tipo descriptivo, se utilizaron 155 cepas que hacen parte del repositorio del laboratorio de Microbiología Veterinaria de la Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia, sede Bogotá, previamente aisladas de canales de cerdo (método de la esponja ISO 17604:2003), provenientes de cuatro plantas de beneficio porcino de zonas de alta producción porcícola en Colombia, durante el periodo comprendido entre marzo y agosto de 2011.
El aislamiento e identificación de los microorganismos se realizó según la técnica ISO 6579:2002. Éstos fueron confirmados con el sistema automatizado VITEK® 2 Compact System, y mediante aglutinación en placa con antisuero Poly A-I & Vi (BD – Difco®). Los aislamientos confirmados fueron almacenados en placas de Agar Tripticasa soya.
Evaluación de susceptibilidad antimicrobiana
La evaluación de la susceptibilidad antimicrobiana se realizó por medio del método estandarizado de difusión en disco (Bauer et. Kirby, 1966) [12]. La medición de la zona de inhibición e interpretación de los resultados se realizó conforme a las recomendaciones técnicas del Clinical and Laboratory Standards Institute (CLSI) para cepas de origen animal (M31-A3, 2008: Performance Standards for Antimicrobial Disk and Dilution Susceptibility Tests for Bacteria Isolated From Animals; Approved Standard – Third Edition) [13].
La selección de los antimicrobianos fue hecha de acuerdo a los siguientes criterios: antimicrobianos de uso veterinario en porcicultura registrados en Colombia (registro Instituto Colombiano Agropecuario -ICA-), en concordancia con la lista de antimicrobianos de importancia veterinaria de la OIE (World Organisation for Animal Healt, Resolution No. XXVIII, 2007) [14], antimicrobianos evaluados por el programa EQUAS (The External Quality Assurance System of the WHO Global Salm-Surv, 2008) [15] para la vigilancia mundial de las resistencias de Salmonella spp. Y antimicrobianos incluidos en los registros del CLSI, para interpretación de resultados [13]. Los antimicrobianos probados fueron: Amoxacilina-ácido clavulánico (20/10ug), Ampicilina (10 ug), Ceftiofur (30 ug), Ciprofloxacina (5 ug), Cloranfenicol (30 ug), Florfenicol (30 ug), Gentamicina (10 ug), Sulfametoxazol y Trimetoprim (25 ug), Tetraciclina (30 ug). El control de calidad fue realizado con la cepa Escherichia coli ATCC 25922.
Resultados
De las 155 cepas de Salmonella spp. Evaluadas, el 5,16 % (n=8) resultaron susceptibles a los nueve antimicrobianos y el 94,85% (n=147) fue resistente a uno o más antimicrobianos.
El mayor porcentaje de resistencia fue frente a Tetraciclina, en el 94,84% (n=147) de las cepas, seguido de Florfenicol, en el 47,74% (n=74) de las cepas. Frente a Ampicilina y Cloranfenicol, el 41,94% (n =65) y 38,71% (n=60) de las cepas fueron resistentes, respectivamente. En la tabla 1 se especifica el número y porcentaje de cepas resistentes para cada antimicrobiano evaluado. Téngase en cuenta que, para el reporte de resistencia por antibiótico, para una misma cepa pueden existir hasta ocho antimicrobianos ineficaces in vitro. Las cepas que manifestaban rangos intermedios fueron consideradas como resistentes.
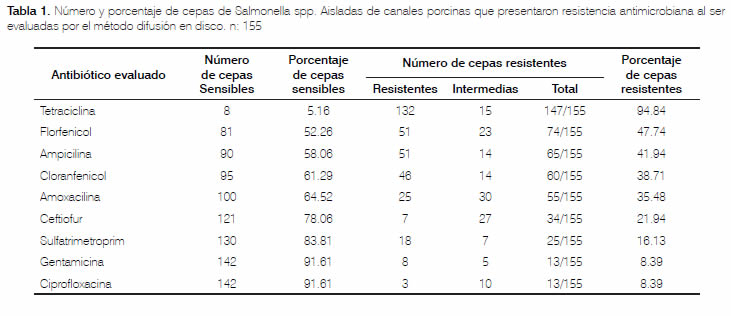
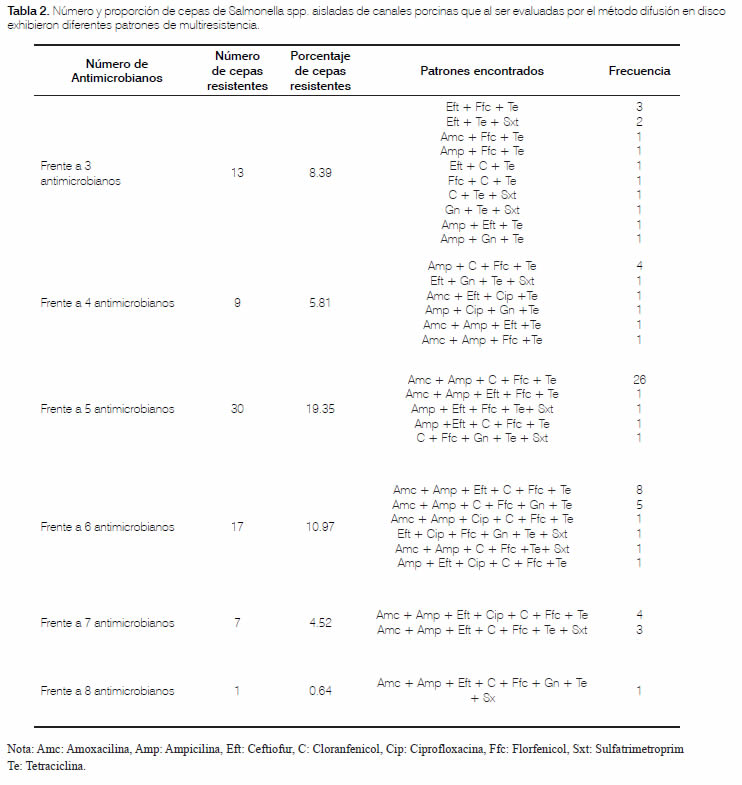
Del total de cepas, el 24,52 % (n=38) resultaron resistentes a un antibiótico; el 20,65% (n=32), frente a dos antimicrobianos, y el 49,68% (n=77), exhibieron 30 diferentes patrones de multiresistencia (resistencia a tres o más antimicrobianos). El patrón de resistencia más frecuentemente observado fue Amoxicilina, Ampicilina, Cloranfenicol, Florfenicol, más Tetraciclina en el 16,77 % (n=26) de las cepas. Multiresistencias frente a seis y siete antimicrobianos, fueron observadas en el 10,96% (n=17) y 4,52% (n=7) de las cepas, respectivamente. Una cepa fue multiresistente frente a ocho antimicrobianos de los nueve evaluados. En la tabla 2 se relaciona la proporción de cepas multiresistentes, caracterizando los patrones observados para cada grupo.
Discusión
La presencia de resistencias antimicrobianas en cepas no tifoideas de Salmonella spp. puede ser de gran impacto para la salud pública, debido a que aumenta la probabilidad de fracaso terapéutico cuando la infección es grave y, al parecer, confiere mayor virulencia a la bacteria [16]. De éste hecho se deriva la importancia de la transmisión de resistencias antimicrobianas de Salmonella spp., a través del consumo de alimentos de origen animal. Los resultados mostraron que el 94,8% (n=147) de las cepas evaluadas fueron resistentes a uno o más antimicrobianos, representando un alto porcentaje de resistencia, contrastado con un informe del programa NARMS (The National Antimicrobial Resistance Monitoring System) de EUA en el 2010, el cual reveló que en el año 2007 el 43,1% de los aislamientos de especies de Salmonella spp. no tifoideas eran resistentes al menos a un antibiótico, semejante a los datos reportados por el mismo organismo en 1996 [17].
De igual forma, en un estudio realizado en España, de 238 aislamientos de Salmonella spp. de origen animal, el 61% fueron resistentes a Tetraciclina y Ampicilina simultáneamente, y el 50% fue resistente frente a Cloranfenicol. Adicionalmente, la resistencia frente a, al menos, un antimicrobiano fue del 98% en aislamientos de S. Typhimurium de origen animal, similar a la reportada en éste estudio [5].
Zhao y otros, 2008, en un estudio realizado en EUA entre el 2002 y 2006, encontraron que el 66,4% (n=198) de aislamientos de Salmonella Heidelberg de carne de pollo, pavo y cerdo exhibieron resistencia frente a, al menos, un antimicrobiano y el 49% (n=16,4), frente a cinco antibióticos simultáneamente. El 3,4% (n=10) de éstos aislamientos correspondían a carne de cerdo; la mitad de los mismos mostró resistencia frente a Tetraciclina [18].
En Colombia, en un estudio realizado en 93 cepas de Salmonella spp. aisladas de diversos alimentos, incluida la carne de cerdo, se reportó que el 46% (n=40) de los aislamientos presentó resistencia, al menos, frente a un antimicrobiano, y la proporción de multiresistencia sólo alcanzó el 4,3% (n=4). Aquí, también la Tetraciclina y la ampicilina fueron los antimicrobianos con mayor porcentaje de resistencia, con el 18,3% (n=17) y el 17.2% (n=16), respectivamente [16].
La posibilidad de transmisión de cepas resistentes que podría darse a lo largo de la cadena productiva, hasta el consumo de alimentos de origen animal, ha sido evidenciada por la asociación entre las diez principales serovariedades de Salmonella spp. causantes de infección para los humanos, que también han sido vinculadas a enfermedad para los animales [19]. En éste estudio, el 16,77% (n=26) de los aislamientos mostró multiresistencia para Amoxicilina, Ampicilina, Cloranfenicol, Florfenicol y Tetraciclina, siendo el patrón más comúnmente observado. Previamente se ha reportado que las familias antibióticas que han manifestado mayores resistencias han sido los B-lactámicos, tetraciclinas, aminoglucósidos y sulfonamidas [17]. La propagación de cepas de Salmonella spp. multiresistentes puede atribuirse a la continua transmisión de elementos genéticos entre poblaciones microbianas de las plantas de beneficio y aislamientos nuevos provenientes de la producción primaria, constituyéndose en un riesgo para la inocuidad de los alimentos y para el consumidor.
En 1984 se reportaron los primeros aislamientos de Salmonella Typhimurium fago tipo DT104, el cual se ha asociado a resistencia simultánea frente a Ampicilina, Cloranfenicol, Tetraciclina, Estreptomicina y Sulfametoxazol [17]. Aunque los dos últimos no fueron probados en éste estudio, es probable que la circulación de este fagotipo se relacione con los tres antimicrobianos que exhibieron mayor resistencia (Tetraciclina, Cloranfenicol y Ampicilina) y, por tanto, sea esperable la resistencia frente a Estreptomicina y sulfametoxazol. No obstante, otros mecanismos pueden estar involucrados; por ejemplo, la resistencia de Salmonella spp. en beta-lactámicos puede atribuirse a la producción de β-lactamasas transferidas por plásmidos [17]. La diferencia entre la resistencia presentada por Ampicilina (41,94%) y Amoxicilina (35,48 %) podría sugerir la participación de dichas enzimas.
Aunque la resistencia frente a Tetraciclina se ha reportado en previas investigaciones, la proporción encontrada en este estudio fue más alta de lo esperada (94,84 %), reflejando probablemente su uso excesivo en la producción primaria porcícola en el país. Es factible que su frecuente indicación como profiláctico en el alimento o agua de bebida en los porcinos esté relacionada con las altas tasas de resistencia reportadas. Éste hallazgo puede ser además relevante respecto a la presión de selección en otras poblaciones bacterianas, ya que el mecanismo de resistencia asociado a este antimicrobiano suele ser por la codificación de bombas de flujo a través de plásmidos. Éstos usualmente median resistencias a múltiples antibacterianos y pueden transferirse rápidamente entre diferentes especies o géneros bacterianos, especialmente entre la familia Enterobacteriaceae [20]. Con base en esto, podría ser esperable una alta resistencia en otras bacterias (flora residente o bacterias patógenas), extendiendo la capacidad de diseminación de resistencia.
El alto porcentaje de resistencia frente a Cloranfenicol (38.79%), teniendo en cuenta que su uso ha sido prohibido en animales destinados a la producción de alimentos, podría señalar la permanencia de patrones de resistencia a través del tiempo, incluso en ausencia de presión de selección, o que probablemente esos aislamientos no provengan de la producción primaria o que mecanismos de resistencia para otros antimicrobianos puedan estar relacionados. La resistencia a Cloranfenicol también es mediada por plásmidos que expresan bombas de flujo, reduciendo las concentraciones tóxicas del fármaco en la bacteria o por la codificación de una acetiltransferasa que modifica la diana del antimicrobiano [17]. Es probable que dicho mecanismo compartido entre Tetraciclina y Cloranfenicol pueda estar relacionado en la extensión de resistencias para este antimicrobiano; o bien, que dicha resistencia se relacione con la circulación de Salmonella Typhimuriumfago tipo DT104, que involucra resistencia a Cloranfenicol [17].
Por otro lado, debe destacarse que en enero del 2012, 26 granjas porcícolas en Alemania fueron cerradas temporalmente por la detección del antibiótico en los piensos, lo cual condujo al sacrificio oficial de cerca de doce mil cerdos. Lo anterior sugiere que fuentes diferentes a la administración de antibióticos en la producción primaria podrían estar vinculadas en el origen de estas resistencias. La importancia de este hallazgo se vincula con el uso particular de éste antibiótico para humanos [21].
En humanos las fluoroquinolonas son antimicrobianos de primera línea para el tratamiento de sepsis por gram-negativos [22]. Las fluoroquinolonas, como la Ciprofloxacina, y las Cefalosporinas de tercera y cuarta generación han sido los antimicrobianos de elección para el tratamiento de salmonelosis en humanos cuando la infección no se limita al TGI, por inmunodepresión o en grupos etarios en riesgo [9]. Sin embargo, el uso de estas familias de antimicrobianos en veterinaria se extiende para un amplio espectro de bacterias [16]. Los resultados de éste estudio muestran que el 8,39% (n=13) de cepas fue resistente a Ciprofloxacina, y el 21,94% (n=34) fue resistente a Ceftiofur, cuya resistencia entre las enterobacterias se relaciona con la resistencia a Ceftriaxona, una de las Cefalosporinas de tercera generación usada en niños para el tratamiento de salmonelosis grave [17]. El monitoreo periódico y continuo de multiresistencias, en especial para estos antimicrobianos clasificados por la OMS como antimicrobianos de importancia crítica prioritarios, es necesario dentro del marco de construcción de estrategias que mitiguen el impacto de la extensión de las resistencias antimicrobianas [21], no olvidando que la resistencia frente a éstos no es un fenómeno nuevo, pues ha venido dándose desde hace tres décadas y se ha reportado en varios países.
Los resultados de éste estudio resaltan la necesidad de la adopción en Colombia de prácticas a lo largo de toda la cadena productiva porcícola, desde la granja hasta la mesa, iniciando con programas que motiven la reducción del uso de antimicrobianos en granja, esclareciendo las situaciones que lo ameriten y fortaleciendo el impacto de la medicina preventiva en las piaras e instalaciones y así evitar la infección con Salmonella spp., pues mientras ingresen animales positivos a las plantas de beneficio habrá un gran riesgo de transmisión al consumidor [23]. En Colombia, Parra y Col. reportan que la ausencia de asistencia técnica médico-veterinaria y la falta de capacitación del personal en la producción pecuaria da como resultado que la formulación de medicamentos sea sin criterio profesional, lo cual genera una mayor probabilidad de uso errado de los medicamentos [24], que para el caso de los antimicrobianos puede contribuir a generar resistencias.
Sin embargo, la producción primaria no será la única fuente de microorganismos resistentes, por eso con la misma importancia debe procurarse la manipulación segura durante todas las etapas, en las plantas de beneficio y transformación, y hasta el consumo final. Éstas acciones implican una coordinación multisectorial con esfuerzos continuos que involucran a todo el sector porcícola y el sector oficial [17].
En la Unión Europea se han implementado medidas drásticas de control para disminuir las resistencias antimicrobianas, como la eliminación de antimicrobianos administrados como promotores de crecimiento en la ganadería y la limitación de su uso cuando no sea justificada por enfermedad, así como el fortalecimiento de programas de vigilancia [17]. Sin embargo, tal proscripción podría no estar soportada por suficientes datos, según otro estudio analizado, ya que el riesgo real podría ser nulo o muy pequeño [25]. En nuestro país, a través del decreto 2640 del 2007, en el artículo doce se establece que los antimicrobianos usados en terapéutica humana o veterinaria no deben indicarse como promotores de crecimiento. Lo cierto es que, ante el problema emergente que resulta de las resistencias antimicrobianas y sus repercusiones sobre la salud pública, se hacen necesarios nuevos estudios que establezcan el uso prudencial de antimicrobianos en piaras de nuestro país, a la par que se van esclareciendo otros monitoreos epidemiológicos sobre el estado de las multiresistencias de Salmonella spp. circulantes en nuestro medio, que desde hace años la OMS ha recomendado, partiendo de la creación de sistemas nacionales de vigilancia, control y prevención de las resistencias antimicrobianas [26, 27].
Conclusión
En el presente estudio se observo una alta proporción de resistencia antimicrobiana en cepas de Salmonella spp. provenientes de plantas de beneficio, vislumbrando la necesidad de garantizar la inocuidad de los alimentos de origen animal desde el eslabón primario (control en el origen) [27] y en cada uno de los eslabones de la cadena productiva con el fin de contener la diseminación de patógenos que podrían tener o adquirir genes de resistencia, mediante programas de monitoreo y a través de la consolidación de un sistema Nacional de Vigilancia de las resistencias como elemento importante del Sistema de Gestión de Inocuidad de los alimentos en Colombia.
Agradecimiento
Al Ministerio de Agricultura y Desarrollo Rural (MADR) por el soporte financiero.
Referencias
1 Multi-drug resistant Salmonellatyphimurium. Fact Sheet No 139. January 1997 [ Links ]
2 Gray JT, Fedorka-Cray PJ. Long-term survival and infectivity of Salmonellacholeraesuis. Berl Munch TierarztlWochenschr. 2001;114:370–4. [ Links ]
3 James J. Microbial Hazard Identification in Fresh Fruits and Vegetables. Wiley Editorial; 2006. p. 46-9. [ Links ]
4 Craig DE, Slauch JM. The Prokaryotes: The Genus Salmonellaspp.Springer Editorial; 2006. p. 123–158. [ Links ]
5 Cruchaga S, Echeita A, Aladueña A, García-Peña J, Frias N, et al.Antimicrobial resistance in Salmonellae from humans, food and animals in Spain in 1998. J Antimicrob Chemother. 2001;47:315-21. [ Links ]
6 Varma JK, Greene KD, Ovitt J, Barrett TJ, MedallaF,et al. Hospitalization and antimicrobial resistance in Salmonella outbreaks, 1984–2002. Emerg Infect Dis. 2005;11:943–946. [ Links ]
7 Organización Mundial de la Salud, 1997; Organización Mundial de Sanidad Animal, 2001.INFOSAN: Resistencia Antimicrobiana a Salmonella. Nota de Información INFOSAN 3/2005. [ Links ]
8 World Organisation for Animal Health (OIE). Terrestrial Animal Health Code. Harmonisation of national antimicrobial resistance surveillance and monitoring programmes. 2009. Chapter 6.8. [ Links ]
9 Rajic’A, McFall ME, Deckert AE, Reid-Smith R, Manninen K, Poppe C, et al. Antimicrobial resistance of Salmonella isolated from finishing swine and the environment of 60 Alberta swine farms. Vet Microbiol. 2004; 104: 189–196. [ Links ]
10 Hendriksen RS, Seyfarth AM, Jensen AB, Whichard J, Karlsmose S, Joyce K, et al. Results of Use of WHO Global Salm-Surv External Quality Assurance System for Antimicrobial Susceptibility Testing of SalmonellaIsolates from 2000 to 2007. J ClinMicrobiol. 2009; 47(1): 79–85. [ Links ]
11 Bahnson, PB, Fedorka-Cray PJ, Ladely SR, Mateus-Pinilla NE. Herd-level risk factors for Salmonellaenterica subsp. enterica in U.S. market pigs. Prev. Vet. Med. 2006; 76: 249–262. [ Links ]
12 Pasterán F, Galas M. Manual de Procedimientos Sensibilidad a los antimicrobianos en Salmonella, Shigella y E. coli . Departamento de Bacteriología Instituto Nacional de Enfermedades Infecciosas A.N.L.I.S. ''Dr. Carlos G. Malbrán''. Centro Regional de Referencia WHO-Global SalmSurv para América del Sur. 2008. [ Links ]
13 Clinical Laboratory and Standards Institute.Performance Standards for Antimicrobial Disk and Dilution Susceptibility Tests for Bacteria Isolated From Animals.Third Edition. 2008; M31-A3. [ Links ]
14 World Organisation for Animal Healt (OIE). Manual of Diagnostic Tests and Vaccines for Terrestrial AnimalsResolution No. XXVIII, 2007. [ Links ]
15 Hendriksen R, Karlsmose S, Jensen AB, Aarestrup F. The External Quality Assurance System of the WHO Global Salm-Surv, 2008. National Food Institute. Technical University of Denmark. [Documento en Internet]. 2009. [Acceso 22 de Febrero de 2012]. Disponible en: http://www.food.dtu.dk/Publikationer.aspx [ Links ]
16 Karczmarczyk M, Martins M, McCusker M, Mattar S, Amaral L, Leonard N, et al. Characterization of antimicrobial resistance in Salmonellaenterica food and animal isolates from Colombia: Identification of a qnrB19-mediated quinolone resistance marker in two novel serovars. FEMS MicrobiolLett. 2010; 313, 10–19. [ Links ]
17 Hur J. Antimicrobial resistance of Salmonella isolated from food animals: A review.Food ResearchInternational. 2011;[In Press, Corrected Proof] doi:10.1016/j.foodres.2011.05.014. [ Links ]
18 Zhao S, White DG, Friedman SL, Glenn A, Blickenstaff K, Ayers SL, et al. Antimicrobial Resistance in Salmonella entericaSerovar HeidelbergIsolates from Retail Meats, Including Poultry, from 2002 to 2006.Applied and Environmental Microbiology. (2008) 74(21): 6656–6662. [ Links ]
19 Foley SL, Lynne AM.Food animals-associated Salmonella challenges: Pathogenicity and antimicrobial resistance. J Anim Sci. 2008; 86(E. Suppl.), E173–E187. [ Links ]
20 Quinn PJ,Markey BK,Leonard FC,Carter MC, Donnelly WJ.Microbiología y Enfermedades Infecciosas Veterinar [ Links ]
21 Reunión conjunta FAO/OMS/OIE de expertos sobre los antimicrobianos de importancia crítica.Informe de la reunión de expertos.Sede de la FAO, Roma (Italia)del 26 al 30 de noviembre de 2007. [ Links ]
22 Molbak K, Baggesen DL, Aarestrup FM, Ebbesen JM, Engberg J, Frydendahl K, et al. An outbreak of multidrug-resistant, quinolone- resistant Salmonellaenterica serotype Typhimurium DT104. N. Engl. J. Med. 1999; 341, 1420–1425. [ Links ]
23 Berends BR, Van Knapen F, Snijders JMA, MosselDA. Identification and quantification of risk factors regarding Salmonella spp. on pork carcasses.Int J Food Microbiol. 1997;36 (2-3,20):199-206. [ Links ]
24 Parra J, Polanco N, Rangel E, Arguello O, Flórez H, Rojas A. Caracterización nutricional, perfil lipídico y buenas prácticas ganaderas para mejorar la calidad de la leche cruda del Piedemonte Llanero para la Industria. Informe Final. 2010 [ Links ]
25 Phillips I, Casewell M, Cox T, De Groot B, Friis C, Jones R. Does the use of antibiotics in food animals pose a risk to human health? A critical review of published data.J AntimicrobChemother. 2004; 53: 28–52. [ Links ]
26 World Health Organization (WHO). Global principles for the containment of antimicrobialresistance in animals intended for food.[Documento en Internet] 2000. [Acceso 22 de Febrero de 2012]. Disponible en: http://www.who.int/emc/diseases/zoo/who_global_principles.html. [ Links ]
27 World Organisation for Animal Health (OIE). International Committee of the OIE during its 77th General Session 24 – 29 May 2009. Resolution N° 24. Animal Production Food Safety. [ Links ]













