Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Salud Pública
Print version ISSN 0120-386X
Rev. Fac. Nac. Salud Pública vol.34 no.2 Medellín Aug. 2016
https://doi.org/10.17533/udea.rfnsp.v34n2a12
REVISIÓN
DOI:10.17533/udea.rfnsp.v34n2a12
Bacillus cereus un patógeno importante en el control microbiológico de los alimentos
Bacillus cereus an important pathogen the microbiological control of food
Bacillus cereus: um patógeno importante no controle microbiológico dos alimentos
Jennifer Sánchez1; Margarita Correa2; Laura Castañeda3
1 Magíster en Biología. Universidad de Antioquia, Medellín, Colombia. Correo electrónico: jennifer.sanchez@udea.edu.co
2 PhD. en Microbiología, Magíster en Microbiología. Universidad de Antioquia, Medellín, Colombia. Correo electrónico: margaritcorrea@gmail.com
3 PhD. Ciencias - Biología Molecular, Magíster en Biotecnología, Universidad de Antioquia, Medellín, Colombia Correo electrónico: laura.castaneda@udea.edu.co
Recibido: 27 de octubre de 2014. Aprobado: 09 de marzo de 2016. Publicado: 20 de mayo de 2016.
Citación sugerida: Sánchez J, Correa M, Castañeda L. Bacillus cereus un patógeno importante en el control microbiológico de los alimentos. Rev. Fac. Nac. Salud Pública 2016; 34(2): 230-242. DOI: 10.17533/udea.rfnsp.v34n2a12
RESUMEN
Bacillus cereus es una bacteria genéticamente diversa que se encuentra comúnmente en el ambiente. Contamina los alimentos afectando la salud humana, al ingerir el microorganismo y/o sus toxinas, la emética o las enterotoxinas. En Colombia son escasos los reportes de intoxicación por B. cereus y se estima que hay un gran subregistro. Por lo anterior, se recomienda aumentar la vigilancia de este patógeno y realizar estudios sobre aspectos relevantes que permitan aplicar medidas de control para disminuir las intoxicaciones por B. cereus. El objetivo de esta revisión bibliográfica es presentar información actualizada sobre B. cereus, que incluye aspectos de su biología, taxonomía, toxinas, alimentos que contamina y metodologías para detectar, prevenir y controlar este microorganismo. La información presentada es de utilidad para el público en general, especialmente personas vinculadas al sector de alimentos, inocuidad alimentaria y control de procesos.
Palabras claves: Bacillus cereus, enterotoxinas, toxina emética, patógeno de alimentos.
ABSTRACT
Bacillus cereus is a genetically diverse bacterium commonly found in the environment. It contaminates food, thus affecting human health upon ingestion of the microorganism and/or its toxins, the emetic or enterotoxins. In Colombia, reports of intoxication by B. cereus are scarce and under-registration is presumed. Because of this, it is recommended to increase surveillance of this pathogen and to develop studies on relevant aspects that allow the application of control measures to reduce intoxications by B. cereus. The aim of this review is to present current information on B. cereus, including aspects of its biology, taxonomy, toxins, food that it contaminates and methodologies for the detection, prevention and control of this microorganism. This information is useful for the general public, especially people involved with the food sector, food safety and process control.
Key words: Bacillus cereus, enterotoxins, emetic toxin, foodborne pathogen.
RESUMO
Bacillus cereus é uma bactéria geneticamente diversa normalmente encontrada no ambiente. Contamina os alimentos dos humanos e estes acabam prejudicados quando ingerem o microorganismo e/ou suas toxinas, a emética ou as enterotoxinas. Na Colômbia existem poucos relatórios de intoxicação por B. cereus, mas se estima um grande sub-registro. Essa estimação faz com que seja recomendável aumentar a vigilância deste patógeno e estudar aspetos relevantes que permitam aplicar medidas de controle, para diminuir as intoxicações por B. cereus. O objetivo desta revisão bibliográfica é apresentar informação atualizada sobre a B. cereus, incluindo aspectos da sua biologia, taxonomia, toxinas, alimentos que pode contaminar e metodologias para detectar, prevenir e controlar este microorganismo. Esta informação é útil para o público geral, especialmente para pessoas ligadas ao setor dos alimentos, à segurança alimentar e ao controle de processos.
Palavras–chave: Bacillus cereus, enterotoxinas, toxina emética, patógeno de alimentos.
Introducción
Bacillus cereus es un microorganismo resistente a los procesos cocción o pasteurización de los alimentos [1]. Se encuentra en el ambiente de forma habitual y tiene el potencial de contaminar fácilmente los alimentos por prácticas de manufactura deficientes, lo cual puede propiciar condiciones adecuadas para su proliferación y desencadenar la presentación de enfermedades transmitidas por alimentos (ETA) al hombre [2]. La ETA se adquiere por el consumo de alimentos contaminados con agentes químicos o microbiológicos y/o sus toxinas en cantidades determinadas que afectan la salud humana [3]. Entre los agentes microbiológicos causantes de ETA se encuentran bacterias, virus, hongos y parásitos; estos pueden multiplicarse en el tracto gastrointestinal, lisarse, producir toxinas o invadir la pared intestinal para alcanzar otros órganos o sistemas [2]. Además de B. cereus, otras bacterias se han relacionado comúnmente a las ETA, por ejemplo, Clostridium spp., Shigella spp., Salmonella spp., Listeria monocytogenes, Staphylococcus aureus y algunas especies de enterobacterias [4]. Comparado con estos patógenos, para B. cereus existe un subregistro de casos, lo que se debe probablemente a que su cuadro clínico es muy corto y por lo general, las personas no acuden a los servicios de salud, ya que los síntomas pueden confundirse con intoxicaciones ocasionadas por otras bacterias como Clostridium perfringes o Staphylococcus aureus [5].
Bacillus cereus tiene una amplia distribución geográfica y se ha reportado causando intoxicaciones en diferentes países como Estados Unidos [6], Finlandia, Bulgaria, Noruega, Reino Unido y Japón [7]. En Colombia, a pesar del escaso registro, se han reportado casos en Antioquia [8–10] y Amazonas [11]. Dada la alta distribución que presenta B. cereus, su potencial patógeno y lo poco que se conoce en nuestro país, el objetivo de esta revisión bibliográfica es presentar información actualizada sobre este microorganismo, se incluyen aspectos relevantes sobre su biología, genética, toxinas y sus efectos en el humano, y los alimentos susceptibles de contaminación por B. cereus. Asimismo, se discutirán las metodologías empleadas para detectar, prevenir y controlar este microorganismo y sus toxinas en los alimentos. Para la elaboración de esta revisión se recopiló literatura científica y reportes de casos publicados en el ambito nacional e internacional; de igual modo, fueron consultadas bases de datos especializados, boletines epidemiológicos locales y nacionales donde se publicara información indizada durante los últimos 10 años. Dicha información es de importancia para académicos que desarrollan trabajos sobre B. cereus, asimismo, para personas relacionadas con los sectores de la industria alimenticia, la salud y los organismos de salud pública, que pueden implementar acciones de mejora en el control microbiológico de los alimentos y generar campañas de prevención de la intoxicación generada por las toxinas de B. cereus.
Biología
Bacillus cereus es un bacilo Gram positivo, anaerobio facultativo y móvil debido a la presencia de flagelos perítricos [12–14]; forma esporas resistentes a condiciones adversas del medio, como altas temperaturas, deshidratación y radiación, y produce diversas toxinas que contaminan gran variedad de alimentos [15]. Es capaz decrecer en un amplio rango de temperaturas, desde los 4 °C a 48 °C, a pHs de 4,9 a 9,3 y soporta concentraciones de NaCl en el medio hasta del 7 % [12]. Las esporas son resistentes a bajas condiciones de humedad y a tratamientos térmicos como la pasteurización o procesos de cocción de los alimentos [16] y al ácido clorhídrico presente en el estómago, lo que constituye un peligro potencial para la salud humana [17].
Características del grupo Bacillus cereus
Bacillus cereus sensu estricto (s.s.) pertenece al grupo 1A del género Bacillus o grupo Bacillus cereus. Este grupo incluye además a Bacillus anthracis, Bacillus thuringiensis, Bacillus mycoides, Bacillus pseudomycoides y Bacillus weihenstephanensis. Cuando alguno de los miembros del grupo es aislado pero no es plenamente identificado, se le denomina B. cereus sensu lato (s.l.). Sin embargo, ellos pueden diferenciarse por pruebas fenotípicas como la actividad hemolítica, movilidad, formación de cápsula y reducción de nitratos [18] (Tabla 1).
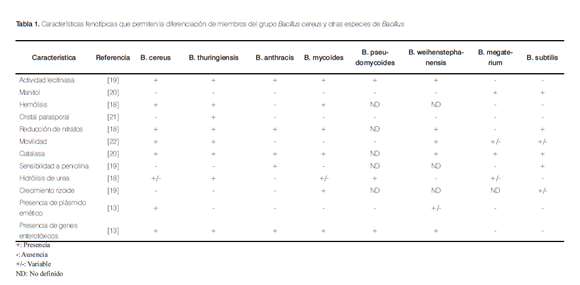
En este grupo se describió una cepa termotolerante y de citotoxicidad elevada, diferenciada genéticamente de B. cereus s.s., que se denominó Bacillus cytotoxicus, pero aún no ha sido incluida oficialmente dentro del grupo [23].
Adicionalmente, para la diferenciación de los miembros del grupo Bacillus cereus se ha utilizado la detección de genes específicos de cada especie [5]; pero dada su estrecha relación filogenética, su ADN genómico es altamente similar y la mayoría de genes codificantes para factores de virulencia son comunes [19]. Sin embargo, se han reportado diferencias en los plásmidos de B. cereus, B. thuringiensis y B. anthracis. En B. thuringiensis, plásmidos con tamaños variables albergan los genes cry que codifican para las δ endotoxinas que son activas contra larvas de insectos [23]. Bacillus anthracis porta dos megaplásmidos que codifican las unidades proteicas que conforman la toxina del anthrax y la cápsula poli—?—D—glutámica, respectivamente [24]. Además, B. anthracis se diferencia por presentar una mutación en el gen del regulador pleiotrópico transcripcional (PlcR), el cual regula la expresión de los genes para las enterotoxinas en B. cereus y B. thuringiensis [23]. El plásmido presente en algunas cepas de B. cereus s.s. contiene los genes para sintetizar la toxina emética; mientras que otros factores de virulencia importantes son producidos cromosomalmente, como son, las enterotoxinas hemolítica (HBL), no hemolítica (NHE), citotoxina K (CytK), la enterotoxinaFM (EntFM) y la enterotoxinaT (BceT), las cuales también están presentes en el cromosoma de B. thuringiensis [5].
Principales factores de virulencia
Bacillus cereus tiene la capacidad de producir diferentes toxinas que afectan la salud humana cuando se consumen alimentos contaminados por el microorganismo en dosis de 105 a 108 UFC por gramo de alimento [15]. Las toxinas generadas dependen de las cepas de B. cereus, la toxina emética, se caracteriza por causar vómito, y las enterotoxinas como la hemolítica, la no hemolítica y la citotoxina K, inducen permeabilidad vascular por la formación de poros en el intestino delgado y por consiguiente, diarrea [18].
Toxina Emética
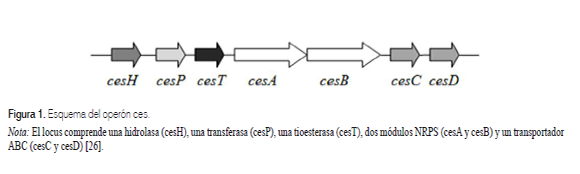
La toxina emética es producida bajo condiciones aeróbicas o microaerofílicas [25]. Es sintetizada por una enzima péptido sintetasa no ribosomal (non ribosomal peptidesynthetase, NRPS), codificada por un operón situado en un plásmido de 208Kb y conformado por siete genes, cesH, cesP, cesT, cesA, cesB, cesC y cesD (figura 1)[26].
La toxina emética se expresa al inicio de la fase estacionaria de B. cereus; consiste de un polipéptido cíclico y actúa como un ionóforo de potasio que afecta los gradientes de concentración de iones transmembrana necesarios para el buen funcionamiento celular [13]; se caracteriza por ser altamente hidrofóbica y termoestable, solo se inactiva a 121°C por 90 minutos y es activa en un rango de pH entre 2 y 11 [27]. La toxina emética es resistente a la digestión de las enzimas proteolíticas del tracto intestinal y a los ácidos presentes en el estómago humano [17]; tras ser ingerida en el alimento, se une al receptor 5—HT3 en el estómago provocando el vómito. Esta toxina puede causar insuficiencia hepática debido a que interfiere en la fosforilación oxidativa llevada a cabo por las mitocondrias de los hepatocitos [18]. Se ha sugerido que existe una baja probabilidad de que la toxina emética se produzca en alimentos refrigerados, debido a que las cepas productoras crecen a temperaturas superiores a 15 °C, por tanto, se asume que los alimentos refrigerados estarían libres de la toxina mientras se conserve la cadena de frío [28]. Sin embargo, se ha encontrado que algunas cepas de B. weihenstephanensis, microorganismo psicrófilo, pueden generar esta toxina a bajas temperaturas, debido posiblemente a la transferencia horizontal del plásmido entre las diferentes cepas [23].
Enterotoxinas
Las enterotoxinas son producidas después de la colonización del intestino delgado por B. cereus; allí forman poros en las membranas de las células epiteliales, generando un desbalance osmótico que induce la diarrea en el humano [18]. Los genes que codifican para las diferentes enterotoxinas se encuentran en el cromosoma bacteriano y su expresión es regulada por una proteína pleotrópica (PlcR) de 34 kDa, la cual está presente en los miembros del grupo Bacillus cereus [29]. Entre las enterotoxinas más relevantes producidas por B. cereus se encuentran la toxina hemolítica, la toxina no hemolítica y la citotoxina K; las cuales se describen a continuación.
Toxina hemolítica o hemolisina BL -HBL
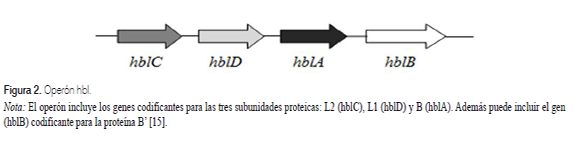
La hemolisina BL (HBL), es considerada el factor de virulencia más importante de B. cereus porque tiene efecto hemolítico, citotóxico, dermonecrótico y puede inducir permeabilidad vascular [27]. Está constituida por las subunidades proteicas L1 y L2 que son componentes citolíticos y la subunidad B, que favorece la unión a la célula huésped. Estas subunidades están codificadas por los genes hblD, hblC y hblA, respectivamente y juntos forman el operón hbl (figura 2); todos los genes deben estar presentes y expresarse para que esta enterotoxina tenga actividad biológica [30]. En algunas cepas se ha detectado un gen adicional en el operón hbl, el gen hblB, que sintetiza la proteína B’, la cual no tiene una función conocida, pero debido a la alta homología con la proteína B, se cree puede ser un sustituto de esta [17]; sin embargo, trabajos más recientes indican que el gen hblB no ha sido transcrito a un nivel detectable, dato que sugiere, que podría ser un pseudogen [23].
Toxina no hemolítica -NHE
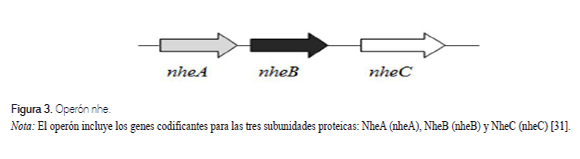
La enterotoxina no hemolítica (NHE), al igual que la enterotoxina HBL, está formada por tres subunidades; la subunidad NheA actúa como componente citolítico y las subunidades NheB y NheC favorecen la unión a las células epiteliales del intestino delgado [13]. La enterotoxina NHE es codificada por los genes nheA, nheB y nheC, los cuales conforman el operón nhe (figura 3), ubicado en el cromosoma de B. cereus [30]. Recientemente se encontró que la cepa B. weihenstephanensis KBAB4, además de portar el operón nhe en el cromosoma, contenía una segunda copia del locus nhe en un plásmido de 400 Kb [23].
Citotoxina K - CytK
La citotoxina K (CytK) forma poros en la membrana de las células epiteliales y tiene actividad necrotizante y citotóxica [32]. CytK es resistente al dodecilsulfato sódico (SDS), pero sensible a las temperaturas de ebullición; se estima que alrededor del 30 al 40% de las cepas de B. cereus contienen los genes para sintetizarla [17]. Se han encontrado dos variantes de esta enterotoxina en diferentes cepas bacterianas, la CytK—1 codificada por el gen cytK—1 y la CytK—2, codificada por el gen cytK—2, ambos genotipos presentes en el cromosoma bacteriano. Estas variantes se diferencian por su efecto biológico en cultivos celulares, la variante CytK—1 presenta un efecto más tóxico que la variante CytK—2, por lo que la primera constituiría un mayor riesgo para la salud humana [33].
Enterotoxina FM- EntFM
La enterotoxina FM (EntFM), es un polipéptido de 45 kDa codificado por el gen entFM [19], localizado en el cromosoma bacteriano. Aunque la EntFM no ha sido implicada directamente en intoxicaciones alimentarias, el gen entFM ha estado presente en la mayoría de cepas que ocasionan los brotes diarreicos; se ha reportado que en experimentos con ratones y conejos, esta enterotoxina genera permeabilidad vascular [18], hecho que sugiere un riesgo potencial de desencadenar diarrea en personas cuyo intestino delgado sea colonizado por una cepa de B. cereus enterotóxica.
Diversidad genética de las cepas toxigénicas
La diversidad genética se refiere a la variedad de alelos y genotipos presentes en un grupo bajo estudio, sea población, especie o grupo de especies [34]. Actualmente, existe gran interés por evaluar la diversidad genética y perfiles toxigénicos en B. cereus, especialmente en aislamientos de alimentos, sobre todo porque la definición de dichos perfiles dan cuenta de la importancia clínica de la cepa y el riesgo de intoxicación con un alimento contaminado con B. cereus [35]. Varios estudios realizados en diferentes países tanto del hemisferio oriental como occidental dan cuenta de la alta diversidad genética presente en B. cereus. En Corea, la diversidad genética de 39 cepas eméticas de B. cereus provenientes de muestras clínicas y alimentos, fue evaluada encontrando que los grupos conformados se relacionaron con la muestra de origen de las cepas y se diferenciaron de las cepas de referencia productoras de enterotoxinas o de toxina emética; asimismo, la diferenciación de las cepas en grupos contrastó con estudios anteriores que evidenciaron un linaje evolutivo único para las cepas eméticas de B. cereus [36].
En un trabajo realizado en Bélgica se evaluó la presencia y diversidad genética de B. cereus s.l. en productos como arroz, pastas, salsas y vegetales, encontrándose que estaba presente en más del 50% de las muestras analizadas y que su diversidad fue alta, puesto que 61 de 80 aislamientos conformaron 15 grupos diferentes. Adicionalmente, se evaluó la presencia de los genes que componen las enterotoxinas y la toxina emética, identificándose 16 perfiles de enterotoxinas, pero ninguno que presentara los genes que codifican para la toxina emética [37]. En Bélgica, se evaluaron los rangos de temperatura de crecimiento y psicrotolerancia y estructura genotípica de 425 cepas de B. cereus s.l. De acuerdo con las características térmicas y genéticas, se establecieron siete grupos filogenéticos. Los grupos I, III y IV reunieron las cepas mesofílicas, el II y el VI las psicrófilas y el VII las termófilas, mientras que el grupo V fue un intermedio entre las cepas psicrófilas y termófilas [35]. En un trabajo posterior, se relacionaron los niveles de actividad citotóxica y distribución de toxinas en estos grupos filogenéticos. Los genes del operón hbl se encontraron en los grupos I, II, IV, V y VI, mientras que los genes del operón ces se encontraron en el grupo III y el gen cytK, en el grupo VII. Un importante hallazgo fue que los genes del operón nhe no se presentaban en un grupo en particular, sino que se encontraban distribuidos en los siete grupos filogenéticos. Al evaluar la actividad de toxicidad celular, las cepas de los grupos III y IV presentaron una mayor toxicidad, dato que sugirió diferencias clínicas entre estos grupos, por lo que su distinción permite determinar el riesgo de intoxicaciones alimentarias por B. cereus [38].
Igualmente, un estudio realizado en el suroeste de Brasil, evidencia la alta diversidad de cepas de B. cereus. Se evaluaron 97 aislamientos relacionados con intoxicaciones alimentarias durante las décadas de los años 80, 90 y 2000. Se detectaron siete grupos y el perfil toxigénico predominante estuvo constituido por las enterotoxinas hemolítica y no hemolítica, la citotoxina K y la enterotoxina FM; notoriamente, los genes que codifican para la toxina emética no fueron detectados [39].
Alimentos susceptibles de contaminación
Bacillus cereus puede presentar diferentes grados de toxicidad de acuerdo a la cepa [23]. Los alimentos más susceptibles de ser contaminados por cepas de B. cereus incluyen, harinas, carnes, leches, quesos, verduras, pescados, arroz y sus derivados [14]. En general, se ha evidenciado que B. cereus se encuentra frecuentemente contaminando alimentos con alto contenido de almidón, debido a que B. cereus produce enzimas del tipo amilasas que le permiten hidrolizar dicho carbohidrato y utilizarlo como fuente de carbono para su crecimiento [16]. Se ha reportado la relación de algunos alimentos con determinados tipos de toxinas; por ejemplo, el síndrome emético causado por la toxina emética se ha asociado principalmente con el arroz frito y cocido [40], mientras que el síndrome diarreico causado por las diferentes enterotoxinas se ha relacionado con carnes, vegetales y leche [7]. El motivo de esta asociación parece ser el tipo de dieta que se acostumbra en los diferentes países, dado que en el hemisferio oriental, donde se presenta un consumo masivo de arroz y sus derivados, se desarrolla con mayor frecuencia el síndrome emético; no obstante se ha evidenciado que las cepas de B. cereus aisladas de arroz producido en Corea son de tipo diarreico [41]; por lo que sería importante realizar más estudios que evalúen la relación entre los tipos de alimentos y las cepas toxigénicas de B. cereus en diferentes regiones.
En la industria de alimentos es de suma importancia mantener la inocuidad de los alimentos, de tal forma que no se excedan los niveles establecidos de microorganismos patógenos, con el fin de no afectar la salud de los consumidores; sin embargo, el control de B. cereus se dificulta por el hecho de ser un microorganismo esporulado con una gran capacidad para sobrevivir en diferentes ambientes y en condiciones de estrés [13]. En la industria lechera, B.cereus puede constituir un serio problema debido a que tanto la leche líquida como en polvo tienen un alto contenido de grasa, condición que favorece la adhesión de las esporas, dificultando su eliminación [16], además puede formar biopelículas en las tuberías de ordeño y equipamiento debido a los ácidos grasos que se presentan durante la lipólisis grasa de la leche [42]. Adicionalmente, de acuerdo al tipo de industria alimenticia se pueden establecer diferentes “nichos térmicos” para B. cereus, por lo cual en plantas donde se trabajan con procesos térmicos como la deshidratación y pasteurización se pueden encontrar cepas termoresistentes y en plantas donde emplean cadenas de frio, prevalecen las cepas psicrófilas, haciendo difícil su eliminación [35].
Intoxicaciones ocasionadas en el ámbito internacional y local
Bacillus cereus tiene una amplia distribución geográfica; se ha relacionado con casos de intoxicación alimentaria tanto en el hemisferio oriental como occidental, principalmente en los países industrializados, posiblemente porque en estos se realiza mayor seguimiento a este tipo de intoxicaciones [7]. Se estima que sólo en Estados Unidos, país que hace un mejor seguimiento, se presentan unos 27.000 casos de intoxicación alimentaria al año, originados principalmente por el consumo de arroz, alimentos con base de almidón, azúcar y lácteos contaminados por B. cereus [6]. En España, entre los años 1994 y 2003, se presentaron 56 casos de intoxicación por este microorganismo [43], en el periodo de 2003 a 2007 fue el agente responsable del 1 % de los casos de ETA [44]; sin embargo, al cerrar el año 2013 no se notificaron casos de ETA por B. cereus [45]. En Latinoamérica, Cuba reportó 13.343 casos de intoxicación alimentaria en el año 2003, de los cuales 400 (3 %) fueron ocasionados por B. cereus [9]. En Uruguay, entre los años 1996 y 2000, fue el agente causal del 3,5 % de las ETA [46]. En San José de Costa Rica en el año 2009, B. cereus se detectó contaminando productos lácteos de consumo masivo, como leche en polvo y queso crema [47], hecho que implica un riesgo para la salud humana. En Argentina fue reportado recientemente el caso de una mujer cuya salud fue gravemente afectada por una cepa altamente citotóxica, la cual fue aislada de pollo cocido [48]. En Guatemala, de los casos de intoxicación alimentaria reportados entre los años 2004 y 2007, solo se confirmaron 16 por B. cereus, mientras 2.233 casos sólo se diagnosticaron por el cuadro clínico, sin identificar el agente causal [49], hecho que puede causar un gran subregistro en el número real de intoxicaciones por B. cereus u otros agentes.
En Colombia, los reportes de casos de intoxicaciones alimentarias producidas por B. cereus son escasos, sin embargo este patógeno es la tercera causa de brotes alimentarios, siendo los alimentos listos para consumo, no industriales, como la arepa y el arroz con pollo, los alimentos frecuentemente involucrados [28]. Adicionalmente, B. cereus se ha detectado en productos como el arroz cocido, natilla, salsas, albóndigas, carnes frías y productos lácteos líquidos y en polvo [50]. Existen algunos reportes aislados de brotes, como el de una intoxicación en un internado indígena del Amazonas en el año 1997, debido al consumo de carne de caimán negro contaminado con B. cereus, hecho que evidencia que otros productos de consumo más restringido a áreas particulares son también susceptibles a la contaminación por este patógeno [11]. Entre los pocos reportes conocidos para Medellín, departamento de Antioquia, se encuentra el de un brote de enfermedad entérica letal en una sala de neonatos en 1977, causado por el consumo de leche en polvo contaminada con B. cereus [8]. Este brote fue bien documentado y el patógeno fue incriminado como un grave riesgo para salud pública en Medellín y particularmente para los neonatos, que son alimentados con leche en polvo, en lugar de leche materna [10]. Adicionalmente, en un restaurante escolar del municipio de Jericó, Antioquia, en el año 2007 se reportó un brote causado por ingerir alimentos contaminados con B. cereus [9]. Entre los años 2007 y 2010 se han presentado 29 casos confirmados con B. cereus, pero se estima que hay gran subregistro, debido a la breve duración del cuadro clínico, a la falta de vigilancia de los alimentos y poco seguimiento° de los casos, además de la confusión en su diagnóstico con Staphylococcus aureus causante del síndrome emético o Clostridium perfringens del síndrome diarreico [16].
Detección del patógeno y sus toxinas
En general, en el ambito mundial, la detección y cuantificación de B. cereus en alimentos por los laboratorios de control de calidad se realiza empleando pruebas de tipo fenotípico y se llevan a cabo de acuerdo a las Normas Internacionales ISO 7932:2004 e ISO 21871:2006 [19]. Estas normas establecen realizar el recuento en placa utilizando agares diferenciales para B. cereus como el agar Polimixina—Yema de huevo—Manitol (MYP) y el agar Polimixina—Yema de huevo—Manitol—Azul de bromotimol (PEMBA), además de la valoración de la producción de β—hemólisis en agar sangre de carnero [51]. En Colombia el Instituto Nacional para la Vigilancia de Medicamentos y Alimentos (INVIMA), implementó la Norma Técnica Colombiana NTC: 4679 versión 1 de 2006, que es una adopción modificada de la norma ISO 7932:2004, por la cual se determina el procedimiento para el análisis y la cuantificación de colonias de B. cereus en alimentos para humanos y animales [52]. A continuación se describen las pruebas fenotípicas y moleculares más utilizadas en la detección de B. cereus; además, se discuten otros ensayos para la detección de sus toxinas, como las herramientas inmunoenzimáticas, la utilización de líneas celulares y métodos de análisis instrumental.
Pruebas fenotípicas
Bacillus cereus puede ser aislado e identificado en muestras alimenticias en el medio de cultivo MYP. La característica principal para la identificación de B. cereus en este medio es la formación de un precipitado blanco, alrededor de las colonias que crecen de color rosa, el cual corresponde a la hidrólisis de lecitina en el medio por B. cereus. El rojo de fenol se utiliza para detectar cambios de pH en el medio producto de la fermentación del manitol; las colonias que crecen de coloración amarilla, resultado del descenso de pH del medio por la fermentación del manitol, no corresponden a colonias de B. cereus, y la polimixina determina la selectividad del medio puesto que inhibe a las bacterias Gram negativas [18]. Este medio ha sido utilizado en diversos estudios para el aislamiento, enumeración y caracterización de B. cereus en diferentes matrices como arroz [53], alimentos refrigerados que contienen vegetales [54], entre otros. El inconveniente de utilizar este medio es que no diferencia a B. cereus de otros miembros del grupo 1A de Bacillus como B. thuringiensis, B. anthracis y B. mycoides, hecho que puede generar una identificación errónea de la cepa de B. cereus [55]; por esta razón, que se requiere utilizar otras pruebas fenotípicas (Tabla 1) para corroborar que se trata de una cepa B. cereus [56]. Además de estas pruebas de diferenciación, también se han utilizado medios cromogénicos como los agares CBC (por sus siglas en inglés Chromogenic Bacillus Cereus agar) y BCM (B. cereus group plating medium); estos son útiles para identificar cepas de B. cereus que no se pueden diferenciar en agar MYP o PEMBA por no tener actividad lecitinasa [57].
Pruebas moleculares
Actualmente las pruebas moleculares, como la Reacción en Cadena de la Polimerasa (PCR), constituyen una gran alternativa a los métodos tradicionales por su utilidad para la detección e identificación de microorganismos contaminantes de alimentos. Estas metodologías tienen como ventajas su alta sensibilidad, especificidad, precisión, reproducibilidad, rapidez y sencillez en su ejecución [58]. En la actualidad se encuentran ensayos basados en la PCR convencional o variaciones de esta, como la PCR múltiple y la PCR en Tiempo Real para detectar cepas de B. cereus por la presencia de genes específicos o aquellos que codifican para sus toxinas.
La PCR convencional: se ha estandarizado y utilizado para amplificar o detectar el complejo de genes que codifican para la toxina NHE en las cepas de referencia NVH 1230/88 y NVH 0075/95; con esta prueba se pudo comprobar que sus tres componentes, NheA, NheB y NheC, son necesarios para su actividad citotóxica [31]. Se han detectado los genes que codifican para la toxina emética, las enterotoxinas hemolítica y la no hemolítica en cepas de B. cereus y B. thuringiensis aisladas de arroz en Estados Unidos [59]. Varios ensayos de PCR convencional, que utilizan diferentes juegos de primers dirigidos a los genes que codifican para la toxina emética fueron evaluados en cepas de B. cereus aisladas de alimentos procesados, granos y muestras clínicas. Los resultados, comparados con la detección de la toxina por medio de cromatografía líquida de alta eficiencia—espectroscopia de masas (High Performance Liquid Chromatography Mass Spectrometry HPLC/MS), encontraron que la PCR estandarizada con uno de los juegos de primers genera resultados confiables y similares a los obtenidos en el HPLC/MS [60]. La PCR ha sido también utilizada para detectar los genes de la enterotoxina FM en muestras de arroz cocido, vegetales y cereales; en este trabajo, también se desarrolló una prueba de hibridización de ADN para la identificación de cepas enterotoxigénicas del grupo Bacillus cereus; ambas pruebas fueron de utilidad para la detección de dichas cepas [61].
La PCR múltiple: es un tipo de PCR con el potencial de amplificar varias secuencias blanco en una misma reacción, tiene la ventaja de requerir menor cantidad de ADN molde y reactivos para una rápida obtención de varios amplicones al mismo tiempo, por lo que también se ha utilizado para la detección simultánea de los genes que codifican para las diferentes toxinas de B. cereus [62]. Una PCR dúplex fue utilizada para lograr la rápida discriminación de los genes cytK—1 y cytK—2 en cepas y diferenciar su potencial enterotóxico; esta diferenciación es importante dado que las cepas que portan estos genes que codifican para la toxina CytK—1 pueden generar una toxina que tiene mayores efectos en la salud [33].
Por PCR múltiple se caracterizaron y tipificaron los genes hblC y cytK de las enterotoxinas HBL y CytK respectivamente, en cepas aisladas de productos de maíz empacado; estas enterotoxinas son las más frecuentemente implicadas en brotes alimentarios en Egipto [63]. Un logro importante para la caracterización y tipificación de las cepas fue la detección de los genes hbl, nhe, cytK—1 de las enterotoxinas y los genes ces de la toxina emética en cepas del grupo Bacillus cereus; los resultados arrojados por la PCR múltiple fueron similares a los obtenidos con un inmunoensayo comercial basado en anticuerpos monoclonales para la detección de las enterotoxinas NHE y HBL [62]. Adicionalmente, ensayos de PCR múltiple dirigida a los genes que codifican para las enterotoxinas NHE y HBL se han aplicado a matrices de alimentos como derivados lácteos y arroz cocido [47, 64, 65].
La PCR en tiempo real: ha sido utilizada para la detección y principalmente para la cuantificación de diversos genes de B. cereus. La subunidad 16S del RNA ribosomal, se utilizó para detectar y cuantificar esporas y células vegetativas de Bacillus cereus, Bacillus subtilis y Bacillus licheniformis en alimentos contaminados artificialmente así como en un tracto gastrointestinal artificial [66,67]; el gen de la fosfolipasa C presente en B. cereus fue cuantificado en alimentos contaminados naturalmente, sin la necesidad del paso de enriquecimiento de la muestra [68]; y los genes nheA, hblD y cytK—1 fueron cuantificados en alimentos para lactantes [58]. Adicional a lo anterior, se ha desarrollado un ensayo de PCR múltiple en tiempo real para la detección y la diferenciación de cepas eméticas y diarreicas de B. cereus en la leche, con el fin de mejorar el diagnóstico diferencial del grupo y minimizar el riesgo de las intoxicaciones relacionadas con el bacilo [69].
La PCR se ha combinado con enzimas de restricción (PCR-RE) para obtener una prueba más específica que logre diferenciar a B. cereus, B. mycoides y B. thuringiensis. Las enzimas utilizadas para la digestión del ADN amplificado del gen gyrB fueron RsaI, Sau3AI y EcoRI [70]. Adicionalmente, el método de ADN polimórfico amplificado aleatoriamente (Random Amplified Polymorphic DNA-RAPD), ha sido empleado con el fin de definir la diversidad genotípica de miembros del grupo Bacillus cereus obtenidos de muestras de arroz crudo y cocido en Australia [71].
Cultivos en líneas celulares
Las enterotoxinas de B. cereus tienen la característica de formar poros en la membrana de las células eucariotas, los cuales se detectan por microscopía electrónica de barrido. Esta particularidad se ha aprovechado para la detección de las toxinas en cultivos en líneas celulares animales como Vero y McCoy [30]. La toxina emética de B. cereus puede ser detectada en un bioensayo utilizando espermatozoides de cerdo, en los cuales la toxina afecta la función mitocondrial, inhibiendo su motilidad; así mismo, puede ser evaluada en el cultivo celular HEp—2; causando vacuolas a las células [5]. En general, estos ensayos basados en líneas celulares animales permiten detectar la actividad biológica de las enterotoxinas y la toxina emética; sin embargo, tienen desventajas como su alto costo y el requerir una compleja infraestructura con la que no cuentan muchos laboratorios de diagnóstico microbiológico de rutina [18].
Inmunoensayos
En la actualidad se encuentran disponibles en el mercado ensayos inmunoenzimáticos basados en anticuerpos, para la detección de las enterotoxinas de B. cereus. El inmunoensayo visual BDE-VIA de Tecra® detecta la subunidad A de la enterotoxina NHE [30]; el método de la aglutinación reversa pasiva (BCET-RPLA) de Oxoid®, detecta la subunidad L2 de la enterotoxina HBL [30], mientras que el test Duopath® Cereus Enterotoxins de Merck®, utiliza anticuerpos monoclonales dirigidos a las subunidades B y L2 de las enterotoxinas NHE y HBL, respectivamente [72]. Las principales desventajas de la mayoría de estas pruebas consiste en que al sólo detectar una toxina específica, pueden producir resultados falsos negativos en cepas de B. cereus que expresen más de una enterotoxina, además, no determinan si la toxina es biológicamente activa, ya que sólo detectan una subunidad de las tres presentes en cada una de las enterotoxinas HBL y NHE, y se conoce que son necesarias las tres subunidades para que la toxina presente actividad biológica [18].
Métodos de análisis instrumental
La detección y cuantificación de toxinas de B. cereus se ha realizado además por cromatografía líquida acoplada a espectroscopia de masas (LC/MS), para la evaluación de la toxina emética en arroz [73, 74]. Una variación de esta metodología es la cromatografía líquida de alta eficiencia acoplada a espectroscopia de masas (HPLC/MS), la cual se utilizó para determinar la concentración exacta a la cual la toxina emética causa inmovilidad en los espermatozoides de cerdo [75]. También se ha utilizado la inmunocromatografía para la detección de la toxina emética en diferentes matrices de alimentos como leche, carne y arroz [76]. En general, la desventaja de estas metodologías es su alto costo, hecho que hace que sean poco accesibles para los laboratorios de diagnóstico.
Prevención y control
Los principales factores que contribuyen a la contaminación de los alimentos por B. cereus y sus toxinas incluyen: una temperatura de cocción inadecuada, equipos contaminados y condiciones higiénicas deficientes en el lugar de procesamiento y preparación de los alimentos [18]. Es importante señalar que una alta temperatura de cocción de los alimentos no garantiza su inocuidad, debido a que las esporas resisten temperaturas altas y pueden germinar al descender la temperatura en el alimento. En general, se recomienda almacenar los alimentos a temperaturas de 4 °C o inferiores, someter a cocción a más de 100 °C y recalentarlos o enfriarlos de forma rápida, para evitar la exposición prolongada a temperaturas que permiten la germinación de las esporas; todo lo anterior disminuye los riesgos de una posible intoxicación [77].
Con el fin de evitar la proliferación de B. cereus en diferentes matrices de alimentos procesados industrialmente se han implementado tratamientos químicos, físicos y biológicos. Por ejemplo, la leche fermentada es acidificada con dióxido de carbono para inhibir el crecimiento de B. cereus sin afectar las propiedades sensoriales del alimento, ni las bacterias probióticas presentes en el mismo [78]. La producción de ácido láctico por parte de las Bacterias Acido Lácticas —BAL—, como Lactococcus y Lactobacillus tienen un efecto negativo en el crecimiento de B. cereus en leche [79]. En el cultivo de BAL en leche, las bacterias producen ácido láctico, acético y dióxido de carbono, que actúan como metabolitos antimicrobianos que inhiben el crecimiento de B. cereus [80]. Se ha reportado que los metabolitos producidos por las BAL inhiben el crecimiento de B. cereus en productos derivados de arroz fermentado, como los fideos; debido a la drástica disminución de pH en el medio [81].
El tratamiento de las esporas de B. cereus con presión moderada y calor, causa la inactivación y, por ende, una menor germinación de las esporas [82]. Asimismo, se ha probado que en condiciones anaeróbicas la producción de esporas es menor, pero las esporas producidas son más resistentes al calor y algunos agentes químicos [83]. Adicionalmente, se ha comprobado la eficacia del dióxido de cloro gaseoso para eliminar las esporas de B. cereus agregadas en biopelículas en superficies de acero inoxidable [84].
Se han evaluado métodos biológicos alternativos para evitar la contaminación de los alimentos con B. cereus o sus esporas, que incluyen metabolitos con actividad antibacterial como la enterocina AS—48; este es un péptido cíclico producido por Enterococcus faecalis que se aplica a los vegetales crudos, solo o en combinación con otros antimicrobianos, para inhibir el crecimiento de B. weihenstephanensis y B. cereus [85]. La enterocina AS—48 también se ha utilizado para inhibir la proliferación de B. cereus en productos a base de arroz [86].
Asimismo, se ha investigado los efectos del quitosano, un polisacárido derivado de la quitina presente en el citoesqueleto de insectos y crustáceos, el cual puede inhibir la germinación de B. cereus en medio de cultivo [87]. El quitosano de alto peso molecular forma una capa que impide que las células de B. cereus tomen nutrientes del medio, mientras que el de bajo peso molecular, penetra las células causando daños morfológicos [88]. Este compuesto ha sido utilizado como agente antimicrobiano en bolsas para alimentos e inhibe el crecimiento de otros microorganismos como Staphylococcus aureus, Escherichia coli y Bacillus subtilis [89].
Entre los métodos físicos utilizados para la inactivación de esporas de B. cereus, se ha reportado el tratamiento de leche de soya con radiación UV—C [90]. Además, se comparó el tratamiento térmico con la radiación con un haz de electrones, observándose que este último fue más efectivo para inactivar células vegetativas y esporas de B. cereus [91]. Adicionalmente, se ha comprobado que la combinación de los agentes antimicrobianos carvacrol y nisina contribuyen a la sensibilidad de la bacteria a la irradiación gamma [92].
Conclusiones
Es importante conocer la biología y establecer los perfiles toxigénicos que presentan las diferentes cepas de B. cereus, dado que esta información permite establecer la importancia clínica de las cepas y el riesgo de intoxicación de un alimento contaminado con el microorganismo. Además, las enfermedades gastrointestinales causadas por B. cereus, en muchas ocasiones no se reportan, por lo que su incidencia es probablemente mayor de lo registrado; hecho que sugiere la importancia de realizar un mejor seguimiento a los casos clínicos y reportar el agente causal de la enfermedad gastrointestinal siempre que sea posible
Es necesario implementar buenas prácticas en la preparación de los alimentos, como el mantenimiento de la cadena de frío, la higiene en las instalaciones y sus empleados, y la utilización de procesos físicos, químicos y biológicos para el control del microorganismo. Procedimientos que permitirán reducir el recuento del microorganismo en el alimento, asegurando su calidad y evitando la presentación de intoxicaciones alimentarias por B. cereus.
Dado que B. cereus causa intoxicaciones alimentarias y que la detección del microorganismo es de carácter obligatorio en alimentos pulverizados en Colombia, es necesario contar con herramientas adecuadas de detección y rápido diagnóstico de B. cereus en muestras clínicas y alimentos. Con los adelantos de los últimos años en materia de biología molecular, la PCR múltiple se presenta como una alternativa rápida, segura, sensible y específica para la detección de B. cereus tanto en alimentos como en muestras clínicas.
Agradecimientos
Este trabajo fue financiado por el Departamento Administrativo de Ciencia, Tecnología e Innovación (Colciencias) y el Comité para el Desarrollo de la Investigación (CODI) de la Universidad de Antioquia, a través de su programa Estrategia para la Sostenibilidad de los Grupos de investigación.
Referencias
1 Carlin F, Brillard J, Broussolle V, Clavel T, Duport C, Jobin M, et al. Adaptation of Bacillus cereus, an ubiquitous worldwide–distributed foodborne pathogen, to a changing environment. Food Res Int. 2010;43(7):1885–94. [ Links ]
2 INS. Boletín epidemiológico para protocolo de vigilancia y control de enfermedades transmitidas por alimentos. Grupo de vigilancia y control de factores de riesgo ambiental, editor. Colombia: Instituto Nacional de Salud; 2010. p. 10. [ Links ]
3 OMS–FAO. Garantía de la inocuidad y calidad de los alimentos: Directrices para el fortalecimiento de los sistemas nacionales de control de los alimentos. Depósito de documentos de la FAO, editor. Roma. 2003. p. 94. [ Links ]
4 Pascual M. Enfermedades de origen alimentario. Su prevención. 2005. [ Links ]
5 Stenfors Arnesen LP, Fagerlund A, Granum PE. From soil to gut: Bacillus cereus and its food poisoning toxins. FEMS Microbiol Rev. 2008;32(4):579–606. [ Links ] Epub 2008/04/22.
6 Madigan M, Martinko J, Parker J. Biología de los microorganismos. 10ª edición ed. Washington DC, Estados Unidos: Prentice Hall; 2003. [ Links ]
7 Kotiranta A, Lounatmaa K, Haapasalo M. Epidemiology and pathogenesis of Bacillus cereus infections. Microbes Infect. 2000;2(2):189–98. [ Links ] Epub 2000/04/01.
8 Torres M, González G, Giraldo M, Olivera M, Camacho A, Leyva C. Enterotoxipatogenicidad de las cepas de Bacillus cereus implicado en un brote de enfermedad entérica letal en neonatos. Medellin: Universidad de Antioquia. Facultad Nacional de Salud Pública; 1977. [ Links ]
9 INS. Informe de la vigilancia de las enfermedades transmitidas por alimentos. Grupo funcional ETA–SVCSP, editor. Colombia. 2007. p. 9. [ Links ]
10 González G, González G, Puerta H, Torres Y. Intoxicación alimentaria por Bacillus cereus en el Servicio de Neonatología del Hospital General de Medellín – Colombia, 1977. Revista Facultad Nacional de Salud Pública 1974–2014 Antología. 2014;32:24–37. [ Links ]
11 Suarez M, Pérez L, Murcia L, Sarmiento L, Casilimas S. Intoxicación alimentaria por consumo de carne de caimán negro (Melanosuchus niger) en el internado indígena de Nazareth, Amazonas, Abril de 1997. Biomédica. 2000;20(001):42–8. [ Links ]
12 De Vos PG, G.; Jones, D.; Krieg, N.; Ludwig, W.; Rainey, F.; Schleifer, K.; Whitman, W., editor. Bergey’s Manual of Systematic Bacteriology. Second ed. Athens, GA: Springer; 2009. [ Links ]
13 Logan NA. Bacillus and relatives in foodborne illness. J Appl Microbiol. 2012;112(3):417–29. [ Links ] Epub 2011/11/30.
14 Gibbs P. Characteristics of spore–forming bacteria. Clive de W. Blackburn and Peter J McClure, editor. Foodborne pathogens: Hazards, risk analysis and control. Boca Raton: CRC Press LLC and Woodhead Publishing Ltd; 2002. [ Links ]
15 Granum PE, Lund T. Bacillus cereus and its food poisoning toxins. FEMS Microbiol Lett. 1997;157(2):223–8. [ Links ] Epub 1998/01/22.
16 INS. Perfil de riesgo Bacillus cereus en alimentos listos para el consumo no industrializados. Unidad de evaluación de riesgos para la inocuidad de los alimentos, editor. Colombia: Ministerio de la Protección Social. Instituto Nacional de Salud; 2011. [ Links ]
17 Granum P. Bacillus cereus. Fratamico P, Bhunia A, Smith J., editor. Foodborne Pathogens: Microbiology and Molecular Biology. United King: Caister Academic Press; 2005. p. 409–19. [ Links ]
18 Bhunia A. Bacillus cereus and Bacillus anthracis. Foodborne Microbial Pathogens: Mechanisms and Pathogenesis. 2008. p. 135–48. [ Links ]
19 Martínez J. Desarrollo de métodos rápidos para el control del Bacillus cereus en alimentos. Tesis Doctoral. España. Universidad de Valencia; 2008 [ Links ]
20 MacFaddin J. Biochemical Tests for Identification of Medical Bacteria: Lippincott Williams & Wilkins; 2000. [ Links ]
21 Tajkarimi M. Bacillus cereus. Personal Health Record 250; 2007. [ Links ]
22 Lindbäck T, Granum P. E. Detection and purification of Bacillus cereus enterotoxins. Adley CC, editor. Food–borne pathogens: Methods and protocols. Totowa: Humana Press; 2006. [ Links ]
23 Økstad O, Kolstø A. Genomics of Bacillus Species. Springer, editor. Genomics of Foodborne Bacterial Pathogens New York 2011. p. 29–53. [ Links ]
24 Leppla S. Bacillus anthracis toxins. Joseph Alouf MP, editor. The Comprehensive Sourcebook of Bacterial Protein Toxins. 3 ed. Burlington, USA: Elsevier; 2006. p. 323–47. [ Links ]
25 J. Finlay WJ, Logan NA, Sutherland AD. Bacillus cereus emetic toxin production in relation to dissolved oxygen tension and sporulation. Food Microbiology. 2002;19(5):423–30. [ Links ]
26 Dommel MK, Lucking G, Scherer S, Ehling–Schulz M. Transcriptional kinetic analyses of cereulide synthetase genes with respect to growth, sporulation and emetic toxin production in Bacillus cereus. Food Microbiol. 2011;28(2):284–90. [ Links ] Epub 2011/02/15.
27 McKillip JL. Prevalence and expression of enterotoxins in Bacillus cereus and other Bacillus spp., a literature review. A Van Leeuw J Microb. 2000;77(4):393–9. [ Links ] Epub 2000/08/26.
28 INS. Perfil de riesgo Bacillus cereus en alimentos listos para consumo no industrializados. Unidad de evaluación de riesgos para la inocuidad de los alimentos, editor. Colombia: Ministerio de Protección Social. Instituto Nacional de Salud; 2011. [ Links ]
29 Agaisse H, Gominet M, Okstad OA, Kolsto AB, Lereclus D. PlcR is a pleiotropic regulator of extracellular virulence factor gene expression in Bacillus thuringiensis. Mol Microbiol. 1999;32(5):1043–53. [ Links ] Epub 1999/06/11.
30 Raddadi N, Rizzi A, Brusetti L, Borin S, Tamagnini I, Daffonchio D. Bacillus. Liu D, editor. Molecular Detection of Foodborne Pathogens. Boca Raton, FL: Taylor & Francis Group; 2010. p. 129–44. [ Links ]
31 Lindback T, Fagerlund A, Rodland MS, Granum PE. Characterization of the Bacillus cereus Nhe enterotoxin. Microbiology. 2004;150 (Pt 12):3959–67. [ Links ] Epub 2004/12/08.
32 Todar K. Bacillus cereus Food Poisoning. In: Todar K, editor. Todar's Online Textbook of Bacteriology. 2008. [ Links ]
33 Guinebretiere MH, Fagerlund A, Granum PE, Nguyen–The C. Rapid discrimination of cytK–1 and cytK–2 genes in Bacillus cereus strains by a novel duplex PCR system. FEMS Microbiol Lett. 2006;259(1):74–80. [ Links ] Epub 2006/05/11.
34 Frankham R, Ballou, J., Briscoe, D. Introduction to Conservation Genetics. United Kindom: Cambridge University Press; 2010. [ Links ]
35 Guinebretiere MH, Thompson FL, Sorokin A, Normand P, Dawyndt P, Ehling–Schulz M, et al. Ecological diversification in the Bacillus cereus Group. Environ Microbiol. 2008;10(4):851–65. [ Links ] Epub 2007/11/27.
36 Kim JB, Park JS, Kim MS, Hong SC, Park JH, Oh DH. Genetic diversity of emetic toxin producing Bacillus cereus Korean strains. Int J Food Microbiol. 2011;150(1):66–72. [ Links ] Epub 2011/08/09.
37 Samapundo S, Heyndrickx M, Xhaferi R, Devlieghere F. Incidence, diversity and toxin gene characteristics of Bacillus cereus group strains isolated from food products marketed in Belgium. Int J Food Microbiol. 2011;150(1):34–41. [ Links ] Epub 2011/08/16.
38 Guinebretiere M, Velge P, Couvert O, Carlin F, Debuyser M, C. N–T. Ability of Bacillus cereus Group Strains To Cause Food Poisoning Varies According to Phylogenetic Affiliation (Groups I to VII) Rather than Species Affiliation. J Clin Microbiol. 2010;48(9):3388—91. [ Links ]
39 Chaves JQ, Pires ES, Vivoni AM. Genetic diversity, antimicrobial resistance and toxigenic profiles of Bacillus cereus isolated from food in Brazil over three decades. Int J Food Microbiol. 2011;147(1):12–6. [ Links ] Epub 2011/03/29.
40 Kim JB, Kim JM, Kim CH, Seo KS, Park YB, Choi NJ, et al. Emetic toxin producing Bacillus cereus Korean isolates contain genes encoding diarrheal–related enterotoxins. Int J Food Microbiol. 2010;144(1):182–6. [ Links ] Epub 2010/09/28.
41 Kim B, Bang J, Kim H, Kim Y, Kim B–s, Beuchat LR, et al. Bacillus cereus and Bacillus thuringiensis spores in Korean rice: Prevalence and toxin production as affected by production area and degree of milling. Food Microbiol. 2014;42(0):89–94. [ Links ]
42 Pasvolsky R, Zakin V, Ostrova I, Shemesh M. Butyric acid released during milk lipolysis triggers biofilm formation of Bacillus species. Int J Food Microbiol. 2014;181:19–27. [ Links ] Epub 2014/05/08.
43 Red Nacional de Vigilancia epidemiológica. Brotes de enfermedades transmitidas por alimentos: Número de brotes notificados según agente causal y año España. 1994–2003. Centro Nacional de Epidemiología, editor. España 2005. [ Links ]
44 Agencia Catalana de Seguridad Alimentaria. Bacillus cereus. España: Departament de Salut; 2011. [ Links ]
45 Instituto de San Carlos III. Boletín epidemiológico semanal en red. Ministerio de Economía y Competitividad, editor. España. 2013. [ Links ]
46 Savio M. La Situación Epidemiológica de las Enfermedades Transmisibles en el Uruguay. Seminario “Las enfermedades Transmisibles en el Uruguay”. Uruguay: Instituto de Higiene; 2001. [ Links ]
47 Blanco W, Arias M, Pérez C, Rodríguez C, Chaves C. Detección de Bacillus cereus toxigénicos en productos lácteos con especias y leches deshidratadas colectadas en Costa Rica. Arch Latinoam Nutr. 2009;59(4):402–6. [ Links ]
48 López AC, Minnaard J, Pérez PF, Alippi AM. A case of intoxication due to a highly cytotoxic Bacillus cereus strain isolated from cooked chicken. Food Microbiol. 2015;46(0):195–9. [ Links ]
49 Kopper G, Calderón G, Schneider S, Domínguez W, Gutiérrez G. Enfermedades transmitidas por alimentos y su impacto socioeconómico: Estudios de caso en Costa Rica, El Salvador, Guatemala, Honduras y Nicaragua. Informe técnico sobre Ingeniería agrícola y alimentaria, FAO, editor. FAO; 2009. [ Links ]
50 Padilla J. Validación secundaria del método de recuento en placa en superficie de Bacillus cereus y Staphylococcus aureus en muestras de alimentos en un laboratorio de referencia. Bogotá D.C.: Universidad Javeriana; 2007. [ Links ]
51 ISO. ISO 7932:2004. Microbiology of food and animal feeding stuffs –– Horizontal method for the enumeration of presumptive Bacillus cereus –– Colony–count technique at 30 degrees C. International Organization for Standardization; 2012. p. 13. [ Links ]
52 ICONTEC. NTC:4679. Metodo horizontal para el recuento de Bacillus cereus Técnica de recuento de colonias. Colombia: ICONTEC. Instituto Colombiano de Normas Técnicas y Certificación. 2006. [ Links ]
53 Sarrías JA, Valero M, Salmerón MC. Enumeration, isolation and characterization of Bacillus cereus strains from Spanish raw rice. Food Microbiol. 2002;19(6):589–95. [ Links ]
54 Choma C, Guinebretiere MH, Carlin F, Schmitt P, Velge P, Granum PE, et al. Prevalence, characterization and growth of Bacillus cereus in commercial cooked chilled foods containing vegetables. J Appl Microbiol. 2000;88(4):617–25. [ Links ] Epub 2000/05/03.
55 Peng H, Ford V, Frampton EW, Restaino L, Shelef LA, Spitz H. Isolation and enumeration of Bacillus cereus from foods on a novel chromogenic plating medium. Food Microbiol. 2001;18(3):231–8. [ Links ]
56 FDA. Bad Bug Book: Foodborne Pathogenic Microorganisms and Natural Toxins Handbook Bacillus cereus and other Bacillus spp. Deparment of Health and Human Services, editor. U.S: FDA. Food and Drug Administration. 2009. [ Links ]
57 Fricker M, Reissbrodt R, Ehling–Schulz M. Evaluation of standard and new chromogenic selective plating media for isolation and identification of Bacillus cereus. Int J Food Microbiol. 2008;121(1):27–34. [ Links ]
58 Wehrle E, Didier A, Moravek M, Dietrich R, Märtlbauer E. Detection of Bacillus cereus with enteropathogenic potential by multiplex real–time PCR based on SYBR green I. Mol Cell Probe. 2010;24(3):124–30. [ Links ]
59 Ankolekar C, Rahmati T, Labbe RG. Detection of toxigenic Bacillus cereus and Bacillus thuringiensis spores in U.S. rice. Int J Food Microbiol. 2009;128(3):460–6. [ Links ]
60 Kim JB, Kim JM, Park YB, Han JA, Lee SH, Kwak HS, et al. Evaluation of various PCR assays for the detection of emetic toxin producing Bacillus cereus. J Microbiol Biotechnol. 2010;20(7):1107–13. [ Links ] Epub 2010/07/30.
61 Wiwat C, Boonchaisuk R. Development of a DNA–Probe for Detection of Enterotoxic Bacillus cereus Isolated from Foods in Thailand. J Pharm Sci. 2009;36:22–33. [ Links ]
62 Wehrle E, Moravek M, Dietrich R, Bürk C, Didier A, Märtlbauer E. Comparison of multiplex PCR, enzyme immunoassay and cell culture methods for the detection of enterotoxinogenic Bacillus cereus. J Microbiol Meth. 2009;78(3):265–70. [ Links ]
63 Azza A, Abou Z. Molecular Characterization and Enterotoxin Genes Typing of Local Strains of Bacillus cereus. Aust J Basic Appl Sci. 2009;3(1):160–6. [ Links ]
64 Corona A, Fois M, Mazzette R, De Santis E. A New Multiplex PCR for the Detection of hbl Genes in Strains of the ‘Bacillus cereus Group’. Veterinary Research Communications. 2003;27(1):679–82. [ Links ]
65 Ombui J, Gitahi J, Gicheru M. Direct detection of Bacillus cereus enterotoxin genes in food by multiplex Polymerase Chain Reaction. International Journal of Integrative Biology. 2008;2(3):172–81. [ Links ]
66 Ceuppens S, Boon N, Rajkovic A, Heyndrickx M, Van de Wiele T, Uyttendaele M. Quantification methods for Bacillus cereus vegetative cells and spores in the gastrointestinal environment. J Microbiol Meth. 2010;83(2):202–10. [ Links ]
67 Fernández–No IC, Guarddon M, Böhme K, Cepeda A, Calo–Mata P, Barros–Velázquez J. Detection and quantification of spoilage and pathogenic Bacillus cereus, Bacillus subtilis and Bacillus licheniformis by real–time PCR. Food Microbiol. 2011;28(3):605–10. [ Links ]
68 Martínez–Blanch JF, Sánchez G, Garay E, Aznar R. Development of a real–time PCR assay for detection and quantification of enterotoxigenic members of Bacillus cereus group in food samples. Int J Food Microbiol. 2009;135(1):15–21. [ Links ]
69 Dzieciol M, Fricker M, Wagner M, Hein I, Ehling–Schulz M. A novel diagnostic real–time PCR assay for quantification and differentiation of emetic and non–emetic Bacillus cereus. Food Control. 2013;32(1):176–85. [ Links ]
70 Manzano M, Cocolin L, Cantoni C, Comi G. Bacillus cereus, Bacillus thuringiensis and Bacillus mycoides differentiation using a PCR–RE technique. Int J Food Microbiol. 2003;81(3):249–54. [ Links ]
71 Oh M–H, Ham J–S, Cox JM. Diversity and toxigenicity among members of the Bacillus cereus group. Int J Food Microbiol. 2012;152(1—2):1–8. [ Links ]
72 Krause N, Moravek M, Dietrich R, Wehrle E, Slaghuis J, Märtlbauer E. Performance characteristics of the Duopath® Cereus Enterotoxins assay for rapid detection of enterotoxinogenic Bacillus cereus strains. Int J Food Microbiol. 2010;144(2):322–6. [ Links ]
73 Hormazábal V, Østensvik Ø, O'Sullivan K, Granum PE. Quantification of Bacillus cereus Emetic Toxin (Cereulide) in Figs Using LC/MS. Journal of Liquid Chromatography & Related Technologies. 2004;27(16):2531–8. [ Links ]
74 Delbrassinne L, Andjelkovic M, Rajkovic A, Dubois P, Nguessan E, Mahillon J, et al. Determination of Bacillus cereus Emetic Toxin in Food Products by Means of LC—MS². Food Anal Methods. 2012;5(5):969–79. [ Links ]
75 Häggblom M, Apetroaie C, Andersson M, M. S–S. Quantitative analysis of cereulide, the emetic toxin of Bacillus cereus, produced under various conditions. Appl Environ Microbiol. 2002;68(5):2479–83. [ Links ]
76 Ueda S, Kuwubara Y. Rapid identification of Emetic Bacillus cereus by immunocromatography. Biocontrol Sci. 2011 16(1):41–5. [ Links ]
77 Manzo A, Natividad D, Quiñones E, C. V. Bacillus cereus: Peligro bajo el tenedor. Revista Digital Universitaria Universidad Autónoma de México. 2005;6(4). [ Links ]
78 Noriega L, Gueimonde M, Alonso L, de los Reyes–Gavilán CG. Inhibition of Bacillus cereus growth in carbonated fermented bifidus milk. Food Microbiol. 2003;20(5):519–26. [ Links ]
79 Røssland E, Andersen G, Langsrud T, Sørhaug T. Inhibition of Bacillus cereus by strains of Lactobacillus and Lactococcus in milk. Int J Food Microbiol. 2003;89:205–12. [ Links ]
80 Røssland E, Langsrud T, Granum PE, Sørhaug T. Production of antimicrobial metabolites by strains of Lactobacillus or Lactococcus co–cultured with Bacillus cereus in milk. Int J Food Microbiol. 2005;98(2):193–200. [ Links ]
81 Yang Y, Tao W–Y, Liu Y–J, Zhu F. Inhibition of Bacillus cereus by lactic acid bacteria starter cultures in rice fermentation. Food Control. 2008;19(2):159–61. [ Links ]
82 Van Opstal I, Bagamboula CF, Vanmuysen SCM, Wuytack EY, Michiels CW. Inactivation of Bacillus cereus spores in milk by mild pressure and heat treatments. Int J Food Microbiol. 2004;92(2):227–34. [ Links ]
83 Abbas AA, Planchon S, Jobin M, Schmitt P. Absence of oxygen affects the capacity to sporulate and the spore properties of Bacillus cereus. Food Microbiol. 2014;42:122–31. [ Links ] Epub 2014/06/16.
84 Nam H, Seo H–S, Bang J, Kim H, Beuchat LR, Ryu J–H. Efficacy of gaseous chlorine dioxide in inactivating Bacillus cereus spores attached to and in a biofilm on stainless steel. Int J Food Microbiol. 2014;188(0):122–7. [ Links ]
85 Cobo Molinos A, Abriouel H, Lucas López R, Ben Omar N, Valdivia E, Gálvez A. Inhibition of Bacillus cereus and Bacillus weihenstephanensis in raw vegetables by application of washing solutions containing enterocin AS–48 alone and in combination with other antimicrobials. Food Microbiol. 2008;25(6):762–70. [ Links ]
86 Grande MJ, Lucas R, Abriouel H, Valdivia E, Omar NB, Maqueda M, et al. Inhibition of toxicogenic Bacillus cereus in rice–based foods by enterocin AS–48. Int J Food Microbiol. 2006;106(2):185–94. [ Links ]
87 Mellegård H, From C, Christensen BE, Granum PE. Inhibition of Bacillus cereus spore outgrowth and multiplication by chitosan. International journal of food microbiology. 2011;149(3):218–25. [ Links ]
88 Fernandes JC, Eaton P, Gomes AM, Pintado ME, Xavier Malcata F. Study of the antibacterial effects of chitosans on Bacillus cereus (and its spores) by atomic force microscopy imaging and nanoindentation. Ultramicroscopy. 2009;109(8):854–60. [ Links ]
89 Lei J, Yang L, Zhan Y, Wang Y, Ye T, Li Y, et al. Plasma treated polyethylene terephthalate/polypropylene films assembled with chitosan and various preservatives for antimicrobial food packaging. Colloids and Surfaces B: Biointerfaces. 2014;114(0):60–6. [ Links ]
90 Bandla S, Choudhary R, Watson DG, Haddock J. UV–C treatment of soymilk in coiled tube UV reactors for inactivation of Escherichia coli W1485 and Bacillus cereus endospores. LWT – Food Sci Technol. 2012;46(1):71–6. [ Links ]
91 Aguirre JS, Ordóñez JA, García de Fernando GD. A comparison of the effects of E–beam irradiation and heat treatment on the variability of Bacillus cereus inactivation and lag phase duration of surviving cells. Int J Food Microbiol. 2012;153(3):444–52. [ Links ]
92 Ayari S, Dussault D, Hayouni EA, Hamdi M, Lacroix M. Radiation tolerance of Bacillus cereus pre–treated with carvacrol alone or in combination with nisin after exposure to single and multiple sub–lethal radiation treatment. Food Control. 2013;32(2):693–701. [ Links ]














