Introducción
El cáncer y la diabetes son enfermedades crónicas, consideradas por la Organización Mundial de la Salud (oms) como problemas prioritarios de salud pública mundial [1]. La Agencia Internacional para la Investigación del Cáncer (iarc) estimó la incidencia mundial del cáncer para 2018 en 18,1 millones, en todas las edades y sexos combinados: 9,5 millones en hombres y 8,6 millones en mujeres, acompañado de 9,6 millones de muertes: 5,4 millones en hombres y 4,2 millones en mujeres. Las regiones mundiales que más contribuyeron al incremento de tales cifras son, en su orden: Asia (48,4 %), Europa (23,4 %) y las Américas (21 %) para incidencia, y Asia (57,3 %), Europa (20,3 %) y las Américas/Caribe (14,4 %) para mortalidad [1].
Actualmente, el cáncer se posiciona como la segunda causa de muerte mundial, así como la primera o segunda causa de muerte prematura en 91 de 172 países, y como la tercera o cuarta en otros 22 países [2]. El riesgo acumulado y la probabilidad de morir prematuramente por cáncer para ambos sexos son 21,4 y 17,7 %, respectivamente; es decir, en 2018, 1 de cada 5 hombres y 1 de cada 6 mujeres padecieron algún tipo de cáncer, y 1 de cada 8 hombres y 1 de cada 10 mujeres fallecieron por esta enfermedad [1].
En concordancia con lo anterior, el Global Burden of Disease Cancer señala que, en las dos últimas décadas, la tasa de mortalidad por cáncer creció 57 % a nivel mundial [2]. Asimismo, iarc proyectó, para el 2032, un incremento general del 81 % en la incidencia mundial del cáncer, es decir, 22 millones de nuevos casos, representados principalmente por adultos de países de alto y muy alto índice de desarrollo humano [3].
Por su parte, el cáncer colorrectal (ccr) representa, en la actualidad, la tercera causa en incidencia y la segunda en mortalidad en ambos sexos a nivel mundial, siendo más frecuente en hombres [1]. Igualmente, se prevé que la carga global para ccr en 2030 superará los 2,2 millones de nuevos casos, acompañado de 1,1 millones de muertes, lo cual representaría un crecimiento del 60 % en la incidencia del ccr en tan solo veinte años [4].
Del mismo modo, Latinoamérica ha tendido al aumento en la incidencia y la mortalidad general atribuible a cáncer [4] y en la mortalidad general específica de ccr durante las dos últimas décadas [5]. El número actual de afectados por cáncer en Latinoamérica y el Caribe asciende a 2,6 millones, y proyecciones para 2035 indican que se presentarán 135 mil nuevos casos de ccr en todas las edades y sexos combinados: 66 mil en hombres y 62 mil en mujeres [6].
En relación con Colombia, el ccr se ubicó tercero en incidencia y en mortalidad para 2018, siendo mayor su frecuencia en mujeres [1]. De hecho, se esperan 12 732 nuevos casos de ccr en todas las edades y sexos para 2035 en el país: 6805 en mujeres y 5927 en hombres [7]. El anterior panorama se agrava tras considerar que en Colombia, la mayoría de casos de ccr son diagnosticados y tratados en estadios avanzados de la enfermedad [8].
En forma similar, la incidencia de diabetes se ha cuadruplicado a nivel global durante las tres últimas décadas. Dicho incremento está representado especialmente por la diabetes mellitus tipo 2 (dmt2) [9]. En 2017, se reportaron 424,9 millones de personas con diabetes y 1,8 millones de defunciones atribuibles a esta enfermedad [10], de las cuales el 80 % habitaban en países de bajos y medianos ingresos económicos, en su mayoría de edad productiva [11].
La cifra actual de individuos diabéticos en Centroamérica y Suramérica asciende a 29,6 millones, fuera de las cuales 11,5 millones conviven con diabetes sin recibir diagnóstico. El crecimiento esperado en la incidencia de dmt2 en adultos de países en desarrollo y desarrollados entre 2010 y 2030 se ha estimado en 69 y 20 %, respectivamente [10,11]. Así mismo, se espera un aumento del 148 y el 65 % en la incidencia de diabetes en Latinoamérica y Centro/Suramérica respectivamente, durante el mismo periodo [12].
En Colombia, la diabetes se ubicó entre las tres primeras causas de mortalidad entre 2005 y 2014, y algunos estudios indican que su prevalencia actual en población general es cercana al 9 %, siendo mayor en individuos de áreas urbanas que rurales, y en mujeres [13]. En 2030, la población colombiana exhibirá un incremento del 54 % en la incidencia de diabetes [12].
El anterior escenario permite interrogarnos sobre la influencia que pudiera ejercer la diabetes tipo 2 como factor de riesgo para el desarrollo del cáncer colorrectal. Por tanto, el objetivo de la presente revisión sistemática cualitativa es describir la evidencia epidemiológica que evalúe la diabetes tipo 2 como factor de riesgo para el desarrollo del cáncer colorrectal a nivel mundial, así como las políticas de salud pública internacionales y colombianas para el control de ambas patologías.
Metodología
Pregunta de investigación
¿Es la diabetes mellitus tipo 2 un factor de riesgo para el desarrollo del cáncer colorrectal en la población adulta a nivel mundial? Y si esto resultara cierto, ¿existen políticas de salud pública eficaces para controlar este riesgo?
Fuentes de datos y estrategia de búsqueda
La presente revisión sistemática es cualitativa, sobre factores de riesgo, e incluyó estudios epidemiológicos originales que evaluaron el riesgo de desarrollar cáncer de colon o de recto en adultos de ambos sexos con diagnóstico de dmt2, a nivel mundial. Fueron seguidas las declaraciones prima (Preferred Reporting Items for Systematic reviews and Meta-Analyses) [14]. Estas guías son ampliamente utilizadas a nivel internacional, por cuanto permiten a los autores mejorar la presentación y la calidad crítica de sus revisiones sistemáticas y metaanálisis. Sin embargo, no es un instrumento para valorar la calidad de las revisiones sistemáticas.
Dos investigadores, de manera independiente, realizaron una primera búsqueda estructurada de publicaciones presentes en la web antes del 30 de junio de 2019, en idioma inglés y español, en PubMmed®, United States National Library of Medicine (u.s nlm®), Embase®, Literatura Latinoamericana y del Caribe en Ciencias de la Salud (Lilacs®) y Scientific Electronic Library Online (SciELO)-. Los términos utilizados en la primera búsqueda incluyeron los siguientes descriptores Descriptores en Ciencias de la Salud (DeCS): “Type 2 diabetes (Diabetes Tipo 2)”, “Diabetes Mellitus Type 2 (Diabetes Mellitus Tipo 2)”, “Colorectal Cancer (Cáncer colorrectal)”, “Colorectal Neoplasms (Neoplasia colorrectal)”, “Colonic Neoplasms (Neoplasia del colon)” y “Rectal Neoplasms (Neoplasia del recto)”. Los documentos así obtenidos fueron añadidos al gestor bibliográfico EndNote y filtrados para comparar los duplicados según título, autores, resumen y número de páginas.
Luego, se seleccionaron las publicaciones no duplicadas, entre las que se realizó una segunda búsqueda de estudios epidemiológicos que evaluaran el riesgo de desarrollar ccr en personas adultas con diagnóstico de dmt2 a nivel mundial. Los términos utilizados en la segunda búsqueda incluyeron los siguientes descriptores DeCS: “Type 2 Diabetes and Colorectal Cancer”, y “Diabetes tipo 2 y Cáncer colorrectal”. De esta segunda búsqueda se escogieron los estudios de investigación original relacionados con la pregunta de investigación. Finalmente, se revisaron completamente uno a uno los contenidos de los estudios evaluados para elegibilidad y se aplicaron los criterios de inclusión y exclusión.
Al mismo tiempo, otros dos investigadores hicieron la revisión de las políticas internacionales y colombianas para el control de la diabetes y el cáncer colorrectal, disponibles en el índice bibliográfico de revistas indexadas del Departamento Administrativo de Ciencia, Tecnología e Innovación de Colombia (Colciencias).
La escogencia de los idiomas en los términos de búsqueda obedeció al interés de tamizar el mayor número de publicaciones relacionadas con la pregunta de investigación y, a su vez, facilitar la identificación de estudios en población hispanoamericana.
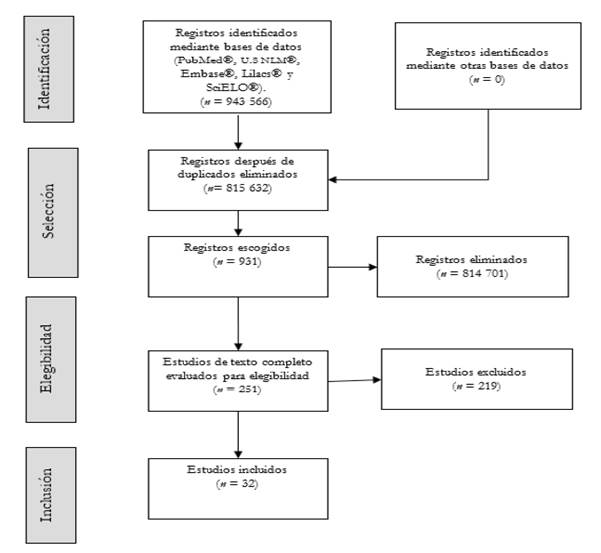
El resumen de los pasos seguidos para la selección de estudios se muestra en la Figura 1.
Selección de estudios y criterios de inclusión y de exclusión
Se incluyeron estudios de investigación original tipo casos y controles, estudios de cohorte prospectiva, cohorte retrospectiva, retrospectivos con enfoque de casos y controles, retrospectivos con enfoque casos-cohorte, que evaluaron el riesgo de desarrollar cáncer de colon o de recto en adultos de ambos sexos con diagnóstico de dmt2, a nivel mundial.
Los criterios de inclusión y exclusión de los estudios se presentan en la Tabla 1.
Tabla 1 Criterios de inclusión y exclusión de estudios epidemiológicos.
| De inclusión | Estudios casos y controles | Estudios que extrajeran información sobre dmt2 y ccr de los registros nacionales de enfermedades crónicas no transmisibles |
| Investigaciones cuyo método de recolección de la información estuviera basado en encuestas estructuradas validadas | ||
| Estudios que incluyeran casos de ccr definidos como aquellos participantes menores de 75 años con diagnóstico histopatológico confirmado de cáncer de colon o de recto incidente en un tiempo no mayor de un año antes de la aplicación de la entrevista o cuestionario autoinformado validado | ||
| Estudios que enrolaran participantes entre los 25 y los 75 años de edad, con diagnóstico de dmt2, conforme a alguna o varias de las guías internaciones para diagnóstico de dmt2 (ifd 2005, atp iii 2005, alad 2007, Criterios armonizados 2009) | ||
| Estudios que incluyeran controles definidos como aquellos participantes menores de 75 años, ingresados a centros hospitalarios por un amplio espectro de afecciones agudas no relacionadas con el tracto digestivo, no neoplásicas, no metabólicas y no relacionadas con las hormonas. Asimismo, procedentes de las mismas áreas de vigilancia de los casos, sin antecedentes de cáncer, sin factores de riesgo relacionados con ccr (adenomas), colonoscopia normal, y que no requirieran modificaciones a largo plazo de la dieta | ||
| Estudios de cohorte | Estudios con un período de seguimiento trimestral a bienal de los participantes | |
| Estudios que implementaran la revisión estructurada de registros nacionales de cáncer y hospitalarios de fuentes electrónicas, con validez certificada por organismos gubernamentales | ||
| Estudios que aplicaran cuestionarios estructurados, validados sobre factores de riesgo y enfermedades crónicas recientemente diagnosticadas, incluyendo dmt2 y ccr | ||
| Participantes con dmt2 autoinformada y confirmación mediante la revisión de registros médicos hospitalarios por especialista en endocrinología | ||
| Participantes con cáncer de colon o de recto autoinformado, y confirmación mediante la revisión de los resultados de patología y los registros médicos hospitalarios por especialista en gastroenterología o medicina interna | ||
| Estudios que enumeraran los casos de cáncer incidentes de toda la cohorte, medidos como un primer registro médico en fuentes electrónicas, y luego estratificados por región anatómica (colon distal, colon proximal y rectal) | ||
| Aquellos estudios que siguieran, en lo posible, una subcohorte aleatoria, seleccionada inmediatamente después de la línea de base, para determinar el estado vital y para estimar el tiempo acumulado de personas en riesgo, pero también para estimar la exposición dentro de toda la cohorte | ||
| Estudios que estimaran potenciales sesgos de confusión al momento del enrolamiento de los participantes y ajustaran su participación por las características clínicas del paciente; enfermedades predisponentes al ccr, co-medicación, medicamentos prescritos para el ccr y, por lo tanto, que pudieran definir los factores de confusión para la asociación entre la dmt2 y el ccr | ||
| De exclusión generales (Todos los estudios) | Estudios que incluyeran individuos con diagnóstico de diabetes tipo 1 | |
| Investigaciones que incluyeran participantes sin historial clínico de dmt2 o individuos con edad menor de 25 años al momento del diagnóstico de diabetes | ||
| Publicaciones que incluyeran individuos sin ninguna prescripción médica de agentes hipoglucemiantes durante el periodo de enrolamiento o seguimiento | ||
| Estudios cuyos participantes autoinformaran antecedentes de cáncer diferente al ccr al inicio del estudio | ||
| Estudios que incluyeran información autosuministrada por el participante, sin confirmación en los registros clínicos de enfermedades crónicas | ||
| Investigaciones que incluyeran participantes con diagnóstico de cáncer de colon o recto por fuera del período de estudio, con fecha de colonoscopia de reclutamiento fuera del período de estudio, con diagnóstico de síndrome genético o con posible diagnóstico de síndrome genético | ||
| Estudios que incluyeran participantes con diagnóstico de otros cánceres, con datos incompletos o sin documentación patológica, colonoscopia incompleta, colitis, historial clínico sin información de dmt2 o ccr | ||
| Estudios de revisión sistemática sobre intervenciones clínicas, sobre métodos diagnósticos y de efectos adversos, así como aquellas revisiones sistemáticas de revisiones y en red, y los metaanálisis de estudios observacionales evaluando la asociación entre diabetes preexistente y riesgo de mortalidad específica de ccr, con mortalidad por todas las causas y recurrencia del ccr | ||
| Estudios de intervención clínico-farmacológica para el tratamiento de dmt2 o ccr, y los estudios básicos experimentales sobre ambas patologías | ||
ccr: Cáncer colorrectal; dmt2: Diabetes mellitus tipo 2
Extracción de datos y evaluación de la calidad
La extracción de los datos fue realizada independientemente por dos investigadores, de forma manual, mediante el empleo de una hoja de extracción. Los datos de interés consistieron en título de publicación, tipo de estudio, población, metodología, resultados y cumplimiento de criterios de inclusión.
La evaluación de la calidad fue basada en la escala de Newcastle-Ottawa [15]. En la Tabla 2, última columna, se muestra dicha evaluación.
Tabla 2 Estudios epidemiológicos sobre la interrelación diabetes mellitus tipo 2 y cáncer de colon o recto. Evaluación de la calidad de estudios según recomendaciones Newcastle-Ottawa [15]
| Autor, año publicación, referencia | Población, período de estudio o seguimiento | Tamaño muestra y tipo de estudio | Hallazgos principales | Nivel de calidad |
|---|---|---|---|---|
| La Vecchia et al., 1991 [16] | Italia, ambos sexos, 1985-1990 | Casos y controles (n = 2579) 673 casos cáncer de colon. 405 casos cáncer de recto. 1501 controles. | El historial clínico de dmt2 se asoció significativamente con el riesgo de desarrollar cáncer de colon (rr: 1,6, ic95 %: 1,1-2,3), mas no con cáncer de recto (rr: 1,3, ic95 %: 0,8-2,0). Test Mantel-Haenszel | Bueno Selección (4); Comparabilidad (1); Exposición (3) |
| Steenland et al., 1995 [17] | Estados Unidos, ambos sexos, 1970-1987 | Cohorte retrospectiva (n = 4 407) 176 casos incidentes de ccr: 94 en hombres y 82 en mujeres | El historial clínico de dmt2 se asoció con el riesgo de desarrollar ccr en hombres (or: 1,43, ic95 %: 0,61-3,31) y en mujeres (or: 1,40; ic95 %: 0,64-3,10). Regresión de Cox | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| La Vecchia et al., 1997 [18] | Italia, ambos sexos, 1992-1996 | Casos y controles multicéntrico (n = 6107) 1225 casos de cáncer de colon. 728 casos de cáncer de recto. 4154 controles | El historial clínico de dmt2 se asoció significativamente con ccr (or: 1,3; ic95 %: 1,0-1,6) e individualmente, con cáncer de colon (or: 1,2; ic95 %: 0,8-1,6) y cáncer de recto (or: 1,5; ic95 %: 1,1-2,2) en ambos sexos. Esta asociación fue más fuerte en individuos con diagnóstico de dmt2 después de los 40 años de edad (or: 1,4; ic95 %: 1,1-1,7), como también en individuos después de 10 o más años del diagnóstico de dmt2 (or: 1,6; ic95 %: 1,1-2,3) y en personas mayores de 60 años de edad al momento del diagnóstico del ccr (or: 1,5; ic95 %: 1,1-2,0). Regresión logística múltiple | Bueno Selección (4); Comparabilidad (1); Exposición (3) |
| Le Marchand et al., 1997 [19] | Estados Unidos, multiétnico, ambos sexos, 1987-1991 | Casos y controles (n = 2384) 1192 casos. 1192 controles. | El historial de dmt2 se asoció con cáncer de colon en lado izquierdo en mujeres (or: 3,0; ic95 %: 1,2-7,1) y hombres (or: 1,9; ic95 %: 1,1-3,5), y en recto solo en mujeres (or: 1,7; ic95 %: 0,7-4,4). Regresión logística | Bueno Selección (4); Comparabilidad (1); Exposición (3) |
| Hu et al., 1999 [20] | Estados Unidos, solo mujeres, 1976-1994 | Cohorte prospectiva (n = 18 403) 892 casos incidentes de ccr: 607 casos cáncer de colon. 176 casos cáncer de recto. 109 casos sin subsitio específico de ccr. | El historial clínico de dmt2 se asoció con incremento en el riesgo de padecer ccr (rr ajustado: 1,43, ic95 %: 1,1-1,87, p = 0,009) y de cáncer de colon (rr ajustado: 1,49, ic95 %: 1,09-2,06, p = 0,01), más no con cáncer de recto (rr ajustado: 1,11, ic95 %: 0,56-2,21, p = 0,76). La dmt2 se asoció con ccr de estadio avanzado (rr ajustado: 1,56, ic95 %: 1,07-2,28, p = 0,02), como también, con ccr fatal (rr ajustado: 2,39, ic95 %: 1,46-3,92, p = 0,0005). En mujeres padeciendo dmt2 durante 11 a 15 años hubo mayor asociación con ccr (rr ajustado: 2,39, ic95 %: 1,43- 3,71, p = 0,0006), con cáncer de colon (rr ajustado: 2,83, ic95 %: 1,67- 4,78, p = 0,0001), con ccr avanzado (rr ajustado: 2,25, ic95 %: 1,11- 4,58, p = 0,02) y con ccr fatal (rr ajustado: 3,96, ic95 %: 1,72- 9,12, p = 0,001). Regresión logística multivariada | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Nilsen et al., 2001 [21] | Noruega, ambos sexos, 1984-1996 | Cohorte prospectiva (n = 75 219) 730 casos incidentes de ccr | Mujeres con historial de dmt2 poseen un 55 % de mayor riesgo de padecer ccr (rr ajustado: 1,55; ic95 %; 1,04-2,31) versus mujeres no diabéticas. La anterior asociación permaneció positiva para cáncer de colon (rr: 1,6; ic95 %: 1,02-2,51) y cáncer de recto (rr: 1,41; ic95 %: 0,61-3,27) en análisis individuales por sitio de cáncer. Regresión de Cox. No se detectó asociación entre dmt2 y ccr en hombres (rr: 0,66; ic95 %: 0,35-1,24) | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Limburg et al., 2005 [22] | Estados Unidos, solo mujeres, 1987-1999 | Cohorte prospectiva (n = 34 972) 1900 mujeres con dmt2. 870 casos incidentes de ccr | Mujeres posmenopáusicas con dmt2 exhibieron un incremento significativo en el riesgo de padecer ccr (rr: 1,5; ic95 %: 1,2-2,0). Análisis por subsitio anatómico mostró un fuerte incremento en el riesgo de padecer cáncer en colon proximal (rr: 1,9; ic95 %: 1,3-2,6), mas no así para cáncer en colon distal (rr: 1,1; ic95 %: 0,6-1,8) ni en recto (rr: 0,8; ic95 %: 0,4-1,6). Regresión de Cox | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Yang et al., 2005 [23] | Reino Unido, ambos sexos, 1987-2002 | Casos y controles (n = 14 876) 10 447 casos de ccr. 104 429 controles. | En individuos de ambos sexos, el diagnóstico de dmt2 se asoció como factor de riesgo para el desarrollo de ccr (or: 1,42; ic95 %: 1,25-1,62). Tanto en mujeres (or: 1,38; ic95 %: 1,14-1,67) como en hombres (or: 1,36; ic95 %: 1,16-1,61) se detectó asociación entre la dmt2 como factor de riesgo para el desarrollo de ccr. El estatus de dmt2 incrementó el riesgo de cáncer de colon (or: 1,45; ic95 %: 1,25-1,7) y de recto (or: 1,34; ic95 %: 1,08-1,68). Regresión logística | Bueno Selección (4); Comparabilidad (1); Exposición (3) |
| Larsson et al., 2005 [24] | Suecia, solo hombres, 1997-2004 | Cohorte prospectiva (n = 45 550) 411 casos incidentes de ccr. | Hombres con dmt2 poseen 49 % de riesgo de padecer ccr (rr ajustado: 1,45; ic95 %: 1,11-1,89, rr multivariado: 1,49; ic95 %: 1,14-1,96). Regresión de Cox. El riesgo observado se mantuvo en análisis multivariado para cáncer de colon (rr: 1,53; ic95 %: 1,02-2,29) y cáncer de recto (rr: 1,79; ic95 %: 1,18-2,73) | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Inoue et al., 2006 [25] | Japón, ambos sexos, 1990-2003 | Cohorte prospectiva (n = 97 771) 46 548 hombres: 6,7 % dmt2 51 223 mujeres: 3,1 % dmt2 | En hombres con dmt2, se apreció moderado incremento en el riesgo de padecer cáncer de colon (hr: 1,36; ic95 %: 1,00-1,85), mas no así en mujeres. Regresión de Cox | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Limburg et al., 2006 [26] | Estados Unidos, ambos sexos, 1970-1999 | Cohorte retrospectiva (n = 975) 51 registros de ccr | El estatus de dmt2 incrementó en 39 % el riesgo de padecer ccr en individuos de ambos sexos (Tasa de incidencia estandarizada- sir: 1,39; ic95 %: 1,03-1,82). En hombres, el estatus de dmt2 se asoció significativamente con incremento en el riesgo de padecer ccr (sir: 1,67; ic95 %; 1,16-2,33) y con cáncer en colon proximal (sir: 1,96; ic95 %: 1,16-3,1). En mujeres, el estatus de dmt2 no se asoció como factor de riesgo para ccr (sir: 1,03; ic95 %: 0,6-1,66), ni para ccr proximal (sir: 1,17; ic95 %: 0,58-2,09), ni para ccr distal (sir: 0,74; ic95 %: 0,24-1,72). Regresión de Poisson | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Seow et al., 2006 [27] | China, ambos sexos, 1993-1998 | Cohorte prospectiva (n = 63 257) 636 casos incidentes de ccr: 352 en hombres y 284 en mujeres. | El historial clínico de dmt2 se asoció significativamente con el riesgo de padecer ccr en hombres (rr: 1,5; ic95 %: 1,2-2,1) y mujeres (rr: 1,4; ic95 %: 1,0-1,9). En análisis individuales por sitio anatómico del ccr, el estatus de dmt2 se asoció con el riesgo de desarrollar cáncer en colon (rr: 1,5; ic95 %: 1,1-2,0) y cáncer de recto (rr: 1,5; ic95 %: 1,0-2,1) en sexos combinados. Regresión de Cox | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Kuriki et al., 2007 [28] | Japón, ambos sexos, 1988-2000 | Casos y controles (n = 59 440) 762 casos de ccr en hombres: 427 en colon y 335 en recto. 549 casos de ccr en mujeres: 347 en colon y 202 en recto. 47 768 controles. | En hombres adultos, se detectó asociación significativa entre el historial de dmt2 con el riesgo de desarrollar ccr (or: 2,19; ic95 %: 1,56-3,07). En mujeres adultas, se detectó asociación significativa entre el historial de dmt2 con el riesgo de desarrollar ccr (or: 2,40; ic95 %: 1,17-4,91). Regresión logística unicondicional | Bueno Selección (4); Comparabilidad (1); Exposición (3) |
| Vinikoor et al., 2009 [29] | Estados Unidos, ambos sexos, 1996-2006 | Casos y controles (n = 3752) 1688 casos. 2064 controles. | Individuos de tez blanca con dmt2 exhibieron mayor riesgo de desarrollar cáncer de colon (or: 1,4, ic95 %: 0,93-2,12) y cáncer de recto (or: 1,38, ic95 %: 1,0-1,9), que sus contrapartes sin diabetes. En individuos de tez blanca con dmt2, el uso crónico con insulina se asoció con el desarrollo de cáncer de recto (or: 1,74, ic95 %: 0,92-3,31). En individuos afroamericanos, la dmt2 no se asoció como factor de riesgo para cáncer de colon (or: 1,17, ic95 %: 0,81-1,7), ni tampoco para cáncer de recto (or: 0,75, ic95 %: 0,44-1,28). Regresión logística | Bueno Selección (4); Comparabilidad (1); Exposición (3) |
| Ogunleye et al., 2009 [30] | Escocia, ambos sexos, 1993-2004 | Cohorte prospectiva (n = 28 731) 9577 con dmt2. 19 154 sin dmt2. | En individuos de ambos sexos, el estatus de dmt2 se constituye en un factor de riesgo para desarrollar cáncer de colon (rr ajustado: 1,46; ic95 %: 1,07-2,01), mas no para cáncer de recto (rr: 0,53; ic95 %: 0,25-1,1). Regresión de Cox | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Campbell et al., 2010 [31] | Estados Unidos, ambos sexos, 1992-2007 | Cohorte prospectiva (n = 84 194) 73 312 hombres. 81 663 mujeres. 1567 hombres y 1242 mujeres desarrollaron ccr. | En hombres, la dmt2 se asoció con incremento en el riesgo de casos incidentes de ccr (rr: 1,24; ic95 %: 1,08-1,44) versus no diabéticos. El riesgo de desarrollar ccr incidente fue mayor en hombres con dmt2 utilizando insulina (rr: 1,36; ic95 %: 1,05-1,78), versus sus contrapartes que no usaban insulina (rr: 1,22, ic95 %: 1,04-1,45). En mujeres, la dmt2 (rr: 1,01; ic95 %: 0,82-1,23) y el uso de insulina (rr: 0,95; ic95 %: 0,64-1,41) no se asociaron con el riesgo de padecer ccr incidente. Regresión de Cox | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Flood et al., 2010 [32] | Estados Unidos, solo mujeres, 1987-1998 | Cohorte retrospectiva, multicéntrico (n = 45 516) 41 096 mujeres: 233 casos incidentes de ccr. | Mujeres con dmt2 mostraron elevado riesgo de desarrollar ccr (rr = 1,60, ic95 %: 1,18-2,18), versus no diabéticas. En mujeres con diagnóstico de dmt2 entre los 4 y 8 años previos al inicio del estudio, se observó mayor riesgo de desarrollar ccr (rr: 2,36; ic95 %: 0,96-5,79). Regresión de Cox | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| He et al., 2010 [33] | Estados Unidos, multiétnico, ambos sexos, 1993-2006 | Cohorte prospectiva (n = 99 143) 3549 casos incidentes de ccr | Individuos con dmt2 tuvieron 19 % mayor riesgo de desarrollar ccr (rr: 1,19, ic95 %: 1,09-1,29, p < 0,001) versus no diabéticos. El riesgo de padecer ccr en individuos con dmt2 fue mayor y más significativo en mujeres (rr: 1,28, ic95 %: 1,12-1,46, p < 0,001) que en hombres (rr: 1,12, ic95 %: 0,99-1,26, p < 0,063; p de interacción: 0,071). El análisis estratificado por sitio de ccr reveló elevado riesgo de padecer cáncer de colon (rr: 1,20; ic95 %: 1,09-1,32, p < 0,0001) y cáncer de recto (rr: 1,15; ic95 %: 0,96-1,36, p = 0,12) en diabéticos tipo 2. En latinos de ambos sexos, residentes en Estados Unidos, se detectó fuerte asociación entre dmt2 y riesgo de ccr (rr: 1,55; ic95 %: 1,13-2,14, p < 0,007), siendo más fuerte dicha asociación en mujeres (rr: 1,61; ic95 %: 0,97-2,69, p = 0,067) que en hombres (rr: 1,51; ic95 %: 1,00-2,27, p = 0,05). Regresión de Cox. El riesgo de padecer ccr en personas con dmt2 fue elevado y se mantuvo en similar magnitud para su sitio de presentación: colon derecho (rr: 1,23, ic95 %: 1,08-1,41, p = 0,002) y colon izquierdo (rr: 1,18, ic95 %: 1,01-1,38, p = 0,04) | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Chodick et al., 2010 [34] | Israel, ambos sexos, 2000-2008 | Cohorte retrospectiva (n = 00 595) 16 721 personas con dmt2 al inicio de la cohorte. 83 874 personas sin dmt2 al inicio de la cohorte. | En mujeres adultas, el estatus de dmt2 se asoció con el riesgo de padecer cáncer de colon (hr ajustado: 1,52; ic95 %: 1,19-1,95), mas no con cáncer de recto (hr ajustado: 1,08; ic95 %: 0,69-1,69). En hombres adultos, el estatus de dmt2 no se asoció con el riesgo de padecer cáncer de colon (hr ajustado: 1,14; ic95 %: 0,91-1,44), ni con cáncer de recto (hr ajustado: 1,1; ic95 %: 0,74-1,61). Regresión de Cox | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Atchison et al., 2011 [35] | Estados Unidos, solo hombres, 1969-1996, | Cohorte prospectiva (n = 4 501 578) 584 915 diabéticos tipo 2. 3 906 763 no diabéticos. | Hombres adultos con dmt2 exhibieron elevado riesgo de desarrollar cáncer de colon (rr ajustado: 1,20, ic95 %: 1,16-1,25) y cáncer de recto (rr ajustado: 1,20, ic95 %: 1,07-1,18). Regresión de Poisson | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Jarvandi et al., 2013 [36] | Estados Unidos, ambos sexos, 1996-2006 | Cohorte prospectiva (n = 484 020) 7598 casos incidentes de ccr: 5130 en hombres y 2486 en mujeres. | En individuos de ambos sexos con dmt2 se detectó riesgo de desarrollar cáncer de colon (hr: 1,27; ic95 %: 1,17-1,39) y de recto (hr: 1,36; ic95 %: 1,18-1,56). Regresión de Cox. El estatus de dmt2 se asoció con el riesgo de padecer cáncer en colon proximal (hr: 1,33; ic95 %: 1,19-1,49) y cáncer en colon distal (hr: 1,20; ic95 %: 1,04-1,37) en análisis por sexos combinados. En hombres, la dmt2 se asoció con riesgo de desarrollar cáncer de colon (hr: 1,24; ic95 %: 1,12-1,38), cáncer en colon proximal (hr: 1,30; ic95 %: 1,13-1,49), cáncer en colon distal (hr: 1,17; ic95 %: 0,99-1,37) y cáncer en recto (hr: 1,34; ic95 %: 1,14-1,57). En mujeres, la dmt2 se asoció con riesgo de desarrollar cáncer de colon (hr: 1,37; ic95 %: 1,16-1,60), cáncer en colon proximal (hr: 1,41; ic95 %: 1,15, 1,72), cáncer en colon distal (hr: 1,29; ic95 %: 0,99- 1,69) y cáncer en recto (hr: 1,43, ic95 %: 1,08-1,88) | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Peeters et al., 2015 [37] | Reino Unido, ambos sexos, 1987-2012 | Cohorte retrospectiva (n = 270 785 diabéticos tipo 2) 2759 registros de ccr en diabéticos tipo 2. 1941 registros de cáncer de colon. 819 registros de cáncer de recto. | La dmt2 se asoció con un incremento de 1,3 veces en el riesgo de padecer ccr (hr: 1,26, ic95 %: 1,18-1,33) en sexos combinados. Existe riesgo de padecer ccr en individuos diabéticos tipo 2 padeciendo obesidad durante 4 a 8 años (hr:1,19, ic95 %: 1,06-1,34) y en diabéticos tipo 2 con más de 8 años de duración de la obesidad (hr:1,28, ic95 %: 1,11-1,49). Regresión de Cox | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Díaz et al., 2015 [38] | Puerto Rico, ambos sexos, 2005-2009 | Casos y controles (n = 451) 295 casos 156 controles | Mujeres con dmt2 exhiben casi tres veces mayor riesgo de desarrollar ccr o adenomas colorrectales (or ajustado: 2,74, ic95 %: 0,94-7,99) que sus contrapartes sin diabetes y, cerca de 5 veces mayor riesgo de desarrollar ccr o adenomas en colon proximal (or ajustado: 4,83, ic95 %: 1,25-18,58) comparado a controles. Mujeres con dmt2 presentan mayor riesgo de desarrollar ccr en colon proximal (or ajustado: 7,19, ic95 %:1,44-35,96) que mujeres sin diabetes. Regresión logística. No fue observada ninguna asociación entre dmt2 y riesgo/localización del ccr/adenomas en hombres | Bueno Selección (4); Comparabilidad (1); Exposición (3) |
| Kort et al., 2016 [39] | Holanda, ambos sexos, 1986-2006 | Cohorte prospectiva y casos-cohorte (n = 20 852) Seguimiento de la cohorte completa: 20,3 años Seguimiento de los casos-cohorte: 17,3 años | Detectan asociación significativa entre dmt2 y riesgo de desarrollar cáncer en colon proximal en mujeres (hr: 1,82, ic95 %: 1,11-2,98), mas no en hombres (hr: 1,37, ic95 %: 0,77-2,42), ni tampoco con cáncer en colon distal y recto en ambos sexos, en el grupo de casos-cohorte. En el enfoque de cohorte completa (4593 casos de ccr y 4292 casos de dmt2), encuentran 82 % de incremento en el riesgo de padecer cáncer en colon proximal en mujeres con dmt2 (hr ajustado: 1,44, ic95 %:1,05-1,99) versus mujeres sin dmt2. Detectan incremento del riesgo de aparición de cáncer en colon proximal en mujeres con duración de la dmt2 entre 0-10 años y diagnóstico de dmt2 luego de los 50 años de edad (hr: 1,89, ic95 %: 1,32-2,69) y con larga duración de la dmt2 y diagnóstico de dmt2 antes de los 50 años de edad (hr: 1,64, ic95 %:1,17-2,32). Regresión de Cox | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Rosato et al., 2016 [40] | Italia y España, ambos sexos, 2007-2013, | Casos y controles (n = 2741) 1147 casos de ccr: 14 % con dmt2. 1594 controles: 12 % con dmt2. | Individuos con dmt2 de ambos países poseen riesgo significativo de padecer cáncer de colon (Riesgo: 20 %, or: 1,15, ic95 %:0,89-1,55), cáncer en colon proximal (or: 1,53, ic95 %:1,06-2,19), cáncer en colon distal (or: 0,94, ic95 %: 0,66-1,36) y cáncer de recto (or: 1,32, ic95 %: 0,94-1,87). El uso crónico de insulina se asoció con incremento en el riesgo de ccr (or: 2,2, ic95 %: 1,12-4,33), fortaleciéndose este riesgo con mayor duración en el uso de la misma (or: 8,18, ic95 %: 2,06-32,5, durante 10 o más años, p Trend = 0,002). Regresión logística | Bueno Selección (4); Comparabilidad (1); Exposición (3) |
| Dankner et al., 2016 [41] | Israel, ambos sexos, 2002-2012 | Cohorte prospectiva (n = 2 186 196) 567 347 individuos con dmt2. 1 618 849 individuos sin diabetes. | Detectan fuerte asociación entre dmt2 incidente con incremento en el riesgo -mayormente en mujeres- de padecer ccr (hr:1,44, ic95 %: 1,33-1,55), como también, detectan riesgo entre dmt2 prevalente y riesgo de padecer ccr en ambos sexos (hr: 1,48, ic95 %: 1,39-1,57). Regresión de Cox | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Kort et al., 2017 [42] | Holanda, ambos sexos, 1998-2010 | Cohorte prospectiva (n = 366 770) 41 716 individuos con dmt2: 394 casos de ccr. 325 054 no diabéticos: 1939 casos de ccr. | El estatus de dmt2 en adultos de ambos sexos se asoció significativamente con el riesgo de padecer ccr (hr ajustado: 1,3; ic95 %: 1,2-1,5. hr no ajustado: 1,4; ic95 %: 1,3-1,6) y con riesgo de cáncer en colon proximal (hr ajustado: 1,7; ic95 %: 1,4-2,0). En hombres, la dmt2 se asoció con riesgo de desarrollar ccr (hr ajustado: 1,3; ic95 %:1,1-1,5) y cáncer en colon proximal (hr: 1,6; ic95 %: 1,2-2,1). Este riesgo incrementó en hombres menores de 55 años con dmt2 (hr: 2,0; ic95 %: 1,0-3,8). En mujeres, la dmt2 se asoció con el riesgo de ccr (hr ajustado: 1,3; ic95 %: 1,1-1,6) y cáncer en colon proximal (hr ajustado: 1,8; ic95 %: 1,4-2,3). Regresión de Cox | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Sinagra et al., 2017 [43] | Italia, ambos sexos, 2000-2008 | Cohorte retrospectiva (n = 741) | La duración de la dmt2 se asoció con el riesgo de padecer cáncer colorectal (hr: 1,93; ic95 %: 0,25-14,77, p < 0,001) en ambos sexos combinados. Regresión logística multivariada | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Pang et al., 2018 [44] | China, ambos sexos, 2004-2008 | Cohorte prospectiva (n = 512 713) 3024 casos incidentes de ccr: 1745 en colon y 1716 en recto. | Adultos de ambos sexos con dmt2 exhibieron riesgo de padecer ccr (hr ajustado: 1,14; ic95 %: 1,01-1,29), cáncer de colon (hr ajustado: 1,14; ic95 %: 0,97-1,34) y cáncer de recto (hr ajustado: 1,11; ic95 %: 0,94-1,34). Regresión de Cox | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Yanan et al., 2018 [45] | Estados Unidos, ambos sexos, 1980-2012 | Cohorte retrospectiva (n = 34 763) 1631 mujeres con dmt2. 1129 hombres con dmt2. | En mujeres, el estatus de dmt2 se asoció con el riesgo de padecer ccr (hr ajustado: 1,32; ic95 %: 1,12-1,55). En forma similar, se detectó asociación entre dmt2 y ccr durante el período de seguimiento superior a 15 años (hr ajustado: 1,37; ic95 %: 1,0-1,87). En hombres, la dmt2 se asoció con el riesgo de desarrollar ccr (hr ajustado: 1,57; ic95 %: 1,24-1,98). Igualmente, se detectó asociación entre dmt2 y ccr durante el período de seguimiento de 0,1-5 años (hr ajustado: 1,51; ic95 %: 1,08-2,12) y de 5,1-10 años de seguimiento (hr ajustado: 1,59; ic95 %: 1,06-2,38). Regresión de Cox | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Overbeek et al., 2019 [46] | Holanda, ambos sexos, 2006-2014 | Cohorte retrospectiva (n = 54 492) 55 055 individuos con dmt2. 99 437 individuos sin dmt2. | Individuos de ambos sexos con dmt2 tuvieron 1,3 veces mayor riesgo de desarrollar ccr que sus contrapartes sin diabetes. Hombres con dmt2 exhibieron mayor riesgo de desarrollar cáncer en colon distal (hr: 1,42, ic95 %: 1,08-1,88) que mujeres con dmt2 (hr: 0,86; ic95 %: 0,55-1,35). Mujeres con dmt2 presentaron mayor riesgo de padecer cáncer en colon proximal (hr: 1,58; ic95 %: 1,13-2,19) que hombres con dmt2 (hr: 1,2; ic95 %: 0,87-1,65). Regresión de Cox. No fue observada asociación estadísticamente significativa para dmt2 y cáncer de recto en ambos sexos | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
| Miłek et al., 2019 [47] | Polonia, ambos sexos, 2009-2011 | Cohorte retrospectiva (n = 976) 91 con dmt2. 885 no diabéticos. | Individuos con dmt2 no controlada poseen mayor riesgo de desarrollar ccr (or: 5,72, ic95 %: 1,32-24,87) que los no diabéticos. Regresión logística. Personas con dmt2 tuvieron mayor incidencia de pólipos con cáncer 9/91 (9,89 %), que individuos no diabéticos 18/885 (2,03 %), p < 0,001. Los casos de ccr incidentes ocurrieron con mayor frecuencia en personas con dmt2 no controlada (p = 0,022). Individuos con dmt2 tuvieron una mayor incidencia de pólipos con displasia de alto grado/carcinoma 32/91 (35,16 %) en comparación a no diabéticos 136/885 (15,37 %), p < 0,001. Test Chi-cuadrado | Bueno Selección (4); Comparabilidad (1); Desenlace (3) |
CCR: Cáncer colorrectal; DMT2: Diabetes mellitus tipo 2; HR: Hazard ratio; IC: Intervalo de confianza; OR: Odds ratio; RR: Riesgo relativo; SIR: Tasa de incidencia estandarizada.
Resultados
En la primera búsqueda resultaron 927 515 documentos en inglés y 16 051 en español, los cuales fueron añadidos al gestor bibliográfico EndNote y filtrados para comparar los duplicados. De esta forma, se obtuvieron 815 632 publicaciones no duplicadas, entre las que se realizó una segunda búsqueda de estudios epidemiológicos que evaluaran el riesgo de desarrollar ccr en personas adultas con diagnóstico de dmt2 a nivel mundial. Esta segunda búsqueda arrojó 931 documentos, conteniendo 251 estudios de investigación original relacionados con la pregunta de investigación.
Posteriormente, se revisaron completamente uno a uno los estudios elegibles y aplicaron los criterios de inclusión y exclusión [Tabla 1]. Finalmente, se incluyeron 32 investigaciones originales que describen a la dmt2 como factor de riesgo para el desarrollo del ccr a nivel mundial. Algunos aspectos sobre la normatividad en salud pública internacional y colombiana para el control de la diabetes tipo 2 y el cáncer colorrectal se comentan en la discusión. Los hallazgos de los estudios incluidos se presentan en la Tabla 2.
Discusión
Las enfermedades crónicas no transmisibles (ecnt), que incluyen al cáncer y la diabetes, son actualmente la principal causa de morbilidad, discapacidad, enfermedad prevenible y de muerte prematura en diversas regiones mundiales. Entre las ecnt, resaltan la dmt2 y el ccr, por exhibir marcada tendencia de incremento en sus proporciones de incidencia y mortalidad en las dos últimas décadas, y porque comparten factores de riesgo, comorbilidades y coexisten en millones de personas en diversas latitudes a nivel global. En este contexto, resultan preocupantes las proyecciones de la oms, la iarc y la International Diabetes Federation (ifd) sobre el aumento sustancial en la carga por enfermedad individual de ccr y dmt2 en los próximos años.
La presente revisión sistemática logró describir evidencias desde estudios epidemiológicos a nivel mundial, que reafirman a la dmt2 como un factor de riesgo importante para el desarrollo del ccr, y que permiten dar respuesta a nuestra pregunta de investigación, al señalar que individuos adultos de ambos sexos con dmt2 exhiben elevado y mayor riesgo de padecer cáncer de colon o de recto, comparado con individuos no diabéticos.
Es notable que el tamaño de las asociaciones de riesgo identificadas parecen ser dependientes del grupo étnico-geográfico estudiado, de la edad, el sexo y sitio/subsitio anatómico del ccr evaluado, así como del tiempo de evolución de la diabetes. Sin embargo, a pesar de las evidencias existentes a la fecha (2019) sobre la interrelación dmt2 y ccr, las intervenciones en prevención primaria y secundaria, y la tamización del cáncer de colon y recto en individuos diabéticos tipo 2 y en menores de 50 años solo se han implementado en pocos países.
En su conjunto, el anterior bloque de evidencias nos conducen a hipotetizar sobre la potencial existencia de variantes genéticas o epigenéticas en individuos con dmt2 en diversas etnias y geografías mundiales que, dependientes del estilo de vida, dieta y duración del tratamiento con insulina, pudieran conferir riesgo diferencial, sexo y sitio específico de padecer cáncer de colon y de recto, y que, a su vez, demarcarían el inicio y el grado de severidad clínica del ccr en diabéticos, como también modificarían el grado de respuesta al tratamiento quimio/radio-terapéutico e incluso quirúrgico, determinando subsecuentemente y de manera aditiva, los desenlaces sobre el pronóstico clínico y los indicadores de incidencia, prevalencia, mortalidad y carga asociada de ambas patologías [55,56].
Panorama internacional y colombiano sobre el control del ccr y dmt2
Las normativas en salud pública internacionales y colombiana para poner en marcha medidas concertadas de lucha contra la diabetes, el cáncer y otras ecnt (véase Tabla 3], convergen en sus objetivos de reducir la mortalidad prevenible asociadas a ecnt, así como disminuir al mínimo la exposición a factores de riesgo comunes, aumentar la exposición a factores protectores y mitigar la carga socio-económica de estas enfermedades.
Tabla 3 Normatividad en salud pública internacional y colombiana para el control de la DMT2 y CCR
| Título de la norma | Objetivos | Período | Referencia |
|---|---|---|---|
| Declaración política de la reunión de alto nivel de la Asamblea General sobre la prevención y el control de las enfermedades no transmisibles. | Examinar las medidas de prevención y control de las ecnt. Reconocer las repercusiones sociales y económicas de la carga conjunta de las ecnt. Dictar medidas para la prevención y el control de las ecnt. | 2011 | [48] |
| Plan de acción mundial para la prevención y el control de las enfermedades no transmisibles 2013-2020 de la oms | Reconocer las principales ecnt que deben priorizarse en su abordaje para prevención y control. Prevenir y reducir la carga de morbilidad y mortalidad por ecnt. | 2013-2020 | [49] |
| Plan de acción para la prevención y el control de las enfermedades no transmisibles en las Américas 2013-2019 ops | Establecer líneas estratégicas de intervención de las ecnt en la región de las Américas. | 2013-2019 | [50] |
| La Agenda 2030 y los objetivos de desarrollo sostenible. Una oportunidad para América Latina y el Caribe. cepal. | Establecer lineamientos para mejorar la sostenibilidad económica, social y ambiental de los Estados de América Latina y el Caribe. Analizar y formular los medios para alcanzar los objetivos de desarrollo sostenible de la onu. | 2016 | [51] |
| Informe wha 70.12 de la Séptima Asamblea de Salud Mundial. Cancer prevention and control in the context of an integrated approach. | Reconocer al cáncer como problema prioritario de salud pública mundial. Brindar recomendaciones a los gobiernos sobre la implementación de planes para la prevención y control del cáncer. | 2017 | [52] |
| Plan decenal de salud pública de Colombia, 2012-2021 | Reducir la inequidad en salud. Proponer medidas para mejorar las condiciones de vida, la situación en salud y disminuir la carga de enfermedad por las ecnt | 2012-2021 | [53] |
| Plan decenal para el control del cáncer en Colombia, 2012-2021 | Describir la situación actual del cáncer en Colombia. Establecer el marco normativo y político, así como las metas y acciones para la prevención y el control del cáncer en población colombiana. | 2012-2021 | [54] |
ccr: Cáncer colorrectal; cepal: Comisión Económica para América Latina y el Caribe; dmt2: Diabetes mellitus tipo 2; ecnt: Enfermedades crónicas no transmisibles, oms: Organización Mundial de la Salud; ops: Organización Panamericana de la Salud; wha: Asamblea de Salud Mundial; onu: Organización de las Naciones Unidas.
El estudio de las acciones internacionales para promover e implementar la prevención primaria de las ecnt permite observar que tales medidas han sido ineficaces en reducir significativamente la carga global y regional de las ecnt, lo que posiblemente esté relacionado con el desconocimiento del grado de progreso y beneficios otorgados por la prevención de tales patologías por parte de los gobiernos mundiales.
Entre algunas de las debilidades identificadas en los planes de salud pública sobre ecnt, destacan: la falta de cumplimiento y ejecución; la escasa prioridad sobre las intervenciones preventivas -promoción de la salud- y regulación, y la falta de profesionalización sobre las actividades normativas relacionadas con los planes en salud, así como el no cumplimiento de las metas e improvisación en los procesos institucionales, con el subsiguiente efecto sobre la calidad y la eficacia en la prestación de los servicios de salud.
Recientemente, Colombia fue incluido en el grupo principal de países con la mayor incidencia y mortalidad prematura por cánceres del mundo, abarcando el ccr [4]. En 2012, el Instituto Nacional de Cancerología de Colombia reconoció la existencia de una tendencia al alza en la mortalidad general por ccr en ambos sexos durante las últimas décadas [54]. Igualmente, el Observatorio Nacional del Cáncer de Colombia señaló que el ccr es uno de los cánceres que generan la mayor probabilidad de morir, y justificó como prioritario el investigar en profundidad las causas subyacentes de estos desenlaces [57].
Por consiguiente, el ccr fue incluido en el “Plan decenal para el control del cáncer en Colombia 2012-2021” entre los cinco cánceres con mortalidad prematura evitable, y se planteó intervenirlo con actividades de atención primaria, secundaria y terciaria [54]. Estas actividades establecen metas enmarcadas en la línea estratégica de detección temprana, que incluyen: ampliar la cobertura de pruebas de tamización, incrementar la proporción de casos de cáncer detectados en estadios tempranos, así como garantizar el acceso oportuno y de calidad al diagnóstico y al tratamiento de pacientes positivos en las pruebas de tamización.
En sustento de lo anterior, el Ministerio de Salud y Protección Social de Colombia, mediante la Guía de práctica clínica (gpc) para la detección temprana, diagnóstico, tratamiento integral, seguimiento y rehabilitación del cáncer de colon y recto[58], estableció que la estrategia óptima de tamización para ccr en población colombiana en riesgo consiste en practicar la prueba de sangre oculta en materia fecal inmunoquímica (somf) cada dos años y colonoscopia cuando exista un resultado positivo de somf o colonoscopia cada diez años -cuando esta se encuentre disponible-, entre los 50 y 75 años de edad.
Sin embargo, el sistema de salud colombiano carece de un programa de tamización organizado para la detección temprana y oportuna del ccr, pues existe solo de oportunidad. La guía anteriormente mencionada no brinda recomendaciones sobre el uso de biomarcadores bioquímicos, ni genético-moleculares para el tamizaje del riesgo poblacional, ni tampoco para el diagnóstico oportuno del ccr en sus estadios tempranos, en mayores de 50 años. De igual manera, esta guía no aborda la tamización en población menor de 50 años, sin antecedentes de riesgo familiar o personal -mucho menos en pacientes con dmt2-, ni tampoco contempla la práctica de colonoscopia antes de los 10 años del primer resultado de colonoscopia negativa en mayores de 50 años. Lo anterior pudiera estar contribuyendo a un diagnóstico y tratamiento tardíos, así como al desfavorable pronóstico de los pacientes con ccr avanzado y al aumento exagerado de la carga de la enfermedad para el sistema de salud colombiano [59].
Adicionalmente, esta guía no reconoce a la dmt2 como factor de riesgo para el desarrollo, severidad y pronóstico del ccr en población colombiana, ni tampoco permite identificar subgrupos de individuos con ccr, en mayor o menor riesgo de padecer dmt2, que pudiera influir negativamente en los desenlaces de la enfermedad oncológica. Así mismo, el algoritmo actual de clasificación del riesgo en ccr no brinda claridad, pues no se aprecian los criterios para definir el tipo y el nivel de riesgo en bajo, medio y alto. Tampoco priorizan el tipo de intervención clínica según el nivel de riesgo, sino por antecedentes de riesgo heredofamiliar.
En relación con la diabetes, Colombia se ubica segundo entre los países suramericanos con el mayor número de personas afectadas por esta patología [60]. Y los reportes epidemiológicos nacionales ubican a la diabetes entre las cinco primeras causas de mortalidad general, y su prevalencia es mayor en individuos de áreas urbanas que rurales, afectando en mayor número a mujeres. Según edad de los afectados, el 88 % de los casos de diabetes se presentan en personas mayores de 45 años de edad [61]. Sin embargo, el perfil de diabetes de Colombia, elaborado por la oms en 2016, reveló una tendencia de incremento progresivo de la enfermedad en mayores de 30 años de ambos sexos [62]. Empero, en el país no existe cobertura total en la prestación de servicios diagnósticos y de tratamiento para la diabetes. Se estima que cerca del 50 % de los diabéticos aún no han sido diagnosticados [61], mientras que el 21 % de los que reciben tratamiento para diabetes no alcanzan objetivos terapéuticos [63].
En forma similar, Colombia no cuenta con un sistema de registro nacional de diabetes y existe escaso número de estudios de corte trasversal y cohorte prospectivo sobre diabetes. Los estudios existentes han sido conducidos en áreas poblaciones urbanas y rurales que incluyen pequeño tamaño muestral, lo cual no permite estimar con precisión o exactitud, y comparar estadísticamente la prevalencia, incidencia y mortalidad general, o estratificar por grupos étnicos o geográficos la presentación real de la enfermedad al nivel nacional. Por tanto, es altamente probable que las proporciones actuales de prevalencia, incidencia y mortalidad para diabetes en Colombia se encuentren subestimadas.
Por su parte, al analizar la Guía de práctica clínica para el diagnóstico, tratamiento y seguimiento de la diabetes mellitus tipo 2 en población mayor de 18 años, en Colombia, del Ministerio de Salud y Protección Social [64], observamos que la misma no clasifica a la dmt2 como un factor de riesgo para el desarrollo, la severidad y el pronóstico del ccr, y viceversa, ni tampoco como una complicación de cualquier tipo de cáncer. Así mismo, no vincula el uso de medicamentos hipoglicemiantes orales o sistémicos para el tratamiento de la dmt2 con el desarrollo, severidad y pronóstico del ccr. Aún más, el sistema de salud estatal no reconoce el grado de interrelación epidemiológica y biológica entre ambas patologías. De igual modo, ninguna de las mencionadas guías considera la potencial existencia de subgrupos de personas con dmt2 en riesgo diferencial de padecer ccr y otros cánceres en población colombiana.
Recomendaciones y perspectivas futuras
El ccr, de acuerdo con la tendencia observada en Latinoamérica, se ubicará muy pronto en el segundo lugar de incidencia y mortalidad en el sexo femenino, favorecido por el desarrollo social y económico de la región, los riesgos hormonales-reproductivos y los hábitos dietarios que conducen a la obesidad y su continuo metabólico, la diabetes mellitus tipo 2.
En Colombia, es necesario adelantar estudios multicéntricos de cohorte prospectivo y de corte trasversal, que incluyan muestras poblacionales más grandes y heterogéneas, tanto de áreas urbanas y rurales a nivel nacional, para dilucidar el panorama epidemiológico de la diabetes y con ello tomar medidas concertadas en salud pública, para lograr su control eficaz. Además, es urgente la creación del registro único de diabetes de Colombia, lo cual permitirá identificar los grupos poblaciones y las geografías con mayores necesidades de intervención.
Es claro que la pandemia de obesidad, vinculada con el ccr, ya sea directamente o con el paso previo por la diabetes mellitus, se debe abordar con políticas de salud pública. Las intervenciones deben orientarse a materializar las acciones que están propuestas en el “Plan decenal del control del cáncer 2012-2021” que priorizó el ccr [54]. Además, deben incluirse, en la prevención secundaria, la tamización con sangre oculta por prueba inmunoquímica y la realización de colonoscopia, de ser procedente cada dos años, a todos los pacientes mayores de 25 años con diagnóstico de diabetes mellitus tipo 2 de mínimo cinco años de evolución.
Igualmente, sería conveniente implementar, en Colombia, programas de prevención de factores de riesgo para ecnt, con mayor énfasis en diabetes y cáncer, acompañados de un programa más agresivo para la detección temprana del ccr en pacientes menores de 50 años -sin riesgo heredofamiliar aparente-, en especial en el grupo con dmt2 y en aquellos que reciben tratamiento crónico con insulina, que integre la realización de marcadores bioquímicos y genético-moleculares útiles en la detección de los estadios precursores e iniciales del ccr.
Otra contingencia que ayudaría a un mayor entendimiento de la asociación entre dmt2 y ccr es la realización de investigación traslacional en las diferentes poblaciones de Colombia, que revele interacciones entre factores ambientales y de comportamiento, medicamentos y polimorfismos genéticos funcionales para la etiología del primer paso tumoral, es decir, los adenomas en colon y recto. Por otro lado, también es conveniente ahondar en la conducción de estudios prospectivos sobre DMT2 y CCR en población colombiana, si consideramos que la comorbilidad de dmt2 empobrece los desenlaces y la supervivencia global del paciente con ccr.
En este sentido, es menos claro si la dmt2 en individuos con ccr es expresión del tratamiento farmacológico o es una complicación per se del ccr. Por tanto, es necesario conducir estudios de epidemiología molecular y básicos experimentales, tendientes a dilucidar los efectos biológico-moleculares de la insulina y de otros grupos de hipoglicemiantes en el desarrollo del ccr en individuos con dmt2. Además, merece nuestra atención el estudio del papel de las hormonas sexuales en el desarrollo del ccr en personas con dmt2.
El presente manuscrito no viola las normas éticas internaciones en materia de publicación, por parte de los autores y los coautores, ni tampoco compromete a las instituciones de filiación de los autores