Introducción
El virus de la inmunodeficiencia humana (VIH) fue aislado por primera vez en 1983 y se identificó como agente causal del síndrome de inmunodeficiencia adquirida (SIDA) en 1984. Es un retrovirus RNA de cadena sencilla y envuelto, posee una transcriptasa reversa que le confiere la capacidad de integrar su genoma a las células del hospedero [1]. Esta infección fue reconocida inicialmente en usuarios de drogas intravenosas, receptores de transfusiones sanguíneas y pacientes con hemofilia, con la posterior confirmación de su transmisión por fluidos corporales como sangre, leche materna, semen y secreciones vaginales [1,2].
La infección presenta un curso crónico, periodo de incubación largo, activa replicación en el sistema nervioso central y gran tropismo por linfocitos CD8 + / CD4 +. La replicación del virus produce inmunosupresión por la destrucción de este tipo de células, sumado a otros mecanismos inmunes que aumentan el riesgo de infecciones oportunistas, tumores y otras manifestaciones clínicas [2,3].
El VIH/SIDA constituye un grave problema de salud pública mundial, con más de 32 millones de fallecimientos por esta causa. Debido al mejoramiento de las estrategias de prevención, diagnóstico y tratamiento, se ha convertido en un problema de salud crónico, que permite aumentar la sobrevida de los infectados. No obstante, persisten barreras para el diagnóstico y tratamiento oportuno; por ello, anualmente se presentan cerca de 80 000 muertes por esta causa y 1,7 millones de nuevas infecciones [2].
En este contexto, los bancos de sangre constituyen un pilar fundamental de las políticas de salud, al ser parte integral del plan de respuesta ante el VIH/SIDA de la Organización Mundial de la Salud (OMS) y de la estrategia mundial para el suministro de sangre segura [2,4-6]. Los bancos de sangre efectúan una tamización oportuna; en los casos positivos, direccionan a los pacientes para recibir tratamiento, y realizan algunas actividades de vigilancia epidemiológica de infecciones que no se tamizan regularmente en población general [6,7]. En este orden de ideas, la tamización del VIH es fundamental para identificar posibles casos, tratar la infección y prevenir su transmisión [2,8].
Desde 1985, se han desarrollado numerosas pruebas diagnósticas [1,9,10], que en la actualidad se clasifican en ensayos de detección de anticuerpos, de antígenos (p24) y cuantificación de ácidos nucleicos virales. El ensayo de inmunoabsorción ligado a enzima (ELISA) es el más usual para la detección de anticuerpos o antígenos del VIH. Esta técnica ha evolucionado desde los ensayos de primera generación, basados en lisados virales que permitían la detección de inmunoglobulina G (IgG), a las pruebas de segunda generación, que incorporan antígenos de péptidos recombinantes o sintéticos; las de tercera generación detectan IgG e IgM, y las de cuarta generación determinan simultáneamente anticuerpos, antígeno p24 y subgrupos de VIH, reduciendo la ventana inmunológica [8-11].
A lo anterior se suma la gran diversidad de pruebas comerciales existentes, las cuales presentan alta heterogeneidad en los parámetros de evaluación diagnóstica, lo que resulta de gran relevancia para su implementación en los bancos de sangre. Por ejemplo, Tagny et al., en 2011, compararon dos ELISA de tercera generación (Human ELISA HIV-1/-2 y Determine HIV-1/-2) y una de cuarta generación (Genscreen ULTRA HIV Ag-Ac), con resultados de sensibilidad entre el 75,5 y el 100 %; mientras que Sommerfelt et al., en 2004, reportaron sensibilidad entre el 90 y el 97,9 % para la prueba de Bionor® HIV-1&2 [12,13]. Wesolowski et al., en 2011, al comparar cinco pruebas rápidas de tercera generación, hallaron resultados de especificidad entre el 98,4 y el 99,9 %, similar a resultados hallados por Aboud et al., en 2006, que compararon dos ELISA de tercera generación plus (Enzygnost® anti-HIV-1/2 plus y Vironostika HIV Uniform II plus O) y dos de cuarta generación (Murex VIH Ag/Ac y Vironostika HIV Uniform II Ag/Ac), con resultados de especificidad entre 97,9 y 100 % [7,11].
Dicha heterogeneidad en los parámetros de utilidad diagnóstica demuestra la necesidad de llevar a cabo una sistematización de la evidencia existente en este campo, dado que las revisiones sistemáticas permiten agrupar la información disponible, generar evidencia de mejor grado, realizar estimaciones de mayor precisión, identificar el nivel de heterogeneidad en los parámetros evaluados, entre otras ventajas [14,15].
El objetivo de esta investigación fue, por tanto, evaluar la validez diagnóstica del ELISA para el VIH en bancos de sangre, con base en estudios publicados en la literatura científica mundial entre el año 2000 y 2020.
Metodología
Para evidenciar el logro del objetivo de este estudio y demostrar su exhaustividad, calidad metodológica y reproducibilidad, los párrafos siguientes describen las fases de ejecución de esta revisión sistemática y el metaanálisis.
Protocolo de búsqueda y selección de estudio
Se efectuó una búsqueda por especificidad, siguiendo las cuatro fases de la guía PRISMA (“Preferred reporting items for systematic reviews and meta-analyses”) (p1) y las recomendaciones de Cochrane [14,16].
Identificación: se buscaron artículos originales, usando ocho términos, para evaluación diagnóstica (“False Positives”, “False Negatives”, “Negative Predictive Value”, “Positive Predictive Value”, “True Negative”, “True Positive”, “Sensitivity”, “Specificity”), cada uno los cuales se combinó con cuatro términos para banco de sangre (“Blood Banks”, “Blood Banking”, “Blood Donation”, “Blood Donor”), mediante el booleano AND (&), dando lugar a 32 estrategias de búsqueda aplicadas en PubMed, SciELO, Science Direct y Google Scholar (los términos también se buscaron en español). Estos términos fueron obtenidos a través del uso de lenguaje controlado en los tesauros DeCS (Descriptores en Ciencias de la Salud) y Mis (Medical Subject Headings).
Tamización: se incluyeron las publicaciones con los términos de búsqueda en título o resumen, se eliminaron todos los estudios duplicados y se incluyeron aquellos que analizaron los parámetros de evaluación diagnóstica, que la evaluación fuese para VIH, realizados a partir del año 2000 y cuya población objeto de estudio estuviera constituida por donantes de sangre.
Elección: se eliminaron los estudios de diseño de pruebas, evaluaciones analíticas o con información incompleta de los parámetros de validez diagnóstica.
Inclusión: todos los artículos que cumplieron con la fase anterior fueron leídos y valorados para la extracción de las siguientes variables: título, autor, año de publicación, lugar del estudio, tamaño de muestra, tipo de prueba de tamización, estándar o prueba de referencia, verdaderos positivos (donantes VIH con resultado positivo en la tamización) y verdaderos negativos (donantes sin VIH con resultado negativo en la prueba de tamización), falsos positivos (donantes sin la infección, con resultado positivo en la prueba de tamización) y falsos negativos (donantes con la infección, con resultado negativo en la prueba de tamización).
Reproducibilidad y evaluación de la calidad
Se aplicó por duplicado el proceso de búsqueda y extracción de las variables; a priori se determinó que las diferencias se resolverían por consenso.
Se evaluó la calidad metodológica, a través de la guía QUADAS (“Quality Assessment of Diagnostic Accuracy Studies”) (p1) [17].
Plan de análisis
La descripción de las variables se realizó con frecuencias absolutas y separando las tecnologías basadas en detección de antígenos, de anticuerpos y aquellas que hacían detección simultánea de ambos.
Dado el bajo número de estudios con detección de antígenos, estos no fueron metaanalizados.
Para los estudios de detección de anticuerpos y los ensayos de cuarta generación, se llevó a cabo un metaanálisis de efectos aleatorios (dada la alta heterogeneidad estadística), para los parámetros de sensibilidad, especificidad, cociente de probabilidad positivo (CPP) y negativo (CPN), razón de odds diagnóstica (ORD) y curva ROC, con sus intervalos de confianza del 95 %.
El análisis de heterogeneidad se efectuó con el estadístico Q (distribución χ2) de DerSimonian-Laird y el I2 (porcentaje de variabilidad del parámetro evaluado que no es explicado por el azar, cuyos valores superiores a 50 % determinan heterogeneidad entre los estudios).
La incertidumbre (sensibilidad) se estableció mediante el porcentaje de peso de cada estudio sobre el resultado global. Los análisis se realizaron en Meta-DISc (“Metaanálisis de estudios de evaluación de pruebas diagnósticas y de screening”).
Inicialmente, la medida combinada se estimó con los estudios que usaron como estándar otra ELISA o Western Blot, dado que estas dos pruebas son similares en el principio inmunológico de la detección viral. Por lo general, ELISA usa antígenos o anticuerpos totales, mientras que Western Blot incluye varios epítopos que reducen la reactividad cruzada; no obstante, en su aplicación en bancos de sangre, no se esperan diferencias amplias, dado que se aplican a población sin factores de riesgo. Además, se hizo este análisis global, dado que, en la actualidad, se asume como positivo a un paciente con reactividad en dos ELISA diferentes, y solo se adiciona el Western Blot cuando son discordantes [18,19].
Luego de estimar la medida global independiente del tipo de estándar, se efectuó el análisis de subgrupos por tipo de prueba de referencia, es decir, metarregresión para la detección de anticuerpos frente a ELISA, y luego, frente a Western Blot. Posteriormente, se hizo lo mismo para las pruebas de detección simultánea de antígenos y anticuerpos.
Resultados
Con la aplicación de los términos de búsqueda, se obtuvieron más de 400 mil estudios, los cuales se redujeron a 4601 con el filtro de título o resumen; de estos, solo 541 se desarrollaron en bancos de sangre y 15 cumplieron los demás criterios de selección (véase Figura 1].
Los estudios cumplieron cerca del 100 % de los criterios de calidad metodológica; los menos aplicados fueron los ítems referidos a la descripción de la prueba índice (87 %), el reporte de resultados indeterminados (87 %) y el uso de umbrales (93 %). Dos estudios [20,21] evaluaron la validez de la detección de antígenos en 120 infectados y 1023 donantes sanos; en estos, no fue posible estimar una medida combinada, dadas sus diferencias tanto en las pruebas evaluadas como en el estándar usado (véase Tabla 1].
Tabla 1 Descripción de los estudios que evaluaron la validez del VIH
| Autor | Año | País | Estándar | Evaluada | Número de infectados | Número de sanos |
|---|---|---|---|---|---|---|
| Detección de antígenos (Ag) (RNA y p24) | ||||||
| Dogbe [20] | 2015 | Gana | ELISA | Inmunocromatografía | 3 | 297 |
| Ha [21] | 2017 | Corea | PCR | Cobas mpx | 117 | 726 |
| Detección de anticuerpos (Ac) (IgG e IgM) | ||||||
| Sommerfelt [13] | 2004 | Suecia | Western Blot | Western Blot hiv 1/2 | 290 | 450 |
| ELISA | Bionor® hiv-1 & 2 | |||||
| Eller [22] | 2007 | Estados Unidos | Determine | 10 | 930 | |
| Uni-Gold | ||||||
| Western Blot | OraQuick | |||||
| stat-pak | ||||||
| Lyamuya [23] | 2009 | Suecia | ELISA | Determina | 390 | 1043 |
| SD BIOLINE | ||||||
| Uni-Gold | ||||||
| First Response | ||||||
| Stat-Pak Dipstick | ||||||
| Wesolowski(11) | 2011 | Estados Unidos | Western Blot | gs plus | 2202 | 1517 |
| Abbott | ||||||
| VITROS | ||||||
| ADVIA | ||||||
| Multispot | ||||||
| ARN APTIMA VIH-1* | ||||||
| Roche Amplicor hiv-1* | ||||||
| Tinguely [24] | 2014 | Suiza | ELISA | Geenius | 100 | 136 |
| Detección de Ag-Ac (p24, IgM e IgG) | ||||||
| Saville [9] | 2001 | Estados Unidos | ELISA | DUO ULTRA | 126 | 2647 |
| Seyoum [25] | 2005 | Etiopía | Vironostika Uniform II | 14 | 394 | |
| Amplicor dna* | ||||||
| ExaVir Load* | ||||||
| Yeom [10] | 2006 | Korea | LG HIV PLUS | 109 | 1081 | |
| Enzygnost Integral | ||||||
| LG ANTI-HIV 1/2 PLUS+ | ||||||
| Enzygnost anti-hiv 1/2 plus+ | ||||||
| Aboud [7] | Suecia | Enzygnost® anti-hiv-1/2 plus+ | 301 | 1079 | ||
| Vironostika Uniform II plus O+ | ||||||
| VIH MUREX (ELISA) | Murex | |||||
| Vironostika Uniform II | ||||||
| Malm [26] | 2009 | Western Blot | AxSYM | 115 | 148 438 | |
| architect | ||||||
| prism hiv | ||||||
| Tagny [12] | 2011 | Francia | Genscreen ultra | 53 | 147 | |
| PCR | elisa hiv-1/-2+ | |||||
| Determine hiv-1/-2+ | ||||||
| Maity [27] | 2012 | India | Western Blot | ELISA | 40 | 60 |
| Microlisa | ||||||
| Urio [8] | 2015 | Ghana | ELISA | Enzygnost Integral II | 209 | 387 |
| Murex | ||||||
| Vironostika Uniform II |
* Pruebas moleculares que no fueron incluidas en los metaanálisis.
+ Pruebas de tercera generación que no fueron incluidas en los metaanálisis de Ag-Ac.
Cinco estudios evaluaron pruebas de detección de anticuerpos en 2992 infectados y 4076 donantes sanos de Suecia, Suiza o Estados Unidos. En este grupo se evaluó principalmente la validez diagnóstica de ELISA, usando como estándar una ELISA diferente o el Western Blot. En estas investigaciones, la sensibilidad combinada fue 100 % (IC 95 % = 100 %-100 %), la especificidad 98,1 % (IC 95 % = 97,9 %-98,3 %), el CPP 117,59 (IC 95 % = 32,99-419,16), el CPN 0,01 (IC 95 % = 0,00-0,02), la ORD 22 172,09 (IC 95 % = 5942,14-82 731,42) y el área bajo la curva fue del 99,92 % (véase Figura 2].
Forest plot para la sensibilidad de la detección de anticuerpos para VIH.
Forest plot para la especificidad de la detección de anticuerpos para VIH.
Forest plot para la CPP de la detección de anticuerpos para VIH.
Forest plot para la CPN de la detección de anticuerpos para VIH.
Forest plot para la ORD de la detección de anticuerpos para VIH.
Forest plot para la curva ROC de la detección de anticuerpos para VIH.

Figura 2 Metaanálisis ELISA tercera generación VIH. a. Sensibilidad; b. especificidad; c. cociente de probabilidad positivo (CPP); d. cociente de probabilidad negativo (CPN); e. razón de odds diagnóstica (ORD), y f. área bajo la curva ROC.
En la metarregresión, al comparar la detección de anticuerpos usando ELISA como estándar, la sensibilidad combinada fue 99 % (IC 95 % = 98,5 %-99,5 %), la especificidad 97,2 % (IC 95 % = 96,9 %-97,5 %), el CPP 92,3 (IC 95 % = 27,5-309,8), el CPN 0,01 (IC 95 % = 0,01-0,03), la ORD 7065,9 (IC 95 % = 2039,6-24 478,5) y el área bajo la curva 99,9 %. Por su parte, al comparar la detección de anticuerpos frente al Western Blot, la sensibilidad fue 100 % (IC 95 % = 100 %-100 %), la especificidad 97,5 % (IC 95 % = 97,2 %-97,8 %), el CPP 76,1 (IC 95 % = 17,7-327,0), el CPN 0,01 (IC 95 % = 0,00-0,03), la ORD 12 798,6 (IC 95 % = 2285,4-71 675,1) y el área bajo la curva 99,9 %.
Por otra parte, ocho estudios evaluaron pruebas de cuarta generación en 967 infectados y 154 264 sanos (véase Tabla 1]. La sensibilidad combinada para la detección simultánea de antígeno-anticuerpo fue 100 % (IC 95 % = 99,6 %-100 %), la especificidad 100 % (IC 95 % = 99,9 %-100,0 %), el CPP 287,0 (IC 95 % = 67,5-1220,8), el CPN 0,01 (IC 95 % = 0,00-0,02), la ORD 40 740,8 (IC 95 % = 11 939,1-139 023,6) y el área bajo la curva 99,9 % (véase Figura 3].
Forest plot para la sensibilidad de la detección de antígeno-anticuerpo para VIH.
Forest plot para la especificidad de la detección de antígeno-anticuerpo para VIH.
Forest plot para la CPP de la detección de antígeno-anticuerpo para VIH.
Forest plot para la CPN de la detección de antígeno-anticuerpo para VIH.
Forest plot para la ORD de la detección de antígeno-anticuerpo para VIH.
Forest plot para la curva ROC de la detección de antígeno-anticuerpo para VIH.
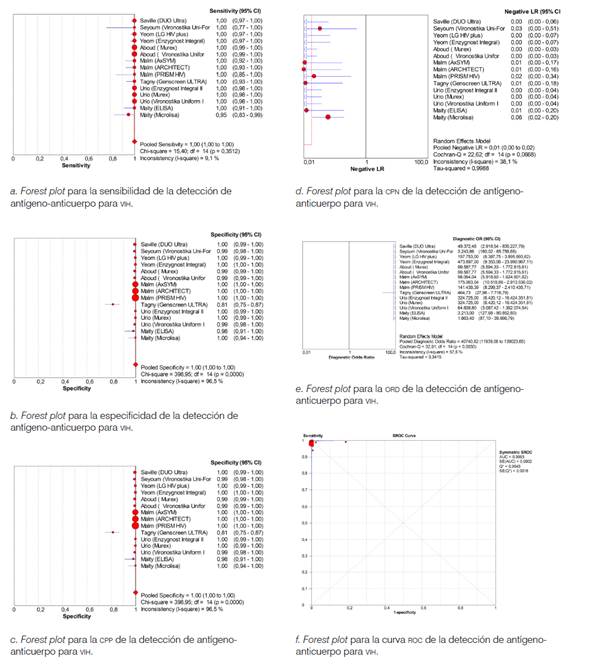
Figura 3 Metanalisis ELISA cuarta generación VIH. a. Sensibilidad; b. especificidad; c. cociente de probabilidad positivo (CPP); d. cociente de probabilidad negativo (CPN); e. razón de odds diagnóstica (ORD), y f. área bajo la curva ROC.
En la metarregresión, al comparar las pruebas de cuarta generación frente a otra ELISA como estándar, la sensibilidad fue 100 % (IC 95 % = 99,8 %-100 %), la especificidad 100 % (IC 95 % = 100 %-100 %), el CPP 203,8 (IC 95 % = 132,8-312,7), el CPN 0,00 (IC 95 % = 0,00-0,01), la ORD 78 100,9 (IC 95 % = 26 846,1-227 211,6) y el área bajo la curva 99,9 %. Mientras que al compararla con el Western Blot, la sensibilidad fue 99,2 % (IC 95 % = 97,1 %-99,9 %), la especificidad 99,9 % (IC 95 % = 99,9 %-99,9 %), el CPP 233,7 (IC 95 % = 8,34-6546,7), el CPN 0,03 (IC 95 % = 0,01-0,07), la ORD 14 069,3 (IC 95 % = 918,73-215 457,60) y el área bajo la curva 99,8 %.
Discusión
El presente metaanálisis sistematizó la evidencia disponible sobre la validez diagnóstica de ELISA de tercera y cuarta generación para VIH, en 3959 infectados y 158 340 sanos. Estos resultados reflejan las ventajas de este tipo de estudios, los cuales permiten extrapolar sus hallazgos con mayor precisión, recopilar la evidencia actual en este campo del conocimiento y generar evidencia de alta calidad para mejorar la toma de decisiones clínicas y epidemiológicas [15,28].
Los resultados demuestran la excelente validez diagnóstica, tanto para las pruebas que detectan anticuerpos (IgG e IgM) como para las pruebas de detección simultánea de antígenos y anticuerpos (p24, IgG e IgM), con valores cercanos al 100 % para la sensibilidad y la especificidad. Estos hallazgos ratifican que la proporción de resultados falsos positivos o negativos en este tipo de pruebas tiende a cero, lo que, sumado a los índices combinados de CPP (cociente de la sensibilidad con la proporción de falsos positivos), CPN (cociente de la proporción de falsos negativos con la especificidad), la ORD (razón entre el CPP y el CPN como reflejo de la capacidad de discriminar entre sanos y enfermos) y el área bajo la curva (o relación de proporción de verdaderos positivos versus la proporción de falsos positivos), conforman la excelente capacidad para discriminar entre sanos e infectados, mediante estas pruebas de inmunodiagnóstico [29-33].
Pese a las similitudes estadísticas de los resultados de la evaluación diagnóstica para las pruebas de tercera y cuarta generación, se debe considerar que esta última tiene mayores ventajas, dado que permiten disminuir la ventana inmunológica entre 4 y 7 días, lo que brinda mayor seguridad en las unidades de sangre [7,8,34].
Estos hallazgos dan cuenta de la excelente validez, rendimiento y seguridad de las pruebas de tercera y cuarta generación en la detección del VIH en los bancos de sangre, su gran relevancia en contextos clínicos y su rol determinante para cumplir las metas 90-90-90 fijadas por las Naciones Unidas para el manejo del VIH; específicamente, el propósito de eliminar la epidemia para el año 2030. Además, muestran que se podría dar cumplimiento a la primera meta 90, que consiste en lograr que el 90 % de los infectados conozcan su verdadero estado de salud, ya que aproximadamente el 21 % de las personas infectadas no lo conocen [35,36].
Lo anterior toma mayor relevancia en países de bajos y medianos ingresos, donde la cobertura de la tamización no es adecuada para identificar a personas con riesgo como adolescentes y jóvenes, de tal forma que los bancos de sangre pueden ayudar a mejorar falencias de los programas de vigilancia epidemiológica del VIH, mediante la detección de casos probables y el direccionamiento para su correcto tratamiento y seguimiento [35-37]. Esto se alinea con las estrategias de la OMS, al plantear que los servicios de detección del VIH deben incluir tres pilares: 1) brindar asesoría (información previa y asesoría posterior a las pruebas realizadas); 2) garantizar la calidad de los resultados y vincular a las personas infectadas con servicios de salud para prevenir la transmisión de la enfermedad; y 3) brindar tratamiento oportuno y otros servicios de apoyo (principios de las cinco C esenciales de la OMS: consentimiento, confidencialidad, consejo, correctos resultados y conexión a los servicios de salud) [38].
Entre las principales limitaciones de este metaanálisis se encuentra la dificultad para identificar la causa clínica o epidemiológica de la heterogeneidad de los resultados, dado que el reporte de otras variables que permitieran realizar metarregresiones fue deficiente en los estudios. Además, es importante remarcar que los estudios sistematizados no incluyen algunas tecnologías recientes que se aplican en los bancos de sangre, y muestra resultados más afines a las pruebas de tamización que se aplican en población general, por lo cual es necesario mejorar los estudios en esta área, con evaluaciones diagnósticas de tecnologías más actuales y específicas de los bancos de sangre.
Conclusión
Esta investigación muestra que las pruebas de inmunoabsorcion de tercera y cuarta generación cuentan con una excelente validez, desempeño y utilidad diagnóstica para la tamización del VIH en donantes de sangre, lo que permite garantizar la inocuidad de las unidades captadas y el acercamiento a los servicios de salud de los donantes positivos, y de este modo contribuye al cumplimiento de algunas metas fijada por las Naciones Unidas.