Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biomédica
versão impressa ISSN 0120-4157versão On-line ISSN 2590-7379
Biomédica (Bogotá) v.24 n.4 Bogotá dez. 2004
Terapia combinada como estrategia en la prevención de la resistencia a los antimaláricos
Pamela Orjuela, Iveth González, Lyda Osorio
Centro Internacional de Entrenamiento e Investigaciones Médicas, CIDEIM, Cali, Colombia
.La resistencia de Plasmodium falciparum a los antimaláricos es uno de los factores responsables del deterioro de la situación de la malaria en el mundo, que surge como resultado de la selección y posterior transmisión de mutantes espontáneos del parásito con susceptibilidad reducida a un fármaco. La terapia combinada es considerada como la principal estrategia para el control de la resistencia a los antimaláricos; actualmente, las terapias combinadas que incluyen derivados de la artemisinina son las más recomendadas. En Colombia se ha usado terapia combinada antimalárica por más de 20 años pero se desconoce su impacto en prevenir la diseminación de la resistencia. En este artículo se revisan las bases teóricas y los estudios clínicos que sustentan el uso de la terapia combinada y se discute su utilización en Colombia.
Palabras clave: malaria, Plasmodium falciparum, antimaláricos, resistencia, terapia combinada, artemisinina.
Combination therapy as a strategy to prevent antimalarial drug resistance
Resistance of Plasmodium falciparum to antimalarials is considered one of the factors responsible for the impairment of the malaria treatment and control worlwide. Resistance emerges as a result of selection and then disemination of spontaneous mutant parasites with reduced drug susceptibility. Combination therapy is considered as the main strategy to control antimalarial drug resistance. Currently, combination therapies that include artemisinin derivatives are highly recommended. Combination therapy has been used in Colombia for more than 20 years; however, its impact on preventing the dissemination of drug resistance is unknown. This paper reviews the theoretical bases and clinical studies that support the use of combination therapy.
Key words: malaria, Plasmodium falciparum, antimalarials, resistance, combination therapy, artemisinin.
La malaria es la enfermedad parasitaria de mayor morbilidad y mortalidad en el mundo. En América la transmisión se presenta en 21 países donde se estima que, aproximadamente, 201 millones de personas viven en áreas con algún riesgo de transmisión (1). A pesar de la implementación de estrategias para su erradicación y control, en los últimos años se ha presentado un incremento progresivo del número de casos de malaria e, incluso, su reaparición en áreas geográficas donde había sido erradicada (2).
Entre los factores que se han considerado como responsables del deterioro del control de la enfermedad a nivel mundial se incluye el surgimiento y la dispersión de cepas de Plasmodium falciparum resistentes a los antimaláricos (2-4). Los primeros casos de falla terapéutica a la cloroquina, el medicamento de uso más extendido, se informaron en la década de 1950 en Suramérica y el sureste asiático (5,6). Desde entonces, se han reportado niveles variables de resistencia a este medicamento en todas las áreas endémicas para la malaria, excepto algunas regiones de Centroamérica, el Caribe y el Medio Oriente (2,4). Este problema no es exclusivo para la cloroquina, ya que también se ha reportado resistencia a otros antimaláricos de primera y segunda línea, tales como la sulfadoxina-pirimetamina, la amodiaquina, la mefloquina, la quinina y a la combinación fija atovaquona-proguanil (Malarone®) (7-12).
Se han propuesto diferentes estrategias para el control de la resistencia a los antimaláricos (7,13,14) entre las cuales figuran la vigilancia del surgimiento y la dispersión de la resistencia, el fomento del uso adecuado de los medicamentos (óptima formulación y adherencia) y la terapia antimalárica combinada (3,15,16).
La terapia combinada se ha utilizado para el tratamiento de la tuberculosis, la lepra, el cáncer y, más recientemente, el VIH. En malaria el efecto preventivo del surgimiento de la resistencia a los antimaláricos mediante el uso combinado de medicamentos fue ampliamente demostrado en los años 90 por Peters et al. en ensayos in vitro y en el modelo en ratones (17-21). Sin embargo, la disponibilidad de opciones combinadas efectivas es limitada y su uso se ve restringido aún más debido a su alto costo relativo (3,15,22).
En Colombia, la terapia combinada antimalárica ha sido utilizada por varios años. No obstante, se desconoce cuál ha sido su efecto en retardar el surgimiento y la diseminación de la resistencia y, más aún, si es necesario considerar otras alternativas combinadas de tratamiento a las existentes actualmente en el país. Esta revisión examina las bases teóricas que sustentan el uso de la terapia combinada como estrategia clave en la prevención del surgimiento y la diseminación de la resistencia de P. falciparum a los antimaláricos, se discuten las terapias combinadas actuales y, finalmente, los factores que se deben tener en cuenta en su implementación.
Para la elaboración de esta revisión de tema se realizó una búsqueda de la literatura publicada que incluyó libros, artículos científicos, revisiones de tema y reportes técnicos. La búsqueda de los documentos se realizó a través de la base de datos bibliográficos (PubMed) del National Center for Biotechnology Information de la National Library of Medicine. Las otras bases de datos bibliográficos que se consultaron fueron las de la Organización Mundial de Salud, la Organización Panamericana de la Salud y la Biblioteca Científica Electrónica del Brasil (SciELO) ( Scientific Electronic Library Online). Los reportes publicados se identificaron utilizando palabras clave en inglés y español, tales como: malaria y terapia combinada, malaria y eficacia in vivo y terapia combinada, malaria y ensayos in vitro y combinaciones de drogas, malaria y artemisinina, malaria y resistencia a drogas, malaria y quimioterapia. También se consultaron las bibliografías citadas en los artículos revisados.
Los datos no publicados fueron generados dentro del marco de estudios de eficacia terapéutica de antimaláricos realizados por el Grupo de Malaria del CIDEIM. La adquisición de los documentos se realizó a través de su acceso gratuito en internet y en las bibliotecas del CIDEIM, el Instituto Nacional de Salud de Colombia y la Escuela de Higiene y Medicina Tropical de Londres.
Resistencia de Plasmodium falciparum a los Antimaláricos
Definición y surgimiento de la resistencia
La resistencia a los antimaláricos se define como la habilidad de una cepa de un parásito para sobrevivir, multiplicarse o ambos a pesar de la administración y la absorción de un fármaco en dosis iguales o mayores a las recomendadas, pero dentro de los límites de tolerancia del paciente (10). Esta resistencia surge como resultado de mutaciones espontáneas del parásito que pueden afectar el acceso, la estructura o la actividad del blanco de un fármaco. Los parásitos mutantes son seleccionados si la concentración del fármaco es suficiente para inhibir el crecimiento de parásitos sensibles pero inadecuada para inhibir aquéllos con sensibilidad reducida o resistentes; este fenómeno se denomina presión de selección (10). Dentro de este contexto, las mutaciones espontáneas son eventos atípicos y, por tanto, su probabilidad de presentación es mayor según aumenta la biomasa de una infección (23). Las infecciones con altas densidades parasitarias son comunes en pacientes no inmunes, en los cuales, un cuadro de malaria aguda puede presentar entre
109 y 1013 formas asexuales del parásito, correspondientes a parasitemias del orden de 0,001% a 10% (15,24). Si se asume una distribución aleatoria de mutantes, un paciente con una parasitemia del 1% presenta una probabilidad 1.000 veces mayor de albergar un parásito mutante resistente que un paciente con una parasitemia de tan sólo 0,001%. Del mismo modo, este paciente presenta una probabilidad menor de desarrollar una inmunidad que elimine sus parásitos (sensibles y resistentes) y al ser sintomático recibe un tratamiento que genera presión de selección.Varios factores influyen en la selección de parásitos resistentes, principalmente aquellos relacionados con las interacciones medicamentohospedero y medicamento-parásito como se describe a continuación.
El papel de la farmacocinética y la farmacodinamia de los antimaláricos en la resistencia
La farmacocinética se refiere al conjunto dinámico de procesos (absorción, distribución, metabolismo y eliminación) que permiten que un fármaco se encuentre en concentraciones terapéuticas en la sangre. La farmacodinamia tiene que ver con la relación entre la concentración de este fármaco y su efecto en el parásito, así como la magnitud con la que se alcanza este efecto (25). Ambos procesos son clave en la selección de parásitos resistentes (24).
Entre los parámetros farmacocinéticos, el más importante para la selección de parásitos resistentes es el tiempo de vida media (T
1/2). El T1/2 se define como el tiempo que debe transcurrir para que se reduzca a la mitad el nivel de un fármaco en la sangre (25). La mayoría de los antimaláricos tienen T1/2 prolongado: cloroquina, 1 a 2 meses; mefloquina, 2 a 3 semanas; sulfadoxina, 10 días, y pirimetamina, 3 días, mientras que antimaláricos como la quinina, 16 horas, o los derivados de la artemisinina, 45 minutos, presentan T1/2 cortos (26). Los antimaláricos con T1/2 prolongados tienen una mayor probabilidad de seleccionar parásitos resistentes que aquéllos con T1/2 cortas.Cuando se administran fármacos con T
1/2 prolongada, la presión de selección puede ocurrir durante dos eventos: 1) cuando los parásitos de una nueva infección se encuentran con concentraciones subterapéuticas de los fármacos que se administraron en una infección primaria, las cuales pueden llegar a inhibir parásitos altamente sensibles pero no parásitos con sensibilidad reducida o resistentes, y 2) cuando los parásitos de una infección primaria logran sobrevivir al tratamiento inicial, usualmente en bajas densidades, y, posteriormente, se ven expuestos a concentraciones subterapéuticas del medicamento que ofrecen la oportunidad a aquellos parásitos con sensibilidad reducida o resistentes (pero no a aquéllos altamente sensibles) de multiplicarse (24). En contraste, cuando se usan fármacos de T1/2 corta los parásitos sobrevivientes o aquéllos procedentes de una nueva infección no se ven expuestos al medicamento y, por tanto, la presión de selección sobre los parásitos mutantes con baja sensibilidad o resistentes es mínima.De esta manera, los antimaláricos de T
1/2 prolongada como la cloroquina, la sulfadoxinapirimetamina o la mefloquina tienen una mayor probabilidad de seleccionar parásitos resistentes que la quinina o los derivados de la artemisinina cuya T1/2 es corta. Entre menor sea el T1/2, menor es la probabilidad de seleccionar parásitos resistentes, como es el ejemplo del antimalárico de formulación fija clorproguanil-dapsona, que con un T1/2 de 2 días presenta una menor probabilidad de seleccionar parásitos resistentes que la sulfadoxina-pirimetamina (3,15).Además de las características farmacocinéticas del medicamento, otro factor que afecta el surgimiento de la resistencia es su farmacodinamia. El principal objetivo de los antimaláricos consiste en eliminar los parásitos de una infección; sin embargo, la diferencia en la farmacodinamia de los antimaláricos hace que no todos presenten la misma eficacia frente al parásito en sus diversos estadios. Cuando los fármacos ejercen su efecto máximo pueden disminuir la biomasa parasitaria en un rango que varía entre 100 y 10.000 veces por ciclo asexual (15). La tasa de reducción parasitaria obtenida al dividir la biomasa inicial de una infección por la biomasa de la misma a las 48 horas de recibir tratamiento, es un buen estimador de la potencia de un antimalárico. De esta manera, los derivados de la artemisinina que presentan una tasa de reducción parasitaria de 104 por ciclo asexual son considerablemente más potentes que otros medicamentos, como la doxiciclina o la clindamicina, con una tasa de reducción parasitaria de tan sólo 10 (23).
El efecto selectivo sobre algunos estadios específicos del parásito también influye de manera significativa en la respuesta clínica y parasitológica del paciente a su tratamiento. Por ejemplo, los medicamentos antifolatos, tales como la sulfadoxina-pirimetamina y el proguanil, actúan frente a los estadios de trofozoíto maduro y esquizonte temprano, mientras que las quinoleínas y sus relacionados como la qiuinina, la mefloquina, la cloroquina y la amodiaquina, presentan una mayor eficacia sobre el estadio de trofozoíto joven. Así, la eliminación de los parásitos se alcanza con mayor rapidez cuando se administran antimaláricos que actúan frente a estadios tempranos del parásito, como la cloroquina que actúa con mayor rapidez que la sulfadoxinapirimetamina (15). Por su parte, los derivados de la artemisinina producen la respuesta terapéutica más potente y rápida que cualquier otro antimalárico existente en la actualidad. Estos compuestos presentan un amplio espectro de acción sobre los estadios asexuales de P. falciparum debido a que actúan desde los estadios de anillo joven hasta el esquizonte maduro. Las formas de esquizonte resultan ser relativamente resistentes a la mayoría de los antimaláricos, lo cual puede ocasionar recrudescencias. Dentro de este contexto, la infección de un paciente sólo se erradicará si las concentraciones de los fármacos que se administraron exceden la concentración requerida para mantener la multiplicación del parásito por debajo de 1 hasta que el último parásito haya sido eliminado (esta concentración equivale a la concentración mínima inhibitoria - CMI - o aquélla necesaria para inhibir el 99% de los parásitos en la infección - IC
99) o hasta que el número de parásitos descienda a niveles tales que puedan ser eliminados por el sistema inmunológico del paciente (15).La persistencia de parásitos de una infección primaria puede evitarse con el uso de medicamentos potentes que actúen frente a varios estadios del parásito. Si esto no es posible y después de una infección primaria aún se encuentran parásitos sobrevivientes, la selección de aquéllos resistentes podría reducirse al usar medicamentos de T
1/2 corta. Estos últimos también reducen la probabilidad de seleccionar parásitos con sensibilidad reducida o resistentes procedentes de una nueva infección. Sin embargo, una consideración importante es que los medicamentos de T1/2 corta usualmente requieren dosis repetidas que afectan la adherencia del paciente al tratamiento y, por tanto, su eficacia.Diseminación de la resistencia
La resistencia a los antimaláricos sólo se disemina e incrementa si los parásitos mutantes resistentes son transmitidos satisfactoriamente a nuevos hospederos. Así, en teoría, la diseminación de la resistencia está dada principalmente por: 1) la diversidad genética de las poblaciones de parásitos en el área endémica; 2) el número de picaduras infectivas o tasa de inoculación entomológica como una medida de la intensidad de la transmisión, y 3) la estabilidad de la transmisión (23,27). En las áreas donde existe una amplia diversidad genética de Plasmodia y coexisten parásitos sensibles y resistentes, la recombinación de diferentes aislamientos, la cual ocurre en el intestino del mosquito infectado, disminuye la probabilidad de diseminación de la resistencia. Si la diversidad genética es baja, la probabilidad de recombinación genética se disminuye y los clones resistentes tienden a permanecer en las poblaciones, siempre y cuando el hecho de ser resistente no implique cambios que alteren su probabilidad de supervivencia ( fitness).
La velocidad con que ocurre la diseminación de la resistencia depende de la intensidad de la transmisión. La mayor intensidad de transmisión en África podría explicar la rápida diseminación de resistencia a los antimaláricos en este continente. La intensidad de la transmisión, por su parte, también determina otros factores que afectan la diseminación de la resistencia como el desarrollo de la inmunidad clínica y, así, el número de parásitos expuestos a medicamentos (presión de selección) y la respuesta inmune de la población (premunición) capaz de eliminar bajos niveles de parásitos (27).
Se ha observado que en las áreas donde la transmisión de la malaria es inestable (especialmente en epidemias), las biomasas parasitarias suelen ser altas y, por lo general, las infecciones son causadas por clones únicos (resistentes o sensibles) lo cual disminuye la recombinación y aumenta la probabilidad de diseminar clones resistentes (24). Por ejemplo, en la región fronteriza entre Tailandia y Myanmar, la resistencia a la mefloquina emergió rápidamente.
Este fenómeno se presentó en una zona donde el promedio de infecciones era bajo (2 a 3 infecciones por persona en el año), existía un control estricto sobre el uso de la mefloquina y en la ausencia presuntiva de automedicación (28).
En las diferentes áreas endémicas de malaria, los factores epidemiológicos, del hospedero, del medicamento y del parásito interactúan para favorecer el surgimiento y la diseminación de la resistencia o para no hacerlo. Mientras se comprende mejor este fenómeno y el peso relativo de cada uno de estos factores en la evolución de la resistencia a los antimaláricos, se requiere la implementación de medidas para su control. La utilización de la terapia combinada es la estrategia más recomendada.
Terapia combinada para la prevención de la resistencia
Definición de terapia combinada
Actualmente, la principal estrategia para la prevención de la resistencia a los antimaláricos ha sido el uso de la terapia combinada. La Organización Mundial de la Salud (OMS) define como terapia antimalárica combinada: "el uso de dos o más medicamentos esquizonticidas con modos independientes de acción y diferentes blancos bioquímicos en el parásito" (29). No se consideran como terapias combinadas aquellas combinaciones que incluyen antibióticos (como quinina-tetraciclina), medicamentos con eficacia esquizonticida tisular o gametocitocida (como la primaquina) o el uso de combinaciones fijas consideradas como un solo producto cuyos componentes individuales no pueden ser utilizados como monoterapia debido a su ineficacia o susceptibilidad a la resistencia (como la sulfadoxina-pirimetamina, la atovaquona-proguanil y la clorproguanil-dapsona). Para efectos de esta revisión, se considera la definición de la OMS.
Raciocinio de la terapia combinada antimalárica
La resistencia resulta de mutaciones genéticas espontáneas del parásito y la probabilidad de que se desarrolle resistencia simultánea a dos fármacos con modos independientes de acción es el producto entre la frecuencia individual de mutaciones y la biomasa parasitaria total de la infección. Por ejemplo, si 1 de 10
8 parásitos es resistente al fármaco A y 1 de 108 parásitos es resistente al fármaco B, entonces tan sólo 1 en 1016 parásitos será resistente simultáneamente a los fármacos A y B. Teniendo en cuenta que la biomasa parasitaria de una infección varía entre 108 y 1012, esta probabilidad se ve aún más reducida (23,30). De esta forma, mediante el uso de la terapia combinada se reduce el número de fallas al tratamiento por parásitos resistentes y se aumenta la eficacia terapéutica. La terapia combinada también tiene un impacto en el control de la resistencia al reducir la probabilidad de que se transmitan satisfactoriamente parásitos resistentes a nuevos hospederos (7).En el éxito y el tiempo de vida útil de la terapia combinada influyen principalmente dos factores discutidos previamente: el T
1/2 y la tasa de reducción parasitaria de los fármacos utilizados en la combinación (15,23). Las monoterapias con fármacos que presentan baja tasa de reducción parasitaria y T1/2 prolongados, tales como la cloroquina, la sulfadoxina-pirimetamina y la mefloquina son potencialmente aptas para seleccionar parásitos que presentan sensibilidad reducida a concentraciones subterapéuticas del fármaco (figura 1a) (22). Por el contrario, en la terapia combinada cuando se utilizan medicamentos con tiempos disímiles de eliminación, como en el caso de mefloquina más artesunato, el artesunato que presenta un T1/2 corto y una alta tasa de reducción parasitaria elimina un alto porcentaje de la biomasa inicial de la infección dentro de las primeras horas de haber comenzado el tratamiento. Los parásitos sobrevivientes a la acción del artesunato serán eliminados por la acción de la mefloquina que presenta un T1/2 mayor con un riesgo mínimo de seleccionar parásitos resistentes (22,23,31) (figura 1b). Sin embargo, el inconveniente de estas terapias radica en que en las áreas de alta transmisión los parásitos resistentes provenientes de nuevas infecciones pueden ser seleccionados al encontrarse con dosis subterapéuticas de mefloquina en la sangre. Por este motivo, idealmente, en las terapias combinadas se deben utilizar medicamentos con propiedades farmacocinéticas similares. Por ejemplo, cuando se utiliza la combinación de amodiaquina más sulfadoxina-pirimetamina todos los parásitos son eliminados antes de que pueda presentarse resistencia simultánea a ambos medicamentos (figura 1c). Además, durante las reinfecciones, si ambos fármacos son eliminados de manera similar ninguno ejercerá presión de selección sobre los parásitos que no hayan sido eliminados por la acción del fármaco que se eliminó primero, tal y como sucede cuando se utilizan terapias combinadas con antimaláricos con T1/2 disímiles (32).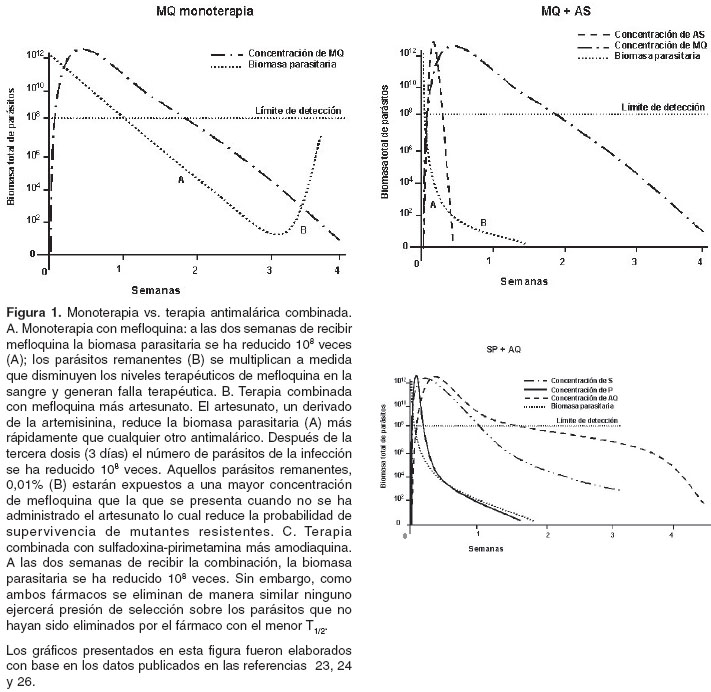
Derivados de la artemisinina en la terapia combinada antimalárica
Con base en los resultados de los ensayos de sensibilidad in vitro y la eficacia clínica que han demostrado las combinaciones que incluyen derivados de la artemisinina, la OMS recomienda el uso de terapias combinadas que incluyan estos compuestos (29). La importancia de los derivados de la artemisinina radica en sus propiedades farmacológicas: 1) reducen en 98% la biomasa parasitaria de una infección dentro de las primeras 4 horas de su administración y, debido a su corto T1/2, la oportunidad de seleccionar parásitos resistentes por concentraciones subterapéuticas es mínima; 2) han demostrado ser seguros y eficaces frente a cepas de P. falciparum multirresistentes (29,33,34); 3) reducen la transmisión de la enfermedad al disminuir la infectividad postratamiento como consecuencia de la rápida y eficaz destrucción de los estadios sanguíneos jóvenes del parásito e impidir que éstos lleguen a diferenciarse en gametocitos (21,35,36), y 4) hasta el momento no se ha reportado resistencia a ninguno de estos compuestos in vitro ni in vivo (29,35,37,38).
Debido a su seguridad y eficacia, los antimaláricos más utilizados en combinación con los derivados de la artemisinina han sido la mefloquina, la amodiaquina y la sulfadoxina-pirimetamina (37) (cuadro 1). Actualmente, algunas de estas combinaciones se utilizan en países del sureste asiático (10) y de Suramérica, tales como Perú y Bolivia (1). En Colombia, los derivados de la artemisinina no se han introducido oficialmente a los esquemas de tratamiento para la malaria (39).
De las combinaciones mencionadas, la de artesunato más mefloquina ha sido la terapia combinada más evaluada in vivo (40-44) y la experiencia de su uso en Tailandia representa un buen ejemplo del impacto positivo que ha tenido su implementación. En este país, la cloroquina fue reemplazada por la sulfadoxina-pirimetamina como monoterapia de primera línea para el tratamiento de la malaria en 1973 (45). Debido al rápido surgimiento de la resistencia a este medicamento, en 1984 se introdujo la mefloquina a una dosis única de 15 mg/kg en combinación con la sulfadoxina-pirimetamina (44). Sin embargo, cuatro años más tarde, los ensayos de sensibilidad in vitro y los estudios de eficacia clínica demostraron una reducción del 75% en la eficacia de la combinación mefloquina más sulfadoxina-pirimetamina. Con base en estos resultados, el esquema de tratamiento se reemplazó por mefloquina como monoterapia a una dosis única de 25 mg/kg. Este tratamiento resultó ser muy eficaz durante su introducción en 1990; sin embargo, para 1994 el número de fallas ya superaba el 50% (45). A partir de la eficacia in vitro e in vivo que demostró la combinación de mefloquina más artesunato sobre aislamientos de P. falciparum multirresistentes, a finales de 1994 se instauró el uso de esta combinación en Tailandia. Mediante la administración de mefloquina (25 mg/kg), en dosis única, y artesunato (12 mg/kg en dosis total), en un esquema de tres días, para 1998 las tasas de curación ya habían aumentado a 100%; desde entonces se ha presentado un descenso progresivo en la incidencia de la malaria por P. falciparum (44).
Con base en la experiencia en Tailandia, la información generada por otros estudios de eficacia clínica y como respuesta a la situación actual de la resistencia a los antimaláricos, la OMS ha realizado un llamado a los países que usan monoterapias para que cambien sus políticas de tratamiento a terapias combinadas basadas, preferiblemente, en algún derivado de la artemisinina (cuadro 1).
Otras terapias combinadas
La única terapia combinada actual recomendada por la OMS que no incluye derivados de la artemisinina es amodiaquina más sulfadoxinapirimetamina. Esta combinación se ha reservado estrictamente a regiones donde la eficacia a amodiaquina y a sulfadoxina-pirimetamina es alta y para aquellos países en los cuales, por diversos factores, no es posible la implementación de terapias combinadas que incluyan derivados de la artemisinina. Sin embargo, algunas desventajas que limitan el uso de amodiaquina más sulfadoxina-pirimetamina, incluyen:
El número de países en los que se presenta eficacia a ambos medicamentos es limitado (en África se limita al occidente del continente) y es de esperase que aquellos países en donde su eficacia está comprometida, el tiempo de vida útil de la combinación sea corto.
Aun en áreas donde la eficacia a amodiaquina y a sulfadoxina-pirimetamina es alta, el mal uso de la combinación puede comprometer la vida terapéutica de ambos medicamentos y, por lo tanto, atentar contra su uso potencial en una terapia combinada que incluya derivados de la artemisinina.
En África, en la actualidad no existe reemplazo para la sulfadoxina-pirimetamina como tratamiento preventivo intermitente, por tanto, antes de comprometer su tiempo de vida útil en una terapia combinada sin derivados de la artemisinina, su uso debe ser reservado para el tratamiento preventivo intermitente (46).
Debido a su ineficacia o al riesgo que representa su utilización en la selección de parásitos resistentes, la OMS no recomienda el uso de algunas terapias combinadas cuadro 2).

Terapia combinada antimalárica en Colombia
Aunque en Colombia la terapia combinada antimalárica ha sido utilizada desde hace más de 20 años, el país no es ajeno al problema de la resistencia y junto con el aumento progresivo en la incidencia de malaria, se ha informado también el aumento de la resistencia de P. falciparum a los antimaláricos. Seguramente si esta estrategia no se hubiera implementado en Colombia el problema de la resistencia sería aún más serio de lo que ya es hoy.
Los primeros casos de P. falciparum resistentes a la cloroquina se informaron en Colombia en 1961 (6) y en 1981 se introdujo su uso combinado con sulfadoxina-pirimetamina. En los años 90, los estudios clínicos realizados en la Costa Pacífica y en el departamento de Antioquia (Urabá y Bajo Cauca) informaron niveles de falla terapéutica a la cloroquina entre el 40% y el 77% (47-51). Debido a su ineficacia, el Misterio de Salud de Colombia, en el 2000, recomendó reemplazar la cloroquina por la amodiaquina en combinación con sulfadoxina-pirimetamina como primera línea de tratamiento para la malaria no complicada por P. falciparum. Sin embargo, para ese entonces se conocía poco respecto a la eficacia de la amodiaquina y la sulfadoxina-pirimetamina y, actualmente, existen pocos estudios de la eficacia de esta combinación (González IJ, Murillo T. Evaluación de la eficacia terapéutica y de la seguridad de la combinación de amodiaquina con sulfadoxina/pirimetamina en el tratamiento de malaria no complicada por Plasmodium falciparum en el municipio de Tadó, Chocó, en la Costa Pacífica colombiana. Informe final. Organización Panamericana de la Salud, 2002, y referencia 52).
En 1998, los estudios de eficacia de la amodiaquina realizados en Antioquia (donde este medicamento se ha utilizado de manera combinada y restringida desde la década de los 90) demostraron niveles de fallas entre el 3% y el 7% (48,49) mientras que los trabajos realizados por el Cideim entre 1999 y 2002 reportaron la presencia de 2/2 fallas en Leticia (Amazonas) y niveles de fallas en Tumaco (Nariño) del 50% (González IJ, Murillo T. Evaluación de la eficacia terapéutica y de la seguridad de la combinación de amodiaquina con sulfadoxina/pirimetamina en el tratamiento de malaria no complicada por Plasmodium falciparum en el municipio de Tadó, Chocó, en la Costa Pacífica colombiana. Informe final. Organización Panamericana de la Salud, 2002, y González IJ. Desarrollo de la capacidad de detección de la resistencia in vivo a drogas antimaláricas en Plasmodium falciparum de la Costa Pacífica colombiana. Informe final de resultados a Colciencias y el Ministerio de Salud, 2001).
Los niveles de falla a la amodiaquina mayores del 25%, nivel por encima del cual se recomienda el cambio del medicamento (2,10), fueron inesperados en la Costa Pacífica debido al corto tiempo de introducción y a la restricción comercial que existe sobre este medicamento en el país. Sin embargo, los estudios de sensibilidad in vitro de aislamientos de campo de P. falciparum de la Costa Pacífica colombiana ya informaban niveles de resistencia del 35,3% a este medicamento (Murillo C et al. Evaluación de la sensibilidad in vitro de aislamientos de Plasmodium falciparum de la Costa Pacífica colombiana a cinco antimaláricos. Tercer encuentro nacional de investigaciones en enfermedades infecciosas. Popayán, 2002, y referencia 53). La presencia de fallas a la amodiaquina en Colombia se podría atribuir a la presión de selección por su uso previo de manera inadecuada o por su resistencia cruzada con la cloroquina, ya que ambos medicamentos pertenecen a la misma familia de antimaláricos (52). No obstante, la eficacia de la amodiaquina en zonas de moderada resistencia a la cloroquina ha sido previamente demostrada (32,54).
La sulfadoxina-pirimetamina ha sido utilizada a nivel mundial como segunda opción de tratamiento para la malaria después de la cloroquina y, actualmente, es la primera línea de tratamiento para la malaria no complicada por P. falciparum en algunos países de África. En Colombia, la resistencia a sulfadoxina-pirimetamina surgió rápidamente y poco después de su introducción se demostró la presencia de fallas en la cuenca amazónica (55) y en otras regiones del país en niveles variables entre el 6% y el 13% (48,49,51,56). Dos estudios recientes realizados en Tumaco y en Antioquia en los que se evaluó la sulfadoxina-pirimetamina como monoterapia, demostraron considerables niveles de falla a este medicamento entre el 15% y el 26%, respectivamente (52,57). El aumento del número de fallas con respecto a estudios previos sugiere que su uso inadecuado como monoterapia ante la ineficacia de la cloroquina, cuando ambos medicamentos eran utilizados en combinación, probablemente permitió el surgimiento de resistencia a este medicamento. A pesar de los niveles moderados de resistencia a la sulfadoxina-pirimetamina, en la actualidad, su uso sigue siendo recomendado en combinación con la amodiaquina (39).
En África, la combinación de amodiaquina más sulfadoxina-pirimetamina ha demostrado ser altamente eficaz frente a la monoterapia con sulfadoxina-pirimetamina y frente a otras terapias combinadas, tales como cloroquina más sulfadoxina-pirimetamina y sulfadoxinapirimetamina más artesunato (32,58,59). No obstante, en el 2002 un estudio de eficacia clínica de amodiaquina más sulfadoxina-pirimetamina realizado en el municipio de Tadó, Costa Pacífica colombiana, encontró niveles significativos de falla terapéutica del 10,8%, a pesar de que esta combinación no había sido utilizada antes en la región (González IJ, Murillo T. Evaluación de la eficacia terapéutica y de la seguridad de la combinación de amodiaquina con sulfadoxina/pirimetamina en el tratamiento de malaria no complicada por Plasmodium falciparum en el municipio de Tadó, Chocó, en la Costa Pacifica colombiana. Informe final. Organización Panamericana de la Salud, 2002).
Los altos niveles de falla a tratamiento de la amodiaquina como monoterapia y la presencia de fallas a la combinación amodiaquina más sulfadoxina-pirimetamina indican que la vida útil de esta combinación probablemente será corta bajo la dosificación actual (25 mg/kg de amodiaquina divididos en 3 días). Por lo tanto, es necesario continuar vigilando la eficacia de la combinación y de sus componentes en diferentes áreas del país, así como nuevas terapias combinadas.
Consideraciones en la implementación de la terapia combinada
La terapia combinada, en teoría y según lo demostrado en Tailandia, es una estrategia útil para la prevención de la resistencia, pero su utilidad en el campo depende de cómo se lleve a cabo su implementación. Con el fin de conservar la eficacia de la terapia combinada y disminuir la presión de selección sobre parásitos resistentes, su implementación se debe realizar siempre dentro del marco de un sistema de farmacovigilancia (60). A través de la farmacovigilancia es posible: 1) diseñar y ejecutar a nivel nacional y regional políticas de tratamiento acordes con la situación particular de las zonas endémicas (61); 2) velar por la disponibilidad y la calidad de los medicamentos que le están siendo administrados a los pacientes, y 3) combatir la automedicación, la mala dosificación y la baja adherencia (1,3,7). Los factores contemplados en este último numeral son fundamentales para proteger la vida útil de la terapia combinada. Así, la adherencia del paciente a su tratamiento bajo los esquemas recomendados es estrictamente necesaria (29,43). Tanto el incumplimiento del régimen prescrito como la mala dosificación conducen a fallas terapéuticas debido a las concentraciones subóptimas de los medicamentos que, además, resultan propicias para seleccionar parásitos resistentes. A la adherencia contribuyen la eficacia y seguridad de los medicamentos que se están administrando para lo cual resulta indispensable la utilización de antimaláricos con la menor cantidad de efectos adversos posibles. El logro de tratamientos de corta duración y dosificaciones sencillas también contribuye de manera importante en la adherencia (29). Dentro de este contexto, idealmente, los medicamentos deberían ser formulados en una tableta única que, además, presentara un aspecto agradable y un buen sabor. Sin embargo, debido a los altos costos a los que conlleva esta clase de formulaciones muchas veces estos medicamentos no se encuentran disponibles para los países donde la malaria es endémica (23,62).
Terapia combinada una inversión a largo plazo
El costo de los medicamentos antimaláricos es uno de los principales factores que determinan su uso y, por consiguiente, el uso de las terapias combinadas (7,29). Sin embargo, el aumento en los costos a corto plazo representa un ahorro hacia el futuro. El uso de la monoterapia conduce inevitablemente al surgimiento de recrudescencias y al aumento de los casos de malaria grave, lo cual incrementa los costos en términos de hospitalización y retratamientos con medicamentos de segunda o tercera línea, como la quinima y la mefloquina que suelen ser más costosos, sin contar, con el impacto en la salud pública del aumento en la morbilidad y mortalidad. Por ejemplo, en Colombia, el Ministerio de la Protección Social encargado de proveer los medicamentos de manera gratuita, paga aproximadamente Col$740 por un tratamiento de primera línea (amodiaquina más sulfadoxinapirimetamina) para un episodio de malaria no complicada por P. falciparum en un paciente adulto. Si este paciente presenta falla en su tratamiento recibirá uno de segunda línea con quinina más clindamicina que le costará al Estado casi 10 veces más (Col$7.000) que el tratamiento anterior o 7 veces más (Col$5.120) si le es administrada la mefloquina como monoterapia. Así, el tratamiento de las recaídas es siempre más costoso y, de ahí, la importancia de mantener la eficacia a través del uso combinado de los pocos antimaláricos económicos que existen en la actualidad. Por el contrario, mediante el uso de terapias combinadas eficaces se mejoran las tasas de curación y se reducen la morbilidad asociada con fallas a tratamiento, la mortalidad y la transmisión, lo cual reduce, por consiguiente, los costos asociados al control de la enfermedad (15,23).
Conclusión
Entre otros factores, puede afirmarse que el uso inadecuado de los antimaláricos ha contribuido a la ineficacia progresiva de la monoterapia de malaria. En el mejor de los casos, cuando un antimalárico falla, otro es introducido. No obstante, las alternativas quimioterapéuticas actuales son reducidas y la evolución de la resistencia en P. falciparum sobrepasa el desarrollo de nuevos fármacos (7); la diseminación de la resistencia a los antimaláricos podría prevenirse especialmente mediante el uso de la terapia combinada. Sin embargo, debido a la existencia de barreras logísticas y económicas, la implementación de la terapia combinada se ha visto limitada en la mayoría de los países donde la malaria es endémica. No obstante, deben realizarse los esfuerzos necesarios para la adopción de terapias combinadas eficaces basadas preferiblemente en derivados de la artemisinina ya que, por el momento, es la única herramienta que parece contribuir de manera significativa a reducir la transmisión de la malaria y a prevenir el surgimiento y la dispersión de la resistencia a los antimaláricos.
Agradecimientos
Esta revisión contó con el apoyo económico del Programa Especial para la Investigación y el Entrenamiento en Enfermedades Tropicales del UNDP/World Bank /WHO (proyecto 981015). Las autoras agradecen a Nancy Saravia, directora científica del CIDEIM, por su revisión crítica y a Enrique Pinzón del Ministerio de la Protección Social por la información suministrada. Pamela Orjuela es joven investigadora de Colciencias (contrato No. CT042-2001).
Correspondencia:
Lyda Osorio, Centro Internacional de Entrenamiento e Investigaciones Médicas, CIDEIM, Avenida 1N # 3-03, Cali, Colombia.
Teléfono: (2) 668 2164; fax: (2) 667 2989.
Recibido: 03/06/04; aceptado: 01/10/04
Referencias
1. Organización Panamericana de la Salud. Informe de la situación de la malaria en las Américas. 26ª Conferencia Sanitaria Panamericana. 54ª sesión del Comité Regional. CSP26/INF/3 (Esp.). Washington, D.C., 2002. 12 de septiembre de 2003 Consultado en http://www.paho.org/Spanish/GOV/CSP/csp26-inf3-s.pdf [ Links ] 2. Organización Mundial de la Salud. WHO expert Committee on malaria: twentieth report. Technical Report Series No. 892. Geneva: WHO; 2000. p.3-7, 27-31. 3. Bloland P, Ettling M, Meek S. Combination therapy for malaria in Africa: hype or hope? Bull World Health Organ 2000;78:1378-88. [ Links ] 4. Wongsrichanalai C, Pickard AL, Wernsdorfer WH, Meshnick SR. Epidemiology of drug resistant malaria. Lancet Infect Dis 2002;2:209-18. [ Links ] 5. D'Alessandro U, Buttiens H. History and importance of antimalarial drug resistance. Trop Med Int Health 2001; 6:845-8. [ Links ] 6. Moore DV, Lanier JE. Observations on two Plasmodium falciparum infections with abnormal response to chloroquine. Am J Trop Med Hyg 1961;10:5-9. [ Links ] 7. Bloland P. Drug resistance in malaria. World Health Organization: Department of Communicable Disease Surveillance and Response, 2001. WHO/CDS/CSR/DRS/2001.4. 5 de mayo 5 de 2003. Consultado en
8. Fivelman QL, Butcher GA, Adagu IS, Warhurst DC, Pasvol G. Malarone treatment failure and in vitro confirmation of resistance of Plasmodium falciparum isolate from Lagos, Nigeria. Malar J 2002;8:1. [ Links ]
9. McIntosh HM. Chloroquine or amodiaquine combined with sulfadoxine-pyrimethamine for treating uncomplicated malaria. Cochrane Database Syst Rev 2000;2:CD000386. [ Links ]
10. Organización Mundial de la Salud. The use of antimalarial drugs. Report of a WHO informal consultation. WHO/CDS/RBM/2001.33. Geneva: WHO; 2001. p.5-136.
11. Segurado AA, di Santi SM, Shiroma M. In vivo and in vitro Plasmodium falciparum resistance to chloroquine, amodiaquine and quinine in the Brazilian Amazon. Rev Inst Med Trop Sao Paulo 1997;39:85-90. [ Links ]
12. Staedke SG, Kamya MR, Dorsey G, Gasasira A, Ndeezi G, Charlebois ED et al. Amodiaquine, sulfadoxine/pyrimethamine, and combination therapy for treatment of uncomplicated falciparum malaria in Kampala, Uganda: a randomized trial. Lancet 2001;358: 368-74. [ Links ]
13. Phillips RJ. Current status of malaria and potential for control. Clin Microbiol Rev 2001;14:208-26. [ Links ]
14. Talisuna AO, Bloland P, D'Alessandro U. History, dynamics, and public health importance of malaria parasite resistance. Clin Microbiol Rev 2004;17:235-54. [ Links ]
15. White NJ. Delaying antimalarial drug resistance with combination chemotherapy. Parassitologia 1999;41: 301-8. [ Links ]
16. Winstanley P. Modern chemotherapeutic options for malaria. Lancet Infect Dis 2001;1:242-50. [ Links ]
17. Peters W. The prevention of antimalarial drug resistance. Pharmacol Ther 1990;47:499-508. [ Links ]
18. Peters W. The chemotherapy of rodent malaria. LVII. Drug combinations to impede the selection of drug resistance. Part 1: Which model is appropriate? Ann Trop Med Parasitol 1999;93:579-87. [ Links ]
19. Peters W, Robinson BL. The chemotherapy of rodent malaria. LVIII. Drug combinations to impede the selection of drug resistance. Par t. 2: The new generationartemisinin or artesunate with long-acting blood schizontocides. Ann Trop Med Parasitol 2000;94:23-35. [ Links ]
20. Peters W, Robinson BL, Stewart LB, Butcher GA. The chemotherapy of rodent malaria. LIX. Drug combinations to impede the selection of drug resistance. Part 3: Observations on cyproheptadine, an antihistaminic agent, with chloroquine. Ann Trop Med Parasitol 2000;94:689-97. [ Links ]
21. Warhurst DC, Chawira AN, Robinson BL, Peters W. The effect of combinations of qinghaosu (artemisinin) with standard antimalarial drugs in the suppressive treatment of malaria in mice. Trans R Soc Trop Med Hyg 1987;81:554-8. [ Links ]
22. White NJ, Olliario P. Strategies for prevention of antimalarial drug resistance: rationale for combination therapy for malaria. Parasitology Today 1996;12:399-401. [ Links ]
23. Nosten F, Brasseur P. Combination therapy for malaria: the way forward? Drugs 2002;62:1315-29. [ Links ]
24. White NJ. Antimalarial drug resistance and combination chemotherapy. Phil Trans R Soc Lond B 1999;354:739-49. [ Links ]
25. Benet LZ, Kroetz DL, Sheiner LB. Pharmacokinetics: the dynamics of drug absorption, distribution, and elimination. En: Hardman JG, Limbird LE, Molinoff PB, Ruddon RW, Gilman AG, editors. Goodman and Gilman's The Pharmacological Basis of Therapeutics. 9th ed. New York: McGraw-Hill; 1996. p.3-27. [ Links ]
26. White NJ. Clinical pharmacokinetics of antimalarial drugs. Clinical Pharmacokinetics 1985;10:187-215. [ Links ]
27. White NJ. Preventing antimalarial drug resistance through combinations. Drug resistance updates 1998; 1:3-9. [ Links ]
28. Nosten F, ter Kuile F, Chongsuphajaisiddhi T, Luxemburger C, Webster HK, Edstein M et al. Mefloquine-resistant falciparum malaria on the Thai-Burmese border. Lancet 1991;337:1140-3. [ Links ]
29. Organización Mundial de la Salud. Antimalarial drug combination therapy. Report of a WHO informal consultation: WHO/CDS/RBM/2001.35. 2001. Geneva: WHO; 2001. p.6-36. [ Links ]
30. White NJ, Nosten F, Looareesuwan S, Watkins MW, Marsh K, Snow RW et al. Adverting a malaria disaster. Lancet 1999;353:1965-7. [ Links ]
31. Barradell LB, Fitton A. Artesunate: a review of its pharmacology and therapeutic efficacy in the treatment of malaria. Drugs 1995;50:714-41. [ Links ]
32. Gasasira A, Dorsey G, Nzarubara B, Staedke S, Nassali A, Rosenthal P et al. Comparative efficacy of aminoquinoleine-antifolate combinations for the treatment of uncomplicated falciparum malaria in Kampala, Uganda. Am J Trop Med Hyg 2003;68:127-32. [ Links ]
33. Duarte EC, Fontes CJ, Gyorkos TW, Abrahamowicz M. Randomized controlled trial of artesunate plus tetracycline versus standard treatment (quinine plus tetracycline) for uncomplicated Plasmodium falciparum malaria in Brazil. Am J Trop Med Hyg 1996;54:197-202. [ Links ]
34. Kevin CK, Shaks D, Keystone J. Malaria chemoprophylaxis in the age of drug resistance I. Currently recommended drug regimens. Clin Infect Dis 2001;33: 226-34. [ Links ]
35. Meshnick SR, Taylor TE, Kamchonwongpaisan S. Artemisinin and the antimalarial endoperoxides: from herbal remedy to targeted chemotherapy. Microbiol Rev 1996;60:301-15. [ Links ]
36. Targett G, Drakeley C, Jawara M, Deslein von L, Coleman R, Deen J et al. Artesunate reduces but does not prevent posttreatment transmission of Plasmodium falciparum to Anopheles gambiae. J Infect Dis 2001;183:1254-9. [ Links ]
37. Adjuik M, Babiker A, Garner P, Olliaro P, Taylor W, White N, International Artemisinin Study Group. Artesunate combinations for treatment of malaria. Lancet 2004:363:9-17. [ Links ]
38. Rosenthal P. Antimalarial chemotherapy: mechanisms of action, resistance, and new directions in drug discovery. First edition. Totowa: Human Press; 2001. p.194. [ Links ]
39. Ministerio de Salud de Colombia. Guía de atención médica para el diagnóstico y tratamiento de la malaria. Resolución N° 0412 de 2000; capítulo 37. [ Links ]
40. Bunnan D, Kanda J, Karbwang K, Thimasarn S, Pungpak S, Harinasuta T. Artemether-mefloquine combination in multidrug resistant falciparum malaria. Trans R Soc Trop Med Hyg 1995;89:213-5. [ Links ]
41. Bwijo B, Bjorkman A, Alin Mh, Abbas N, Wernsdorfer W. Efficacy of artemisinin and mefloquine combinations against Plasmodium falciparum. In vitro simulation of in vivo pharmacokinetics. Trop Med Int Health 1997;2:461-7. [ Links ]
42. Hien T, Arnold K, Hung P, Loc N, Dung T, Cuong L et al. Single dose artemisinine-mefloquine treatment for acute uncomplicated malaria. Trans R Soc Trop Med Hyg 1994;88:688-91. [ Links ]
43. Nosten F, Luxemberg C, Kuile O, Woodrow J, Chongsuphajaisiddhi T, White N. Treatment of multidrug resistant Plasmodium falciparum with 3-d artesunate-mefloquine combination. J Infect Dis 1994; 170:971-7. [ Links ]
44. Nosten F, van Vugt M, Price R, Luxemburger C, Thway KL, Brockman A et al. Effects of artesunatemefloquine combination on incidence of Plasmodium falciparum malaria and mefloquine resistance in western Thailand: a prospective study. Lancet 2000;356:297-302. [ Links ]
45. Thimasarn K. Report on situation analysis of malaria drug resistance. Bangkok, Thailand: Malaria Division, Ministry of Public Health; 1994. [ Links ]
46. Organización Panamericana de la Salud. Position of WHO's Roll Back Malaria, 2003. Department on Malaria Treatment Policy. Agosto 20 de 2003. Consultado en http://www.paho.org/English/AD/DPC/CD/mal-whoposition-paper.htm. [ Links ] 47. Blair S. Resistencia de Plasmodium a drogas en Colombia 1961-1986. Biomédica 1986;6:3-4. [ Links ] 48. Blair S, Lacharme LL, Fonseca JC, Tobón A. Resistance of Plasmodium falciparum to 3 antimalarials in Turbo (Antioquia, Colombia), 1998. Rev Panam Salud Pública 2001;9:23-9. [ Links ] 49. Blair S, Lacharme LL, Carmona F. Resistance of Plasmodium falciparum to antimalarial drugs in Zaragoza (Antioquia, Colombia). Mem Inst Oswaldo Cruz 2002;97:401-6. [ Links ] 50. Castillo CM, Osorio LE, Palma GI. Assessment of therapeutic response of Plasmodium vivax and Plasmodium falciparum to chloroquine in a malaria transmission free area in Colombia. Mem Inst Oswaldo Cruz 2002;97:559-62. [ Links ] 51. Osorio LE, Giraldo LE, Grajales LF, Arriaga AL, Andrade AL, Ruebush TK et al. Assessment of therapeutic response of Plasmodium falciparum to chloroquine and sulfadoxine-pyrimethamine in an area of low malaria transmission in Colombia. Am J Trop Med Hyg 1999;61:968-72. [ Links ] 52. González JI, Padilla CJ, Giraldo LE, Saravia N. Eficacia de amodiaquina y sulfadoxina-pirimetamina en el tratamiento de malaria no complicada por Plasmodium falciparum en Nariño, Colombia 1999-2002. Biomédica 2003;23:38-46. [ Links ] 53. González IJ, Varela R, Murillo C, Ferro B, Salas J, Giraldo LE et al. Polymorphisms in Cg2 and pfcrt genes and in vitro resistance to chloroquine and other antimalarials in Plasmodium falciparum isolates from Colombia. Trans R Soc Trop Med Hyg 2003;3:318-24. [ Links ] 54. Brasseur P, Guiguemde R, Diallo S, Guiyedi V, Kombila M, Ringwald P et al. Amodiaquine remains effective for treating uncomplicated malaria in West and Central Africa. Trans R Soc Trop Med Hyg 1999; 93:645-50. [ Links ] 55. Espinal C, Cortés GT, Guerra P, Arias A. Sensivity of Plasmodiun falciparum to antimalarial drugs in Colombia. Am J Trop Med Hyg 1985;34:675-80. [ Links ] 56. Espinal C, Uribe LM, Eslava A, Rodríguez M. Resistencia del Plasmodium falciparum a la combinación sulfadoxina-pirimetamina: descripción de los 3 primeros casos en Colombia. Biomédica 1981;1:213-7. [ Links ] 57. Blair S, Lopez ML, Piñeros JG, Alvarez T, Tobón A, Carmona J. Eficacia terapéutica de 3 esquemas de tratamiento de malaria no complicada por Plasmodium falciparum, Antioquia, Colombia, 2002. Biomédica 2003; 23:318-27. [ Links ] 58. Dorsey G, Njama D, Kamya MR, Cattamanchi A, Kyabayinze D, Staedke SG et al. Prevention of increasing rates of treatment failure by combining sulfadoxine-pyrimethamine alone or with amodiaquine or artesunate for treatment of uncomplicated malaria: a longitudinal randomised trial. Lancet 2002:360:2031-8. [ Links ] 59. Dorsey G, Vlahos J, Kamya MR, Staedke SG, Rosenthal PJ. Prevention of increasing rates of treatment failure by combining sulfadoxinepyrimethamine with artesunate or amodiaquine for the sequential treatment of malaria. J Infect Dis 2003;188: 1231-8. [ Links ] 60. Organización Mundial de la Salud. Position of WHO's Roll Back Malaria. 2003. Department on Malaria Treatment Policy. Agosto 20 de 2003 Consultado en
61. Organización Mundial de la Salud-Organización Panamericana de la Salud. Amazonian Network for the Surveillance of Antimalarial Drug Resistance (RAVREDA) in Cooperation with USAID's Amazon Malaria Initiative 2004. Febrero 6 de 2004 Consultado en http://www.paho.org/English/HCP/HCT/MAL/ravreda-ami.htm. [ Links ] 62. Winstanley P. Chemotherapy for falciparum malaria: the armory, the problems and the prospects. Parasitol Today 2000;16:146-53. [ Links ] 63. Chawira AN, Warhurst DC. The effect of artemisinin combined with standard antimalarials against chloroquine-sensitive and chloroquine-resistant strains of Plasmodium falciparum in vitro. J Trop Med Hyg 1987; 90:1-8. [ Links ] 64. Gupta S, Thapar M, Mariga S, Wernsdorfer W, Bjorkman A. Plasmodium falciparum: in vitro interactions of artemisinin with amodiaquine, pyronaridine, and chloroquine. Exp Parasitol 2002;100: 28-35. [ Links ] 65. Nguyen MH, Davis TM, Cox-Singh J, Hewitt S, Tran QT, Tran BK et al. Treatment of uncomplicated falciparum malaria in southern Vietnam: can chloroquine or sulfadoxine-pyrimethamine be reintroduced in combination with artesunate? Clin Infect Dis 2003;37: 1461-6. [ Links ] 66. Sutherland CJ, Drakeley CJ, Obisike U, Coleman R, Jawara M, Targett GA et al. The addition of artesunate to chloroquine for treatment of Plasmodium falciparum malaria in Gambian children delays, but does not prevent treatment failure. Am J Trop Med Hyg 2003; 69:19-25. [ Links ] 67. Deen JL, von Seidlein L, Pinder M, Walraven GE, Greenwood BM. The safety of the combination artesunate and pyrimethamine-sulfadoxine given during pregnancy. Trans R Soc Trop Med Hyg 2001;95:424-8. [ Links ] 68. Doherty JF, Sadiq AD, Bayo L, Alloueche A, Olliaro P, Milligan P et al. A randomized safety and tolerability trial of artesunate plus sulfadoxine-pyrimethamine versus sulfadoxine-pyrimethamine alone for the treatment of uncomplicated malaria in Gambian children. Trans R Soc Trop Med Hyg 1999;93:543-6. [ Links ] 69. Dorsey G, Njama D, Kamya MR, Cattamanchi A, Kyabayinze D, Staedke SG et al. Sulfadoxine/ pyrimethamine alone or with amodiaquine or artesunate for treatment of uncomplicated malaria: a longitudinal randomised trial. Lancet 2002;360:2031-8. [ Links ] 70. Adjuik M, Agnamey P, Babiker A, Borrmann S, Brasseur P, Cisse M et al. Amodiaquine-artesunate versus amodiaquine for uncomplicated Plasmodium falciparum malaria in African children: a randomized, multicentre trial. Lancet 2002;359:1365-72. [ Links ] 71. Brockman A, Price RN, Van Vugt M, Heppner DG, Walsh D, Sookto P et al. Plasmodium falciparum antimalarial drug susceptibility on the north-western border of Thailand during five years of extensive use of artesunate-mefloquine. Trans R Soc Trop Med Hyg 2000;94:537-44. [ Links ] 72. Fivelman QL, Walden JC, Smith PJ, Folb PI, Barnes KI. The effect of artesunate combined with standard antimalarials against chloroquine sensitive and chloroquine resistant strains of Plasmodium falciparum in vitro. Trans R Soc Trop Med Hyg 1999;93:429-32. [ Links ] 73. Gupta S, Thapar W, Wernsdorfer H, Bjorkman A. In vitro interactions of artemisinins with atovaquone, quinine, and mefloquine against Plasmodium falciparum. Antimicrob Agents Chemother 2002;46:1510-5. [ Links ] 74. Price RN, Nosten F, Luxemburger C, Vugt V, Phaipum L, Chongsuphajaisiddni T et al. Artesunate and mefloquine treatment of multi-drug resistant falciparum malaria. Trans R Soc Trop Med 1997;91:574-7. [ Links ] 75. De Vries PJ, Bich NN, Van Thien H, Hung LN, Anh TK, Kager PA et al. Combinations of artemisinin and quinine for uncomplicated falciparum malaria: efficacy and pharmacodynamics. Antimicrob Agents Chemother 2000;44:1302-8. [ Links ] 76. Newton PN, Chierakul W, Ruangveerayuth R, Silamut K, Teerapong P, Krudsood S et al. A comparison of artesunate alone with combined artesunate and quinine in the parenteral treatment of acute falciparum malaria. Trans R Soc Trop Med Hyg 2001;95:519-23. [ Links ] 77. Bakshi R, Hermeling-Fritz I, Gathmann I, Alteri E. An integrated assessment of the clinical safety of artemether-lumefantrine: a new oral fixed-dose combination antimalarial drug. Trans R Soc Trop Med Hyg 2000;94:419-24. [ Links ] 78. Novartis. A novel antimalarial combination. One product two concepts: Riamet®, Coartem®. Product monograph 1999. Julio 1 de 2003 Consultado en
79. Trung TN, Davis TM, Hewitt S, Thuan LK, Quang HH, Anh CV et al. Treatment of falciparum malaria in Vietnamese children: the need for combination therapy and optimized dosage regimens. Ann Trop Pediatr 2001; 21:307-12. [ Links ]
80. van Vugt M, Looareesuwan S, Wilairatana P, McGready R, Villegas L, Gathmann I et al. Artemether-lumefantrine for the treatment of multidrugresistant falciparum malaria. Trans R Soc Trop Med Hyg 2000;94:545-8. [ Links ]
81. Hassan A, Bjorkman A, Wernsdorfer W. Synergism of benflumetol and artemether in Plasmodium falciparum. Am J Trop Med Hyg 1999;61:439-45. [ Links ]
82. Medicines for malaria venture. Development project: Pyronaridine artesunate. 2003. Noviembre 24 de 2003 [ Links ]Consultado en http://www.mmv.org/pages/content _frame.asp? thepage =page 1_00030004_8 .htm&Nav=00030004.
83. Ringwald P, Moukoko M, Bickii J, Basco L. In vitro activities of pyronaridine, alone and in combination with other antimalarial Drugs, against Plasmodium falciparum. Antimicrob Agents Chemother 1999;43: 1525-7. [ Links ]
84. Lang T, Greenwood B. The development of Lapdap, an affordable new treatment for malaria. Lancet Infect Dis 2003;3:162-8. [ Links ]
85. Medicines for malaria venture. Development project: Chlorproguanil-dapsone (Lapdap®) + artesunate (CDA). 2003. Noviembre 24 de 2003 Consultado en http://www.mmv.org/pages/content_frame.asp?ThePage=page1_00030004_8.htm&Nav=00030004 [ Links ]
86. Organización Mundial de la Salud. Lapdap: a new antimalarial for Africa. TDRNews 2003 No. 70. Sep. Online. Noviembre 24 de 2003 Consultado en http://www.who.int/tdr/publication/tdrnews/No62june2003news70/lapdap.htm. [ Links ] 87. Winstanley P. Chlorproguanil-dapsone (LAPDAP) for uncomplicated falciparum malaria. Trop Med Int Health 2001;6:952-4. [ Links ] 88. Denis MB, Davis TM, Hewitt S, Incardona S, Nimol K, Fandeur T et al. Efficacy and safety of dihydroartemisinin- piperaquine (Artekin) in Cambodian children and adults with uncomplicated falciparum malaria. Clin Infect Dis 2002;35:1469-76. [ Links ] 89. Karunajeewa H, Lim C, Hung TY, Ilett KF, Denis MB, Socheat D, Davis TM. Safety evaluation of fixed combination piperaquine plus dihydroartemisinin (Artekin) in Cambodian children and adults with malaria . Br J Clin Pharmacol 2004;57:93-9. [ Links ] 90. Tran TH, Dolecek C, Pham PM, Nguyen TD, Nguyen TT, Le HT et al. Dihydroartemisinin-piperaquine against multidrug-resistant Plasmodium falciparum malaria in Vietnam: randomised clinical trial. Lancet 2004;363: 18-22. [ Links ]














