Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biomédica
versão impressa ISSN 0120-4157versão On-line ISSN 2590-7379
Biomédica v.24 supl.1 Bogotá jun. 2004
Perspectivas para nuevas vacunas antituberculosas
en la era posgenómica
Luis F. García, Luis F. Barrera
Grupo de Inmunología Celular e Inmunogenética, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia
.A pesar de que la vacunación con Mycobacterium bovis BCG es el procedimiento más utilizado a nivel mundial para prevenir la tuberculosis, su eficicacia es muy cuestionable, lo cual ha motivado la búsqueda de nuevas opciones inmunoprofilácticas. El conocimiento generado con el secuenciamiento completo de una cepa de Mycobacterium tuberculosis H37Rv y la aplicación de nuevas tecnologías inmunológicas, bioquímicas y genéticas han permitido realizar una disección fina del transcriptoma y el proteoma de M. tuberculosis, lo cual ha generado una gran cantidad de conocimiento sobre la biología de este microorganismo. Dado que alrededor de una tercera parte de la población mundial puede estar infectada con M. tuberculosis y que éste sólo se detecta cuando se inicia la enfermedad, la mayor parte de los esfuerzos se han dedicado al diseño de vacunas posinfección que induzcan un aumento selectivo de la inmunidad celular específica del hospedero a largo plazo, no generen reacciones adversas y sean de bajo costo. Dentro de las nuevas estrategias que están siendo utilizadas para el desarrollo de vacunas, se destaca la utilización de mezclas de proteínas con una alta inmunogenicidad, cepas de M. bovis BCG recombinantes y de M. tuberculosis genéticamente atenuadas o modificadas para inducir una mayor respuesta inmune, y las vacunas de AND desnudo. Los candidatos con más potencial incluyen las vacunas de subunidades micobacterianas, las cuales expresan moléculas ampliamente reconocidas por el sistema inmune y cuyo reconocimiento resulta en el incremento de la respuesta Th1 y aquéllas que utilizan vectores virales diseñados para expresar moléculas micobacterianas antigénicas. Aunque los modelos animales son de valor limitado, puesto que la patología observada en ellos sólo reproduce parcialmente la observada en humanos, los resultados obtenidos con estas vacunas son muy prometedores y algunas están siendo actualmente evaluadas en ensayos clínicos de fase I.
Palabras claves: tuberculosis, vacunas, Mycobacterium tuberculosis
Perspectives for new anti-tuberculous vaccines in the post-genomic era
Vaccination with attenuated Mycobacterium bovis BCG has been used as the routine procedure to immunize against tuberculosis. Since the efficacy of BCG vaccination is very controversial, the search for new immunoprophylatic tools against tuberculosis is an area of intense interest. Knowledge of the complete sequence of Mycobacterium tuberculosis (Mtb) H37Rv genome and the application of new immunological, biochemical and genetic technologies has led to a detailed understanding of the transcriptome and proteome of this bacterium. Approximately one-third of the human population is infected with Mtb; however, the bacillus is only detected once the symptoms appear and therefore most of the recent efforts have been devoted to the development of a post-infection vaccine. In theory, this vaccine (1) will give rise to an increase in the long-lasting specific immunity against Mtb, (2) will not have significant adverse effects, and (3) will be affordable for the people in third world countries. The main strategies that have been developed include the subunit vaccines, either as a mixture of relevant immunogenic proteins or DNA constructs, recombinant strains of Mycobacterium bovis BCG and Mtb, designed to secrete immunogenic proteins or with attenuated virulence, respectively, and DNA-based vaccines. The subunit vaccines are delivered either as mixtures of immunogenic proteins and adjuvants, or as naked DNA or by viral vectors in order to induce a potent Th1 response. Most of these vaccines have been tested in several kinds of animal models, but they do not fully reproduce the human pathology. However, the results obtained so far are very encouraging and have led to the development of phase I trials in humans.
Key words: tuberculosis, vaccines, Mycobacterium tuberculosis
Desde que en 1993 la Organización Mundial de la Salud declaró la tuberculosis como una emergencia mundial, los recursos y el interés por nuevas formas de controlar y tratar la enfermedad han aumentado dramáticamente y 10 años después es posible decir que las posibilidades de alcanzar estas metas son cada vez más cercanas. Los esfuerzos investigativos durante esta década se han centrado básicamente en cuatro campos: 1) mejor comprensión de la patogénesis de la enfermedad y, particularmente, del fenómeno de la infección latente; 2) desarrollo de métodos inmunológicos y moleculares para el diagnóstico rápido y la epidemiología molecular; 3) definición de las vías biosintéticas y metabólicas de la micobacteria que pudieran servir como blanco para el desarrollo de nuevos fármacos antimicobacterianos, y 4) desarrollo de nuevas vacunas que superen la protección brindada por Mycobacterium bovis BCG (BCG). Quizá el mayor logro, que ha permitido avanzar mucho más rápidamente en la búsqueda de estas herramientas, ha sido la secuenciación completa del genoma de Mycobacterium tuberculosis H37Rv, publicado en 1998 (1). La información derivada del genoma de M. tuberculosis ha permitido identificar las diferencias genéticas entre micobacterias virulentas y atenuadas y entre M. tuberculosis y BCG (2). Así mismo, ha sido posible identificar cerca de 4.000 marcos abiertos de lectura (ORF) los cuales conforman el proteoma de M. tuberculosis, muchos de estos ORF corresponden a enzimas involucradas en la síntesis de los glicolípidos de la pared de la micobacteria y, por tanto, son blancos potenciales para el desarrollo de nuevas drogas anti-tuberculosas. Otros ORF corresponden a moléculas antigénicas con potencial para nuevas vacunas. Aunque recientemente se han publicado excelentes revisiones sobre el desarrollo de nuevas vacunas para la tuberculosis (3-7), en la presente revisión retomamos el tema y analizamos los presupuestos básicos para este fin, los enfoques utilizados experimentalmente y los antígenos candidatos estudiados hasta el momento.
¿Por qué una nueva vacuna para la tuberculosis?
La vacuna antituberculosa que actualmente se continúa utilizando en muchos países, incluso Colombia, es la BCG, llamada así en honor a Calmette y Guérin, quienes encontraron que un aislamiento de M. bovis había perdido completamente su virulencia después de 230 subcultivos y que confería protección a la infección con M. tuberculosis virulento. La utilización de esta vacuna fue rápidamente aceptada y la cepa original del Instituto Pasteur se distribuyó ampliamente y se generaron subcepas que, como consecuencia del conocimiento del genoma micobacteriano, se sabe que han ido acumulando diferentes mutaciones y deleciones que han resultado en su divergencia, aunque todas han perdido toda su virulencia. Estudios genéticos recientes han demostrado que todas las cepas de BCG estudiadas son deficientes en una región de 9,5 kb denominada RD1, la cual está presente en M. tuberculosis. Esta región contiene 9 ORF e incluye aquéllos que codifican los antígenos inmunodominantes ESAT-6 y CFP-10. La delección de esta región en M. tuberculosis indujo una disminución significativa de la virulencia (8), mientras que su reintroducción en BCG y Mycobacterium microti resultó en un crecimiento más vigoroso de estos microorganismos en comparación con los controles mutantes (9), lo cual sugiere que esta región puede jugar un papel crítico en la multiplicación de la micobacteria dentro de su hospedero.
Los diferentes estudios sobre la eficacia de la vacunación con BCG han sido inconsistentes. Algunos han mostrado protección hasta del 80%, mientras que otros no han mostrado ninguna protección. El estudio más grande, y quizás mejor controlado, se realizó en el sur de la India durante los años 60 y 70 y no mostró ninguna protección (10). La explicación más aceptada para el fracaso de la BCG en este estudio, y posiblemente en la mayor parte del mundo, es la exposición a micobacterias del medio ambiente que interferirían con la respuesta protectora supuestamente inducida por el BCG. Actualmente, existe consenso en que la BCG sólo proteje de la tuberculosis infantil y, particularmente, de la tuberculosis meníngea; induce una memoria que en la mayoría de los adultos ya se ha perdido, que se manifiesta por la reactividad tuberculínica (hipersensibilidad retardada) que le resta a esta prueba un posible valor diagnóstico. Por estas razones, se acepta la necesidad de nuevas vacunas para la tuberculosis, partiendo de que una vacuna ideal para esta enfermedad debería cumplir los requisitos mostrados en el
cuadro 1. Requisitos ideales de una futura vacuna para tuberculosis.____________________________________________________________________________
- Que sea segura, estable y poco costosa;
- que brinde protección, a nivel mundial, contra la infección y contra la enfermedad; - que proteja con una sola aplicación;
- que induzca memoria inmunológica prolongada (idealmente, de por vida); - que pueda combinarse con otras vacunas en la infancia;
- que no afecte la reactividad tuberculínica.
______________________________________________________________________________
Tomado de: Andersen (4)
Presupuestos básicos
El objetivo de una vacuna es inducir una respuesta inmune protectora. La respuesta inmune contra M. tuberculosis involucra todos los componentes del sistema inmune y se establece con un fino equilibrio entre los mecanismos de protección y los de daño tisular, pues ambos fenómenos son mediados por las mismas células, principalmente los linfocitos T y los macrófagos (11). Idealmente, una vacuna debería ser capaz de inhibir la penetración de la bacteria en las células hospederas y, así, impedir el establecimiento de la infección; sin embargo, en el caso de la tuberculosis este objetivo no parece realista. Para una mejor comprensión de los posibles sitios de acción de una vacuna antituberculosa, la figura 1 muestra nuestra visión panorámica de la respuesta inmune que se presenta en respuesta en esta infección. M. tuberculosis ingresa al organismo por vía aérea y, una vez alcanza el alvéolo pulmonar, es fagocitado por los macrófagos alveolares mediante mecanismos opsónicos y no opsónicos a través de receptores en la membrana de la célula fagocítica (12). Una vez fagocitado, M. tuberculosis se replica en el interior del macrófago, según sea la capacidad innata de éste de inhibir o no a la micobacteria. La muerte de algunas de estas células hospederas por efecto de la infección permite la liberación de micobacterias e induce una reacción inflamatoria que incluye la migración al sitio de nuevas células fagocíticas que van ser infectadas, repitiéndose el ciclo y aumentando la lesión. Existe un consenso entre los investigadores de la respuesta inmune en tuberculosis que, a diferencia de otras infecciones, este proceso inicial de infección de las células fagocíticas mononucleares no es un blanco factible en el desarrollo de vacunas antituberculosas.
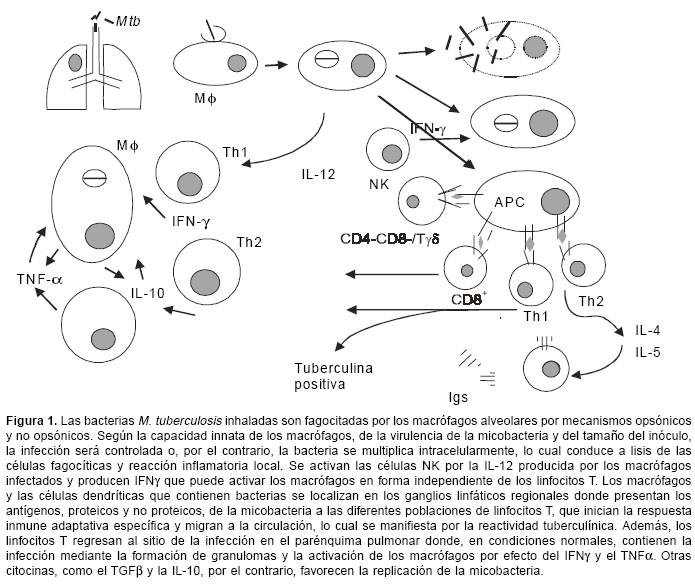
En el transcurso de estas etapas iniciales de la infección, los macrófagos y las células dendríticas infectadas producen citocinas, como la IL-12 y la IL-18, capaces de inducir la producción de IFNg por parte de las células NK en una forma independiente de los linfocitos T (13). Además, los macrófagos y las células dendríticas infectados han migrado a los ganglios linfáticos del hilio pulmonar donde ocurre la presentación de los antígenos de la micobacteria a las diferentes poblaciones de linfocitos T. Las células Tab CD4+ y CD8+ reconocen los antígenos micobacterianos en el contexto de las moléculas de histocompatibilidad clase II y clase I, respectivamente (16,17); las células Tab doblemente negativas (CD4-CD8-) reconocen glicolípidos presentados por moléculas CD1 (18,19) y los linfocitos Tgd reconocen en el humano compuestos pirofosforados de tipo isoprenoides (20). Aunque todos estos linfocitos T reconocen moléculas micobacterianas, proliferan y se diferencian en células efectoras con diferentes funciones, su papel en la respuesta protectora anti-M. tuberculosis no es similar. Las evidencias en modelos experimentales que utilizan ratones con disrupción de genes esenciales para cada subpoblación celular, sugieren que los linfocitos Tgd son importantes en las fases iniciales de la infección y en la organización del granuloma, mientras que los linfocitos T CD8 parecen tener una mayor importancia en las infecciones crónicas o latentes; de tal manera que la célula con un papel más preponderante es el linfocito T CD4+ de tipo Th1, productor de IL-2 e IFNg . Todas las evidencias sustentan el papel fundamental del IFNg en la respuesta protectora anti-micobacteriana, principalmente por su capacidad de incrementar la actividad antimicobacteriana de los macrófagos (11,21). El papel de las respuestas tipo Th1 y del IFNg en la respuesta protectora antimicobacteriana está, además, sustentado en el humano por una mayor susceptibilidad a infecciones por micobacterias en pacientes con mutaciones en los genes de la IL-12, su receptor o el receptor del IFNg (22). Los linfocitos T de tipo Th2, productores de IL-4 e IL-5, son responsables de la activación de los linfocitos B que han reconocido antígenos micobacterianos y de su diferenciación en células plasmáticas productoras de anticuerpos específicos, cuyo papel en la respuesta antimicobacteriana no es aún claro (11).
Las diferentes poblaciones de linfocitos que han sido activados por el reconocimiento de los antígenos de la micobacteria, entran nuevamente en el torrente circulatorio y regresan al parénquima pulmonar donde está localizado el foco de infección activa en el granuloma. Es en esta estructura donde los macrófagos infectados, localizados en el centro del granuloma, son el blanco de las acciones de citocinas producidas por los linfocitos T y por ellos mismos. Algunas de estas citocinas, como el IFNg y el TNFa , son activadoras de la actividad antimicobacteriana, mientras que otras, como la IL-10 y el TGFb , favorecen su replicación. Una vacuna 'preexposición' que induzca respuestas Th1 capaces de eliminar el foco de infección primaria y conferir una fuerte memoria inmunológica que proteja en 'reexposiciones' futuras, sería ideal como reemplazo del BCG en la inmunización de neonatos, pero tardaría un largo tiempo en tener un impacto positivo en la incidencia de la enfermedad. La realidad es que la mayor parte de la humanidad, y principalmente en áreas donde la probabilidad de desarrollar la enfermedad tuberculosa es mayor, ha sido vacunada con BCG, ha estado expuesta a micobacterias del medio ambiente o, adicionalmente, se ha expuesto naturalmente a M. tuberculosis y tiene una infección (no confundir con enfermedad) latente, susceptible de reactivarse en algún momento de la vida. Este hecho hace que las vacunas 'posexposición' deben ser capaces de reactivar la memoria inducida por el BCG y complementarla contra antígenos propios y relevantes de M. tuberculosis, revertir o neutralizar las posibles respuestas inhibitorias inducidas por la exposición a micobacterias ambientales, e inducir una respuesta capaz de detectar la presencia de unos pocos micro-organismos latentes en el interior de un granuloma bien formado. Infortunadamente, existe evidencia de que las vacunas preexposición no protegen cuando se administran posexposición (23).
Los modelos experimentales para la evaluación de las vacunas candidatas
El desarrollo de nuevas vacunas requiere necesariamente de modelos experimentales para evaluar los diferentes candidatos en las varias formas en que se presentan al sistema inmune.
En la actualidad, los modelos animales más utilizados son el ratón y el cobayo y, en menor escala, los primates. Cada uno de estos modelos tiene sus ventajas y sus desventajas. El modelo murino ha sido el más utilizado, dada la disponibilidad de gran número de cepas genéticamente caracterizadas, la existencia de gran cantidad de reactivos específicos y métodos para analizar su respuesta inmune y, por supuesto, el conocimiento acumulado sobre el sistema inmune de esta especie. Sin embargo, las lesiones histopatológicas que se presentan en la infección experimental del ratón no presentan necrosis ni caseificación, las cuales son características de las lesiones en humanos. Las lesiones del cobayo son más parecidas a las de la tuberculosis clínica, pero en esta especie no existe ni la variedad de cepas, ni la cantidad de reactivos, ni el mismo nivel de conocimientos que en los ratones. En cuanto a los primates, aunque serían el modelo ideal dada su similitud al humano, los costos y las facilidades requeridas para manejar estas especies, principalmente una vez que se han expuesto a M. tuberculosis virulento, limitan su uso (7).
Los estudios en modelos animales han permitido establecer algunas conclusiones generales en relación con las vacunas candidatas: 1) las diferentes cepas de BCG utilizadas protegen bien y consistentemente, particularmente en los modelos de infección primaria, una situación similar a la que se presenta en la tuberculosis humana; 2) sólo un pequeño número de vacunas candidatas protege tan bien como el BCG, y un subgrupo de éstas protege mejor; 3) los resultados obtenidos hasta ahora evidencian la necesidad de desarrollar modelos animales que imiten mejor las condiciones de la enfermedad en humanos, por ejemplo, hospederos que hayan sido previamente inmunizados con BCG, expuestos a micobacterias ambientales o estén infectados persistentemente con M. tuberculosis; 4) la mayor parte de los modelos animales permiten estudiar las consecuencias de la infección a corto plazo, y, por tanto, ofrecen información limitada sobre el efecto de la vacunación, y 5) la capacidad predictiva y, consecuentemente, el valor del modelo animal sólo podrá estimarse una vez se comparen los resultados con los ensayos en humanos (3,5). Lo anterior significa que, en la evaluación de nuevas vacunas anti-TB, el BCG sigue siendo el estándar de oro. En los diferentes modelos experimentales, la vacunación con BCG induce una reducción de dos o tres órdenes de magnitud logarítmica en la cantidad de bacterias que se pueden aislar de los órganos infectados (generalmente, se evalúan pulmones, hígado y bazo) pero no se logra la esterilización completa.
En general, las vacunas candidatas ensayadas hasta el momento sólo en condiciones excepcionales superan al BCG, lo que indica que aún no se han encontrado los antígenos apropiados, su preparación óptima o su esquema de administración eficaz.
Nuevos tipos de vacunas
En un programa auspiciado por los National Institutes of Health de los Estados Unidos, se han probado más de 170 vacunas diferentes desde 1997, utilizando como modelos de infección ratones y cobayos expuestos a cantidades bajas de M. tuberculosis en aerosol (7) (Patrick Brennan, comunicación personal). Una primera opción es la utilización de micobacterias vivas, las cuales dada su replicación in vivo tendrían la capacidad de inducir una respuesta contra gran cantidad de antígenos secretados, de pared e, inclusive, citosólicos, además de inducir una fuerte respuesta de memoria (24). Sin embargo, puesto que un número significativo de pacientes inmunocomprometidos requerirían de una vacuna, existe el riesgo de infección diseminada por estas cepas vacunales en dichos individuos. De todas maneras, se ha ensayado la modificación genética del BCG restaurándole la expresión de algunos de los genes que ha perdido en comparación con M. tuberculosis (con el riesgo de que recupere su virulencia), sobreexpresando otros que se consideran relevantes (25-27) o, incluso, expresando algunas citocinas u otras moléculas que pueden modular positivamente la respuesta Th1 (28,29). Vale la pena mencionar el estudio del grupo de Horwitz en cobayos, en el cual utilizando BCG con sobreexpresión de la proteína de 30 kd Ag85 se logró una reducción en el número de colonias aún mayor que la obtenida con el BCG sin modificaciones (30,31). Otros grupos han utilizado vectores no micobacterianos atenuados, como Salmonella y el virus Vaccinia (32).
Otra estrategia, utilizada principalmente por el grupo de Jacobs, ha sido el uso de mutantes auxotróficas (33,34), las cuales son producidas mediante la mutación selectiva en genes involucrados en la síntesis de aminoácidos o mediante mutagénesis por inserción y, por tanto, tienen una disminución en su virulencia como consecuencia de la falta de algunos genes funcionales para la síntesis de factores de crecimiento o de los lípidos de la pared celular, necesarios para la supervivencia de la bacteria.
Los resultados de la infección de ratones inmunocompetentes con cepas de M. tuberculosis deficientes en la síntesis de metionina ( metB), prolina ( proC) o triptófano ( trpD) sugirieron que tanto los genes proC como los trpD son esenciales para la virulencia de M. tuberculosis y que su disrupción podría ser utilizada para la generación de vacunas (24). En otro estudio, un auxótrofo de leucina de BCG confirió protección significativa en ausencia de reactividad a la tuberculina (34).
En un estudio similar con el auxótrofo leuD, incapaz de sintetizar la enzima isopropil malato isomerasa (Rv2987c), ratones inmunizados con el auxótrofo y, luego, confrontados con M. tuberculosis virulento, exhibieron curvas de supervivencia equivalentes a los vacunados con BCG y significativamente mayores que los ratones sin vacunar. Sin embargo, la vacunación con el auxótrofo resultó menos efectiva en la reducción de la cantidad de bacterias en los órganos y en la patología tisular que la BCG (33). Otra estrategia utilizada es la inducción de mutaciones al azar en el genoma de M. tuberculosis y, luego, identificar aquellas mutantes que han perdido la capacidad de crecer en un medio mínimo. Algunos de estos mutantes se han utilizado como vacunas en cobayos con resultados muy variables (35). Infortunadamente, las protecciones alcanzadas no uperan la obtenida con el BCG y la pérdida de virulencia se ha correlacionado con pérdida de la protección ofrecida por estas vacunas. Es posible que nuevos progresos en esta dirección permitan obtener otras mutantes con mejores posibilidades. Finalmente, en relación con el uso de bacterias vivas, vale la pena mencionar la utilización de Mycobacterium microti por vía oral con resultados alentadores (36) y Mycobacterium vaccae con fines vacunales pero con resultados poco satisfactorios (37).
Las vacunas de subunidades micobacterianas representan más del 50% de las ensayadas en el programa antes mencionado. La justificación para estas vacunas es que con unos pocos antígenos puede lograrse la misma protección que se obtiene con la bacteria completa y, por tanto, pudieran obtenerse vacunas seguras, reproducibles y sin problemas para aplicarse a individuos inmunocomprometidos. Los mejores antígenos para este fin son las moléculas secretadas presentes en el filtrado de cultivos que inducen una fuerte respuesta de linfocitos T CD4+ productores de IFNg . Estas moléculas pueden obtenerse a partir de electroeluidos de electroforesis en dos dimensiones de los filtrados que, luego, se identifican por microsecuenciación (38,39) y se ensayan con células de animales infectados o clonas de linfocitos T obtenidas de individuos sanos tuberculino positivos (40-44). Sin embargo, la disponibilidad del genoma micobacteriano ha permitido identificar genes propios de M. tuberculosis (45) y mediante clonaje en vectores de expresión realizar un tamizaje de aquéllos con mayor capacidad de inducir respuestas Th1 y, luego, evaluarlos como candidatos. Otra posibilidad que se ha explorado es la producción de proteínas de fusión que permiten en una sola molécula tener los epítopos relevantes de dos o tres de las subunidades candidatas (46).
La inducción de una respuesta potente con subunidades requiere de su administración con adyuvantes y, de éstos, el más utilizado en humanos es el alumbre, el cual es un fuerte inductor de respuestas Th2; esto significa que deben encontrarse adyuvantes seguros para uso en humanos que favorezcan las respuestas Th1. Algunos de los candidatos incluyen microesferas, derivados del lípido A del lipopolisacárido (LPS), bromuro de dimetildioctadecil amonio (DDA) y la saponina QS21 (43,47-49). También se están probando vectores virales como adyuvantes en la vacunación con BCG. La utilización de un vector adenoviral que expresa GM-CSF (AdGM-CSF) en conjunto con BCG en ratones genéticamente bajos respondedores a BCG, resultó en un incremento significativo de la longevidad y la magnitud de la respuesta Th1, así como en la producción de IFN-g (50).
Una de las posibilidades más atractivas para el desarrollo de nuevas vacunas es la utilización de ADN desnudo la cual ha sido recientemente revisada por Huygen (6). La justificación para la vacunas de ADN es la misma que para las vacunas de subunidades; es decir, que con un número reducido de antígenos puede lograrse una protección adecuada, utilizando vacunas seguras, reproducibles y aplicables a individuos inmunocomprometidos, sin la necesidad de utilizar adyuvantes adicionales, pues el ADN bacteriano tiene propiedades adyuvantes. La estrategia es identificar la proteína inmunogénica, aislar su gen, insertarlo en un plásmido de expresión que posea un gen promotor fuerte, seguido de un sitio de poliadenilación para garantizar la estabilidad de la transcripción en eucariotes. El promotor utilizado generalmente es el IE1, el primer antígeno temprano-inmediato del citomegalovirus seguido por su primer intrón (intrón A). El proceso consiste en transformar bacterias para expandir el plásmido, aislarlo y ensayarlo como vacuna (5,6). Las rutas de inmunización más utilizadas han sido la intramuscular y la cutánea, con las células musculares y los queratinocitos, respectivamente, como blancos aunque las células presentadoras de antígeno presentes en estos tejidos también toman efectivamente los plásmidos. Una vez dentro de las células, los plásmidos se translocan al núcleo, se inicia la transcripción de los genes micobacterianos y la síntesis de los antígenos, que son procesados en forma similar a como ocurre con las infecciones intracelulares. Las vacunas de ADN estimulan la presentación antigénica tanto por la vía endógena en el contexto de las moléculas de histocompatibilidad clase I al inducir potentes respuestas de los linfocitos CD8+, como por la vía exógena por medio de las moléculas de histocompatibilidad clase II, al generar respuestas de los linfocitos CD4+. Además, las células dendríticas pueden fagocitar los miocitos transfectados apoptóticos y presentar los péptidos procesados a los linfocitos CD4+ y CD8+ por el fenómeno de sensibilización cruzada ( cross-priming).
El ADN bacteriano tiene cualidades adyuvantes debido a la presencia de hexanucleótidos que contienen dinucleótidos CpG no metilados flanqueados por dos purinas 5' y dos pirimidinas 3' (el motivo en el humano es GTCGTT, y en los murinos GACGTT) (51). La actividad adyuvante de los CpG se debe a que éstos se unen a los receptores tipo Toll 9 (TLR9) e inducen la producción de IL-12 (que estimula la producción de IFNg por las células NK, y dirigen la respuesta Th1), IFNa , TNFa e IL-6 (52). Es interesante que, después de muchos meses, el patrón de metilación del ADN de los plásmidos inyectados continúa siendo de tipo bacteriano (adenosinas metiladas) lo cual indica que éstos no se replican en las células eucarióticas y que, por lo tanto, su capacidad de hacer recombinaciones homólogas, así como su potencial mutagénico y carcinogénico es muy bajo (53).
Son muchas las vacunas de ADN contra la tuberculosis que se han ensayado experimentalmente; incluyen la proteína de choque térmico 60 (Hsp60) (54-56), el Ag85 (57-59), el MPB83 (60), la Apa (61) , los receptores transportadores de fosfatos (PstS) (62) y aun cocktails (63-65) en diferentes esquemas, bien sea de preinfección o posinfección y por diferentes rutas (intramuscular, aerosol, oral, cutánea) con resultados, en general, prometedores. Sin embargo, el informe reciente de que la vacunación con ADN de Hsp60 de Mycobacterium leprae y Ag85B de M. tuberculosis en ratones y cobayos, puede no conferir protección y, por el contrario, inducir reacciones necróticas graves en el pulmón, obliga a reevaluar las estrategias seguidas hasta el momento (66,67). Una estrategia que ha generado grandes expectativas ha sido propuesta por Reed y colaboradores y consiste en utilizar genes híbridos como el Mtb72F que codifica la proteína Mtb39 PPE y la proteasa de serina de 32 kDa (6) (Patrick Brennan, comunicación personal).
Por último, se han utilizado combinaciones de vacunas, como inmunizar inicialmente con BCG o con vacunas de ADN seguidas de un refuerzo con Ag85 o viceversa, lo cual ha mostrado resultados muy prometedores (32,64,68,69). Para su aplicación al humano, en quienes la vacunación neonatal con BCG tiene coberturas muy altas, y aceptando que tenga un efecto protector en la tuberculosis infantil, se ha propuesto que un refuerzo con una vacuna tipo subunidad o de AND con antígenos como el Ag85 o ESAT-6, pareciera ser una opción bastante prometedora y es la base de algunos estudios clínicos en fase I iniciados recientemente.
El paso a humanos
Como ya se mencionó, apenas comienzan algunos estudios en fase I para evaluar nuevas vacunas antituberculosas. El primer candidato en ser utilizado en estos ensayos es el antígeno Ag85A de M. tuberculosis, expresado en una una cepa deficiente en replicación del virus de la vaccinia (MVA-Ag85A). Otros candidatos incluyen: una cepa de rBCG que sobreexpresa el antígeno Ag85B de M. tuberculosis; una vacuna multicomponente compuesta de una proteína de fusión, Ag72f+/-Ag85; una combinación de varios epítopos inmunodominantes diferentes con un adyuvante y cepas mutantes atenuadas de M. tuberculosis (7). Lógicamente, el paso de los estudios experimentales a los ensayos clínicos requiere una serie de pruebas sobre seguridad, toxicidad, pureza, esterilidad, potencia y estandarización entre lotes. De todas maneras, los avances logrados en la última década y, particularmente, en los últimos 5 años desde que se publicó el genoma de M. tuberculosis, han sido muy significativos y ya es posible avizorar que en los próximos años dispondremos de herramientas inmunológicas para prevenir y controlar una enfermedad que creíamos del pasado, pero que se ha convertido en una tragedia del presente y en un reto para el futuro.
Algunos problemas pendientes
Sin embargo, como lo plantea Ginsberg (7), aún hay pendientes grandes problemas técnicos, éticos, económicos y políticos que deben resolverse antes de tener disponible una nueva vacuna para la tuberculosis. Algunos de los problemas planteados por esta investigadora son:
1) ¿Cuáles son los mecanismos que le permiten a M. tuberculosis permanecer por largos periodos dentro del hospedero humano sin causar síntomas, y en ciertas circunstancias, reactivarse?
2) ¿Cuáles son los principales constituyentes de la respuesta inmune antituberculosa en humanos y cuáles elementos pueden ser utilizados como marcadores de protección, de tal manera que se puedan utilizar para determinar la eficiencia de una vacuna?
3) Es necesario resolver algunos aspectos éticos importantes, como la utilización de grupos control a los cuales no se les administra la vacuna y la seguridad de la vacuna en poblaciones donde el HIV es prevalente.
4) ¿Cuales son las obligaciones de las compañías que desarrollan las vacunas con los países pobres que han participado en los estudios clínicos?
Correspondencia:
Luis F. García, Carrera 51D #62-29, Laboratorio 283, Medellín, Colombia.
Teléfono: (574) 510 6064; fax: (574) 510 6079.
Recibido: 30/06/03; aceptado: 23/01/04
Referencias
1. Cole ST, Brosch R, Parkhill J, Garnier T, Churcher C, Harris D et al. Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence. Nature 1998; 393: 537-44. [ Links ]
2. Brosch R, Philipp WJ, Stavropoulos E, Colston MJ, Cole ST, Gordon SV. Genomic analysis reveals variation between Mycobacterium tuberculosis H37Rv and the attenuated M. tuberculosis H37Ra strain. Infect Immun 1999; 67: 5768-74. [ Links ]
3
Kaufmann SHE. How can immunology contribute to the control of tuberculosis? Nature Rev Immunol 2001; 1: 20-30. [ Links ]4. Andersen P. TB vaccines: progress and problems. Trends Immunol 2001; 22: 160-8. [ Links ]
5. Orme IM. The search for new vaccines against tuberculosis. J Leuk Biol 2001; 70: 1-10. [ Links ]
6. Huygen K. On the use of DNA vaccines for the prophylaxis of mycobacterial diseases. Infect Immun 2003; 71: 1613-21. [ Links ]
7. Ginsberg AM. What´s new in tuberculosis vaccines? Bull WHO 2002; 80: 483-8. [ Links ]
8. Lewis KN, Liao R, Guin KM, Hickey MJ, Smith S, Behr MA et al. Deletion of RD1 from Mycobacterium tuberculosis mimics bacille Calmette-Guerin attenuation. J Infect Dis 2003; 187: 117-23. [ Links ]
9. Pym AS, Brodin P, Brosch R, Huerre M, Cole ST. Loss of RD1 contributed to the attenuation of the live tuberculosis vaccines Mycobacterium bovis BCG and Mycobacterium microti. Mol Microbiol 2002; 46: 709-17. [ Links ]
10. Griffin JF, Buchan GS. Vaccination against tuberculosis: is BCG more sined against than sinner? Immunol Cell Biol 1993; 71: 431-42. [ Links ]
11. Flynn J, Chan J. Immunology of tuberculosis. Ann Rev Immunol 2001; 19: 93-129. [ Links ]
12. Schlesinger LS. Role of mononuclear phagocytes in M. tuberculosis pathogenesis. J Invest Med 1997; 44: 312-23. [ Links ]
13. van Crevel R, Ottenhoff THM, van der Meer JWM. Innate immunity to Mycobacterium tuberculosis. Clin Microbiol Rev 2002; 15: 294. [ Links ]
14. Gonzalez-Juarrero M, Orme IM. Characterization of murine lung dendritic cells infected with Mycobacterium tuberculosis. Infect Immun 2001; 69: 1127-33. [ Links ]
15. Bodnar KA, Serbina NV, Flynn J. Fate of Mycobacterium tuberculosis within murine dendritic cells. Infect Immun 2001; 69: 800-9. [ Links ]
16. Smith SM, Klein MR, Malin AS, Sillah J, Huygen K, Andersen P et al. Human CD8+ T cells specific for Mycobacterium tuberculosis secreted antigens in tuberculosis patients and healthy BCG-vaccinated controls in the Gambia. Infect Immun 2000; 68: 7144-8. [ Links ]
17. Lewinsohn DM, Briden AL, Reed SG, Grabstein KH. Mycobacterium tuberculosis-reactive CD8+ T lymphocytes: The relative contribution of classical versus nonclassical HLA restriction. J Immunol 2000; 165: 925-30. [ Links ]
18. Porcelli SA, Morita CT, Modlin RL. T-cell recognition of non-peptide antigens. Curr Opin Immunol 1996; 8: 510-6. [ Links ]
19. Porcelli SA, Modlin RL. The CD1 system: antigen-presenting molecules for T cell recognition of lipids and glycolipids. Ann Rev Immunol 1999; 17: 221-54. [ Links ]
20. Morita C, Beckman EM, Bukowski JF, Tanaka Y, Band H, Bloom BR et al. Direct presentation of nonpeptide prenyl pyrophosphate antigens to human gd T cells. Immunity 1995; 3: 495-507. [ Links ]
21. Collins HL, Kaufmann SHE. The many faces of host response to tuberculosis. Immunol 2001; 103: 1-9. [ Links ]
22. Casanova JL, Abel L. Genetic dissection of immunity to mycobacteria: The Human Model. Ann Rev Immunol 2002; 20: 581-620. [ Links ]
23. Turner J, Rhoades ER, Keen M, Belisle JT, Frank AA, Orme IM. Effective preexposure tuberculosis vaccines fail to protect when they are given in an immunotherapeutic mode. Infect Immun 2000; 68: 1706. [ Links ]
24. Smith DA, Parish T, Stoker N, Bancroft GJ. Characterization of auxotrophic mutants of Mycobacterium tuberculosis and their potential as vaccine candidates. Infect Immun 2001; 69: 1142-50. [ Links ]
25. Marshall BG, Wangoo A, O´Gaora P, Cook HT, Shaw RJ, Young DB. Enhancend antimycobacterial response to recombinant Mycobacterium bovis BCG expressing latency-associated peptide. Infect Immun 2001; 69: 6676-82. [ Links ]
26. Bao L, Chen W, Zhang H, Wang X. Virulence, immunogenicity, and protective efficacy of two recombinant Mycobacterium bovis Bacillus Calmette-Guerin strains expressing the antigen ESAT-6 from Mycobacterium tuberculosis. Infect Immun 2003; 71: 1656-61. [ Links ]
27. Minion FC, Menon SA, Mahairas GG, Wannemuehler MJ. Enhanced murine antigen-specific gamma interferon and immunoglobulin G2a responses by using mycobacterial ESAT-6 sequences in DNA vaccines. Infect Immun 2003; 71: 2239-43. [ Links ]
28. Stover CK, de la Cruz VF, Fuerst TR, Burlein JE, Benson LA, Bennet LT et al. New use of BCG for recombinant vaccines. Nature 1991; 351: 456-60. [ Links ]
29. Baumgart KW, Mckenzie KR, Radford AJ, Ramshaw I, Britton WJ. Immunogenicity and protection studies with recombinant mycobacteria and vaccinia vectors coexpressing the 18-kilodalton protein of Mycobacterium leprae. Infect Immun 1996; 64: 2274-81. [ Links ]
30. Horwitz MA, Harth G, Dillon BJ, Maslesa-Galic S. Recombinant bacillus Calmette-Guerin (BCG) vaccines expressing the Mycobacterium tuberculosis 30-kDa major secretory protein induce greater protective immunity against tuberculosis than conventional BCG vaccines in a highly susceptible animal model. Proc Nat Acad Sci USA 2000; 97: 13853. [ Links ]
31. Horwitz MA, Harth G. A new vaccine against tuberculosis affords greater survival after challenge than the current vaccine in the Guinea pig model of pulmonary tuberculosis. Infect Immun 2003; 71: 1672-9. [ Links ]
32. McShane H, Brookes R, Gilbert SC, Hill AVS. Enhanced immunogenicity of CD4+ T-cell responses and protective efficacy of a DNA-modified vaccinia virus Ankara prime-boost vaccination regimen for murine tuberculosis. Infect Immun 2001; 69: 681-6. [ Links ]
33. Hondalus MK, Bardarov S, Russell R, Chan J, Jacobs WR, Bloom BR. Attenuation of and protection induced by a leucine auxotroph of Mycobacterium tuberculosis. Infect Immun 2000; 68: 2888-98. [ Links ]
34. Chambers MA, Williams A, Gavier-Widen D, Whelan A, Hall G, Marsh PD et al. Identification of a Mycobacterium bovis BCG auxotrophic mutant that protects guinea pigs against M. bovis and hematogenous spread of Mycobacterium tuberculosis without sensitization to tuberculin. Infect Immun 2000; 68: 7094-9. [ Links ]
35. Repique CJ, Li A, Collins FM, Morris SL. DNA immunization in a mouse model of latent tuberculosis: effect of DNA vaccination on reactivation of disease and on reinfection with a secondary challenge. Infect Immun 2002; 70: 3318-23. [ Links ]
36. Manabe YC, Scott CP, Bishai WR. Naturally attenuated, orally administered Mycobacterium microti as a tuberculosis vaccine is better than subcutaneous Mycobacterium bovis BCG. Infect Immun 2002; 70: 1566-70. [ Links ]
37. Stanford JL, Stanford CA. Immunotherapy for tuberculosis with M. vaccae. J Med Microbiol 1996; 44: 24-8. [ Links ]
38. Sonnenberg MG, Belisle JT. Definition of Mycobacterium tuberculosis culture filtrate proteins by two-dimensional polyacrilamide gel electrophoresis, N-terminal amino acid sequencing, and electrosray mass spectrometry. Infect Immun 1997; 65: 4515-24. [ Links ]
39. Rosenkrands I, Welding K, Jacobsen S, Veggerby Hansen C, Florio W, Gianetri I et al. Mapping and identification of Mycobacterium tuberculosis proteins by two-dimensional gel electrophoresis, micro-sequencing and immunodetection. Electrophoresis 2000; 21: 935-48. [ Links ]
40. Roberts AD, Sonnenberg MG, Ordway DJ, Furney SK, Brennan PJ, Belisle JT et al. Characteristics of protective immunity engendered by vaccination pf mice with purified culture filtrate protein antigens of Mycobacterium tuberculosis. Immunol 1995; 85: 502-8. [ Links ]
41. Demissie A, Ravn P, Olobo J, Doherty TM, Eguale T, Geletu M et al. T-cell recognition of Mycobacterium tuberculosis culture filtrate fractions in tuberculosis patients and their household contacts. Infect Immun 1999; 67: 5967-71. [ Links ]
42. Doherty MT, Weinrich A, Laurens O, Pinxteren Lv, Andersen P. Oral vaccination with subunit vaccines protects animals against aerosol infection with Mycobacterium tuberculosis. Infect Immun 2002; 70: 3111-21. [ Links ]
43. Brandt L, Elhay MJ, Rosenkrads I, Lindblad EB, Andersen P. ESAT-6 subunit vaccination against Mycobacterium tuberculosis. Infect Immun 2000; 68: 791-5. [ Links ]
44. Horwitz MA, Lee B- WE, Dillon BJ, Harth G. Protective immunity against tuberculosis induced by vaccination with major extracellular proteins of Mycobacterium tuberculosis. Proc Nat Acad Sci USA 1995; 92: 1530-4. [ Links ]
45. Gomez M, Johnson S, Gennaro ML. Identification of secreted proteins of Mycobacterium tuberculosis by a bioinformatic approach. Infect Immun 2000; 68: 2323-7. [ Links ]
46. Olsen AW, Pinxteren LAHv, Okkels LM, Rasmussen PB, Andersen P. Protection of mice with a tuberculosis subunit vaccine based on a fusion protein of antigen 85B and ESAT-6. Infect Immun 2001;69:2773-8. [ Links ]
47. Alving CR. Lipopolysaccharide, lipid A, and liposomes containing lipid A as immunologic adjuvants. Immunobiol 1993; 187: 430-46. [ Links ]
48. Andersen P. Effective vaccination of mice against Mycobacterium tuberculosis infection with a soluble mixture of secreted mycobacterial proteins. Infect Immunity 1994; 62: 2536-44. [ Links ]
49. Persing D, Coler R, Lacy M, Johnson D, Baldridge J, Hershberg R et al. Taking toll: lipid A mimetics as adjuvants and immunomodulators. Trends Microbiol 2002; 10: s32-s37. [ Links ]
50. Wang J, Zganiacz A, Xing Z. Enhanced immunogenicity of BCG vaccine by using a viral-based GM-CSF transgene adjuvant formulation. Vaccine 2002; 20: 2887-98. [ Links ]
51. Krieg AM. CpG motifs in bacterial dna and their immune effects. Ann Rev Immunol 2002; 20: 709-60. [ Links ]
52. Klinman DM, Yi A- K, Beaucage SL, Conover J, Krieg AM. CpG motifs present in bacterial DNA rapidly induce lymphocytes to secrete interleukin 6, interleukin 12, and interferon-g. Proc Natl Acad Sci USA 1996; 93: 2879-83. [ Links ]
53. Nichols WW, Lewith BJ, Manan SV, Troilo PJ. Potential DNA vaccine integration into host genome. Ann NY Acad Sci 1995; 30-9. [ Links ]
54. Lowrie DB, Tascón RE, Colston MJ, Silva CL. Towards a DNA vaccine against tuberculosis. Vaccine 1994; 12: 1537-40. [ Links ]
55. Tascon RE, Colston MJ, Ragno S, Stavropoulos E, Gregory D, Lowrie D. Vaccination against tuberculosis by DNA injectio n. Nature Med 1996; 2: 888-92. [ Links ]
56. Silva CL, Silva MF, Pietro RCLR, Lowrie DB. Characterization of t cells that confer a high degree of protective immunity against tuberculosis in mice after vaccination with tumor cells expressing mycobacterial HSP65. Infect Immun 1996; 64: 2400-7. [ Links ]
57. Huygen K, Content J, Denis O, Montgomery DL, Yawman AM, Deck RR et al. Immunogenicity and protective efficacy of a tuberculosis DNA vaccine. Nature Med 1996; 2: 893-8. [ Links ]
58. Montgomery DL, Huygen K, Yawman AM, Deck RR, Dewitt CM, Content J et al. Induction of humoral and cellular immune responses by vaccination with M. tuberculosis antigen 85 DNA. Cell Mol Biol 1997; 43: 285-92. [ Links ]
59. Tanghe A, Denis O, Lambrecht B, Motte V, Berg Tvd, Huygen K. Tuberculosis DNA vaccine encoding Ag85A is immunogenic and protective when administered by intramuscular needle injection but not by epidermal gene gun bombardment. Infect Immun 2000; 68: 3854-60. [ Links ]
60. Chambers MA, Williams A, Hatch G, Gavier-Widen D, Hall G, Huygen K et al. Vaccination of guinea pigs with DNA encoding the mycobacterial antigen MPB83 influences pulmonary pathology but not hematogenous spread following aerogenic infection with Mycobacterium bovis. Infect Immun 2002; 70: 2159-65. [ Links ]
61. Kumar P, Amara RR, Challu VK, Chadda VK, Satchidanandam V. The Apa protein of Mycobacterium tuberculosis stimulates gamma interferon-secreting CD4+ and CD8+ T cells from purified protein derivative-positive individuals and affords protection in a Guinea pig model. Infect Immun 2003; 71: 1929-37. [ Links ]
62. Tanghe A, Lefevre P, Denis O, D'Souza S, Braibant M, Lozed E et al. Immunogenecity and protective efficacy of tuberculosis DNA vaccines encoding putative phosphate transport receptors. J Immunol 1999; 162: 1113-9. [ Links ]
63. Martin E, Kamath AT, Triccas JA, Britton WJ. Protection against virulent Mycobacterium avium infection following DNA vaccination with the 35-kilodalton antigen is accompanied by induction of gamma interferon-secreting CD4+ T cells. Infect Immun 2000; 68: 3090-6. [ Links ]
64. Kamath AT, Feng CG, Macdonald M, Briscoe H, Britton WJ. Differential protective efficacy of DNA vaccines expressing secreted proteins of Mycobacterium tuberculosis. Infect Immun 1999; 67: 1702-7. [ Links ]
65. Delogu G, Li A, Repique C, Collins F, Morris SL. DNA vaccine combinations expressing either tissue plasminogen activator signal sequence fusion proteins or ubiquitin-conjugated antigens induce sustained protective immunity in a mouse model of pulmonary tuberculosis. Infect Immun 2002; 70: 292-302. [ Links ]
66. Turner OC, Roberts AD, Frank AA, Phalen SW, McMurray DN, Content J et al. Lack of protection in mice and necrotizing bronchointerstitial pneumonia with bronchiolitis in guinea pigs immunized with vaccines directed against the hsp60 molecule of Mycobacterium tuberculosis. Infect Immun 2000; 68: 3674-9. [ Links ]
67. Taylor JL, Turner OC, Basaraba RJ, Belisle JT, Huygen K, Orme IM. Pulmonary necrosis resulting from DNA vaccination against tuberculosis. Infect Immun 2003; 71: 2192-8. [ Links ]
68. Feng CG, Umaimainthan P, Demangel C, Spratt JM, Britton WJ. Priming by DNA immunization augments protective efficacy of Mycobacterium bovis bacille Calmette-Guerin against tuberculosis. Infect Immun 2001; 69: 4174-6. [ Links ]
69. Tanghe A, D´Souza S, Rosseels V, Denis O, Ottenhoff THM, Dalemans W et al. Improved immunogenicity and protective efficacy of a tuberculosis DNA vaccine encoding Ag85 by protein boostin g. Infect Immun 2001; 69: 3041-7. [ Links ]














