Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157On-line version ISSN 2590-7379
Biomédica vol.25 no.4 Bogotá Dec. 2005
Detección de Chlamydia pneumoniae en tejido aórtico humano:
amplificación del gen kdtA e hibridación in vitro
Natalia Guzmán 1, Claudia Espitia 1, Pilar Delgado 1, Darío Echeverri 2, Lorena Buitrago 2, Carlos Jaramillo 1
1 Laboratorio de Diagnóstico Molecular y Bioinformática, Universidad de los Andes, Bogotá, D.C., Colombia.
2
Laboratorio de Investigación en Función Vascular, Fundación CardioInfantil, Instituto de Cardiología, Bogotá, D.C., Colombia.Introducción. La ateroesclerosis es la principal causa de enfermedad coronaria y cerebrovascular, las cuales, a su vez, son las causas más comunes de mortalidad y morbilidad en el mundo occidental. Publicaciones recientes sugieren que ciertos microorganismos infecciosos podrían jugar un papel importante en la génesis y progresión de la aterosclerosis. De acuerdo con reportes seroepidemiológicos y de detección directa, Chlamydia pneumoniae podría ser el candidato más plausible. No obstante, no se ha determinado su papel específico en el proceso aterogénico, por lo cual en los últimos años ha surgido la necesidad de explorar diversas técnicas de detección de C. pneumoniae en arterias.
Objetivo. El propósito de este estudio fue investigar la presencia de C. pneumoniae en muestras de tejido aórtico de catorce pacientes sometidos a cirugía de reemplazo aórtico, utilizando la amplificación del gen kdtA por PCR acoplada a un ensayo de hibridación in vitro.
Materiales y métodos. De cada uno de catorce segmentos de aorta se obtuvo una muestra al azar para la extracción de ADN y la detección de C. pneumoniae por PCR-hibridación in vitro.
Resultados. Doce (85,7%) de catorce muestras de tejido de aorta resultaron positivas para C. pneumoniae.
Conclusión. Los resultados encontrados en este estudio sugieren que la presencia de C. pneumoniae es frecuente en el tipo de muestras analizado. En estudios posteriores resultaría importante examinar si esta proporción se mantiene en una muestra poblacional mayor.
Palabras clave: infección, aorta, tejido , reacción en cadena de la polimerasa.
Detection of Chlamydia pneumoniae in human aortic tissue: kdtA gene amplification and in vitro hybridization
Introduction. Atherosclerosis is the main cause of coronary and cerebrovascular disease which, in turn, are the most common causes of mortality and morbidity in the western world. Recent publications suggest that infective microorganisms may play an important role in the genesis and progression of atherosclerosis. According to seroepidemiological and direct detection reports, Chlamydia pneumoniae is the most plausible candidate. Nevertheless, the mechanisms by which the microorganism induces its pathological effect have not yet been conclusively determined; hence, the need exists to explore different detection techniques of C. pneumoniae on arteries.
Objective. The purpose of the current study was to detect the presence of C. pneumoniae in aortic tissue samples from 14 patients submitted to aortic replacement surgery. Detection method involved kdtA gene amplification coupled with an in vitro hybridization assay.
Materials and methods. Samples of aortic tissue for DNA extraction and C. pneumoniae detection by PCR- in vitro hybridization were randomly obtained from each of 14 aorta specimens.
Results. C. pneumoniae was detected in 12 (85.7%) of the 14 aortic tissue samples.
Conclusions. This result indicates a frequent association of C. pneumoniae with aortic tissue disease. Further studies are required to determine if this proportion of positive samples persists within larger samples.
Key words: infection, aorta, tissue, polymerase chain reaction.
La ateroesclerosis, base patológica de la enfermedad arterial coronaria, es una de las principales causas de mortalidad y morbilidad en países industrializados y en países en desarrollo en el hemisferio occidental (1,2). La patogénesis de la ateroesclerosis ha sido un tema de amplio debate. Actualmente se la clasifica como una enfermedad inflamatoria crónica que puede resultar de una respuesta inmune excesiva a diversos estímulos inflamatorios que conducen al deterioro del endotelio vascular (3-5). El hábito de fumar, la hipercolesterolemia, la diabetes mellitus, la hipertensión y los antecedentes familiares relacionados con enfermedad coronaria, se consideran factores de riesgo asociados con esta patología (6). En este contexto, varias publicaciones (2, 3, 7-11) sugieren que uno o más agentes infecciosos podrían jugar un papel en el proceso aterogénico a través de mecanismos proinflamatorios (12,13). La evidencia de una relación entre Chlamydia pneumoniae y la enfermedad coronaria es mucho más concluyente que para cualquier otro de los microorganismos posiblemente implicados (2,6,7,14), y se ha asociado con la presencia de enfermedad coronaria, carotídea, aneurismas de aorta y enfermedad vascular periférica (7). No obstante, otros reportes no confirman dicha asociación (15).
C. pneumoniae es una bacteria intracelular obligada que no puede generar ATP independientemente y, por lo tanto, debe hacer uso del que produce la célula hospedera (7,8). Se encuentra ampliamente distribuida a nivel mundial y es un agente causal común de enfermedad respiratoria aguda (7,8). Además, tiene la capacidad de infectar y multiplicarse en distintos tipos de células que comúnmente se encuentran en ateromas, incluidas las células endoteliales, los macrófagos y las células de músculo liso vascular (2,16,17). Asimismo, posee la facultad para modular las interacciones macrófago-lipoproteína, lo cual contribuye al desarrollo de la enfermedad.
El diagnóstico de la infección por C. pneumoniae puede establecerse de manera directa (por detección del organismo completo, sus antígenos o su ácido nucleico), o indirecta (midiendo los anticuerpos anti- C. pneumoniae en suero). Los dos tipos de metodología presentan algunas limitaciones, y los reportes de las tasas de detección varían en diferentes publicaciones (15), lo cual evidencia la necesidad de explorar otros protocolos para detectar la presencia del microorganismo en el tejido vascular (18). La evidencia más fehaciente de la asociación existente entre la enfermedad y la infección por C. pneumoniae se ha establecido mediante el uso de la reacción en cadena de la polimerasa (PCR), técnica que ha permitido detectar la presencia de ADN de C. pneumoniae directamente en las placas ateromatosas (7).
El propósito de este estudio fue explorar un método de detección de C. pneumoniae en muestras de tejido aórtico humano por medio de una técnica que involucra la amplificación del gen kdtA por PCR, conjugada con una prueba de hibridación in vitro. Esta técnica es un ensayo de captura diseñado para detectar amplicones de ADN específicos del gen kdtA de C. pneumoniae, que codifica para la enzima ácido 3-deoxi-alfa-Dmano- octulosónico (Kdo) transferasa, la cual desempeña un papel importante en la biosíntesis de lipopolisacáridos de la bacteria (19).
Materiales y métodos
Este estudio fue aprobado por el Comité de Ética en Investigación Clínica y el Comité de Investigaciones de la Fundación Cardioinfantil-Instituto de Cardiología, y clasificado como un estudio con riesgo mínimo acorde con las normas nacionales e internacionales. Todos los pacientes de quienes se extrajo la muestra de aorta durante el procedimiento quirúrgico, firmaron voluntariamente un consentimiento informado previamente establecido.
Muestras
Se recolectó tejido aórtico obtenido de catorce pacientes con diagnóstico de enfermedad de aorta ascendente (aneurismas de aorta, ateroesclerosis) en un frasco estéril que contenía una solución de etanol al 70%. Las muestras fueron almacenadas a 4°C hasta el momento de la extracción de ADN.
Extracción de ADN
La extracción de ADN a partir de tejido de aorta se estandarizó utilizando 4 muestras que fueron sometidas a procedimientos de extracción con dos estuches comerciales (QIAamp DNA Mini Kit de QIAGEN® y AquaPure Genomic DNA kit de BIORAD ®) de acuerdo con las recomendaciones de los fabricantes. El ADN extraído mediante las dos metodologías fue cuantificado con lecturas espectrofotométricas y, además, se calculó su índice de pureza (20). Finalmente, para determinar si el ADN obtenido era de grado PCR, se procedió a amplificar el gen de la
b-globulina humana. El ADN de las 10 arterias restantes se extrajo utilizando el estuche AquaPure Genomic DNA de BIO-RAD®, ya que se obtuvo una mayor concentración de ADN (51,11 ng/µl) que con el estuche QIAamp DNA Mini Kit (45,98 ng/µl). Esto es un factor determinante en protocolos de detección de ácidos nucleicos de C. pneumoniae en tejido aórtico dada su limitada cantidad en el tejido.PCR-hibridación in vitro
Se llevó a cabo la amplificación de un fragmento de 110 pb del gen kdtA (número de acceso en GenBank: Z31593) por PCR con iniciadores biotinilados. Se empleó el estuche (Light Diagnostics
TM Chlamydia pneumoniae Oligodetect de Chemicon®), de acuerdo con las recomendaciones del fabricante.En resumen, las reacciones de amplificación se realizaron en un volumen total de 25
ml que contenía 1 ml del ADN extraído, 20mM de Tris-HCl (pH 8,4), 50mM de KCl, 200mM de cada uno de los cuatro desoxinucleótido trifosfatos, 1 mM de MgCl2, 0,3 mM de la mezcla de iniciadores del gen kdtA y 2,5 U de Taq polimerasa (InvitrogenTM). Como control negativo de amplificación se adicionó 1ml de agua ultrapura en lugar de ADN, y como control positivo se utilizó el que provee el estuche. El perfil térmico consistió en una denaturación inicial de 1 minuto a 94°C ; 40 ciclos de denaturación, anillaje y elongación a 94°C (1 min), 58°C (30 seg) y 72°C (1 min), respectivamente, y 8 minutos a 72°C para la elongación final.Los amplicones de las muestras y los controles fueron evidenciados por electroforesis en geles de poliacrilamida al 6% en corrido de 150 minutos a 80 voltios para determinar si los resultados eran concordantes con los resultados de la hibridación in vitro. La tinción de los geles se realizó en piscina de bromuro de etidio (10 mg/ml) al 2% durante 20 minutos a 20°C y se visualizó por transiluminación con luz UV en un sistema de documentación de geles, y el cálculo de los pesos moleculares se realizó mediante el Software Quantity One de BIORAD®.
Para el ensayo de hibridación, en cada pozo de captura se adicionaron 10
ml del producto de amplificación de las muestras o de los controles. Se utilizaron cinco tipos de controles de hibridación: los controles negativos y positivos de hibridación; los controles positivo y negativo de amplificación que provenían de las reacciones de PCR y muestras de amplicones de ß-globulina que se utilizaron como control negativo adicional. A continuación se agregaron 5 ml de solución de denaturación y se incubó durante 10 minutos a temperatura ambiente. Se añadieron 85 ml de tampón de hibridación y la reacción se incubó a 37°C durante 30 minutos. Se realizaron lavados por triplicado de la placa con tampón de lavado 1X. Luego se adicionaron 100 ml de un conjugado de estreptavidina-peroxidasa a cada pozo y se incubó a 37 °C durante 30 minutos. Se aspiró el conjugado y se lavó 3 veces con el tampón de lavado 1X. Se agregaron 100 ml de sustrato (TMB/ E) y se incubó a 37 °C durante 10 minutos.Por último, se adicionaron 100
ml de solución de frenado. La lectura se realizó en un lector de microplacas (Benchmark de BIO-RAD®) a 450 nm/ 655 nm. Para determinar los puntos de corte, se calculó el promedio de las absorbancias (obtenidas en el ensayo de hibridación) correspondientes a las muestras de 3 controles negativos de la reacción de PCR, en la que, en lugar de ADN, se utilizó agua ultrapura. A continuación se calculó la desviación estándar (DE). El punto de corte negativo se determinó como la suma del promedio de los controles negativos más 2 DE y el punto de corte positivo se determinó como la suma del promedio de los controles negativos más 3 DE. Se calculó una pareja adicional de puntos de corte a partir del promedio de absorbancia de 3 muestras de amplicones de b-globulina con el fin de descartar hibridaciones inespecíficas y de comparar con los puntos de corte obtenidos a partir de los controles negativos de amplificación. A partir del ADN de las muestras que resultaron negativas en el ensayo de hibridación, se llevó a cabo una reacción de PCR utilizando iniciadores para el gen de la b-globulina (21) como control interno de la reacción de amplificación. Los productos se visualizaron en geles de agarosa al 1,5% teñidos con bromuro de etidio al 2%.Resultados
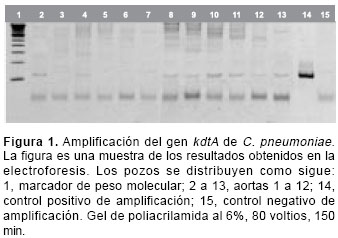
Doce (85,7%) de las 14 arterias procesadas resultaron positivas para C. pneumoniae (
cuadro 1). Las muestras positivas y negativas se determinaron de acuerdo con los puntos de corte calculados a partir de los controles negativos de amplificación así: positivo=>0,3835; negativo=< 0,2811 . Los puntos de corte generados a partir de las muestras de b-globulina fueron: positivo=> 0,3529; negativo=< 0,2782, lo que indica que la técnica no presenta hibridaciones inespecíficas con amplicones diferentes al del fragmento de 110 pb del gen kdtA. No en todos los casos la presencia de bandas en la electroforesis de las muestras coincidió con un resultado positivo en la hibridación in vitro. Esto se observó en el caso de la arteria 3 (figura 1, pozo 4). Asimismo, en las muestras de las arterias 2, 4, 5 y 6 (figura 1, pozos: 3, 5, 6 y 7, respectivamente) no se presentó banda en el gel y los resultados en la hibridación fueron positivos.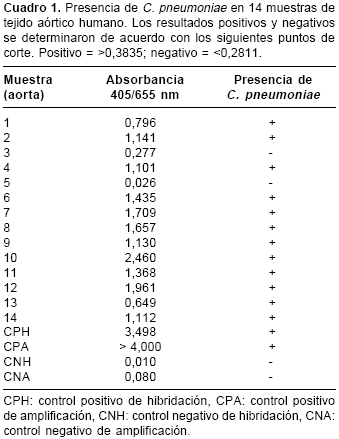
En las muestras de las arterias 3 y 5, que resultaron negativas en la hibridación in vitro, la amplificación del gen de la
b-globulina resultó positiva, lo cual permitió descartar que fueran falsos negativos.Discusión
En el presente estudio se detectó la presencia de ADN de C. pneumoniae en 12 de 14 muestras de tejido aórtico con la técnica PCR-hibridación in vitro, lo cual representa 85,7%. Este es un valor elevado si se lo compara con estudios revisados en los últimos 5 años (15,22-26). No obstante, en un estudio reciente, Bahrmand et al. (6) demostraron que 12 de 14 (86%) casos eran positivos para C. pneumoniae por PCR en pacientes de 60 años o mayores. De hecho, los autores de ese estudio sugieren que C. pneumoniae podría estar involucrada en la ateroesclerosis en humanos, en particular en casos donde los factores de riesgo clásicos no explican la incidencia de la enfermedad vascular ateroesclerótica, lo cual apoya nuestros resultados.
La infección de tejidos no respiratorios, como la pared de la vasculatura, requiere que el microorganismo sobrepase las barreras del pulmón y se disperse a través del torrente sanguíneo. Moazed et al. (27) demostraron que C. pneumoniae tiene la habilidad de infectar macrófagos in vivo y de diseminarse sistémicamente por medio de los macrófagos infectados en ratones. En otro estudio reciente (28), se demostró que en conejos infectados por vía intratraqueal con C. pneumoniae, los macrófagos alveolares infectados migran a través de la mucosa y le dan acceso al patógeno al tejido linfático peribronqueolar y, subsecuentemente, los monocitos infectados en sangre periférica transmiten la infección a la pared vascular. Los resultados de estos estudios sugerirían que, puesto que se estima que virtualmente toda la población ha tenido contacto con C. pneumoniae en algún momento de su vida y que la reinfección es recurrente (7,29), su presencia en la vasculatura por vía de macrófagos infectados, podría ser de carácter ocasional.
No obstante, al revisar la hipótesis de la presencia ocasional de C. pneumoniae en tejido vascular, Jackson et al. (30) encontraron que C. pneumoniae no se encuentra frecuentemente en tejidos no cardiovasculares, lo cual indica que podría existir algún grado de tropismo del microorganismo hacia el tejido vascular (13,14). Este hecho explicaría, en parte, el alto porcentaje de positividad encontrado en nuestro estudio.
El uso de diferentes metodologías de detección, que en ocasiones no muestran coherencia entre sí, es uno de los factores que podría explicar los resultados contradictorios reportados en la literatura sobre la prevalencia de C. pneumoniae en tejido vascular en los últimos años. Por ejemplo, en los estudios de detección de C. pneumoniae por PCR, los porcentajes de incidencia varían de 0% hasta 100% (22,23). Incluso, existe un reporte reciente (15) que ha sugerido que los resultados obtenidos por PCR varían tanto que impiden que a partir de ellos se obtengan conclusiones sobre la asociación de la ateroesclerosis con C. pneumoniae.
No obstante, hasta el momento la PCR ha sido una de las técnicas de mayor uso para la detección del microorganismo en tejido vascular. En este estudio se utilizó la técnica de PCR acoplada a una reacción de hibridación in vitro para la detección de los amplicones, lo cual permite evidenciar con una mayor sensibilidad y especificidad la presencia del ADN amplificado, ya que la detección depende de la secuencia y no del tamaño del amplicón. De hecho, hubo una muestra en nuestro estudio que presentaba una banda del peso esperado, pero al realizar la hibridación el resultado fue negativo (
figura 1), lo que indica un evento de amplificación inespecífica de un fragmento del mismo tamaño del esperado (110 pb), pero con una secuencia diferente a la del gen kdtA, que no hibridó con el oligonucleótido específico, evitando de esta manera la aparición de falsos positivos en los resultados.Además, hubo 4 casos en los que no se presentó banda en el gel y los resultados en la hibridación fueron positivos (
figura 1). Esto indica que la detección de amplicones por hibridación aumenta la sensibilidad de la detección de C. pneumoniae. Otro factor que le da una ventaja a la metodología que se exploró en este estudio es que la técnica es altamente específica para la detección de C. pneumoniae, ya que se ha reportado (19) que la secuencia de aminoácidos deducida de la secuenciación de nucleótidos del gen kdtA de C. pneumoniae amplificado por PCR en nuestro estudio tiene 69% de similitud y 43% de identidad con la secuencia correspondiente en C. trachomatis y C. psittaci (las otras dos especies que afectan al ser humano), lo cual hace de esta secuencia un candidato muy apropiado para la detección de C. pneumoniae debido a que no es de esperarse que existan reacciones cruzadas con las otras dos especies mencionadas.Los resultados encontrados en este trabajo sugieren que la presencia de C. pneumoniae es frecuente en tejido de aorta enfermo, y aportan nueva evidencia a la línea de investigación de la asociación entre la infección y el desarrollo de las enfermedades de la aorta. Las implicaciones clínicas de estos resultados podrían tener gran relevancia, ya que la presencia de la bacteria en el tejido vascular, bien sea como un factor causal de enfermedad o como un factor secundario de los daños inflamatorios generados por diferentes enfermedades de la aorta, podría contribuir al desarrollo de dichas enfermedades.
Varios estudios apoyan esta hipótesis. Por ejemplo, Selzman et al. (31) demostraron que in vitro, C. pneumoniae induce la proliferación de células de músculo liso vascular, la expresión del antígeno nuclear de proliferación celular y la reducción en la expresión de p53, y promueve la liberación de citocinas aterogénicas específicas. En otro estudio (32) se encontró que en aortas de conejos inoculados con C. pneumoniae por vía nasofaríngea, se presentaron cambios de novo característicos de ateroesclerosis. Los autores sugieren que C. pneumoniae puede tener una participación fisiopatológica en la aterogénesis.
Al igual que la ateroesclerosis, los aneurismas de aorta se asocian con altas tasas de mortalidad y morbilidad (33). Por ello, se ha surgido la necesidad de identificar factores de riesgo asociados al desarrollo y progresión de esta patología que permitan determinar el riesgo de disección o ruptura arterial (34). Halme et al. (35) demostraron la presencia de linfocitos T anti- C. pneumoniae en la pared de aneurismas de aorta abdominal, lo que sugiere que C. pneumoniae participa en el mantenimiento de la respuesta inflamatoria en el tejido y, por lo tanto, puede estar involucrada en la progresión de la enfermedad.
En conclusión, aunque permanece la controversia respecto de un posible papel de C. pneumoniae en el desarrollo de enfermedades de aorta como ateroesclerosis y aneurismas, el hecho de esclarecer si la infección con C. pneumoniae representa un factor de riesgo diferente de los que tradicionalmente son blanco de la terapia no invasiva, constituiría un hallazgo de gran importancia en el tratamiento de las enfermedades de aorta.
En estudios futuros resultaría interesante contrastar los hallazgos del presente trabajo con muestras de tejido vascular sano, y verificar si el porcentaje de detección se mantiene en una muestra más amplia. Asimismo, sería importante comparar nuestros resultados con los obtenidos al utilizar otras metodologías de detección de C. pneumoniae en tejido, como la inmunocitoquímica, la hibridación in situ y el cultivo. Por último, los estudios que compararan el grado de infección con la gravedad de la enfermedad de aorta por medio de una técnica como la PCR en tiempo real serían de gran importancia en esta línea de investigación.
Agradecimientos
Agradecemos a la Facultad de Ciencias de la Universidad de los Andes por haber financiado este proyecto, y a los miembros del Laboratorio de Diagnóstico Molecular y Bioinformática por su gran apoyo en el desarrollo de este trabajo.
Conflicto de intereses
La investigación a partir de la cual se generó el artículo titulado "Detección de Chlamydia pneumoniae en tejido aórtico humano: amplificación del gen kdtA e hibridación in vitro", no tiene ningún tipo de conflicto de interés.
Financiación
Facultad de Ciencias de la Universidad de los Andes.
Correspondencia:
María del Pilar Delgado P
Carrera 1 N° 18A -10. Edificio J (203). Universidad de los Andes, Bogotá, D.C., Colombia.
Teléfonos: 3394949 ext. 3761 o 2773
Fax: 3394949 ext. 2817
- Recibido: 03/05/05; aceptado: 01/09/05
Referencias
1. Ross R. The pathogenesis of atherosclerosis: an update. N Engl J Med 1986;314:488-500. [ Links ]
2. Noll G. Pathogenesis of atherosclerosis: a possible relation to infection. Atherosclerosis 1998;140:3-9. [ Links ]
3. Morré SA, Stooker W, Lagrand WK, van den Brule AJ, Niessen HW. Microorganisms in the aetiology of atherosclerosis. J Clin Pathol 2000;53:647–54. [ Links ]
4. Ross R. The pathogenesis of atherosclerosis: a perspective for the 1990s. Nature 1993;362:801–9. [ Links ]
5. Ross R. Atherosclerosis: an inflammatory disease. N Engl J Med 1999;340:115-26. [ Links ]
6. Bahrmand AR, Bahadori M, Hossaini A, Velayati AA, Aghabozorgy S, Shakoor A, et al. Chlamydia pneumoniae DNA is more frequent in advanced than in mild atherosclerosis lesions. Scand J Infect Dis 2004;36:119-23. [ Links ]
7. Campbell LA, Kuo CC, Grayston JT. Chlamydia pneumoniae and cardiovascular disease. Emerg Infect Dis 1998;4:571-9. [ Links ]
8. Wong YK, Gallagher PJ, Ward ME. Chlamydia pneumoniae and atherosclerosis. Heart 1999;81:232–8. [ Links ]
9. Streblow DN, Orloff SL, Nelson JA. Do pathogens accelerate atherosclerosis? J Nutr 2001;131:2798-804. [ Links ]
10. Kalayoglu MV, Libby P, Byrne GI. Chlamydia pneumoniae as an emerging risk factor in cardiovascular disease. JAMA 2002;288:2724-31. [ Links ]
11. Leinonen M, Saikku P. Evidence for infectious agents in cardiovascular disease and atherosclerosis. Lancet Infect Dis 2002;2:11-7. [ Links ]
12. Gupta S. Chlamydia pneumoniae, monocyte activation and azithromycin in coronary heart disease. Am Heart J 1999;138:539–41. [ Links ]
13. Ngeh J, Anand V, Gupta S. Chlamydia pneumoniae and atherosclerosis – what we know and what we dont. Clin Microbiol Infect 2002;8:2–13. [ Links ]
14. Kuo CC, Campbell LA. Is Infection with Chlamydia pneumoniae a causative agent in atherosclerosis. Mol Med Today 1998;4:426-30. [ Links ]
15. Ieven MM, Hoymans VY. Involvement of Chlamydia pneumoniae in atherosclerosis: more evidence for lack of evidence. J Clin Microbiol 2005;43:19-24. [ Links ]
16. Juvonen J, Juvonen T, Laurila A, Alakarppa H, Lounatmaa K, Surcel HM, et al. Demonstration of Chlamydia pneumoniae in the walls of abdominal aortic aneurysms. J Vasc Surg 1997;25:499-505. [ Links ]
17. Schacter J. Pathogenesis of chlamydial infections. Pathol Immunopathol Res 1989;8:206–20. [ Links ]
18. Lindholt JS, Fasting H, Henneberg E, Ostergaard L. A review of Chlamydia pneumoniae and atherosclerosis. Eur J Vasc Endovasc Surg 1999;17: 283-9. [ Links ]
19. Lobau S, Mamat U, Brabetz W, Brade H. Molecular cloning, sequence analysis, and functional characterization of the lipopolysaccharide biosynthetic gene kdtA encoding 3-deoxy-alpha-D-mannooctulosonic acid transferase of Chlamydia pneumoniae strain TW-183. Mol Microbiol 1995;18:391-9. [ Links ]
20. Robert J, Jostein G, Asim K, Ronald M. Recovery of DNA from soils and sediments. Appl Environ Microbiol 1988;54:2908-15. [ Links ]
21. Saiki R, Scharf S, Faloona F, Mullis KB, Horn GT, Erlich HA, et al. Enzymatic amplification of
b-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia. Science 1985;230: 1350-4. [ Links ]22. Apfalter P, Blasi F, Boman J, Gaydos CA, Kundi M, Maass M et al. Multicenter comparison trial of DNA extraction methods and PCR assays for detection of Chlamydia pneumoniae in endarterectomy specimens. J Clin Microbiol 2001;39:519-24. [ Links ]
23. Muhlestein JB, Hammond EH, Carlquist JF, Radicke E, Thomson MJ, Karagounis LA, et al. Increased incidence of Chlamydia species within the coronary arteries of patients with symptomatic atherosclerotic versus other forms of cardiovascular disease. J Am Coll Cardiol 1996;27:1555-61. [ Links ]
24. Farsak B, Yildirir A, Akyön Y, Pinar A, Öç M, Böke M, et al. Detection of Chlamydia pneumoniae and Helicobacter pylori DNA in human atherosclerotic plaques by PCR. J Clin Microbiol 2000;38:4408-11. [ Links ]
25. Smieja M, Mahony J, Petrich A, Boman J, Chernesky M. Association of circulating Chlamydia pneumoniae DNA with cardiovascular disease: a systemic review. BMC Infect Dis 2002;2:21. [ Links ]
26. Kuo CC, Campbell LA. Detection of Chlamydia pneumoniae in arterial tissues. J Infect Dis 2000;181: 432-6. [ Links ]
27. Moazed, TC. Kuo CC, Grayston JT, Campbell LA. Evidence of systemic dissemination of Chlamydia pneumoniae via macrophages in the mouse. J Infect Dis 1998;177:1322-5. [ Links ]
28. Gieffers J, van Zandbergen G, Rupp J, Sayk F, Krüger S, Ehlers S, et al. Phagocytes transmit Chlamydia pneumoniae from the lungs to the vasculature. Eur Respir J 2004;23:506-10. [ Links ]
29. Grayston JT. Background and current knowledge of Chlamydia pneumoniae and atherosclerosis. J Infect Dis 2000;181:402-10. [ Links ]
30. Jackson LA, Campbell LA, Schmidt RA, Kuo CC, Cappuccio AL, Lee MJ, et al. Specificity of detection of Chlamydia pneumoniae in cardiovascular atheromas. Evaluation of the innocent bystander hypothesis. Am J Pathol 1997;150:1785-90. [ Links ]
31. Selzman CH, Netea MG. Zimmerman hypothesis. J Thorac Cardiovasc Surg 2003;126:688-93. [ Links ]
32. Fong IW, Chiu B, Viira E, Jang D, Mahony JB. De novo induction of atherosclerosis by Chlamydia pneumoniae in a rabbit model. Infect Immun 1999;67:6048-55. [ Links ]
33. Laheij RJF, van Marrewijk CJ. Endovascular stenting of abdominal aortic aneurysm in patients unfit for elective open surgery. Eurostar group. European collaborators registry on stent-graft techniques for abdominal aortic aneurysm repair. Lancet 2000;356:832. [ Links ]
34. Juvonen T, Biancari F, Juvonen J. Chlamydia pneumoniae and aortic aneurysms. Scand Cardiovasc J 2002;36:327-8. [ Links ]
35. Halme S, Juvonen T, Laurila A, Juvonen J, Mosorin M, Saikku, et al. Chlamydia pneumoniae reactive T lymphocytes in the wall of abdominal aortic aneurysms. Eur J Clin Invest 1999;29:546-52. [ Links ]














