Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157On-line version ISSN 2590-7379
Biomédica vol.26 no.1 Bogotá Mar. 2006
Comités de ética de investigación en humanos:
el desafío de su fortalecimiento en Colombia
María Consuelo Miranda 1, Gloria I. Palma 2, Ernesto Jaramillo 3
1 Centro Internacional de Entrenamiento e Investigaciones Médicas, CIDEIM, Cali, Colombia.
2
Facultad de Salud, Universidad del Valle, Cali, Colombia.3
Escuela de Salud Pública, Facultad de Salud, Universidad del Valle, Cali, Colombia.Introducción.
Los comités de ética de investigación en humanos que aplican los estándares internacionales en la evaluación ética de proyectos de investigación son un recurso indispensable para garantizar la integridad ética de la investigación en humanos.Objetivo. El presente trabajo se propuso conocer las características de los comités de ética de investigación en humanos y sus necesidades con miras a su fortalecimiento en Colombia.
Materiales y métodos. En el 2003, se seleccionaron 280 grupos de investigación en humanos de un listado de grupos de investigación que acudieron a la convocatoria del año 2002 de la Red de Ciencia y Tecnología de Colciencias. El 80% de estos grupos pertenecía a 40 instituciones entre universidades, hospitales y centros de investigación públicos y privados.
Treinta de 40 instituciones tenían comité de ética. Se les envió un cuestionario que indagaba sobre la constitución, reglamentación, composición multidisciplinaria, pluralidad, representatividad e independencia de los comités. Las respuestas se analizaron utilizando como referencia las Guías operacionales para comités de ética de investigación biomédica (TDR/PRD/ETHICS/2000). Se complementó la información obtenida mediante discusiones con miembros de estos comités en cinco ciudades del país.
Resultados. Veintiséis comités respondieron la encuesta. El 47% de los miembros eran médicos, 23% de los comités tenía un miembro representante de la comunidad, 40% tenía un miembro independiente, 70% tenía manual de operaciones. Mencionaron la necesidad de mejorar la constitución de los comités, la capacitación de sus miembros, la regulación y las guías nacionales.
Conclusión. Es urgente que en Colombia se elaboren guías nacionales para los comités de ética de investigación basados en estándares internacionales, se capacite a sus miembros y se promueva la integridad ética de la investigación.
Palabras clave: comités de ética de investigación, investigación biomédica, ética.
Ethics review committees for human research: the challenge of strengthening this process in Colombia.
Introduction. Ethics committees are a necessary resource to guarantee ethical integrity in human research; they must apply international standards in their ethical evaluation of research projects involving human subjects.
Objective. The ethics committees for human research of Colombia were characterized, and recommendations for strengthening them were formulated.
Materials and Methods. In 2003, 280 groups with research projects involving human subjects were selected from a list of research groups which form part of the science and technology network of Colciencias. (Colciencias is the Colombian national agency that promotes and funds science and technology.) Eighty percent (224) of the projects were associated with 40 institutions, consisting of universities, hospitals, and public or private research centers. Thirty of these institutions had at least one ethics committee for evaluating use of human subjects. A questionnaire was mailed to each of these Committees, requesting information concerning its their compostition, regulations, multidisciplinarity, plurality, representativity and independence.
The World Health Organizations Operational Guidelines for Ethic Committees that Evaluate Biomedical Research (TDR/PRD/ETHICS/2000) was used as reference for the analysis. In 5 of the cities, supplemental information was obtained by direct discussions with members of the ethics committees.
Results. Twenty-six committees responded to the questionnaire. The results indicated that 47% of the committee members were physicians,but only 23% of the committees had representatives from the community. In 60% of the Committees, members were not independent from the organization in which it was based. Seventy percent had established operating procedures. Lack of national regulations and limited education in research ethics were mentioned as the main drawbacks in providing effective guidance.
Conclusions. These observations led to the conclusion that national guidelines must be established for ethics committees that correspond to international standards. Committee members must be trained before accepting committee responsibilities. Finally, new committees must be created along with the improvement of the currently existing committees for reinforcing and promoting the importance of ethical integrity in research.
Keywords: Ethics committees, research, biomedical research, ethics.
Los comités de ética de investigación en humanos que aplican los estándares internacionales en la evaluación ética de proyectos de investigación son un recurso indispensable para garantizar la integridad ética de esas investigaciones, y son esenciales para el desarrollo de la capacidad de respuesta de un país a la necesidad de generar conocimiento. Estos estándares científicos y éticos para el desarrollo de la investigación biomédica con participantes humanos, se han establecido según lineamientos internacionales que incluyen la Declaración de Helsinki (1), los lineamientos éticos internacionales para investigación biomédica con sujetos humanos del Concilio para Organizaciones Internacionales de Ciencias Médicas (CIOMS)(2), los lineamientos para la buena práctica clínica de la Conferencia Internacional de Armonización de Requerimientos Técnicos para el Registro de Fármacos para Uso en Humanos (3) y las guías operacionales para comités de ética que evalúan la investigación biomédica (4). De acuerdo con lo observado en otros países latinoamericanos, se tiene la impresión de que la velocidad de los avances científicos en el campo de las ciencias biomédicas no ha corrido paralela con avances semejantes en el campo de la bioética y de la ética de la investigación (5).
En el 2003, en Colombia existían alrededor de 125 grupos de investigación en salud reconocidos por el Instituto Colombiano para el Desarrollo de la Ciencia y la Tecnología "Francisco José de Caldas", Colciencias (entidad del estado colombiano que fomenta y financia investigación); estos grupos estaban distribuidos en Bogotá (28 a 90 grupos), Antioquia (20 a 27 grupos), Caldas, Santander y Valle (3 a 19 grupos), Risaralda, Quindío y Atlántico (2 grupos), y Cauca y Tolima con un grupo de investigación cada uno. El reconocimiento representa la calidad de estos grupos de investigación de acuerdo con criterios tales como el número de proyectos financiados, el número de investigadores, el grado de formación de sus investigadores (al menos, un investigador con doctorado en ciencias de la salud, maestrías, etc.), y el número de publicaciones en revistas indexadas, pero no se conocía del desarrollo de estos grupos en el campo de la ética de la investigación en humanos.
A partir de 1993, en el país se hizo un primer intento de establecer normas técnicas y administrativas y algunas normas éticas para la investigación en salud con la Resolución 008430 del entonces Ministerio de Salud (6). Esta resolución no contempla la creación, ni el funcionamiento, ni la regulación de estos comités, aunque sí exige la creación de un comité de ética de investigación en toda institución que realice investigación biomédica. Los organismos responsables de promover la evaluación ética de los proyectos de investigación han dado pasos significativos en este campo; sin embargo, sólo en 1999 Colciencias hizo obligatorio que todos los proyectos de investigación que se presentaran a concurso en las convocatorias del Programa Nacional de Ciencia y Tecnología de la Salud se ajustaran a dicha resolución y fueran evaluados y aprobados por un comité de ética de investigación.
Si bien es cierto que en Colombia no existen guías para la conformación y funcionamiento de los comités, internacionalmente existen estos lineamientos que introducen principios que guían el funcionamiento de los comités de ética de investigación biomédica y hacen recomendaciones sobre su conformación.
El programa especial para investigación y entrenamiento en enfermedades tropicales ( Special Programme for Research & Training In Tropical Diseases - TDR), establece en el documento Guías operacionales para Comités de Ética que evalúan investigación biomédica, publicado por la Organización Mundial de la Salud (OMS) (4), que los comités deben constituirse para asegurar la revisión y evaluación competente de todos los aspectos éticos de los proyectos de investigación que reciban, y deben asegurar que sus labores puedan desarrollarse libres de sesgo e influencias que afecten su independencia. Estos comités deben tener una composición multidisciplinaria, es decir que sus miembros provengan de diferentes áreas y disciplinas, por ejemplo, del área psicosocial (filósofos, psicólogos, antropólogos), del área de las ciencias médicas (médicos, biólogos, bacteriólogos), del área administrativa y de leyes (abogados, administradores). Los comités también deben ser multisectoriales, es decir, representar diferentes sectores de la sociedad: por ejemplo, miembros que se desempeñen en el sector público y en el sector privado, y de diferente orientación política. Además, sus integrantes deben tener conocimiento científico relevante, con una distribución balanceada de sexo y edad, y entre ellos debe haber personas naturales que representen los intereses y asuntos de la comunidad. Igualmente, la Guía de la Conferencia Internacional de Armonización de Buenas Prácticas Clínicas (3) recomienda que el comité conste de al menos cinco miembros , que haya al menos un miembro cuya área primaria de interés sea un área no científica y que haya por lo menos un miembro ajeno al lugar o institución donde se realice la investigación.
Una de las áreas en las que Colciencias ha expresado interés por llenar el vacío actual es en la evaluación ética de los proyectos de investigación.
Para determinar las necesidades del fortalecimiento de los comités de ética de investigación biomédica en Colombia se propuso realizar un diagnóstico de la situación. Para tal fin, primero se determinó el estado actual de los comités pertenecientes a las organizaciones de la Red de Ciencia y Tecnología identificadas por Colciencias. Esta actividad se complementó con una serie de talleres de actualización para los miembros de los comités sobre las normas y procedimientos propuestos por el Programa TDR para la evaluación ética de proyectos de investigación.
Materiales y métodos
Para determinar el estado actual de los comités en el país se realizó un estudio descriptivo, transversal de tipo censal en instituciones y grupos de investigación de Colombia durante el periodo comprendido entre mayo y noviembre del 2003.
Con el objeto de definir el universo de estudio, se obtuvo de Colciencias el listado de grupos de investigación que participaron en la Sexta Convocatoria a Grupos del año 2002 en el marco del Programa Nacional de Ciencia y Tecnología de la Salud. Por otra parte, la Asociación para el Avance de la Investigación Clínica en Colombia (Avanzar) suministró un listado de universidades con escuelas de medicina e instituciones hospitalarias que informaron tener un comité de ética de investigación en humanos, las cuales habían sido identificadas en un estudio previo en el 2002 (7).
Colciencias suministró un listado con información sobre 340 grupos de investigación provenientes de todo el país. Con la actualización de la información que suministró Avanzar, se completó un listado de 350 grupos de investigación que contenía los siguientes datos: nombre del grupo, nombre del director del grupo, dirección, teléfono, ciudad y correo electrónico.
Se hizo contacto telefónico con todos los grupos de investigación para determinar si realizaban investigación con sujetos humanos. Con base en este criterio se descartaron 70 grupos que, aunque estudiaban problemas de salud humana, lo hacían in vitro o con modelos animales.
Se estableció que de los 280 grupos contactados, 118 reconocidos por Colciencias, el 80% de ellos pertenecía a 40 instituciones públicas y privadas que realizan investigación en seres humanos, entre universidades, hospitales universitarios y centros de investigación independientes.
Telefónicamente se indagó en estas 40 instituciones que realizaban investigación en salud si su estructura organizativa contaba con un comité de ética de investigación. Con este criterio se descartaron 10 instituciones.
Finalmente, se envió la encuesta a 30 comités de ética de investigación en humanos pertenecientes a igual número de instituciones.
La encuesta enviada se diseñó para evaluar la conformación y reglamentación de los comités con base en el documento del Programa TDR Surveying and evaluating ethical review practices (8). Las preguntas se limitaron a la constitución y composición de los comités de ética y a la tenencia o ausencia de un manual de operaciones en cada comité.
Los miembros de los comités y los investigadores que asistieron a los talleres de actualización en normas y procedimientos para comités de ética de investigación biomédica realizados en cinco ciudades de Colombia mencionaron otros aspectos sobre el funcionamiento de estos comités y los requisitos para su fortalecimiento. Esta información fue recogida en un documento elaborado por la persona que coordinó el proyecto. Las sedes de los talleres regionales fueron las ciudades de Bogotá, Medellín, Cali, Bucaramanga y Barranquilla, ya que, de acuerdo con la información suministrada por Colciencias, en estas ciudades se concentra el mayor número de grupos e instituciones de investigación biomédica en Colombia. En cada taller hubo dos facilitadores y, además, se contó con la participación de dos expositores en Bogotá y en Cali.
Con la información obtenida se creó una lista de categorías relevantes para esta investigación.
Resultados
Diagnóstico
En el proceso de establecimiento de la muestra en los grupos de las universidades, se identificaron las situaciones que enumeramos a continuación.
1. En las universidades existe un número variable de grupos de investigación que involucra sujetos humanos.
2. En las universidades en las que se realiza investigación que involucra sujetos humanos, existe un solo comité que evalúa los proyectos de los diversos grupos de investigación de acuerdo con la normatividad establecida por las mismas instituciones.
3. En la mayoría de las universidades en donde existe facultad de medicina, hay un comité que integra a la facultad de medicina con la institución hospitalaria.
Por lo anterior, el número total de grupos de investigación no es igual al número total de comités institucionales de ética.
Al indagar en las 40 instituciones a las que pertenecían los grupos de investigación se pudo establecer lo siguiente.
1. En cuatro de ellas no existía comité de ética de investigación, y sus proyectos de investigación eran evaluados por comités de ética de "otras instituciones".
2. Seis de estas instituciones informaron que no existía un comité como tal, sino que dentro de su estructura administrativa tenían un comité de investigaciones, en el cual participaba un "representante de ética".
Fue así como el grupo quedó conformado por 30 instituciones cuya estructura cuenta con un comité de ética de investigación; esto corresponde a un número muy bajo (11%) de comités respecto al número de grupos (280) que realizan investigación en humanos. Este número es insuficiente, especialmente en las universidades grandes, en las cuales un comité debe evaluar y hacer seguimiento a un promedio de 7 grupos de investigación que generan un número variable de proyectos (entre 3 y 10 al año) de investigación que involucran humanos y que requieren de revisión y seguimiento por parte de un comité.
Resultados de la encuesta
Veintiséis comités de ética de investigación en humanos respondieron la encuesta, lo que corresponde al 87% de los comités identificados (figura 1).
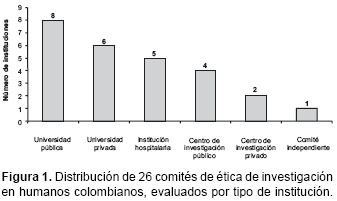
Las instituciones de base de la mayoría de los comités eran universidades públicas o privadas. Los demás comités pertenecían a instituciones hospitalarias, centros de investigación, y un comité de ética informó ser independiente (
figura 1). El número promedio de miembros de los comités de ética es de 8 personas, con un mínimo de 3 miembros y un máximo de 14. En el 50% de los comités se encontró equidad referente a la constitución por sexo, y en el otro 50%, entre 70% y 100% de los miembros son de un mismo sexo. El perfil profesional de los miembros de nuestros comités, así como otros aspectos evaluados se muestran en los cuadros 1 y cuadro 2.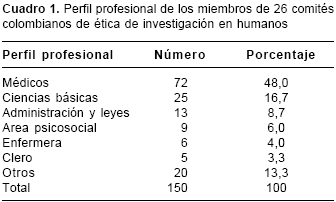

Talleres de actualización para comités de ética en investigación biomédica
A los talleres de actualización asistieron entre 20 y 39 personas por cada taller. Los participantes pertenecían a grupos y centros de investigación, a los comités, y asistieron, así mismo, representantes del Instituto Nacional de Salud y de Colciencias. En los talleres participaron 82 miembros de 26 comités y 119 investigadores que hacían parte de las instituciones identificadas que realizan investigación biomédica.
A continuación se listan los principales aspectos mencionados por los asistentes a estos talleres como requisitos para el fortalecimiento de los comités.
· La necesidad de conformar en cada institución universitaria, comités de ética que evalúen y establezcan un seguimiento a sus proyectos de investigación básica o clínica en humanos.
· La necesidad que tienen los grupos de investigación de capacitarse en la normatividad, funcionamiento y desarrollo de los comités de ética de investigación.
· La necesidad de establecer mecanismos de seguimiento de los proyectos de investigación.
· Se hizo una solicitud para la revisión y actualización de la Resolución 008430 del Ministerio de Salud Nacional, en la que se incluya la regulación para comités de ética de investigación basada en estándares internacionales, en especial las Guías operativas para comités de 'ética que evalúan investigación biomédica (5).
· La necesidad de constituir una red regional y nacional de comités de ética de investigación en humanos que promueva la importancia de la perspectiva ética como un componente insoslayable en la planificación y ejecución de los proyectos de investigación.
Discusión
En la primera parte del proyecto se logró una aproximación para identificar los comités existentes y determinar su estado actual con respecto a su constitución, composición y tenencia de manual de operaciones. Hay limitaciones respecto a los hallazgos de esta etapa, pues no se incluyeron otros aspectos importantes de evaluación de un comité de ética de investigación en humanos, tales como su funcionamiento, debilidades y fortalezas. Esta limitación se trató de superar al recoger los aspectos necesarios para el fortalecimiento de los comités, mencionados por los asistentes a los talleres de actualización realizados en la segunda etapa del proyecto. Además, la divulgación de los resultados preliminares de este diagnóstico sirvió como una estrategia didáctica de autoevaluación para los comités participantes en los talleres.
Los hallazgos de este proyecto indican claramente que la capacidad de respuesta de los comités existentes es insuficiente frente a las necesidades de los grupos y centros de investigación en Colombia. Llama la atención que algunas instituciones y grupos reconocidos por Colciencias por la calidad de sus investigaciones en seres humanos informaron no tener comité de ética de investigación; en otras instituciones, el comité de ética no funcionaba regularmente, sino que se constituía temporalmente de acuerdo con las convocatorias para financiación de proyectos de investigación. La calidad de las investigaciones de estas instituciones es limitada si carece de un espacio de análisis y reflexión plural, garante del respeto y del cuidado debido a la dignidad de los participantes humanos de sus proyectos de investigación.
En la mayoría de los comités evaluados existen debilidades respecto a la constitución, composición y reglamentación; no existe independencia de sus miembros con respecto a la institución a la que pertenece el comité; la mayoría carece de miembros que representen los intereses y asuntos de la comunidad; no hay una constitución balanceada de sus miembros en cuanto a sexo, y se requiere mejorar el aspecto de la composición multi-disciplinaria. Estas debilidades influyen negativamente en el desempeño de los comités, y la evaluación ética de los proyectos de investigación puede verse afectada por conflictos de interés, o por una visión reducida o carente de objetividad frente a las consideraciones éticas que suscite un proyecto de investigación. Obviamente, todo lo anterior va en detrimento del objetivo primordial de los comités, que es la protección de los sujetos humanos participantes en las investigaciones. Sin embargo, el interés de los participantes en los talleres por mejorar estos aspectos en sus respectivos comités constituye una fortaleza. La propuesta conjunta de todos los participantes en los talleres es continuar con el fortalecimiento de los comités de ética de investigación en humanos mediante la capacitación de sus miembros y de los investigadores en ética de la investigación. Para tal fin es fundamental elaborar guías nacionales para el desarrollo de la actividad investigativa en salud, y revisar y actualizar la Resolución 008430 de 1993 del Ministerio de Salud Nacional. Esta revisión debe incluir la normatividad para los comités nacionales de ética de investigación, para lo cual las guías propuestas por el Programa TDR pueden ser un adecuado punto de referencia.
Los hallazgos de esta investigación subrayan la urgente necesidad de conformar y de darle mayor operatividad a los comités de ética de investigación en humanos acordes con los estándares internacionales de la revisión ética.
Seguidamente, el Estado debe asumir el compromiso de divulgar estas normas, además de regular, vigilar y avalar la constitución y el funcionamiento de los comités de ética de investigación en salud a nivel nacional.
De esta manera se fortalece la capacidad de respuesta de los centros y grupos de investigación a los desafíos cada vez más complejos de la investigación en humanos.
Agradecimientos
Agradecemos la colaboración de Luz Elena Cristancho en la obtención de información; de Mauricio Pérez y Carlos Quiceno del CIDEIM en el análisis de la información; de Avanzar; de Roberto Rivera en Family Health Internacional; del Foro Latinoamericano de Comités de Ética de Investigación en Salud (FLACEIS) y su presidenta, Dafna Feinholz, en la obtención de información y en la participación en los talleres.
Agradecemos la colaboración en la realización de los talleres de Raymundo Abello y Alexandra Bolaños, Universidad del Norte (Barranquilla); Sergio Isaza y Beatriz Santos, Fundación Santa Fé (Bogota); Federico Silva y Luisa Osorio, Fundación Cardiovascular de Colombia (Bucaramanga); Adolfo Contreras, Universidad del Valle (Cali) y Leida Sánchez, Hospital Pablo Tobón Uribe (Medellín)
Conflicto de intereses
Los autores manifiestan que no existe ningún conflicto de interés.
Financiación
Este proyecto fue financiado por la UNESCO (contrato 183632.05 COL) y el CIDEIM, y contó con el apoyo institucional de Colciencias y la Facultad de Salud de la Universidad del Valle.
Correspondencia:
Maria Consuelo Miranda, Centro Internacional de Entrenamiento e Investigaciones Médicas (CIDEIM).
- Avenida 1N # 3-03, Cali, Colombia
Teléfono: (572) 668 2164. Fax. (572) 667 2989
Recibido: 13/06/05; aceptado: 23/10/05
Referencias
1. Asociación Médica Mundial. Declaración de Helsinki. Principios éticos para las investigaciones médicas en seres humanos. 52ª Asamblea General. Edimburgo, Escocia: Organización Mundial de la Salud; 2000. [ Links ]
2. Consejo de Organizaciones Internacionales de las Ciencias Médicas (CIOMS)/Organización Mundial de la Salud (OMS). Pautas éticas internacionales para la investigación biomédica en seres humanos. Ginebra: Organización Panamericana de la Salud/Organización Mundial de la Salud; 2002. [ Links ]
3. Conferencia Internacional de Armonización. Guía tripartita armonizada de la Conferencia Internacional de Armonización. Lineamientos para la buena práctica clínica (BPC) sobre requerimientos técnicos para el registro de productos farmacéuticos para uso en humanos. Conferencia Internacional de Armonización (CIARM © ICH), 1997. Disponible en:
http://www.fda.gov/cder/guidance/959fnl-spanish.pdf [ Links ]4. Organización Mundial de la Salud. Guías operacionales para comités de ética que evalúan investigación biomédica.TDR/PRD/ETHICS/2000.1. Ginebra: Organización Mundial de la Salud; 2000. [ Links ]
5. Serrano La Vertu D, Linares AM. Ethical principles of biomedical research on human subjects: their application and limitations in Latin America and the Caribbean. En: Scolle S, Fuenzalida-Puelma HL, editors. Bioethics issues and perspectives. Washington: PAHO; 1990. p.107-15. [ Links ]
6. República de Colombia. Ministerio de Salud de Colombia. Normas científicas, técnicas y administrativas para la investigación en salud. Resolución 008439 de 1993. [ Links ]
7. Ortegón M, Alvarado R, Alterio MG, Garzón F. Primera Encuesta Nacional sobre la Estructura, Organización y Funcionamiento de los Comités de Ética en Investigación en Colombia. Avanzar Forum 2002;3. [ Links ]
8. World Health Organization. Surveying and Evaluating Ethical Review Practices. TDR/PRD/ETHICS/2002.1. Geneva: World Health Organization; 2002. [ Links ]














