Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157On-line version ISSN 2590-7379
Biomédica vol.26 no.4 Bogotá Dec. 2006
Leishmaniasis cutánea difusa en un paciente con sida
Carlos Pérez 1, Yoanet Solías 1, Gerzaín Rodríguez 2
1Departamentos de Medicina Interna y Servicio de Dermatología, Hospital Militar Central, Bogotá D.C., Colombia
2
Departamento de Patología y Laboratorio de Biología Molecular de las Micobacterias, Facultad de Medicina, Universidad de La Sabana, Chía, Cundinamarca, ColombiaObjetivo. Estudiar un paciente con leishmaniasis cutánea difusa y sida y comentar el tema.
Materiales y métodos. Soldado de 29 años, procedente de San José del Guaviare, con pérdida de 18 kilos de peso en los últimos 10 meses y erupción generalizada de dos meses de evolución. El Elisa y el Western blot fueron positivos para virus de inmunodeficiencia humana. Tenía 92 LT CD4/mm3. Presentaba máculas, pápulas y placas eritematoescamosas, psoriasiformes y generalizadas, cuyas biopsias demostraron abundantes microorganismos fagocitados por macrófagos, que se teñían de negro con la coloración de Gomory. Se diagnosticó histoplasmosis diseminada. Se inició tratamiento antirretroviral y antimicótico con itraconazol sin observar mejoría.
Resultados. La anfotericina B produjo mejoría, pero las lesiones recidivaron más numerosas y nodulares con compromiso oral. Once meses después del comienzo de su enfermedad, nuevas biopsias de piel y la revisión de las anteriores confirmaron que el paciente tenía leishmaniasis cutánea difusa. El cultivo no permitió aislar el parásito. La miltefosina produjo mejoría importante. Las pápulas y máculas recidivaron varios meses después; recibió 52 ampollas de glucantime® durante dos meses, consiguiéndose la curación clínica, situación que permanece dos años y medio después de iniciada la enfermedad.
Conclusiones. La leishmaniasis cutánea difusa debe plantear sospecha de sida. El tratamiento es difícil; debe ser antirretroviral y antileishmaniásico, con profilaxis antiparasitaria. Los amastigotes de Leishmania no son positivos con la coloración de Gomory en técnicas controladas; se diferencian del histoplasma por morfología, cultivo, inmunohistoquímica, anticuerpos específicos y reacción en cadena de la polimerasa. La asociación leishmaniasis-sida es beneficiosa para ambos gérmenes; es posible el aumento de casos en Colombia por el auge de ambas entidades.
Palabras clave: leishmaniasis, leishmaniasis cutánea difusa, síndrome de inmunodeficiencia adquirida, infecciones oportunistas relacionadas con sida, diagnóstico diferencial, inmunosupresión.
Diffuse cutaneous leishmaniasis in a patient with AIDS
Objective: A patient with a leishmaniasis-Aids co-infection was presented and discussed..
Methods and results: A 29-year -old soldiier, coming from the Province of San José del Guaviare, Colombia, complained of a weight loss of 18 kgs in the previous ten months as well as a two-month-old cutaneous leision. Elisa and Western blot tests were positive for HIV infection. LT CD4 were 92/mm3. He had a generalized erythematous, psoriasiform dermal lesion,which, upon biopsy, revealed an abundance of phagocytosed microorganisms that stained black with Gomorys technique. Disseminated histoplasmosis was diagnosed. The patient received anti-retroviral therapy and itraconazole, without regression of the lesions. Amphotericin B was beneficial but the lesions recurred several months later, more numerous, nodular and with occurrence in the oral mucosa. Nine months after the initial diagnosis additional skin biopsies and review of the previous biopsies established that the patient had diffuse cutaneous leishmaniasis. The leishmania parasite did not grow in culture. Miltefosine produced marked improvement, but the lesions recurred and were cured finally with 52 Glucantime® injections administered for two months. Presently, the patient remains in good condition 21 months after diagnosis of leishmaniasis.
Conclusions: Diffuse cutaneous leishmaniasis may be a common clinical manifestation when leishmaniasis and AIDS co-occur. Its treatment is difficult and must include an antiparasitic drug as well as prophylactic,and anti-retroviral therapy. Leishmania amastigotes typically are not Gomory-positive and can be differentiated from Histoplasma by morphology, immunohistochemistry, culture, antibody-specific response and PCR. The leishmaniasis-AIDS co-infection enhances invasive capacity for both causal microorganisms. Increasing case numbers can be expected in Colombia, due to the high frequency of both diseases.
Key words: leishmaniasis, diffuse cutaneous leishmaniasis, leishmaniasis-AIDS co-infection, leishmaniasis and disseminated histoplasmosis, differential diagnosis, AIDS-related opportunistic infection, immunosuppression.
La inmunosupresión inherente al sida permite la aparición de enfermedades oportunistas con cuadros clínicos sorprendentes, de diagnóstico y tratamiento difíciles. Cuando la entidad oportunista es parasitaria, su curso es más grave, empeora con el aumento de la inmunosupresión, el número de microorganismos es enorme y las recidivas de la enfermedad aparentemente controlada son comunes (1-5). Tal es el caso de las leishmaniasis, que han adquirido el carácter de enfermedades oportunistas en todos sus síndromes, cutáneo, mucoso y visceral, cuando afectan a un enfermo con sida (1-10). La situación más grave se presenta con la leishmaniasis visceral, frecuente en España, Portugal, Italia, Francia, Bengala, India, Nepal, Sudán y Brasil, países que en conjunto aportan el 90% de los 600.000 nuevos casos anuales de la enfermedad, originando al menos 59.000 muertes en el mismo periodo (3,4,8,9,11). La leishmaniasis visceral es un indicador de sida, y se ha sugerido su inclusión entre las enfermedades oportunistas que definen el sida según los Center for Disease Control and Prevention y la Organización Mundial de la Salud (OMS) (1-11).
En Colombia, el problema se centra en la leishmaniasis cutánea, de la cual ocurrieron en 2005 cerca de 18.000 casos nuevos (12,13). Al menos 8.000 casos se presentaron en soldados de las áreas rurales o selváticas del país, de los cuales un 8% adquiere la enfermedad luego de un año de permanencia en un área endémica (14). Así, hasta marzo de 2006 se habían registrado 3.500 casos nuevos de leishmaniasis cutánea en las Fuerzas Militares (12,13). Es por lo tanto probable que entre tanta casuística se presenten casos de coinfección leishmaniasis-sida, situación que estudiamos en esta presentación del caso de un hombre joven con lesiones cutáneas diseminadas, maculosas, papulares, nodulares, descamativas y psoriasiformes, que originaron considerable dificultad en su diagnóstico y tratamiento.
Caso clínico
Se presenta el caso de un soldado de 29 años de edad procedente de San José del Guaviare. Ingresó al hospital el 30 de septiembre de 2003 por pérdida de 18 kilos de peso en los 10 meses previos y diarreas esporádicas. Desde hacía dos meses presentaba una erupción cutánea generalizada. Ocho años antes había sido tratado por herpes genital, que curó sin recidivas, y cinco años antes había sufrido una herida por arma de fuego en su pierna izquierda. Al examen se vieron máculas y pápulas eritematosas, pitiriasiformes, que confluían para formar placas que afectaban toda la superficie cutánea (
figura 1A y figura 1B), incluyendo las palmas y plantas. Presentaba adenopatías axilares e inguinales, no confluentes ni dolorosas, blandas, cauchosas, de menos de un centímetro de diámetro.Los exámenes de laboratorio mostraron leucocitopenia de 2.880 leucocitos/mm3, con recuento diferencial normal. La hemoglobina, plaquetas, glicemia, electrolitos, transaminasas, uricemia, proteínas totales, albúmina, amilasa sérica, fosfatasa alcalina, creatinina, BUN, LDH, VDRL, parcial de orina y coprológico fueron normales. La IgG para toxoplasma fue positiva y la IgM negativa. El Elisa para VIH fue positivo, lo mismo que la prueba de Western blot. El recuento de LT CD4 fue de 92/mm3. Las lesiones cutáneas sugirieron leucemia o linfoma. La biopsia reveló una dermatitis difusa con abundantes microorganismos fagocitados por macrófagos que se interpretaron como Histoplasma capsulatum porque se impregnaron de negro con la coloración de plata metenamina (Gomory) (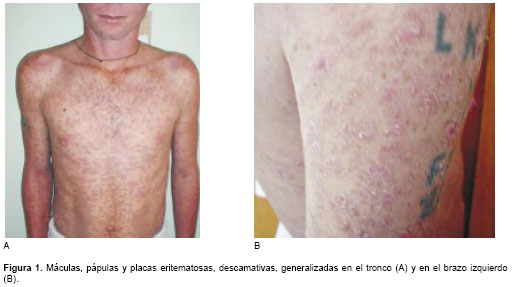
Se inició tratamiento antirretroviral con zidovudina, lamivudina, lopinavir/ritonavir; antimicótico con itraconazol, y profiláctico con trimetoprim sulfametoxazol y azitromicina. En octubre de 2003 había mejoría discreta de sus lesiones cutáneas y el recuento de los LT CD4 fue de 181/mm3. Una nueva biopsia de piel dio resultados semejantes a la anterior. Continuó con el tratamiento establecido. En febrero de 2004 reingresó porque las lesiones habían aumentado en número y tamaño. Nuevas biopsias de piel sugirieron histoplasmosis. Recibió anfotericina B intravenosa durante 20 días, hasta completar un gramo de dosis total, la cual toleró muy mal; presentó fiebre, escalofríos y artromialgias. Las lesiones se aplanaron, pero no remitieron completamente. Continuó con la dosis óptima de itraconazol (400 mg/día). Regresó en agosto de 2004 porque las lesiones eran más grandes y numerosas; algunas eran nódulos prominentes y ulcerados (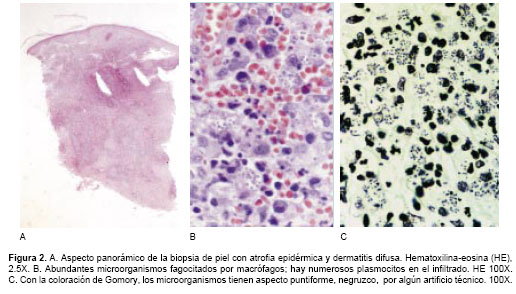
Se tomaron nuevas biopsias de piel y se revisaron las anteriores, concluyéndose que el paciente tenía leishmaniasis cutánea difusa confirmada con inmunohistoquímica (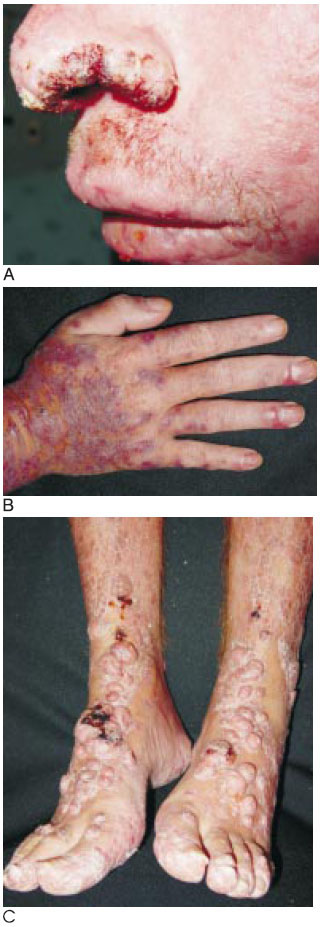
Se instauró tratamiento con miltefosina en dosis de 2,5 mg/kg/día, que toleró bien, con mejoría notoria de sus lesiones. Una biopsia de control mostró pocos amastigotes, aparentes sólo con la técnica inmunohistoquímica, por lo cual se prolongó la terapia durante 52 días; la inflamación cutánea se tornó epitelioide y había focos de necrosis fibrinoide, indicios de recuperación inmune y de hipersensibilidad. En enero de 2006 las lesiones recidivaron, por lo cual recibió en otro centro asistencial 52 ampollas de antimoniato de meglumina (Glucantime®) con remisión de sus pápulas y nódulos cutáneos. En mayo de 2006 no presentaba lesiones cutáneas de leishmaniasis. Se prescribió una dosis profiláctica mensual de 20 mg/kg de peso de antimonio pentavalente (Glucantime®). Discusión El diagnóstico de sida en este paciente se sospechó clínicamente por su marcada pérdida de peso y el deterioro de su estado general, y fue rápidamente confirmado por el laboratorio. La biopsia de piel demostró una dermatitis difusa con enorme número de gérmenes intracelulares fagocitados por macrófagos, que se interpretaron como Histoplasma capsulatum en varias biopsias porque tomaron color negruzco con la coloración de plata-metenamina (Gomory). El manejo con itraconazol y la terapia antirretroviral no mejoraron la condición cutánea, por lo cual se usó la anfotericina B, antibiótico efectivo tanto contra Histoplasma como contra Leishmania (8); produjo mejoría rápida pero con recaída seis meses después, a pesar de continuar con el itraconazol. Además, no sólo se presentó la recaída de las lesiones sino la aparición de otras nuevas, algunas nodulares y otras en la mucosa oral, que condujeron a la revisión de las biopsias y a la toma de otras, así como al frote directo, con lo que se confirmó la presencia de leishmaniasis cutánea difusa en el enfermo. No se habían practicado cultivos ni pruebas inmunológicas, pero al realizarse no permitieron aislar el parásito ni precisar su especie. En la región de San José del Guaviare, en donde con mayor probabilidad el paciente adquirió la leishmaniasis, se ha confirmado la presencia de L. braziliensis, L. amazonensis y L. panamensis (15), hecho que explica la resistencia del parásito al itraconazol, medicamento que ha sido útil en el tratamiento de leishmaniasis producida por otras especies (4,8). El diagnóstico diferencial histopatológico de la leishmaniasis cutánea difusa es la histoplasmosis diseminada (16), con consideraciones secundarias para la micosis por Penicillium marneffei, no descrita en América, para la tripanosomiasis y la toxoplasmosis (2). La histoplasmosis y la leishmaniasis cutánea difusa muestran enorme número de microorganismos fagocitados por los macrófagos y la histoplasmosis diseminada asociada con el sida es común en nuestro país (16). Los hongos tienen 2 a 5 micras de diámetro, son redondeados y con un halo a su alrededor que sugiere una cápsula, de donde proviene su nombre; son PAS positivos y con la coloración de plata metenamina se tiñen de negro, en conglomerados o en cadenas con gemación, características que no tienen los amastigotes, los cuales no se tiñen con la coloración de Gomory; pero en este caso, los núcleos de los amastigotes se impregnaron con el nitrato de plata (AgNO3) por algún artificio de la técnica histológica, prestándose la confusión con Histoplasma. Los amastigotes tienen cinetoplasto fácil de visualizar con la coloración de hematoxilina-eosina y con la de Giemsa, no forman conglomerados sino que tienden a permanecer adosados a la membrana del fagosoma que los alberga y no presentan gemación. El diagnóstico histopatológico de leishmaniasis cutánea difusa, leishmaniasis visceral o histoplasmosis se debe confirmar con otras técnicas tales como el examen directo, la inmunohistoquímica, el cultivo, los títulos de anticuerpos y técnicas de biología molecular (17-20), lo cual excluye toda posibilidad de error. No es rara la confusión entre histoplasmosis y leishmaniasis visceral en el ganglio linfático o en las biopsias del hígado (21), lo cual puede tener consecuencias catastróficas para el paciente. Algunos casos de leishmaniasis en pacientes con sida se han interpretado inicialmente como histoplasmosis y paracoccidioidomicosis (22-24). Una vez confirmado el diagnóstico de leishmaniasis cutánea difusa era necesario excluir que el paciente tuviera leishmaniasis visceral, aunque no presentara esplenomegalia ni hepatomegalia, lo cual es posible hasta en cerca del 20% de los enfermos con sida y leishmaniasis visceral, aunque la clínica de los pacientes con coinfección leishmaniasis visceral-sida no es muy diferente de la clásica (3,9,18,25,26). La biopsia de médula ósea no mostró amastigotes. Es útil recordar que si bien la zona de procedencia del enfermo no es un área epidemiológica para L. chagasi, agente etiológico de la leishmaniasis visceral en Colombia (27), en los pacientes con sida cualquier especie de Leishmania que afecte la piel puede generalizarse y originar compromiso visceral y parasitar cualquier célula del sistema de macrófagos, en cualquier tejido u órgano, inclusive en el sistema nervioso central (3-5,25,26,28). En otras palabras, la localización de las lesiones no depende de la especie del parásito sino del estado inmune del hospedero (4). En las leishmaniasis cutáneas, la profusión de lesiones papulosas o nodulares con presencia de un número variable de amastigotes, usualmente muy abundante, ofrece cuatro formas clínicas y epidemiológicas diferentes. 1. La leishmaniasis cutánea difusa es una forma anérgica de la enfermedad, con múltiples lesiones cutáneas que comienzan con una pápula o con un nódulo, que tarda tres meses a varios años en diseminarse (29,30). Es producida por L. mexicana, L. amazonensis y L. pifanoi en América y por L. tropica en África (29-32), parásitos que son muy abundantes en las lesiones. El paciente no está inmunosuprimido, su anergia es específica ante el parásito, la leishmanina es negativa y el tratamiento farmacológico es inefectivo una vez que la enfermedad se ha diseminado, aunque hay buena respuesta a la inmunoterapia (33). En las fases iniciales, con lesión única, el tratamiento con calor local y glucantime ha sido curativo (30). La enfermedad se caracterizó mejor en Africa y Venezuela (29,32) y apenas hay registro de menos de 10 casos en Colombia (30,31,34). 2. En la leishmaniasis cutánea difusa hay más de 10, y a veces centenares, de pápulas acneiformes, algunas ulceradas; no hay nódulos y el paciente es leishmanina positivo o se torna así con el tratamiento, al cual responde bien en la mayoría de los casos; los parásitos no son particularmente abundantes (35,36). Es otra presentación de la leishmaniasis cutánea, que es importante diferenciar de la leishmaniasis cutánea difusa, con la que se confunde por la abundancia de lesiones clínicas. 3. En la leishmaniasis dérmica post kala-azar se presentan placas y pápulas cutáneas después del tratamiento de la leishmaniasis visceral muy ricas en amastigotes; es propia de Sudán, en donde ocurre en el 50% de los pacientes con leishmaniasis visceral, y de la India, en donde se presenta en 5 a 10% de ellos (4,8). No hay registrados casos en Colombia ni en América (37). Se han descrito pacientes con características semejantes en el sida (38-41). 4. En la leishmaniasis cutánea difusa asociada con el sida, las lesiones cutáneas son manchas, pápulas, placas y nódulos eritematosos muy numerosos (4,22-24,38-51), que semejan los de la lobomicosis, como ocurrió con nuestro enfermo (22-24), variceliformes (23), verruciformes (45), psoriasiformes (48), o semejantes a las placas de la dermatomiositis (49). Tiene la misma denominación mencionada antes en el punto 1, pero aquí las lesiones son más variadas y numerosas y el enfermo tiene la inmunosupresión general que induce el virus del sida. Según el control que se ejerza sobre esa inmunosupresión varía el aspecto clínico y la densidad parasitaria. Las lesiones cutáneas de la leishmaniasis asociadas con el sida no sólo han conducido al diagnóstico de este síndrome sino al de leishmaniasis visceral (6,49,52-54), entidad que en estos enfermos compromete la piel en 8 a 18% de los casos (5,45). La leishmaniasis asociada con el sida puede tomar muchas peculiaridades clínicas, distintas de la forma cutánea difusa. Así, el compromiso de las mucosas oro-rino-faríngeas puede ser la única manifestación de la leishmaniasis cuando no hay historia previa de lesiones cutáneas (55-59); las lesiones mucosas pueden preceder las manifestaciones cutáneas (23,24), o son simultáneas con numerosas lesiones de la piel. Por consiguiente, en Europa, toda forma de leishmaniasis se convirtió en un eventual indicador de sida, y con mayor razón cuando tenía una localización inusual (10,25,26,60,61), si era muy rica en amastigotes (42,59), o si recidivaba después del tratamiento (7,25,45-47,62-65). Una úlcera rectal condujo al diagnóstico de leishmaniasis y de sida (60). Las lesiones mucosas de la leishmaniasis, exóticas en Europa, se tornaron frecuentes y condujeron al diagnóstico de leishmaniasis visceral y de sida (55,57,58). La leishmaniasis visceral podía cursar con la clínica tradicional o sin hepato ni esplenomegalia, o con lesiones aberrantes como la afección pulmonar, gastrointestinal, renal, de la piel y de las mucosas oro-rino-faríngeas (1,4,5,7,9-11,51,52,66). Las lesiones muy ricas en amastigotes deben inducir a sospechar sida o leishmaniasis cutánea difusa, con mayor razón en Colombia en donde los parásitos son difíciles de demostrar en las lesiones de piel de más de dos meses de evolución, y apenas se demuestran en la mitad de los casos mucosos (67). Con el sida también se ha presentado reactivación de las lesiones cutáneas, mucosas o viscerales como expresión de la inmunosupresión nueve a 12 años después de haber sido tratadas (63,64), o cuando el paciente presenta una infección asintomática (4,25). La reactivación de las lesiones permite recordar que una vez que el hospedero adquiere la leishmaniasis, el parásito persiste en él de manera vitalicia y que su ADN se puede demostrar en las cicatrices cutáneas de la leishmaniasis curada (46,51,62-64,68). La leishmaniasis cutánea difusa en sida se ha implantado sobre otras entidades o condiciones. El parásito se ha demostrado sobre lesiones de dermatofibroma, sarcoma de Kaposi, angioma-tosis bacilar, criptococosis, micobacterias atípicas, tatuaje, en la piel normal y dentro de conductos sudoríparos (49,51,53,54,57,61). Es probable entonces que ocurra la coinfección de leishmaniasis e histoplasmosis en un paciente con sida, un reto diagnóstico que los patólogos, infectólogos y laboratoristas deben ser capaces de resolver. Las lesiones cutáneas de leishmaniasis pueden aparecer como expresión de la recuperación inmune del paciente que recibe tratamiento antirretroviral (69,70). La coinfección leishmaniasis visceral o cutánea difusa y sida se ha descrito también en los niños (28,71,72). La coinfección VIH-Leishmania tomó importancia epidemiológica cuando se comenzaron a detectar casos de leishmaniasis visceral asociados con el sida en España, Portugal, Francia e Italia en 1985 (3,7,50,73), y en Brasil en 1987 (40). Hasta 2001 se habían detectado 1.911 casos en Europa, por lo cual fue necesario establecer un programa especial de control y tratamiento con la cooperación de la OMS (11). Se calculó que tener sida aumenta entre 100 y 1.000 veces la posibilidad de tener leishmaniasis visceral, que entre 1,5 y 9% de los pacientes con sida tiene leishmaniasis visceral y que 25 a 60% de los enfermos con leishmaniasis visceral está infectado con el VIH (4,11). Desde entonces, la asociación ha disminuido por las medidas adoptadas para evitar compartir agujas entre los drogadictos intravenosos y por la eficacia del tratamiento antirretroviral (4,10,11). En Europa fue posible apreciar cambios epidemiológicos notorios: por ejemplo, la leishmaniasis visceral propia de los niños comenzó a presentarse en los adultos hasta en el 75% de los casos (4,10,11,50); los pacientes con este tipo de leishmaniasis y sida presentan parasitemias altas y ya no es necesario un reservorio animal del parásito, sino que los pacientes también cumplen esta función (4,9,11,50). Los vectores se infectan picando a estos enfermos (9,11), pero no son estrictamente necesarios porque las agujas que comparten los drogadictos intravenosos son el vehículo de transmisión de la enfermedad y en ellas se demostró el ADN del parásito (11,50,74). La leishmaniasis visceral se convirtió en una antroponosis (3,11). Más de medio centenar de casos de leishmaniasis visceral, difusa y mucosa asociados con el sida se han informado en Brasil (75-77), y hay informes de casos en Perú (64), Argentina (78) y Venezuela (79,80). En Colombia hemos observado dos casos de coinfección leishmaniasis-sida, uno de ellos con la forma visceral, también en un soldado (resultado no publicado), y el descrito aquí. En congresos nacionales se han informado casos; uno de ellos en un paciente procedente también de San José del Guaviare con lesiones tan difusas como el paciente que presentamos y con similares dificultades de tratamiento (Hoyos EV. Leishmaniasis y sida. Simposio Internacional de Dermatología. Piel e infección. Medellín, marzo 17-18 de 2006). Un paciente de Cali con leishmaniasis visceral y sida probablemente adquirió su enfermedad en Europa (R. Rueda, comunicación personal, mayo, 2006). En cuanto al agente etiológico, tanto en Europa como en América, el tradicional tropismo selectivo de la especie de Leishmania por la piel, las mucosas o las vísceras cambió radicalmente y cualquier especie se tornó capaz de producir enfermedad visceral, cutánea, localizada o diseminada, mucosa, o una mezcla de todas ellas, y nuevas especies con zimodemas diferentes se tornaron patógenas (3,25,28,56,68,79,80). El virus del sida y los amastigotes parasitan los macrófagos y las células dendríticas, coexistencia que les permite una cooperación beneficiosa para el parásito y el virus (81-83). El lipofosfoglicano de L. donovani promueve la expresión viral en los macrófagos, y la inducción de una respuesta inmune Th2 por parte del virus propicia la supervivencia de la leishmania, que se controla con una respuesta Th1 centrada en la producción de IL-12 e IFN-gama (84,85). Una acción favorable para el virus ocurre también con la infección por L. infantum (81,82). A su vez, el tratamiento anti-Leishmania disminuye la carga viral (83,85). Esta asociación puede entonces llegar a ser catastrófica para los afectados y origina condiciones clínicas diferentes y asombrosas, como las que hemos tratado de revisar. La leishmaniasis visceral y la mucocutánea se presentan en cualquier fase del sida, pero son más comunes cuando el recuento de LT CD4 es menor de 200/mm3 (4,11); la enfermedad visceral grave, mortal a los 10 a 27 meses, cursa con recuentos menores de 100 LT CD4/mm3 (51,86). Los títulos de anticuerpos antileishmania pueden ser positivos, aun con recuentos muy bajos de LT, ayudan a establecer el diagnóstico de leishmaniasis visceral y pueden indicar si un enfermo de sida hace seroconversión de la enfermedad latente, o si ya tenía anticuerpos y hace reactivación de la enfermedad latente (86). La leishmanina positiva indica mejor pronóstico y se correlaciona con el recuento linfocitario (59). Nuestro paciente ilustra las dificultades del tratamiento con recidivas después de mejorías notorias. Nunca mejoró con el itraconazol, que ha sido útil en el manejo de enfermos con la coinfección producida por otra especie de Leishmania (4,8). Mejoró después de recibir un gramo de anfotericina B, pero recidivó seis meses después. El tratamiento con miltefosina durante 52 días produjo resultados satisfactorios en cuanto a la evolución clínica de las lesiones y el control histopatológico, que reveló franca recuperación inmune y parasitológica. La miltefosina ha sido ensayada con éxito en pacientes colombianos con leishmaniasis cutánea producida por L. braziliensis (87,88) y en pacientes con leishmaniasis y sida (89,90). Probablemente se convierta en el medicamento de elección en el tratamiento de la leishmaniasis visceral (91). La remisión de la enfermedad cutánea se prolongó por cerca de un año y la recidiva respondió al manejo con 52 ampollas de glucantime®. No presentó toxicidad con este medicamento, que en pacientes con sida y leishmaniasis, además de la toxicidad hepática, cardiaca y osteo-muscular, puede originar pancreatitis fatal (92,93). Actualmente el paciente tiene controlada su leishmaniasis, pero apenas ha recibido una dosis de glucantime® profiláctica mensual, prevención que es recomendable (46,93,94). Para este propósito no hay un esquema establecido, pero se ha sugerido una dosis quincenal o mensual de antimonio pentavalente (glucantime®) equivalente a 20 mg/kg de peso, o 50 mg/semanales de anfotericina B, preferiblemente liposomal, o 4mg/kg mensuales de pentamidina intramuscular o intravenosa (47,94). La diamino-difenil-sulfona se ha mostrado útil contra la infección por L. infantum (4,8). Un paciente respondió bien al tratamiento con glucantime® e inmunoterapia con promastigo-tes (95). Siempre debe sopesarse el beneficio terapéutico frente a la toxicidad. La restauración inmunológica que permite la terapia antirretroviral ayuda a evitar las infecciones oportunistas (96), por lo cual es esencial para el control del sida y de la leishmaniasis, pero apenas está disponible para el 5 a 10% de quienes la necesitan (4,51). Las probabilidades de asociación sida-leishmaniasis son menos favorables en nuestro país y en América Latina que en Europa del Sur, Africa y la India porque nuestra leishmaniasis es rural o selvática, y el sida es urbano con mayor frecuencia. A medida que los casos de ambas enfermedades, urbanos y rurales, confluyan o se interconecten, se puede dar la oportunidad para la coinfección Leishmania-VIH (97). En áreas urbanas de nuestro país se han encontrado vectores de leishmaniasis, así como casos de la enfermedad (98). Los soldados colombianos, campesinos que van a los cuarteles urbanos y luego a las selvas y territorios en conflicto armado, constituirían una población en la que la coinfección podría ser más frecuente. Los médicos deben estar prestos a prevenirla, identificarla y manejarla. Agradecimientos A Edgard Parra del Laboratorio de Patología de Instituto Nacional de Salud (INS) por los estudios inmunohistoquímicos y por su ayuda en la toma de microfotografías digitales. Al laboratorio de Parasitología del INS por su colaboración en el intento de cultivo de Leishmania. Conflicto de intereses Los autores declaran que no tienen ningún conflicto de intereses con respecto a lo expresado en este trabajo. Financiación Hospital Militar Central (Bogotá) y Universidad de La Sabana (Chía, Cundinamarca). Correspondencia: Gerzaín Rodríguez, Facultad de Medicina, Universidad de La Sabana, Chía, Cundinamarca, Colombia. Tel 8615555, extensión 2664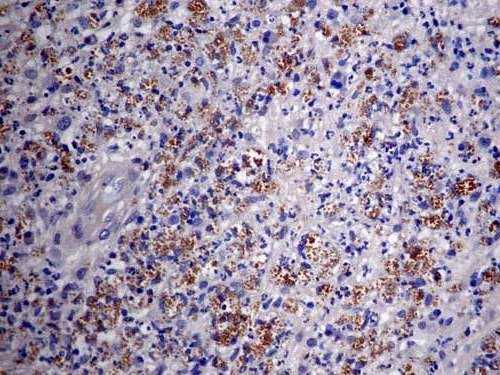
Recibido: 28/06/06; aceptado: 08/09/06
Referencias
1. Albrecht H. Leishmaniosis- new perspectives of an underappreciated opportunistic infection. AIDS 1998;12:2225-6. [ Links ]
2. Albrecht H. Redefining AIDS: towards a modification of the current AIDS case definition. Clin Infect Dis 1997;24:64-74. [ Links ]
3. Paredes R, Muñoz J, Diaz I, Domingo P, Gurgui M, Clotet B. Leishmaniasis in HIV infection. J Postgrad Med 2003;49:39-49. [ Links ]
4. Catorze G. Leishmaniose e sida. Med Cut Iber Lat Amer 2005;6:327-50. [ Links ]
5. Alvar J. Leishmaniasis and AIDS co-infection: the Spanish example. Parasitol Today 1994;10:160-3. [ Links ]
6. Botella ER, Sanmartín JO, Febrer BML, Aliaga BA, Salavert LM, Roig RP, et al. Leishmaniasis cutáneo-visceral: una nueva infección oportunista en pacientes con HIV. Med Cut Iber Lat Am 1990;18:119-23. [ Links ]
7. Altés J, Salas A, Riera M, Udina M, Galmés A, Balanzant J, et al. Visceral leishmaniasis: another opportunistic infection? Report of eight cases and review of the literature. AIDS 1991;5:201-7. [ Links ]
8. Herwaldt BL. Leishmaniasis. Lancet 1999;354: 1191-9. [ Links ]
9. Harms G, Feldmeier H. Review: HIV infection and tropical parasitic diseases- deleterious interactions in both directions? Trop Med Int Health 2002;7:479-88. [ Links ]
10. Pasquau F, Ena J, Sanchez R, Cuadrado JM, Amador C, Flores J, et al. Leishmaniasis as an opportunistic infection in HIV-infected patients: determinants of relapse and mortality in a collaborative study of 228 episodes in a Mediterranean region. Eur J Clin Microbiol Infect Dis 2005;24:411-8. [ Links ]
11. Desjeux P, Alvar J. Leishmania/HIV co-infections: epidemiology in Europe. Ann Trop Med Parasitol 2003; 97(Suppl 1):3-15. [ Links ]
12. Instituto Nacional de Salud. Programa de Enfermedades de Transmisión Vectorial. Informe sobre leishmaniasis en Colombia. Sivigila 2005. Semana 52. [ Links ]
13. Instituto Nacional de Salud. Programa de Enfermedades de Transmisión Vectorial. Situación de leishmaniasis en Colombia. Sivigila 2006. Semanas epidemiológicas 1-12. [ Links ]
14. Vélez ID, Gilchrist K, Arbeláez MP, Rojas C, Puerta JA, Antúnez CF, et al. Failure of killed Leishmania amazonensis vaccine to protect against American cutaneous leishmaniasis in Colombia. Trans R Soc Trop Med Hyg 2005;99:593-8. [ Links ]
15. Corredor A, Kreutzer RD, Tesh RB, Boshell J, Palau MT, Cáceres E, et al. Distribution and etiology of leishmaniasis in Colombia. Am J Trop Med Hyg 1990;42:296-314. [ Links ]
16. Rodríguez G, Motta A, Ordóñez N. Estudio histopatológico de 19 biopsias cutáneas de pacientes con sida e histoplasmosis diseminada. Biomédica 2001;21:107-15. [ Links ]
17. Sinha PK, Pandey K, Bhattacharya SK. Diagnosis & management of leishmania/HIV co-infection. Indian J Med Res 2005;121:407-14. [ Links ]
18. Singh S, Sivakumar R. Recent advances in the diagnosis of leishmaniasis. J Posgrad Med 2003;49:55-60. [ Links ]
19. Schalling HD, Oskam L. Molecular biological applications in the diagnosis and control of Leishmaniasis and parasite identification. Trop Med Int Health 2002;7:641-51. [ Links ]
20. Deniau M, Canavate C, Faraut-Gambarelli F, Marty P. The biological diagnosis of leishmaniasis in HIV-infected patients. Ann Trop Med Parasitol 2003;97(Suppl. 1):115-33. [ Links ]
21. Rodríguez G, Ricaurte O, Naranjo JP. Granulomas infecciosos del hígado. Biomédica 1994;9:32-57. [ Links ]
22. Rosatelli JB, Souza CS, Soares SA, Foss Nt, Roselino AM. Generalized cutaneous leishmaniasis in acquired immunodeficiency syndrome. J Eur Acad Dermatol Venereol 1988;10:229-32. [ Links ]
23. Nogueira-Castañón MC, Pereira CA, Furtado T. Unusual association of American cutaneous leishmaniasis and acquired immunodeficiency syndrome. Int J Dermatol 1996;35:295-7. [ Links ]
24. Machado ES, Braga MP, Da Cruz AM, Coutinho SG, Vieira AR, Rutowitsch MS, et al. Disseminated American muco-cutaneous leishmaniasis caused by Leishmania braziliensis braziliensis in a patient with AIDS: a case report. Mem Inst Oswaldo Cruz 1992;87:487-92. [ Links ]
25. Fernández-Guerrero ML, Robles P, Rivas P, Mojer F, Muniz G, de Gárgolas M. Visceral leishmaniasis in immunocompromised patients with and without AIDS: a comparison of clinical features and prognosis. Acta Trop 2004;90:11-6. [ Links ]
26. Pintado V, Martín-Rabadán P, Rivera ML, Moreno S, Bouza E. Visceral leishmaniasis in human immunodeficiency virus (HIV)-infected and non-HIV infected patients. Medicine (Baltimore) 2001;80:54-73. [ Links ]
27. Corredor A, Gallego JF, Tesh R, Morales A, Ferro C, Young D, et al. Epidemiology of visceral leishmaniasis in Colombia. Am J Trop Med Hyg 1989;40:480-6. [ Links ]
28. Da Silva E, Pacheco R, Gontijo C, Carvalho I, Brazil P. Visceral leishmaniasis caused by Leishmania (Viannia) braziliensis in a patient infected with the human immunodeficiency virus. Rev Inst Med Trop Sao Paulo 2002;44:145-9. [ Links ]
29. Bryceson AD. Diffuse cutaneous leishmaniasis in Ethiopia. III. Immunological studies. IV. Pathogenesis. Trans R Soc Trop Med Hyg 1970;64:380-7. [ Links ]
30. Rodríguez G, Corredor A, Cáceres E, Casiano G, Arroyo C, Palau MT, et al. Leishmaniasis difusa. Biomédica 1985;5:95-111. [ Links ]
31. Rodríguez G. Leishmaniasis difusa. Revista de la Asociación Colombiana de Dermatología 2000;8:33-40. [ Links ]
32. Convit J, Pinardi ME, Rondón AJ. Diffuse cutaneous leishmaniasis: a disease due to an immunological defect of the host. Trans R Soc Trop Med Hyg 1972; 66:603-10. [ Links ]
33. Convit J, Castellanos PL, Ulrich M, Castés M, Rondón A, Pinarde ME, et al. Immunotherapy of localized, intermediate and diffuse forms of American cutaneous leishmaniasis. J Infect Dis 1989;160:104-15. [ Links ]
34. Vélez I, Agudelo S, Robledo S, Jaramillo L, Segura I, Soccol V, et al. Diffuse cutaneous leishmaniasis with mucosal involvement in Colombia, caused by an enzymatic variant of Leishmania panamensis. Trans R Soc Trop Med Hyg 1994;88:199. [ Links ]
35. Couppié P, Clyti E, Sainte–Marie D, Dedet JP, Carme B, Pradinaud R. Disseminated cutaneous leishmaniasis due to Leishmania guyanensis: case report of a patient with 425 lesions. Am J Trop Med Hyg 2004;71:558-60. [ Links ]
36. Carvalho EM, Barral A, Costan JM, Bittencourt A, Mariden P. Clinical and immunological aspects of disseminated cutaneous leishmaniasis. Acta Trop 1994;56:315-25. [ Links ]
37. Halpert E, Rodríguez G, Hernández CA. Leishmaniasis. In: Harper J, Oranje A, Prose N, editors. Texbook of Pediatric Dermatology. Vol I, chap 7.2. London: Blackwell Publishing; 2006. p.614-26. [ Links ]
38. Catorze G, Alberto J, Alfonso A, Vieira R, Cortes S, Campino L. Leishmania infantum/HIV co-infection: cutaneous lesions following treatment of visceral leishmaniasis. Ann Dermatol Venereol 2006;133:39-42. [ Links ]
39. Alarcón R, García C, Daudén E, Guerra A, Vanaclocha F. Leishmaniasis cutánea post kala-azar en un paciente con inmunodeficiencia adquirida. Actas Dermo-Sif 1987;78:475-7. [ Links ]
40. Calza L, DAntuono A, Marinacci G, Manfredi R, Colangeli V, Passarini B, et al. Disseminated cutaneous leishmaniasis after visceral disease in a patient with AIDS. J Am Acad Dermatol 2004;50:461-5. [ Links ]
41. Rios-Buceta L, Buezzo GF, Peñas PF, Dauden-Tello E, Fraga-Fernández J, García-Díez A. Post kala-azar dermal leishmaniasis in an HIV–patient. Int J Dermatol 1996;35:303-4. [ Links ]
42. Coura RJ, Galvao-Castro B, Grimaldi Junior G. Disseminated American cutaneous leishmaniasis in a patient with Aids. Mem Inst Oswaldo Cruz 1987; 82:581-2. [ Links ]
43. Puig L, Pradinaud R. Leishmania and HIV coinfection: dermatological manifestations. Ann Trop Med Parasitol 2003;97(Suppl. 1):107-4. [ Links ]
44. Palacios R, Santos J, Rivero A, Bosch R, Cabra B, Márquez M. Dermatosis de evolución subaguda en una mujer con sida. Enferm Infec Microbiol Clin 2000;18:476-8. [ Links ]
45. Peña A, Moreno S, Ramos JA, Menasalvas AI, Nieto A, Blázquez RM. Erupción papulosa aislada y confluente en tronco y manos en varón con infección por el virus de la inmunodeficiencia humana. Enferm Infec Microbiol Clin 2001;19:339-40. [ Links ]
46. Mattos M, Caiza A, Fernandes O, Gonçalves A, Pirmez C, Souza C, et al. American cutaneous leishmaniasis associated with HIV infection: report of four cases. J Eur Acad Dermatol Venereol 1998;10:218-25. [ Links ]
47. Borges A, Machado A, Ferreira M, Figuereido J, Silva G, Cimerman S, et al. Concomitancia de leishmanioses e infecçao pelo virus da imunodeficiència humana (HIV): estudo de quatro casos. Rev Soc Bras Med Trop 1999;32:713-9. [ Links ]
48. Rubio FA, Robayna G, Herranz P, Torres E, Peña JM, Contreras F, et al. Leishmaniasis presenting as a psoriasiform eruption in AIDS. Br J Dermatol 1997;136:792-4. [ Links ]
49. Daudén E, Peñas PF, Ríos L, Jiménez M, Fraga J, Alvar J, et al. Leishmaniasis presenting as a dermatomyositis-like eruption in AIDS. J Am Acad Dermatol 1996;35:316-9. [ Links ]
50. Alvar J, Canavate C, Gutiérrez-Solar B, Laguna F, López-Vélez R, Molina R, et al. Leishmania and human immunodeficiency virus infection: the first ten years. Clin Microbiol Rev 1997;10:289-319. [ Links ]
51. Colebunders R, Depraetere K, Verstrueten T, Lambert J, Hauben E, Van Marck E, et al. Unusual cutaneous lesions in two patients with visceral leishmaniasis and HIV infection. J Am Acad Dermatol 1999;41:847-50. [ Links ]
52. Belda MA, Díaz SF, Martínez GB, Gonzalvo BE, Antón CV, Rendón MJ. Leishmaniasis visceral y sida. Informe de dos casos con diseminación cutánea. An Med Interna 1994;11:398-400. [ Links ]
53. Bosch RJ, Rodrigo AB, Sánchez P, de Galvez MV, Herrera E. Presence of Leishmania organisms in specific and non-specific skin lesions in HIV-infected individuals with visceral leishmaniasis. Int J Dermatol 2002;41: 670-5. [ Links ]
54. Ara M, Maillo C, Peón G, Clavel A, Cuesta J, Grasa MP, et al. Visceral leishmaniasis with cutaneous lesions in a patient infected with human immunodeficiency virus. Br J Dermatol 1998;139:114-7. [ Links ]
55. Milian MA, Bagan JV, Jiménez Y, Pérez A, Scully C. Oral leishmaniasis in a HIV-positive patient. Report of a case involving the palate. Oral Dis 2002;8:59-61. [ Links ]
56. Aliaga L, Cobo F, Mediavilla JD, Bravo J, Osuna A, Amador JM, et al. Localized mucosal leishmaniasis due to Leishmania infantum: clinical and microbiological findings in 32 patients. Medicine (Baltimore) 2003;82:147-58. [ Links ]
57. Miralles ES, Nunez M, Hilara Y, Harto A, Moreno R, Ledo A. Mucocutaneous leishmaniasis in HIV. Dermatology 1994;189:275-7. [ Links ]
58. Sánchez P, Bosch RJ, de Galvez MV, Rodrigo AB, Herrera E. Mucocutaneous leishmaniasis in a patient with the human immunodeficiency virus. Int J STD AIDS 2001;12:687-9. [ Links ]
59. Da-Cruz AM, Machado ES, Menezes JA, Rutowitsch S, Coutinho SG. Cellular and humoral immune responses of a patient with American cutaneous leishmaniasis and AIDS. Trans R Soc Trop Med Hyg 1992;86:511-2. [ Links ]
60. Rosenthal PJ, Chaisson RE, Hadley WK, Leech JH. Rectal leishmaniasis in a patient with acquired immunodeficiency syndrome. Am J Med 1988;84:307-9. [ Links ]
61. Hofman V, Marty P, Perrin C, Saint-Paul MC, Le Fichoux Y, Michiels JF, et al. The histological spectrum of visceral Leishmaniasis caused by Leishmania infantum MON-1 in acquired immune deficiency syndrome. Human Pathol 2000;31:75-84. [ Links ]
62. de Souza e Souza I, Naiff RD, Guimaraes TC, Naiff MF, Cupolillo E, Rodrigues WA, et al. American cutaneous leishmaniasis due to Leishmania (Viannia) guyanensis as an initial clinical presentation of human immunodeficiency virus infection. J Eur Acad Dermatol Venereol 1988;10:214-7. [ Links ]
63. Berhe N, Haike A, Gemetchu T. Human immunodeficiency virus and recurrence of cutaneous leishmaniasis long after healed localized cutaneous leishmaniasis due to Leishmania aethiopica. Trans R Soc Trop Med Hyg 1995;89:400-1. [ Links ]
64. Echevarría J, Camos P, Chang J, Cuellar l, Gotuzzo E, Paz L, et al. Mucocutaneous leishmaniasis and AIDS: case report. Trans R Soc Trop Med Hyg 1993;87:186. [ Links ]
65. Couppié P, Clyti E, Sobesky M, Bissuel F, Del Giudice P, Sainte–Marie D, et al. Comparative study of cutaneous leishmaniasis in human immunodeficiency virus (HIV)-infected patients and non- HIV-infected patients in French Guaiana. Br J Dermatol 2004;151:1165-71. [ Links ]
66. Rollino C, Bellis D, Beltrame G, Basolo B, Montemagno A, Bucolo S, et al. Acute renal failure and leishmaniasis. Nephrol Dial Transplant 2003;18:1950-1. [ Links ]
67. Rodríguez G, Hernández CA, Sarmiento L. Leishmaniasis mucosa y otras lesiones destructivas centrofaciales. Biomédica 1994;14:215-25. [ Links ]
68. Scaglia M, Malfitano A, Douville H, Sacchi P, Gatti S, Gradoni L, et al. Dermonodular and visceral leishmaniasis due to Leishmania infantum with a new isoenzyme pattern: report of a case involving a patient with AIDS. Clin Infect Dis 1996:22:376-7. [ Links ]
69. Sarazin E, Nacher M, Toure Y, Clyti E, El Guedj M, Aznar C, et al. Dermatological manifestations associated with immune reconstitution syndrome in HIV + patients starting HAART: a retrospective study in French Guiana. Bull Soc Pathol Exot 2005;98:187-92. [ Links ]
70. Posada-Vergara MP, Lindoso JA, Tolezano JE, Pereira-Chioccola VL, Silva MV, Goto H. Tegumentary leishmaniasis as a manifestation of immune reconstitution syndrome in 2 patients with AIDS. J Infect Dis 2005;192:1819-22. [ Links ]
71. Ferreira E, Lucena S, Fonseca G, Barbosa TC, Aquino RB, Lambert JS, et al. Visceral leishmaniasis in a Brazilian child infected perinatally with human immunodeficiency virus. Pediatr Infect Dis J 2001;20:224-6. [ Links ]
72. Gillis D, Klaus S, Schnur LF, Piscopos P, Maayan S, Okon E, et al. Diffusely disseminated cutaneous Leishmania major infection in a child with acquired immunodeficiency syndrome. Pediatr Infect Dis J 1995;14:247-9. [ Links ]
73. De la Loma A, Alvar J, Martínez-Galiano E, Blázquez J, Alcalá Muñoz A, Nájera R Leishmaniasis or AIDS? Trans R Soc Trop Med Hyg 1985;79:421-2. [ Links ]
74. Cruz I, Morales MA, Noguer I, Rodríguez A, Alvar J. Leishmania in discarded syringes from intravenous drug users. Lancet 2002;359:1124-5. [ Links ]
75. Rabello A, Orsini M, Disch J. Leishmania/HIV coinfection in Brazil: an appraisal. Ann Trop Med Parasitol 2003;97(Suppl. 1):17-28. [ Links ]
76. Morgado MG, Barcelos C, Pina MdeF, Bastos FI. Human immunodeficiency virus/acquired immuno-deficiency syndrome and tropical diseases: a Brazilian perspective. Mem Inst Oswaldo Cruz 2000;95(Suppl. 1):145-51. [ Links ]
77. Mota Sasaki Md, Matsumo Carvalho M, Schmitz Ferreira ML, Machado MP. Cutaneous leishmaniasis coinfection in AIDS patients: case report and literature review. Braz J Infect Dis 1997;1:142-4. [ Links ]
78. Romero HD, Taranto NJ, Malchiodi EL. Leishmaniasis tegumentaria americana asociada con sida en Argentina. Medicina (Buenos Aires) 2004;64:47-50. [ Links ]
79. Hernández DE, Rodríguez N, Wessolossky M, Convit J. Visceral leishmaniasis due to Leishmania variant that shares kinetoplast DNA sequences with Leishmania braziliensis and Leishmania mexicana in a patient infected with human immunofeficiency virus: identification of the Leshmania species with use of the polymerase chain reaction. Clin Infect Dis 1995; 21:701-2. [ Links ]
80. Hernández D, Rodríguez N, Martínez C, García L, Convit J. Leishmania braziliensis causing visceral leishmaniasis in a patient with human immunodeficiency virus infection, identified with the aid of the polymerase chain reaction. Trans R Soc Trop Med Hyg 1993;87:627-8. [ Links ]
81. Zhao C, Papadopoulou B, Tremblay MJ. Leishmania infantum enhances human immunodeficiency virus type-1 replication in primary human macrophages through a complex cytokine network. Clin Immunol 2004;113:81-8. [ Links ]
82. Zhao C, Papadopoulou B, Tremblay MJ. Leishmania infantum promotes replication of HIV type 1 in human lymphoid tissue cultured ex vivo by inducing secretion of the proinflammatory cytokines TNF-a and IL-1a. J Immunol 2004;172:3086-93. [ Links ]
83. Wolday D, Berhe N, Briton S, Akuffo H. HIV-1 alters T helper cytokines interleukin-12 and interleukin-18 responses to the protozoan parasite Leishmania donovani. AIDS 2000;14:921-9. [ Links ]
84. Olivier M, Badaro R, Medrano FJ, Moreno J. The pathogenesis of Leishmania/HIV co-infection: cellular and immunological mechanisms. Ann Trop Med Parasitol 2003;97(Suppl 1):79-98. [ Links ]
85. Savoia D, Allice T, Tovo PA. Antileishmanial activity of HIV protease inhibitors. Int J Antimicrob Agents 2005;26:92-4. [ Links ]
86. Kubar J, Martin P, Lelièvre A, Quaranta J-F, Staccini P, Caroli-Bosc C, et al. Visceral Leishmaniasis in HIV positive patients: primary infection, reactivation and latent infection. Impact of the CD4+ T-lymphocyte counts. AIDS 1998;12:2147-53. [ Links ]
87. Soto J, Arana BA, Toledo J, Rizzo N, Vega JC, Díaz A, et al. Miltefosine for New World cutaneous leishmaniasis. Clin Infect Dis 2004;38:1266-72. [ Links ]
88. Soto J, Toledo J, Gutierrez P, Nicholls RS, Padilla J, Engel MJ, et al. Treatment of American cutaneous leishmaniasis with miltefosine, an oral agent. Clin Infect Dis 2001;33:57-61. [ Links ]
89. Schraner C, Hasse B, Hasse U, Baumann D, Fach A, Burg G, et al. Successful treatment with miltefosine of disseminated cutaneous leishmaniasis in a severely immunocompromised patient infected with HIV-1. Clin Infect Dis 2005;40:20-4. [ Links ]
90. Sindermann H, Engel KR, Fischer C, Bommer W, Miltefosine Compassionate Use Program. Oral miltefosine for leishmaniasis in immunocompromised patients. Compassionate use in 39 patients with HIV infection. Clin Infect Dis 2004;39:1520-3. [ Links ]
91. Rosenthal E, Marty P. Recent understanding of the treatment of visceral leishmaniasis. J Postgrad Med 2003;49:61-8. [ Links ]
92. Reymond JM, Desmeules J. Sodium stibogluconate (Pentostam) overdose in a patient with acquired immunodeficiency syndrome. Ther Drug Monit 1998;20:714-6. [ Links ]
93. Laguna F. Treatment of leishmaniasis in HIV-positive patients. Ann Trop Med Parasitol 2003;97(Suppl 1):135-42. [ Links ]
94. Orlando G, Sorbo F, Corbellino M, Schiavini M, Cargnel A. Secondary prophylaxis to Leishmania infection in an HIV-positive patient. AIDS 1998;12:2086-7. [ Links ]
95. Da-Cruz A, Filgueiras D, Coutinho Z, Mayrink W, Grimaldi Jr G, De Luca P, et al. Atypical mucocutaneous leishmaniasis caused by Leishmania braziliensis in an acquired immunodeficiency syndrome patient: T-cell responses and remission of lesions associated with antigen immunotherapy. Mem Inst Oswaldo Cruz 1999;94:537-42. [ Links ]
96. Gotch F, Hardy G. The immune system: our best antiretroviral. Curr Op Infect Dis 2000;13:13-7. [ Links ]
97. Dujardin JC. Risk factors in the spread of leishmaniasis: towards integrated monitoring? Trends Parasitol 2006;22:4-6. [ Links ]
98. Agudelo LA, Uribe J, Sierra D, Ruiz F, Velez ID. Presence of American cutaneous leishmaniasis vectors surrounding the city of Medellín, Colombia. Mem Inst Oswaldo Cruz 2002;97:641-2. [ Links ]














