Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Biomédica
versión impresa ISSN 0120-4157versión On-line ISSN 2590-7379
Biomédica v.26 n.4 Bogotá dic. 2006
Estudio inmunocitoquímico y molecular de cultivo primario de tejido molar
Yinth Andrea Bernal 1, Luis Eduardo Díaz 1, Jinneth Acosta 2, Cecilia Crane 3, Stella Carrasco-Rodríguez 1, Antonio José Bermúdez 3, Myriam Sánchez-Gómez 1
1 Laboratorio de Hormonas, Departamento de Química, Universidad Nacional de Colombia, Bogotá, D.C., Colombia.
2
Departamento de Patología, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá, D.C., Colombia.3
Laboratorio de Genética, Instituto Nacional de Salud, Bogotá, D.C., Colombia.Introducción. La enfermedad trofoblástica gestacional comprende un conjunto de patologías caracterizadas por crecimiento e invasión anómalos del trofoblasto. Las bases moleculares de esta patología son desconocidas, en parte por la dificultad para disponer de modelos biológicos adecuados. Se plantea que el sistema de factores de crecimiento similares a la insulina puede tener un papel fundamental en el desarrollo de la enfermedad.
Objetivo. Caracterizar cultivos primarios de placentas de primer trimestre provenientes de pacientes con mola hidatidiforme completa y aborto espontáneo no molar mediante morfología, inmunocitoquímica y expresión diferencial de algunos genes del sistema de factores de crecimiento similares a la insulina.
Materiales y métodos. Se empleó inmunocitoquímica para determinar células trofoblásticas y detección por transcripción reversa y reacción en cadena de la polimerasa de genes del sistema de factores de crecimiento similares a la insulina asociados al tipo celular.
Resultados. La morfología evidenció heterogeneidad de los cultivos, incluidas células mesenquimales, trofoblásticas y de decidua. El contenido de células de trofoblasto con citoqueratina-7 (marcador específico) estuvo entre 16 y 37%. La expresión de genes corroboró la presencia de trofoblasto por medio del ARNm del factor II de crecimiento similar a la insulina, en tanto que los transcritos de la hormona de crecimiento variante evidenciaron la presencia de sincitiotrofoblasto. El factor I de crecimiento similar a la insulina y la proteína de unión tipo 1 se relacionaron con células mesenquimales y de decidua. Se observó una mayor expresión del factor II de crecimiento similar a la insulina en tejidos molares en comparación con aborto no molar.
Conclusiones. Los resultados mostraron la utilidad de combinar tres metodologías, morfología, inmunocitoquímica y expresión de genes, como herramientas para la caracterización y seguimiento de cultivos placentarios a partir de muestras de tejidos anómalos complejos, facilitando así el diagnóstico.
Palabras Clave: mola hidatiforme invasiva, factor I de crecimiento similar a la insulina, factor II de crecimiento similar a la insulina, proteína 1 de unión a factor de crecimiento similar a la insulina.
Immunocytochemical and molecular studies with primary cultures of molar tissue
Introduction. Gestational trophoblastic disease includes a group of pathologies characterized by abnormal trophoblast growth and invasion. The molecular bases of the disease are largely unknown, due in part to the lack of appropriate biological models. The insulin-like growth factor (IGF) system plays a fundamental role in the growth and development of many tissues and is involved in the progression of several diseases.
Objectives. Primary cell cultures derived from first trimester placenta were characterized from patients with complete hydatidiform mole and spontaneous non molar abortion by immunocytochemical and molecular methods.
Materials and Methods. The immunocytochemical method used specific markers for trophoblastic cells, whereas RT-PCR was used to identify insulin-like growth factor gene expression.
Results. Histochemical staining with hematoxilin-eosin revealed that the cultures contained heterogeneous cell types, including trophoblast and endometrial decidual cells. The ratio of trophoblast cells in the cultures varied between 16% and 37%, as detected by cytokeratine-7 as the specific trophoblast marker. Gene expression analysis corroborated the presence of trophoblasts by detecting insulin-like growth factor II mRNA, whereas GH-V transcripts were correlated with the presence of syncitiotrophoblasts. Insulin-like growth factor I and insulin-like growth factor binding protein 1 mRNAs were related to mesenchyimal and decidual cells, respectively. Higher insulin-like growth factor II expression levels were found in molar tissues in comparison with non-molar abortions.
Conclusion. By combining three methodologiesmorphology, immunocytochemistry and gene expression, characterization and follow-up of placenta cultures from abnormal tissues is found to facilitate diagnosis.
Key words: Hydatidiform mole, invasive, insulin-like growth factor I, insulin-like growth factor II, insulin-like growth factor binding protein 1.
La placenta es un órgano transitorio que permite el intercambio de gases y productos metabólicos entre el feto y la madre y constituye la única barrera física entre la sangre materna y la sangre fetal (1). Para que la placenta pueda cumplir sus funciones y se de el correcto desarrollo del embrión, es necesario que ocurra el proceso de implantación por la interacción inicial del blastocisto con el epitelio endometrial y posterior proliferación e invasión del trofoblasto (2). La desregulación de este proceso conlleva al desarrollo de enfermedades trofoblásticas gestacionales que se caracterizan por la proliferación e invasión incontrolada del trofoblasto. Esta enfermedad comprende: mola hidatidiforme completa y parcial, tumores trofoblásticos y coriocarcinoma (3).
Existen pocos estudios acerca del papel que pueden desempeñar los factores de crecimiento en el desarrollo de esta enfermedad. Entre ellos se ha demostrado que los factores de crecimiento transformante (TGF) y epidérmico (EGF) desempeñan una acción autocrina en la proliferación de células trofoblásticas provenientes de mola (4). La biología y el papel que juegan los factores de crecimiento similares a la insulina (IGFs) no se ha evaluado en cultivo de tejido molar. Los factores de crecimiento similares a la insulina IGF-I e IGF-II y sus receptores son sintetizados y secretados por células del citotrofoblasto, lo que plantea un posible mecanismo de acción autocrino/paracrino. Su expresión comienza después de la implantación del embrión con niveles detectables de los mensajeros a partir de la sexta semana de gestación (5). Se ha establecido que los IGFs son reguladores importantes de la supervivencia y migración de muchos tipos celulares y se han asociado con el desarrollo de tumores y cáncer. Estudios previos han demostrado por medio de hibridización in situ, que la familia de IGFs posee una distribución espacial en la interfase materno-fetal (decidua-placenta-embrión) y algunos de ellos son característicos de ciertos tipos celulares (6). Las células mesenquimales producen IGF-I, factor de crecimiento necesario para la proliferación e invasión del trofoblasto en la decidua (7), mientras que se ha encontrado que la proteína de unión tipo 1 (IGFBP-1) es expresada exclusivamente por la decidua, está en la interfase feto-maternal y ha sido postulada como un mediador y regulador de las acciones de los IGFs (8). La hormona de crecimiento variante (GH-V), se expresa exclusivamente en el sincitiotrofoblasto, indicando la diferenciación terminal de las vellosidades coriónicas. Los mecanismos que regulan la expresión espacial de IGFs e IGFBPs en la placenta aún no son claros en estados normales y mucho menos se conoce cómo se podrían ver afectados en un estado patológico.
Muy pocos estudios se han realizado con el fin de establecer el papel de los IGFs en el desarrollo de la ETG y su transformación maligna en coriocarcinoma. En un trabajo anterior de nuestro grupo se determinaron los niveles de expresión de algunos genes del sistema IGF en muestras de tejidos molares, en los que se pudo establecer la sobre expresión de IGF-II en molas hidatidiformes en comparación con abortos espontáneos no molares de primer trimestre (Díaz E, Cantero M, Carrasco-Rodríguez S, Sánchez-Gómez M. IGF-I, IGF-II and IGF-IR mARN expression in Colombian women with hydatidiform mole and spontaneous abortion. Placenta 2006;27:A63. Joint Meeting: II Latinamerican Symposium on Fetal-Maternal Interaction and Placenta and XIX Annual Meeting of the Chilean Society of Physiological Sciences, 2005, Santiago). Se conoce que el gen Igf-2 se expresa sólo a partir del alelo paterno con silenciamiento del materno, por lo tanto, su elevada expresión en mola completa, donde hay ausencia de genoma materno, podría ser un factor importante en el desarrollo de la enfermedad.
Si bien los estudios in situ son una herramienta muy valiosa para avanzar en la biología de esta enfermedad, son deseables los ensayos in vitro para complementar el papel de dichos factores y contribuir al conocimiento de la enfermedad. El objetivo del presente trabajo fue hacer un estudio comparativo de la expresión de genes del sistema IGF en cultivos primarios obtenidos a partir de explantes de placenta molar y no molar como base para la identificación de posibles genes útiles como marcadores moleculares de esta patología del embarazo.
Materiales y métodos
Pacientes
Las pacientes que ingresaron con diagnóstico probable de mola hidatidiforme fueron captadas en el marco del plan de vigilancia centinela de la enfermedad trofoblástica en instituciones de la red hospitalaria del Distrito Capital y el Hospital de Zipaquirá. Las pacientes fueron informadas sobre los objetivos del estudio y posteriormente se firmó un consentimiento informado en todos los casos. El protocolo fue avalado por los comités de ética de las instituciones participantes en el estudio.
Muestras
Los tejidos obtenidos mediante curetaje de succión, legrado o histerectomía, fueron lavados con solución salina y recolectados en condiciones de asepsia en medio de cultivo L15 (Leibovitz), suplementado con suero fetal bovino (SFB) al 20% y posteriormente divididos bajo estereoscopio o microscopio de contraste de fase por un patólogo: una parte para estudio patológico, otra para cultivo celular y estudio de cariotipos y microsatélites (STR) y otra parte para estudio de expresión de genes. Esta última porción fue congelada inmediatamente en nitrógeno líquido. La muestra de estudio quedó conformada por cinco casos de mola completa y tres abortos no molares de primer trimestre clasificadas con base en ecografía, niveles de gonadotropina coriónica (hGC) en suero e histopatología combinada con análisis de cariotipo y marcadores microsatélites tipo STRs de las muestras de tejido (manuscrito en preparación).
Cultivo celular
El tejido se lavó en solución salina y se cortó para obtener explantes de un tamaño de 1 mm3; después de sembrarlos y de permitir su adherencia por una hora a los frascos de cultivo de 25 cm2 se adicionó el medio de cultivo L15 y se mantuvo a 37 ºC y 5% de CO2. Después de tres días, las células no adheridas fueron removidas y el cultivo se mantuvo por tres a cuatro semanas antes de realizar el primer pase. Se utilizó 1 ml de tripsina por cada 25 cm2 de superficie. Se realizaron tres pases en total.
Inmunocitoquímica
Se empleó como marcador específico de células trofoblásticas la proteína de membrana citoqueratina 7 (9). Las células (3 a 6x106) de cultivo de mola en pase uno fueron centrifugadas en medio L15 a 500 x g por 10 minutos, el bloque celular obtenido fue embebido en parafina. Se obtuvieron cortes de 4 µm de espesor y fueron fijados en láminas tratadas con poli-L-lisina.
Las láminas se desparafinizaron a 60°C por 12 horas, se trataron con xilol y se hidrataron pasán-dolas a través de un gradiente de etanol (100, 95 y 70%). Se realizó digestión con tripsina al 0,083% y se hizo reaccionar toda la noche a 5°C con anticitoqueratina 7 (anticuerpo primario) (M7018 Dako), posteriormente se adicionó el anticuerpo secundario acoplado a biotina y a los 30 minutos se agregó estreptoavidina marcada con peroxidasa por 30 minutos (estuche Dako LSAB + System HRP). Se reveló con diaminobencidina (DAB Sigma) al 70% y H2O2 al 0,07%, se contrastó con hematoxilina por 10 minutos y solución de amoniaco al 5% por un minuto. Las láminas fueron montadas, examinadas y fotografiadas en microscopio. Como control positivo se utilizó la línea celular de cáncer de cérvix HeLa (10) y como control negativo se usaron las mismas células, pero sin la adición del primer anticuerpo.
RT-PCR en cultivos celulares
La extracción de ARN total se realizó con el reactivo de Trizol (Invitrogen) a partir de 1x106 células; la reacción de transcripción reversa se realizó con 3 µg de ARN total; el ARN se denaturó y se sometió a 50°C durante una hora con previa adición de hexámeros al azar 50 ng/µL, dNTPs 0,5 mM, DDT 5mM , ARNasa OUT 40 U, Tris HCl (pH 8,3) 50 mM, KCl 70 mM, MgCl2 3mM y Super Script III (Invitrogen) 200 U.
Se realizó PCR dúplex para los genes IGF-I, IGF-II, IGFBP-1 y GH-V (
cuadro 1). Con tal fin se utilizaron 2 µL de la reacción de transcripción reversa, MgCl2 1,5 mM, dNTPs 0,2 µM, Tris-HCl (pH 8,0) 10 mM, KCl 50 mM y Taq Polimerasa 1U en un volumen final de 25 µL. Las relaciones de iniciadores respecto al gen casero (GAPDH) utilizada para cada una de las PCR duplex fueron las siguientes: IGF-I 0,3 µM Vs GAPDH 0,4 µM; IGF-II 0,3 µM Vs GAPDH 0,4 µM; IGFBP-1 0,4 µM Vs GAPDH 0,4 µM; GH-V 0,12 µM Vs. GAPDH 0,1 µM.
El programa utilizado fue el siguiente: 5 minutos a 95°C para denaturar, 30 ciclos de 1 minuto a 90°C, 1 minuto a 56 - 60°C y 1 minuto a 72°C. El programa finalizó con una incubación a 72°C durante 10 minutos para llevar a cabo la extensión final de los productos de reacción en cadena de la polimerasa (PCR).
Cada muestra se analizó por triplicado en cada pase del cultivo y se visualizó mediante electroforesis en un gel de poliacrilamida usando tinción de plata. Las concentraciones se determinaron por densitometría y analizados utilizando el programa Quantity One 4.1.
Resultados
Cultivo celular
El crecimiento de las células se observó aproximadamente después de cinco días de la adhesión de los explantes a los frascos de cultivo. Una vez el cultivo llegó a una confluencia del 90%, se realizó el primer pase, en el cual las células se dispersaron y formaron una monocapa que permitió observar la morfología celular que poseía el cultivo como una apreciación general de los posibles tipos celulares existentes. Algunos cultivos de mola presentaron células con morfología alargada típica de fibroblastos y células mesenquimales, mientras que otros resultaron más heterogéneos y en ellos se observaron además células con morfología redondeada típica de decidua y trofoblasto. No se establecieron diferencias morfológicas entre los cultivos de mola y de aborto no molar. Los dos tipos de cultivo presentaron el mismo grado de heterogeneidad, la cual se atribuye a la naturaleza misma del tejido evacuado.
Estos hallazgos morfológicos celulares se valoraron con hematoxilina-eosina, lo que permitió diferenciar el núcleo del citoplasma. Interpretados en conjunto, se pudo concluir que alrededor del 70% de los cultivos, tanto de aborto como de mola, presentaban una morfología muy heterogénea y solo el 30% estaba enriquecido de una determinada población correspondiente a cultivo de mola (caso M1) en pase tres con morfología de células de trofoblasto y decidua.
Inmunocitoquímica
Con el fin de determinar el porcentaje de células de trofoblasto en el cultivo celular, se realizó inmunocitoquímica utilizando anticitoqueratina 7 como anticuerpo primario, ya que es un marcador característico de este tipo celular (9). En los cultivos se obtuvo una población de trofoblasto que varió de 16 a 37%, aunque la mayoría de ellos estuvo alrededor de 30%. Las células positivas a citoqueratina-7 presentaron tinción a nivel citoplasmático y mostraron una morfología redondeada que confirma lo descrito con la tinción hematoxilina-eosina. Como control positivo se utilizó la línea celular de cáncer de cérvix HeLa y como control negativo se incubaron las mismas células, pero sin adición del anticuerpo primario (anti-citoqueratina 7).
Medida de la expresión de genes por RT-PCR
A partir de ARN total de las células en cultivo de aborto y de mola se realizó la síntesis de ADNc para efectuar la PCR con el fin de detectar la presencia de transcritos de IGF-I, IGFBP-1 y GH-V como marcadores moleculares de la presencia de células mesenquimales, decidua y sincitio-trofoblasto, respectivamente (
figura 1). Los resultados mostraron la presencia de mensajeros para los tres genes, lo cual confirma la naturaleza celular compleja de los cultivos, que ya había sido evidenciada por morfología e inmunocitoquímica. Cabe la pena resaltar que en los cultivos de molas, y en menor grado en los de abortos, se observó un incremento en la expresión del ARNm de GH-V a través de los diferentes pases.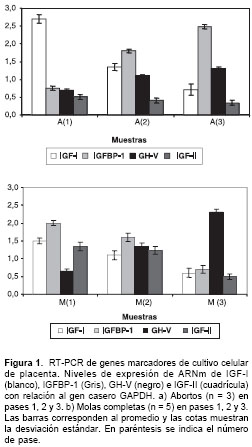
Una vez establecida la presencia de tres tipos celulares en los cultivos, se examinó la expresión del gen Igf-2 en los mismos. Como ya se mencionó en un estudio previo, en los tejidos molares se encontró que este gen está altamente expresado en comparación con placentas provenientes de abortos espontáneos no molares (Díaz E, Cantero M, Carrasco-Rodríguez S, Sánchez-Gómez M. IGF-I, IGF-II and IGF-IR mARN expression in Colombian women with hydatidiform mole and spontaneous abortion. Placenta 2006;27:A63. Joint Meeting: II Latinamerican Symposium on Fetal-Maternal Interaction and Placenta and XIX Annual Meeting of the Chilean Society of Physiological Sciences, 2005, Santiago). Los resultados obtenidos en los cultivos corroboran la sobreexpresión de IGF-II en mola hidatidiforme (
figura 1). Los resultados mostraron que tanto IGF-I como IGF-II son expresados por las células en cultivo, pero comparativamente se aprecian diferencias. En primer lugar, el IGF-I es mayor en aborto en comparación con mola y su transcripción tiende a disminuir con la edad del cultivo, tanto en aborto como en mola (figura 1). En contraste, IGF-II muestra una alta expresión en cultivo de mola respecto del de aborto (figura 1) y disminuye con el número de pases. Por otra parte, la transcripción de la hormona de crecimiento variante GH-V mostró una tendencia a aumentar con el número de pases del cultivo, tanto para mola como aborto, lo que se puede interpretar como resultado de la presencia de más sincitiotro-foblasto productor de la hormona. Los niveles de ARNm de IGFBP-1 fueron comparativamente mayores en mola que en aborto al iniciar el cultivo (figura 1), y con los pases consecutivos se obtuvo un comportamiento opuesto, incrementándose en los abortos mientras que en los cultivos de mola disminuyó.Discusión
Las células trofoblásticas son las encargadas de la invasión en la decidua materna y el anclaje de la placenta al útero. Conociendo que es precisa-mente este tipo celular el que prolifera e invade de una manera anormal cuando se desarrolla la enfermedad trofoblástica gestacional, se propone que los IGFs pueden tener un papel crítico en este proceso.
Las vellosidades coriónicas constituyen la unidad estructural mínima de la placenta, cuyo tamaño y características histológicas varían dependiendo de la edad gestacional. Poseen componentes mesenquimales vasculares y trofoblásticos (11). Esto significa que tratar de aislar micros-cópicamente un tipo celular específico es difícil y por ello es necesario conocer los tipos celulares presentes en cultivo celular de placenta cuando se realiza a partir de explantes. La citoqueratina 7 y la vimentina han sido los marcadores más conocidos y recomendados para la caracterización de cultivos celulares de placenta, ya que respectivamente permiten la detección de células trofoblásticas y mesenquimales por medio de inmunohistoquímica (12), aunque no permiten conocer el estado de diferenciación de las células ni alteraciones en el mismo.
En la literatura se describen varios métodos para la obtención de cultivos primarios de trofoblasto. En primer lugar figura la digestión enzimática con la cual se obtienen preparaciones que contienen alrededor de 45% de trofoblasto, con la desventaja de que se diferencia a sincitiotrofoblasto en un término de 48 horas (13). Por otra parte, existe el método de inmunoselección positiva utilizando esferas magnéticas recubiertas con anticuerpo específico (anti-citoqueratina 7), el cual secuestra las células trofoblásticas. A pesar de su gran especificidad, este método presenta limitaciones en cuanto a la obtención de un buen número de células para un estudio como el presente, sumado al elevado costo que implica la utilización de las esferas. Otra técnica usada ha sido la cromatografía de afinidad (14), que permite la purificación de las células mediante selección negativa utilizando columnas cuya matriz es recubierta con anticuerpo anti-CD9, ya que este marcador es expresado por los diferentes tipos celulares presentes en la placenta con excepción del trofoblasto. Aunque esta metodología da buenos resultados, no está disponible comercial-mente y su implementación es costosa y dispendiosa.
En este trabajo se adaptó un método de obtención de cultivos de trofoblasto (15) a partir de explantes y su propagación en cultivo tomando muestras de abortos no molares y tejido molar. El método resultó simple, económico y además permitió obtener subcultivos. Mediante inmunocitoquímica, usando citoqueratina 7, se pudo establecer que los cultivos tenían un contenido de trofoblasto entre 16 y 37%, resultado que corresponde con la diversidad celular encontrada a partir de explantes de vellosidades coriónicas (15). Además de la diversidad en composición celular, los cultivos también mostraron diversidad morfológica con base en la tinción con hematoxilina-eosina, que sugiere la presencia de células mesenquimales, trofoblásticas y de decidua.
Por medio de la amplificación por PCR de IGFBP-1 e IGF-I, en este trabajo se pudo corroborar la presencia de decidua y células mesenquimales en los cultivos analizados. La abundancia relativa del ARNm de cada uno de estos genes estuvo de acuerdo con la morfología observada, siendo la PCR una alternativa rápida y sencilla para la caracterización del cultivo celular de placenta.
Un aporte valioso del estudio de la expresión de genes en los cultivos fue la posibilidad de observar diferenciación de citotrofoblasto a sincitio-trofoblasto. Se conoce que la diferenciación va acompañada del aumento en la expresión de la GH-V y nuestros resultados adicionalmente mostraron una disminución en los niveles de ARNm de IGF-II, lo que confirma la disminución del citotrofoblasto. Por lo tanto, los cambios en los perfiles de expresión de estos dos genes podrían tener utilidad como marcadores moleculares del proceso de sincitialización en la placenta. Esta mejora en la caracterización del tipo celular en cultivo repercute en que los análisis realizados a partir de los cultivos de los tejidos complejos, evacuados bien sea por aborto o por mola, tengan a su vez más certeza para el médico. Un ejemplo es el estudio de cariotipo que se hace en las células cultivadas, pero es frecuente que el resultado no sea confiable, pues no se tiene la seguridad del tipo celular del cual se obtuvo el genoma. Igual aplica para cualquiera de los genes cuya expresión se quiera estudiar.
En conclusión, los resultados obtenidos sugieren que la caracterización de cultivos de células trofoblásticas humanas a partir de explantes puede hacerse mediante la combinación de la expresión de genes del sistema IGF, inmuno-citoquímica y morfología. De la misma manera, las diferencias en los perfiles de expresión del IGF-II en mola y aborto no molar plantean el valor potencial de este marcador molecular para el diagnóstico diferencial de patologías del embarazo. Creemos que tanto la caracterización de las células cultivadas como el posible marcador genético tendrían impacto en la salud pública en la medida en que contribuirían a la reducción de la morbilidad materna si se aplican para mejorar el diagnóstico. La posibilidad de implementar una metodología que permita la purificación de los distintos tipos celulares provenientes de los tejidos mejorará la precisión de los estudios de expresión, lo que redundará en beneficios para el diagnóstico de esta patología.
Agradecimientos
Los autores agradecen a las instituciones que realizaron los exámenes complementarios de esta investigación.
Conflicto de intereses
En la realización de esta investigación no hubo conflicto de intereses, pues ninguna influencia económica o política incidió en sus resultados.
Financiación
Este trabajo fue financiado por el International Program in the Chemical Sciences IPICS (Proyecto COL:01) y Colciencias (proyectos código: 1101-04-11874 y código 1101-05-14657).
Correspondencia:
Myriam Sánchez de Gómez, Laboratorio de Hormonas,
Departamento de Química, Universidad Nacional de Colombia, Bogotá D.C., Colombia. Telefax: (571) 3165000 ext. 14466.
Recibido: 13/03/06; aceptado: 28/09/06
Referencias
1. Petraglia F, Florio P, Nappi C, Genazzani AR. Peptide signaling in human placenta and membranes: autocrine, paracrine and endocrine mechanisms. Endocr Rev 1996;17:156-86. [ Links ]
2. Giudice LC, Irwin JC. Roles of the insulin-like growth factor family in nonpregant human endometrium and at the decidual:trophoblast interface. Semin Reprod Endocrinol 1999;17:13-21. [ Links ]
3. Ezpeleta J, López A. Enfermedad trofoblástica gestacional. Rev Esp Patol 2002;35:187-200. [ Links ]
4. Balaram P, John M, Enose J, Symaladevi PK. Demonstration of TGF-á-EGFR and EGF-EGFR autocrine loops and their relation to proliferation in complete hydatidiform moles (CHM). Int J Gynecol Cancer 2001;11:397-402. [ Links ]
5. Wihman IL, Carlstrom K, Faxen M. Insulin-like growth factor-I in women with hydatidiform mole and in normal pregnancy. Obstet Gynecol 1998;92:431-4. [ Links ]
6. Han VK, Basset N, Walton J, Challis JR. The expression of insulin-like growth factor (IGF) and IGF-binding protein (IGFBP) genes in the human placenta and membranes: Evidence for IGF-IGFBP interactions at the feto-maternal interfase. J Clin Endocrinol Metab 1996;81:2680-93. [ Links ]
7. Lacey H, Haigh T, Westwood M, Aplin JD. Mesenchymally-derived insulin-like growth provides a paracrine stimulus for trophoblast migration. BMC Dev Biol 2002; 2:5. [ Links ]
8. Nayak NR, Guidice LC. Comparative biology of the IGF system in endometrium, decidua, and placenta, and clinical implications for foetal growth and implatantion disorders. Placenta 2003;24:281-96. [ Links ]
9. Yagel S, Casper RF, Powell W, Parhar RS, Lala PK. Characterization of pure human first-trimester cytotrophoblast cells in long-term culture: Growth pattern, markers and hormone production. Am J Obstet Gynecol 1989;160:938-45. [ Links ]
10. Chen JC, Ornelles DA, Shenk T. The adenovirus l3 23-kilodalton proteinase cleaves the amino-terminal head domain from cytokeratin 18 and disrupts the cytokeratin network of HeLa cells. J Virol 1993;67:3507-14. [ Links ]
11. Han VK, Carter AM. Spatial and temporal patterns of expression of messenger RNA for Insulin-like growth factors and their binding proteins in the placenta of man and laboratory animals. Placenta 2000;21:289-305. [ Links ]
12. Blaschitz A, Weiss U, Dohr G, Desoye G. Antibody reaction patterns in first trimester placenta: implications for trophoblast isolation and purity screening. Placenta 2000;21:733-41. [ Links ]
13. Tarrade A, Kuen RL, Malassiné A, Tricottet V, Blain P, Vidaud M, et al. Characterization of human villous and extravillous trophoblast isolated from first trimester placenta. Lab Invest 2001;81:1199-211. [ Links ]
14. Pötgens AJ, Kataokab H, Ferstla S, Frank HG, Kaufmanna P. A positive immunoselection method to isolate villous cytotrophoblast cells from first trimester and term placenta to high purity. Placenta 2003;24:412-23. [ Links ]
15. Irving JA, Lysiak JJ, Graham CH, Hearn S, Han VK, Lala PK. Characteristics of trophoblast cells migrating from first trimester chorionic villus explants and propagated in culture. Placenta 1995;16:413-33. [ Links ]














