Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biomédica
versão impressa ISSN 0120-4157versão On-line ISSN 2590-7379
Biomédica v.26 supl.1 Bogotá out. 2006
Estado actual y futuro de la terapia anti-leishmaniásica en Colombia
Jaime Soto, Paula Soto
CIBIC, Centro de Investigaciones Bioclínicas de la Fundación FADER, Bogotá, Colombia.
Recibido: 15/09/05; aceptado: 28/05/06
Los antimoniales pentavalentes son la primera elección para el tratamiento de la leishmaniasis en Colombia pero la dosis ha tenido que incrementarse en mas de 600% para mantener su eficacia que en distintos reportes varía entre 93 y 25%, lo cual puede reflejar diferencias en la sensibilidad de los parásitos pero más probablemente incumplimiento de los esquemas recomendados. Los resultados de su empleo, así como la situación actual de pentamidina, anfotericina B y miltefosina son revisados y se hace una proyección sobre el desarrollo de la terapia en los próximos años. Para definir el real estado de la respuesta a los medicamentos anti-leishmaniásicos y prolongarles su vida útil, es indispensable establecer mecanismos de vigilancia de los factores implicados en el manejo de la enfermedad por lo que se plantea una estrategia de sitios centinela que permitan observaciones puntuales en el tiempo, en áreas específicas y sobre situaciones particulares.
Palabras clave: leishmaniasis/terapia, vigilancia epidemiológica, resistencia a las drogas, resultado del tratamiento, efectividad.
Current situation and future of antileihmanial therapy in Colombia
Pentavalent antimonials are the first choice to treat leishmaniasis in Colombia. However, a 600% increase in the total dose has been necessary in order to maintain their efficacy. Cure rates varying between 93 and 25% can reflect differences in parasite susceptibility, but are more likely secondary to deficiencies in compliance with treatment guidelines. We review the current situation of efficacy and use of pentavalent antimony compounds, amphotericin B, pentamidine and miltefosine and attempt a projection for the next following years. To determine the real situation of response to antileishmanial drugs and to extend their useful life, the establishment of surveillance mechanisms to cover all factors involved is necessary. A sentinel site surveillance strategy to allow punctual observations in time, in specific geographical areas and in particular local situations, is proposed.
Key words: Leishmaniasis/therapy, epidemiologic surveillance, drug resistance, treatment outcome, effectiveness.
El 99% de los casos nuevos de leishmaniasis en Colombia son cutáneos, causados por varias especies de parásitos hemoflagelados de los subgéneros Viannia y Leishmania con amplio predominio de Leishmania (V) panamensis. En el 2004 se registraron en nuestro país cerca de 13.000 casos nuevos de leishmaniasis (1) lo que representa un incremento de más del 37% sobre lo reportado en 2003. Se prevé que el comportamiento epidémico mostrado por la enfermedad se mantenga durante los próximos años dada la persistencia de factores sociales y de orden público que exponen a un número mayor de personas al riesgo de la infección, así como la aparición de nuevos focos de transmisión resultado de la colonización vectorial de nuevas áreas geográficas, incluidas las zonas urbanas.
Desde su introducción en 1945, los antimoniales pentavalentes se han mantenido en primera línea como medicamentos anti-leishmaniásicos; de ellos, el antimoniato de meglumina (Glucantime®, Aventis) es el empleado en el Nuevo Mundo mientras que el estibogluconato de sodio (Pentostam®, GSK) es mas comúnmente usado en el Viejo Mundo. En el curso de los últimos treinta años se han venido haciendo ajustes en la dosificación como mecanismo para mantener su eficacia. En 1975, la dosis total para un adulto de 65 kg era de 4,25 g de antimonio (1 ampolla por día durante 10 días); en 1984, la Organización Mundial de la Salud (OMS) recomendó la dosis de 20 mg/kg por día durante 20 días con dosis tope de 850 mg diarios (2) y, luego, en 1990, eliminó el tope (3), criterio que acogió Colombia (4) y que hoy sigue vigente, por lo que una persona de 65 kg recibe un total de 26 g. Esto significa que la dosis se ha incrementado el 612%. Si bien los antimoniales pentavalentes tienen una ventana terapéutica amplia, lo que permitió este aumento de la dosis, sus efectos secundarios son ahora más frecuentes y severos tanto en pacientes afectados por leishmaniasis cutánea como en los enfermos de leishmaniasis visceral que, generalmente, tienen un mayor compromiso de su estado general (5-11).
Los reportes de eficacia del antimoniato de meglumina en diversos estudios clínicos adelantados en la última década con pacientes colombianos afectados por leishmaniasis cutánea varían entre 25% y 93% (12-18); tal amplitud en la variación es también reportada en estudios regionales (19-22) y se puede explicar por factores directamente relacionados con la enfermedad (dependientes del parásito o del hospedero), con el esquema terapéutico empleado o con factores inherentes al estudio (diseño, número de sujetos incluidos, criterios de curación y falla, tiempo de seguimiento, etc.) (23).
A la variabilidad en la eficacia de los antimoniales pentavalentes se suman otros factores (alto costo, vía de administración parenteral, disponibilidad, etc.) que limitan su empleo, por lo que regional-mente se han hecho múltiples estudios para encontrar alternativas terapéuticas. Se han probado otros medicamentos inyectables como la anfotericina B (24), la pentamidina (12,25) y la paromomicina (13); drogas orales como el alopurinol (14), la mefloquina (26), la dapsona (27), la rifampicina (28), el metronidazol (29), el itraconazol (12), el ketoconazol (30), el fluconazol (31), la azitromicina (32) y la terbinafina (33), y preparados tópicos (15,34,35) así como otras modalidades terapéuticas físicas como la crioterapia (36) y la termoterapia (37). Algunos muestran resultados iniciales alentadores pero tales resultados no siempre se reproducen en otras regiones y en pacientes infectados por otras especies. Existe, pues, una amplia variación en la respuesta a los diversos intentos terapéuticos. Desde 1998 (38), la miltefosina por vía oral ha mostrado ser un medicamento efectivo en la leishmaniasis visceral por L. donovani y en la leishmaniasis cutánea por L. panamensis (en este número de Biomédica se publica una revisión sobre miltefosina).
Dada la amplia variabilidad de las tasas de eficacia reportadas en los distintos estudios clínicos y la persistente preocupación de los médicos que trabajan en las zonas endémicas por la aparente disminución de la efectividad de los antimoniales pentavalentes, así como la introducción de nuevos medicamentos, la presente revisión esboza al final una propuesta para establecer un programa de vigilancia centinela para analizar los resultados de las intervenciones terapéuticas.
Esquemas terapéuticos vigentes en América
La OMS recomendó en 1990 el empleo de antimoniales pentavalentes a la dosis de 20 mg/kg por día durante 20 días continuos, sin dosis tope, para la forma cutánea y durante 28 días para la forma mucosa (3). El Ministerio de Salud de Colombia acogió tal recomendación en su guía y, en la actualidad, se emplea el antimoniato de meglumina en una dosis diaria por vía intramuscular (IM). Ante un paciente que no responde o que recae, se recomienda un nuevo curso completo del antimonial bajo supervisión directa, y ante la posibilidad de una segunda recaída, se recomienda emplear cuatro inyecciones IM de isotianato de pentamidina a la dosis de 3 mg/kg por día en días alternos (4).
Al revisar la situación de los países vecinos, se encuentra que la recomendación oficial en Perú (año 2000) indica la misma dosis diaria por 20 días en la forma cutánea y 28 en la mucosa, admite la administración endovenosa (EV) o IM y se mantiene una dosis tope de tres ampollas (1.275 mg) por día (39, 40). En Argentina (año 2004) la dosis es la misma, el tiempo de administración es igual pero la dosis tope está en dos ampollas (850 mg) diarios y sólo se recomienda la vía IM (41). En México (año 2003) se recomienda la misma dosis por un mínimo de 20 días para la forma cutánea localizada y con una dosis tope de dos ampollas (850 mg) por día complementada por 4 a 6 inyecciones intra-lesionales semanales de antimoniales y calor local (42). En Brasil (año 2000) la recomendación es de 10 a 20 mg/kg por día durante 20 a 30 días (43,44). En Ecuador (año 2001) la recomendación es la inyección IM de 10 a 20 mg/kg por día por 10 a 15 días para la forma cutánea y 28 para la mucosa (45). En Venezuela (año 2003) se emplean 20 mg/kg por día durante 20 días para los casos cutáneos y 28 para los mucosos por vía EV o IM (46). El ejército de los Estados Unidos (año 2004) recomienda 20 mg/kg por día durante 20 días por vía EV, sin dosis tope (47). En síntesis, aunque existe una recomendación de la OMS hay una amplia variedad de esquemas que pueden ser consecuentes con situaciones y factores locales de cada país.
Mecanismo de acción de antimoniales pentavalentes
El blanco de los agentes quimioterápicos en leishmaniasis es el amastigote intracelular que escapa de los mecanismos naturales de destrucción y que sobrevive y se multiplica dentro de la vacuola parasitófora del macrófago tisular cuyo pH ácido facilita la nutrición y la homeostasis del parásito (48,49).
Las diversas especies de leishmanias aparente-mente ocupan macrófagos distintos y ejercen actividades de adaptación variadas, lo que podría explicar, al menos en parte, la diversidad en la respuesta a los medicamentos (50). Los mecanismos de acción de los antimoniales pentavalentes no están aún totalmente dilucidados pero sabemos que la forma pentavalente del antimonio se transforma dentro del amastigote en antimonio trivalente que es más tóxico y mata al parásito por acción sobre la enzima reductasa que depende de tiol (TDR1) y por inhibición de la tripanotión reductasa, afectando de esta manera la vía del metabolismo tiol que participa en la síntesis de deoxirribonucleótidos, en la conjugación, secuestro y transporte de metales y medicamentos y en la depuración de radicales tóxicos del oxígeno (51). Al inhibirse las enzimas involucradas en el metabolismo tiol, el parásito queda expuesto intracelularmente a la acción de los metabolitos reactivos del oxígeno que lo matan (51).
Mecanismos de resistencia a antimoniales pentavalentes
El estudio de los mecanismos de resistencia se ve influenciado por el tipo de modelo in vitro usado, las especies estudiadas, los medios y el medicamento empleado. Así, por ejemplo, L. braziliensis y L. donovani son tres a cinco veces más sensibles al estibogluconato de sodio que L. mexicana en un modelo macrófago/amastigote (51,52). Empleando promastigotes en cultivo, Grögl (53,54) demostró una amplia variación en la sensibilidad de leishmanias aisladas de lesiones cutáneas a los antimoniales y sugirió una correlación entre dosis subterapéuticas y la menor sensibilidad a la droga encontrada in vitro. Un reflejo de estas variaciones en la clínica es que Navin encontró en Guatemala (55) diferencias en las tasas de curación de pacientes infectados con L. braziliensis o L. panamensis tratados con estibogluconato de sodio.
En los parásitos resistentes a SbV hay niveles aumentados de las enzimas del metabolismo tiol antes mencionadas, que depuran los radicales tóxicos del oxígeno eliminando este mecanismo de ataque al parásito y permitir la preservación y multiplicación de los amastigotes dentro de los macrófagos. Hay, además, una modificación en el transporte del medicamento que frena su ingreso y acelera su salida del parásito disminuyendo, de esta manera, las concentra-ciones citoplasmáticas que podrían ser fatales para el microorganismo. Para una mayor ilustración al respecto se recomienda la revisión publicada por Osorio et al. (56).
Situación actual de la eficacia de los antimoniales
Resistencia a los antimoniales pentavalentes
El que se genere resistencia a los medicamentos es especialmente crítico en casos de leishmaniasis visceral del Viejo Mundo producidos por L. donovani dada su característica diseminación antroponótica, por lo que el principal problema para el tratamiento de las leishmaniasis está en la provincia de Bihar en India en donde se presenta la mayor cantidad de casos de resistencia. Allí, en menos de 20 años, el antimoniato de meglumina perdió el 60% de su eficacia, razón por la cual ya no se emplea como tratamiento de primera línea (57). Esta situación es consecuencia de un proceso generado por el empleo de dosis subterapéuticas, cursos acortados de tratamiento y uso de medicamento no originales de baja calidad en una enfermedad de transmisión antroponótica. Las prácticas de iniciar con dosis bajas e ir aumentando hasta la dosis plena ("para inducir tolerancia"), de hacer pausas durante el tratamiento ("para disminuir los efectos secundarios") o de dividir la dosis diaria en dos o tres aplicaciones ("para reducir el volumen que se va a inyectar") resultan en niveles sanguíneos subterapéuticos y en una tolerancia de los parásitos al antimonio (58).
La resistencia a los antimoniales pentavalentes, hecho evidente en leishmaniasis visceral en India (59), puede convertirse en un problema de igual magnitud en la leishmaniasis cutánea del Nuevo Mundo; un incremento de más del 600% en la dosis en los últimos 30 años pone de manifiesto que los parásitos se han vuelto menos sensibles y que, de alguna manera, esta característica se está esparciendo. Estrictamente hablando, la leishmaniasis cutánea en América se considera aún una zoonosis, pero los cambios en su ecoepidemiología y su acercamiento a los asentamientos humanos están permitiendo que el hombre pase de simple huésped accidental a jugar un papel más protagónico en el ciclo de transmisión (60).
Desde 1989 (53) sabemos que es posible generar in vitro cepas resistentes a SbV mediante exposición a dosis subóptimas y que esa característica se mantiene luego de múltiples pasos por cultivos e, incluso, después de haber pasado por huéspedes mamíferos y ser cultivada nuevamente, lo que significa que se inducen modificaciones genéticas que producen cambios estructurales y funcionales permanentes que son heredados por su descendencia, es decir que dosis bajas de SbV favorecen la persistencia de parásitos genéticamente más resistentes (54). El que 13 de 14 aislamientos procedentes de pacientes que habían sido tratados con antimoniales y no habían curado mostraran menor sensibilidad que la demostrada por esas mismas cepas antes del tratamiento (61) es una confirmación in vivo de esta importante observación.
Los parásitos aislados de pacientes con leishmaniasis visceral por L. donovani que no respondieron a SbV eran en promedio cinco veces más resistentes in vitro que los aislamientos de los pacientes que sí curaron (62). La mitad de los pacientes catalogados como "refractarios" a los antimoniales en India en 1994 realmente no hicieron el tratamiento siguiendo las recomendaciones oficiales de OMS (59), dato que concuerda con lo hallado en nuestro país recientemente: de 226 enfermos tratados con antimonio pentavalente, 43 (19%) fallaron y al revisar la forma como se llevó a cabo el tratamiento se evidenció que quienes fallaron recibieron entre 3% y 13% menos de la dosis recomendada lo que significa que aun las variaciones pequeñas en la cantidad diaria de medicamento pueden ser responsables de respuestas anormales (18).
La leishmaniasis cutánea americana se ha considerado siempre una zoonosis que afecta incidentalmente al ser humano cuando penetra en el área de transmisión, por lo que la resistencia a los medicamentos no es aún crítica desde el punto de vista epidemiológico. Sin embargo, los patrones de exposición y transmisión de la enfermedad han cambiado: antes los hombres viajaban solos a sus áreas de trabajo mientras que ahora se desplazan las familias completas y, así, todos los miembros están en riesgo.
Además, la deforestación y los cambios ambientales han acercado los vectores a la periferia de las poblaciones en donde se han asentado las familias desplazadas de los campos y ciudades; de la misma manera, algunos vectores han cambiado sus hábitos y se han hecho peri o intradomiciliarios (63-66). La distribución por sexo y por grupos de edad se ha modificado y hoy sabemos que en Colombia una tercera parte de los pacientes diagnosticados con leishmaniasis cutánea son menores de 14 años y que una tercera parte del total son mujeres (67,68), situación común a la de otros países de la región (69). Puede, entonces, decirse que la leishmaniasis cutánea está en un proceso de urbanización y "domiciliación" lo que permite la eventual participación del ser humano en el proceso de transmisión, caso en el cual la posibilidad de diseminación de resistencia se vuelve crítica.
En 1989 se comunicó el primer caso de respuesta anormal a SbV en un paciente colombiano infectado con L. panamensis, que había sido tratado inicialmente con tres "cursos" de diez días; en el lapso de 14 meses este paciente recibió más de 92 g de SbV en muy variados esquemas sin que llegara a curarse de la leishmaniasis (Soto J, Chalela J, Flórez M. Respuesta anormal a Glucantime en Colombia, VIII Congreso Mundial de Dermatología, Rio de Janeiro, Brasil, 1989). En este caso hubo una evidente subdosificación del medicamento durante el primer tratamiento lo que pudo influir en la falta de respuesta a los antimoniales, situación similar a la planteada en India como explicación a la generación de resistencias (58,59).
Otros factores que afectan la eficacia de los antimoniales pentavalentes
Intentar reducir el tratamiento de las leishmaniasis a una fórmula única es prácticamente imposible pues a las variaciones intrínsecas de las especies (54), al estado inmunológico del paciente (23) y a la localización geográfica del foco (70), se suman las diferencias en la farmacocinética que imponen la localización cutánea o visceral de la enfermedad (50), la edad del paciente (16) e, incluso, las diferencias en el contenido de SbV de los distintos lotes de los antimoniales pentavalentes (71-73).
En condiciones reales de empleo, hay factores no directamente dependientes del medicamento, el parásito o el enfermo, que pueden modificar el curso y el resultado de una intervención terapéutica, tales como:
A. forma como es prescrito y como se suministra el medicamento;
B. interacciones del personal de salud con el paciente (empatía, grado y calidad de la información proporcionada, acompañamiento y seguimiento);
C. creencias sobre los medicamentos y sus efectos, tanto de los pacientes como del personal de salud;
D. forma de presentación de los medicamentos;
E. falsas percepciones de los resultados del tratamiento, tanto de los pacientes como del personal de salud, y
F. efectos colaterales.
Todos estos factores deben ser evaluados y sus resultados deben ser confrontados periódicamente para buscar las estrategias necesarias que ayuden a mejorar el cumplimiento de los tratamientos por parte de la población y la adecuada prescripción por parte de los trabajadores de la salud; de esta manera, es posible determinar la efectividad de los medicamentos antileishmaniásicos. Pero es necesario que estas observaciones sean adelantadas por grupos independientes de los servicios de salud, pues por ser cualitativos, la subjetividad de los implicados directamente con la prescripción y el seguimiento del cumplimiento del tratamiento, podría generar sesgos. En nuestro país hay numerosas zonas endémicas de leishmaniasis por lo cual es imposible adelantar una vigilancia sistemática en todo el territorio; se requieren estudios de tiempo limitado y lugar específico cuyos resultados tengan utilidad inmediata y directa en el sitio donde se realizan. Al consolidarse centralmente los datos de cada sitio centinela, se pueden determinar tendencias y características comunes que sean útiles para los responsables de las políticas nacionales.
Situación actual de la atención a los enfermos
Además de la eficacia reportada en los estudios clínicos, es necesario saber cómo es el comportamiento de los antimoniales en condiciones reales y qué circunstancias afectan su efectividad. En el 2004 (68) se revisaron las condiciones de atención de los pacientes con sospecha clínica de leishmaniasis cutánea en cuatro centros localizados en distintas áreas endémicas del país a los que acudieron 406 pacientes que fueron atendidos por el personal local siguiendo las normas de cada centro. Un investigador revisó las fichas de registro, las historias (cuando se diligenciaron), los reportes de laboratorio y las fórmulas médicas y entrevistó algunos pacientes. Los principales hallazgos de este trabajo se presentan a continuación.
Diagnóstico. La descripción de las lesiones se hizo en el 41% pero los datos fueron escuetos ("úlcera" o "placa" sin más especificaciones); los antecedentes médicos y el examen físico general fueron escritos en 43% de las fichas, pero sólo en 58 pacientes (14%) hubo anotaciones más completas que "normal" o "negativo". En 67% se anotó el peso del paciente y en 12% hubo solicitud de exámenes de laboratorio (hemograma, pruebas de función renal y hepática y parcial de orina) pero sin que se pudiera esclarecer la razón para solicitarlos en cada caso. 256 (63%) casos fueron confirmados parasitológicamente por examen directo; en 52 (15%) no se practicó el frotis. En 8% se tomó biopsia de piel y sólo en una tercera parte se aplicó la prueba de intradermorreacción.
Se hallaron anotaciones por controles médicos al final del tratamiento en 190 (40%). En los documentos de la mitad de las mujeres en edad fértil que recibieron tratamiento no se encontraron datos sobre la fecha de la última menstruación, medidas anticonceptivas o prueba de embarazo previa al inicio de las inyecciones. Los registros epidemiológicos son más completos lo que refleja la clara tendencia de la ficha de registro de pacientes actualmente en uso en Colombia hacia este aspecto.
Tratamiento. 238 pacientes fueron tratados con antimoniato de meglumina (Glucantime®, Aventis). En 163 (68%) se cumplieron las recomendaciones de 20 mg/kg por día durante 20 días continuos y 150 (92%) de ellos se consideraron curados. En comparación, 35 de 75 (47%) que recibieron esquemas incompletos fallaron (
cuadro 1). Once de quienes fallaron recibieron un segundo tratamiento supervisado y sólo 5 (45%) se curaron.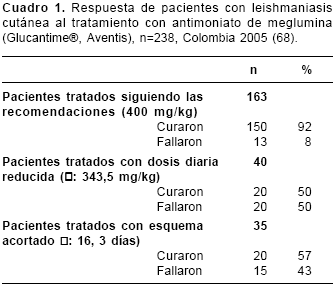
Hubo dos razones principales para los esquemas incompletos: 1) ajuste de dosis, para no "desperdiciar", con aproximación por lo bajo al número de ampollas exacto, lo que sucedió en el 60% de los que fallaron, y 2) reducción de efectos secundarios, lo que sucedió en el 40% restante en quienes el intenso dolor en el sitio de las inyecciones fue la queja principal.
Control de los programas de atención. La información sobre la atención de los pacientes con leishmaniasis hace parte de los reportes periódicos que deben rendir las unidades de salud de los diferentes niveles hasta que se consolida en el nivel central. La centralización en el procesamiento y análisis de la información es indispensable para definir las políticas nacionales de salud pero, dada la enorme cantidad de datos que se manejan, la introducción de modificaciones toma mucho tiempo. Cuando se necesita mejorar la salud en aspectos puntuales, en áreas específicas y a corto plazo, la adopción de un sistema más sencillo y ágil que recoja sólo lo que el personal local de salud puede analizar y utilizar, permite un mayor dinamismo y una solución más eficiente del problema individual del paciente (74). Esta es la razón por la cual el modelo de sitios centinela se ha impuesto en enfermedades como malaria y tuberculosis y por la cual esta estrategia podría ser útil en áreas de leishmaniasis en Colombia.
Propuesta de vigilancia terapéutica mediante la estrategia de sitios centinela
Las intervenciones terapéuticas buscan la curación del paciente y las intervenciones epidemiológicas y sanitarias pretenden la eliminación de la enfermedad en una determinada comunidad. La combinación de todas las estrategias debería dar por resultado el control o la eliminación del riesgo de padecer leishmaniasis. La compleja interrelación de múltiples factores hace que la eliminación de la leishmaniasis sea prácticamente imposible por lo que el control para reducir la enfermedad es una meta más factible, al menos, en el mediano plazo. En relación con el manejo individual de los enfermos el objetivo es curarlos mediante la intervención más simple, costo-efectiva y segura.
La sección de terapéutica de las guías oficiales de manejo de la leishmaniasis fija unas pautas que buscan resolver el problema de la mayoría de los enfermos, propósito que logran en buena medida. El manejo actual de la información y la enorme cantidad de datos sobre distintas enfermedades que se deben enviar periódicamente para su procesamiento centralizado hacen que los análisis, los resultados, las conclusiones y las recomendaciones se demoren. Fruto de este proceso son, lógicamente, guías que buscan cubrir la mayoría de las situaciones pero que, obviamente, no pueden detenerse en circunstancias particulares. Cuando hay variaciones individuales y casos que se salen de las presentaciones habituales quedan, por supuesto, fuera del alcance de dichas guías. ¿Qué debe, entonces, hacer un médico y qué puede esperar un paciente ante una situación no contemplada en las guías?
La creación de una red operativa de vigilancia de los resultados de la terapéutica antileishmaniásica puede servir para resolver esas situaciones puntuales, para brindar apoyo a médicos y pacientes en forma inmediata ante una situación que no da espera, al tiempo que recoge información sobre el tratamiento y las circunstancias que lo rodean, de forma tal que se convierta en un soporte para el análisis y la toma de decisiones en el momento de revisar las guías generales de manejo.
La metodología de sitios centinela ha sido exitosamente empleada en otras enfermedades infecciosas como la malaria y la tuberculosis (75,76). Los sitios centinela son localidades representativas a nivel regional de las distintas condiciones de salud, de los diferentes niveles de acceso a los servicios de salud, de la diversidad étnico-cultural y de la densidad de la población. Son comunidades en las que se realiza la recolección cíclica de información detallada, confiable y utilizable en la planificación, que complementa el sistema rutinario de información (77). No es un área de pruebas sino un lugar corriente que es fiel reflejo de las comunidades que representa y del que se obtienen resultados que pueden ser reproducibles (78) y, sobre todo, aplicables para la resolución de situaciones específicas de un paciente o de un grupo pequeño de pacientes. Mientras que sistemas como el SIVIGILA reciben y procesan información pertinen-te para la definición de las políticas generales de salud de aplicación en el ámbito nacional, una red de sitios centinela provee herramientas para decidir situaciones locales individuales, puntuales y específicas de manera inmediata.
Haciendo uso de los sitios centinela se puede obtener información que responda a la inquietud existente entre investigadores, clínicos, administradores y comunidad en relación con los resultados del programa de control de leishmaniasis cutánea en nuestro país, especialmente en lo que hace referencia a la utilidad y seguridad de los medicamentos. Un programa de esta naturaleza debe resolver las inquietudes sobre:
eficacia, tolerancia y seguridad de los medicamentos;
efectividad de los servicios de salud en la administración del programa antileishmaniásico.
vigencia y aplicabilidad de las recomenda-ciones del nivel central, y
conocimientos, actitudes y prácticas tanto del usuario como del prescriptor del tratamiento antileishmaniásico.
Organizar una red de vigilancia centinela tiene efectos prácticos en diversas áreas. Algunos de los más importantes son:
En educación:
Recolectar, procesar y evaluar información sobre conocimientos, creencias, actitudes y prácticas de la población en relación con la enfermedad, sus medidas de prevención y su manejo.
Establecer el grado de conocimiento y preparación del personal local de salud encargado del manejo de la enfermedad, así como su actitud y compromiso.
Determinar las necesidades reales de información de los enfermos, de la comunidad, del personal de salud y de las autoridades locales.
Analizar y ofrecer alternativas de solución a las situaciones específicas locales de una forma más ágil y puntual.
Alimentar a los entes de salud de niveles superiores con información que les provea de elementos para revisar el programa e introducir ajustes que lo hagan más operativo para que responda a necesidades reales de la población.
Hacer aportes al conocimiento de la leishmaniasis toda vez que, como en cualquier proceso dinámico, se dan cambios que pueden ser detectados más fácil y rápidamente a este nivel. Estas observaciones locales pueden ser posteriormente evaluadas por los entes superiores para determinar su validez e impacto global.
En asistencia:
Unificar criterios clínicos y de laboratorio para el diagnóstico de la enfermedad.
Fomentar el desarrollo y acceso a técnicas de laboratorio confirmatorias.
Seguir la prescripción, administración y control al manejo farmacológico de los pacientes.
Establecer criterios para seguimiento y determinación de curación o falla.
En administración:
Evaluar los procesos actuales y proponer e implementar los que sean más eficientes para la atención de los enfermos.
Racionalizar tiempos y costos.
Ejercer un mayor control sobre los recursos, especialmente en lo relacionado con exámenes paraclínicos y con el medicamento.
Constatar la aplicabilidad de las recomenda-ciones actuales para diagnóstico de laboratorio, esquemas supervisados de administración de los antimoniales pentavalentes, tiempo de seguimiento, etc.
En investigación y epidemiología:
Conocer la frecuencia de presentación de leishmaniasis en los sitios seleccionados.
Conocer el comportamiento epidemiológico de la leishmaniasis.
Fomentar el desarrollo de otras investigaciones relacionadas.
Aportar información útil para la implementación de medidas de control.
Detectar y comunicar circunstancias que se alejen de la norma.
Perspectivas en el tratamiento
¿Qué piensan los autores que sucederá con la terapia antileishmaniásica en los próximos cinco años en Colombia?
Antimoniales pentavalentes. La eficacia, actualmente entre 80% y 90% puede disminuir pero sin llegar aún a niveles críticos; habrá un mayor cuidado en su administración y tanto médicos como pacientes estarán más pendientes de los eventuales efectos secundarios lo cual, seguramente, hará que los reportes se incrementen pero que se detecten a tiempo los problemas y se puedan manejar rápidamente los potenciales eventos adversos graves. La aparición en el mercado nacional del estibogluconato de sodio original (Pentostam®, GSK), así como de varios genéricos (uno de meglumina de Laboratorios BCN y tres de estibogluconato: GR Intercomerce, Lakor Farmacéutica y Albert David Ltd.) abrirá la oferta, lo que puede contribuir a disminuir costos de tratamiento. Sin embargo, en este punto habrá que ser especialmente cuidadosos para asegurarse de que existan estudios clínicos locales que demuestren la eficacia de tales productos contra las especies circulantes en Colombia, así como un perfil de seguridad óptimo. La implementación de la vía endovenosa en aquellos lugares donde sea logísticamente posible, podrá ayudar a disminuir el efecto adverso más frecuente –el dolor local– causante de las pausas y de las interrupciones prematuras relacionadas con, al menos, el 40% de las fallas terapéuticas.
Pentamidina. Incluida en las guías oficiales como la segunda alternativa pero sin que se disponga de ella en la actualidad. De conseguirse, será una buena opción para aquellos pacientes que no puedan recibir antimoniales por contraindicaciones médicas. También será útil para tratar los casos de fracaso terapéutico. El hecho de que el volumen total que se inyecta sea entre 10 y 20 veces menor y que el tiempo de tratamiento sea un tercio o la mitad que el de los antimoniales son ventajas importantes, máxime cuando su perfil de seguridad es comparativamente mejor.
Miltefosina. La alta eficacia demostrada contra L. panamensis, especie identificada en más del 80% de los aislamientos locales, hará que este medicamento se considere de primera línea en Colombia, pero es necesario establecer su comportamiento frente a L. braziliensis, L. guyanensis y L. mexicana. Su administración por vía oral y su excelente perfil de seguridad son ventajas muy importantes; sin embargo, deben extremarse los cuidados para su empleo en mujeres en edad fértil así como para realizar el tratamiento bajo supervisión que garantice la administración completa para evitar los fracasos terapéuticos y la eventual generación de resistencia.
Anfotericina B. Seguirá siendo una alternativa en casos de leishmaniasis visceral y mucosa que no respondan a los antimoniales. Su costo, la necesidad de hospitalización y los frecuentes e importantes efectos secundarios seguirán siendo limitantes para su empleo. Las formas liposómicas se emplearán poco debido a sus altos costos.
Terapias combinadas. La tendencia es hacia la búsqueda de combinaciones medicamentosas que potencien sus efectos y disminuyan eventos secundarios y costos, siguiendo la experiencia de otras enfermedades como la malaria, la lepra y la tuberculosis. El que no presente resistencia cruzada contra antimoniales, anfotericina ni paromomicina, hacen de la miltefosina un medicamento ideal para buscar las combinaciones.
Otras alternativas. La crioterapia, la termoterapia, las inyecciones intralesionales y los esquemas acortados con antimoniales y otros medicamentos deben demostrar su real utilidad en estudios clínicos controlados. La posibilidad de desarrollo de lesiones mucosas es una de las principales razones para tratar la leishmaniasis cutánea en Colombia; por tal motivo, y hasta tanto no exista una forma rápida y confiable de determinar la especie infectante o la posibilidad de extensión mucosa, el tratamiento debe hacerse con los medicamentos, a las dosis y por las vías recomendadas.
Profilaxis. La posibilidad de una vacuna segura y efectiva contra las diversas especies circulantes en el país está aún muy lejana. Considerando que la búsqueda de una vacuna antileishmaniásica lleva más de cien años, los autores no creen que en el próximo lustro se disponga de ella. Las medidas preventivas individuales (ropa protectora, repelentes, etc.) tendrán una utilidad limitada mientras que las colectivas seguirán siendo difíciles de aplicar y poco útiles, por lo que es en el correcto tratamiento de los enfermos en donde se debe concentrar el mayor esfuerzo.
Conclusiones
Los antimoniales pentavalentes han perdido eficacia antileishmaniásica en otros países como resultado del empleo de dosis insuficientes, cursos acortados de tratamiento, transmisión antro-ponótica y uso de medicamentos de baja calidad. Errores frecuentes como iniciar con dosis bajas e ir aumentando hasta la dosis plena, hacer el tratamiento en ciclos, hacer pausas durante el tratamiento o dividir la dosis diaria en dos o tres aplicaciones resultan en niveles sanguíneos subterapéuticos y en una tolerancia de los parásitos al antimonio.
Aunque en Colombia los antimoniales siguen siendo primera elección para el tratamiento de las leishmaniasis, es reconfortante observar los esfuerzos por encontrar nuevos medicamentos que los complementen o los remplacen pero es necesario evaluarlos en nuestra propia situación antes de aceptar resultados obtenidos en otras latitudes y con otras especies. Bajo las actuales circunstancias, los medicamentos para leishmaniasis deben ser escogidos de acuerdo con la especie circulante en el área de infección. En las regiones en donde hay resistencia comprobada a SbV, se han considerado diversas posibilidades de esquemas con múltiples fármacos, vectorización de la droga mediante su inclusión en liposomas y potenciación de la respuesta inmune del paciente, con miras a conseguir la curación del enfermo y a disminuir la posibilidad de generar o transmitir resistencia. En Colombia debemos tener en mente la posibilidad de resistencia a los antimoniales y tomar las precauciones necesarias para evitar que el problema nos desborde.
La supervisión del manejo general, y muy especial-mente, del tratamiento, debe implementarse en distintas áreas del país. Debe hacerse un gran esfuerzo en la capacitación y el entrenamiento de los profesionales a cargo del cuidado médico de los pacientes como medida para garantizar el manejo ideal del programa, mejorar las capacidades diagnósticas clínicas y paraclínicas, racionalizar tiempos y costos y ofrecer al paciente el mejor cuidado posible.
Aprovechando la experiencia con actividades similares en malaria es necesario tomar medidas para evitar que la avalancha de información recolectada localmente sature el programa e impida su análisis y empleo para generar cambios e introducir los ajustes necesarios en forma rápida. De igual manera, hay que desarrollar una estrategia que elimine las incompatibilidades con escalones superiores, para evitar que se manejen cifras retrasadas que subestimen o sobreestimen ciertas realidades que pueden no ser el reflejo del momento actual para esa zona específica.
Por último, es indispensable que la información haga su ciclo completo y regrese a la comunidad. De esta manera se puede hacer un manejo más racional de la enfermedad y se pueden proteger los medicamentos para prolongarles su vida útil.
Conflicto de intereses
Jaime Soto ha obtenido fondos para adelantar estudios clínicos con medicamentos antileish-maniásicos de las siguientes entidades: Albert David Ltd, Asta Médica, Aventis, BCN Medical, Carlos Erba, Teva, WRAIR y Zentaris.
Financiación
Este trabajo fue parcialmente financiado por la AB Foundation for Medical Research de North Bethesda, MD, USA y por la Fundación FADER, Bogotá, Colombia.
Correspondencia:
Jaime Soto, CIBIC, Centro de Investigaciones Bioclínicas de la Fundación FADER, Calle 60 A No. 5-54, oficina 201, Bogotá.
Teléfono 348 2171; fax: 347 6093
jaime.soto@medplus.org.co y jaime.soto@cable.net.co
Referencias
1. Vera M, Galindo F, Zambrano P, Equipo de Vigilancia y Control ETV, Subdirección de Vigilancia y Control de Salud Pública, Méndez J et al. Informe de enfermedades transmitidas por vectores (ETV). Inf Quinc Epidemiol Nac 2005;10:33-9. [ Links ]
2. World Health Organization. The leishmaniases: report of a WHO Expert Committee. Technical report series 701. Geneva: World Health Organization; 1984. p.99-108. [ Links ]
3. World Health Organization. Control of leishmaniases: report of an expert committee. Technical Report Series 793. Geneva: World Health Organization; 1990.p.50-5. [ Links ]
4. República de Colombia. Ministerio de Salud. Guía de atención de las leishmaniasis. [Consultado: 9 de septiembre de 2005]. Disponible en: http://www.metrosalud.gov.co/Paginas/Protocolos/MinSalud/guias/35-LEISHMANIASIS.htm [ Links ]
5. Berman JD. Human leishmaniasis: clinical, diagnostic, and chemotherapeutic developments in the last 10 years. Clin Infect Dis 1997;24:684-703. [ Links ]
6. Gasser RA Jr, Magill AJ, Oster CN, Franke ED, Grogl M, Berman JD. Pancreatitis induced by pentavalent antimonial agents during treatment of leishmaniasis. Clin Infect Dis 1994;18:83-90. [ Links ]
7. Singh S, Sundar S. Toxicity of pentavalent antimony. J Assoc Physicians India 1994;42:755. [ Links ]
8. Silveira BP, Araujo Sobrinho J, Leite LF, Sales MN, Gouveia Mdo S, Mathias RL et al. Parto prematuro após uso de antimonial pentavalente: relato de um caso. Rev Soc Bras Med Trop 2003;36:523-5. [ Links ]
9. Delgado J, Macias J, Pineda JA, Corzo JE, Gonzalez-Moreno MP, de la Rosa R et al. High frequency of serious side effects from meglumine antimoniate given without an upper limit dose for the treatment of visceral leishmaniasis in human immunodeficiency virus type-1-infected patients. Am J Trop Med Hyg 1999;61:766-9. [ Links ]
10. Berhe N, Abraham Y, Hailu A, Ali A, Mengistu G, Tsige K et al. Electrocardiographic findings in Ethiopians on pentavalent antimony therapy for visceral leishmaniasis. East Afr Med J 2001;78:608-10. [ Links ]
11. Guerin PJ, Olliaro P, Sundar S, Boelaert M, Croft SL, Desjeaux P et al. Visceral leishmaniasis: current status of control, diagnosis and treatment and a proposed research and development agenda. Lancet Infect Dis 2002;2:494-501. [ Links ]
12. Soto J, Grogl M, Berman JD. Evaluation of pentamidine for the treatment of cutaneous leishmaniasis in Colombia. Clin Infect Dis 1993;16:417-25. [ Links ]
13. Soto J, Grogl M, Berman J, Olliaro P. Limited efficacy of injectable aminosidine as single-agent therapy for Colombian cutaneous leishmaniasis. Trans R Soc Trop Med Hyg 1994;88:695-8. [ Links ]
14. Vélez I, Agudelo S, Hendrickx E, Puerta J, Grogl M, Modabber F et al. Inefficacy of allopurinol as monotherapy for Colombian cutaneous leishmaniasis. A randomized, controlled trial. Ann Intern Med 1997;126:232-6. [ Links ]
15. Soto J, Fuya P, Herrera R, Berman J. Topical paromomycin/methyl-benzethonium chloride plus parenteral meglumine antimoniate as treatment for American cutaneous leishmaniasis: controlled study. Clin Infect Dis 1998;26:56-8. [ Links ]
16. Palacios R, Osorio LE, Grajales LF, Ochoa MT. Treatment failure in children in a randomized clinical trial with 10 and 20 days of meglumine antimonate for cutaneous leishmaniasis due to Leishmania Viannia species. Am J Trop Med Hyg 2001;64:187-93. [ Links ]
17. Soto J, Valda-Rodríguez L, Toledo J, Vera-Navarro L, Luz M, Monasterios-Torrico H et al. Comparison of generic to branded pentavalent antimony for treatment of New World cutaneous leishmaniasis. Am J Trop Med Hyg 2004;71:577-81. [ Links ]
18. Soto J, Toledo J, Vega J, Berman J. Short report: efficacy of pentavalent antimony for treatment of Colombian cutaneous leishmaniasis. Am J Trop Med Hyg 2005;72: 421-2. [ Links ]
19. Navin T, Arana B, Arana F, de Mérida A, Castillo A, Pozuelos J. Placebo-controlled clinical trial of meglumine antimoniate (Glucantime) vs. localized controlled heat in the treatment of cutaneous leishmaniasis in Guatemala. Am J Trop Med Hyg 1990;42:43-50. [ Links ]
20. Romero GA, Guerra MV, Paes MG, Macedo VO. Comparison of cutaneous leishmaniasis due to Leishmania (Viannia) braziliensis and L. (V.) guyanensis in Brazil: therapeutic response to meglumine antimoniate. Am J Trop Med Hyg 2001;65:456-65. [ Links ]
21. de Paula C, Sampaio J, Cardoso D, Sampaio R. Estudo comparativo da eficácia de isotionato de pentamidina administrada em três doses durante uma semana e de N-metil-glucamina 20mgSbV/kg/dia durante 20 dias para o tratamento da forma cutânea da leishmaniose tegumentar americana. Rev Soc Bras Med Trop 2003;36:365-71. [ Links ]
22. Andersen EM, Cruz-Saldarriaga M, Llanos-Cuentas A, Luz-Cjuno M, Echevarria J, Miranda-Verastegui C et al. Comparison of meglumine antimoniate and pentamidine for Peruvian cutaneous leishmaniasis. Am J Trop Med Hyg 2005;72:133-7. [ Links ]
23. Berman J. Recent developments in leishmaniasis: epidemiology, diagnosis and treatment. Curr Infect Dis Rep 2005;7:33-8. [ Links ]
24. Gontijo B, de Carvalho M. Leishmaniose tegumentar americana. Rev Soc Bras Med Trop 2003;36:71-80. [ Links ]
25. Soto J, Buffet P, Grogl M, Berman J. Successful treatment of Colombian cutaneous leishmaniasis with four injections of pentamidine. Am J Trop Med Hyg 1994;50:107-11. [ Links ]
26. Hendrickx EP, Agudelo SP, Muñoz DL, Puerta JA, Vélez ID. Lack of efficacy of mefloquine in the treatment of New World cutaneous leishmaniasis in Colombia. Am J Trop Med Hyg 1998;59:889-92. [ Links ]
27. Osorio LE, Palacios R, Chica ME, Ochoa MT. Treatment of cutaneous leishmaniasis in Colombia with dapsone. Lancet 1998;351:498-9. [ Links ]
28. Do Valle TZ, Oliveira Neto MP, Schubach A, Lagrange PH, Da Costa SC. New World tegumentar leishmaniasis: chemotherapeutic activity of rifampicin in humans and experimental murine model. Pathol Biol (Paris) 1995;43:618-21. [ Links ]
29. Walton BC, Paulson JE, Arjona MA, Peterson CA. American cutaneous leishmaniasis. Inefficacy of metronidazole in treatment. JAMA 1974;228:1256-8. [ Links ]
30. Saenz RE, Paz H, Berman JD. Efficacy of ketoconazole against Leishmania braziliensis panamensis cutaneous leishmaniasis. Am J Med 1990; 89:147-55. [ Links ]
31. Gonzalez U. Fluconazole for cutaneous leishmaniasis: looking for a better treatment. Arch Dermatol 2002;138:1604-6. [ Links ]
32. Silva-Vergara ML, Silva L de A, Maneira FR, da Silva AG, Prata A. Azithromycin in the treatment of mucosal leishmaniasis. Rev Inst Med Trop Sao Paulo 2004;46:175-7. [ Links ]
33. Hay RJ. Therapeutic potential of terbinafine in subcutaneous and systemic mycoses. Br J Dermatol 1999;141(Suppl.56):36-40. [ Links ]
34. Soto JM, Toledo JT, Gutiérrez P, Arboleda M, Nicholls RS, Padilla JR et al. Treatment of cutaneous leishmaniasis with a topical antileishmanial drug (WR279396): phase 2 pilot study. Am J Trop Med Hyg 2002;66:147-51. [ Links ]
35. Gamier T, Croft SL. Topical treatment for cutaneous leishmaniasis. Curr Opin Investig Drugs 2002;3:538-44. [ Links ]
36. Willard RJ, Jeffcoat AM, Benson PM, Walsh DS. Cutaneous leishmaniasis in soldiers from Fort Campbell, Kentucky returning from Operation Iraqi Freedom highlights diagnostic and therapeutic options. J Am Acad Dermatol 2005;52:977-87. [ Links ]
37. Reithinger R, Mohsen M, Wahid M, Bismullah M, Quinnell RJ, Davies CR et al. Efficacy of thermotherapy to treat cutaneous leishmaniasis caused by Leishmania tropica in Kabul, Afghanistan: a randomized, controlled trial. Clin Infect Dis 2005;40:1148-55. [ Links ]
38. Sundar S, Rosenkaimer F, Makharia MK, Goyal AK, Mandal A, Voss A et al. Trial of miltefosine for visceral leishmaniasis. Lancet 1998;352:1821-3. [ Links ]
39. Ministerio de Salud del Perú. Leishmaniasis. Módulos técnicos. Serie de documentos monográficos. Vol II. Lima: Ministerio de Salud del Perú; 2000. p.1-80. [ Links ]
40. Sánchez-Saldana L, Sáenz-Anduaga E, Pancorbo-Mendoza J, Zegarra del Carpio R, Garcés-Velasco N, Regis-Roggero A. Leishmaniasis. Dermatol Peru 2004;14:82-98. [ Links ]
41. Ministerio de Salud de la República Argentina. Manual de procedimientos para el nivel gerencial y profesional sobre leshmaniosis. Resolución 386 de 2004. [Consultado: 9 de septiembre de 2005]. Disponible en: http://infoleg.mecon.gov.ar/infolegInternet. [ Links ] 42. Secretaría de Salud de México. Norma oficial mexicana NOM-032-SSA2-2002. Para la vigilancia epidemiológica, prevención y control de enfermedades transmitidas por vector. 2003. [Consultado: 9 de septiembre de 2005]. Disponible en: 43. Ministério da Saúde do Brasil. Manual de controle da leishmaniose tegumentar americana. Brasilia: Ministério da Saúde do Brasil; 2000.p.1-64. [ Links ] 44. Basano S, Camargo L. American cutaneous leishmaniasis: history, epidemiology and prospects for control. Rev Bras Epidemiol 2004;7:328-37. [ Links ] 45. Calvopina M, Armijos RX, Hashiguchi Y. Epidemiology of leishmaniasis in Ecuador: current status of knowledge - a review. Mem Inst Oswaldo Cruz 2004;99:663-72. [ Links ] 46. Castro S, Zerpa O, Rondón A. Leishmaniasis en la infancia. Med Cutan Iber Lat Am 2003;31:351-61. [ Links ] 47. CENTCOM. Policy on cutaneous leishmaniasis diagnosis and treatment. 2004. [Consultado: 9 de septiembre de 2005]. Disponible en
48. Zilberstein D. Transport of nutrients and ions across membranes of trypanosomatid parasites. Adv Parasitol 1993;32:261-91. [ Links ]
49. Burchmore RJ, Barrett MP. Life in vacuoles-nutrient acquisition by Leishmania amastigotes. Int J Parasitol 2001;31:1311-20. [ Links ]
50. Croft SL, Coombs GH. Leishmaniasis: current chemotherapy and recent advances in the search for novel drugs. Trends Parasitol 2003;19:502-8. [ Links ]
51. Allen S, Neal R. The in vitro susceptibility of macrophages infected with amastigotes of Leishmania spp. to pentavalent antimonial drugs and other compounds with special relevance to cutaneous isolates. En: Hart D, editor. Leishmaniasis. New York: Plenum Press; 1989. p.711-20. [ Links ]
52. Neal RA, Allen S, McCoy N, Olliaro P, Croft SL. The sensitivity of Leishmania species to aminosidine. J Antimicrob Chemother 1995;35:577-84. [ Links ]
53. Grogl M, Oduola AM, Cordero LD, Kyle DE. Leishmania spp: development of Pentostam-resistant clones in vitro by discontinuous drug exposure. Exp Parasitol 1989;69:78-90. [ Links ]
54. Grogl M, Thomason TN, Franke ED. Drug resistance in leishmaniasis: its implication in systemic chemotherapy of cutaneous and mucocutaneous disease. Am J Trop Med Hyg 1992;47:117-26. [ Links ]
55. Navin TR, Arana BA, Arana FE, Berman JD, Chajon JF. Placebo-controlled clinical trial of sodium stibogluconate (Pentostam) versus ketoconazole for treating cutaneous leishmaniasis in Guatemala. J Infect Dis 1992;165:528-34. [ Links ]
56. Osorio E, Robledo S, Arango G, Muskus C. Leishmania: papel de la glicproteína P en la mediación de resistencia a medicamentos y estrategias de reversión. Biomédica 2005;25:242-60. [ Links ]
57. Sundar S, More DK, Singh MK, Singh VP, Sharma S, Makharia A et al. Failure of pentavalent antimony in visceral leishmaniasis in India: report from the center of the Indian epidemic. Clin Infect Dis 2000;31:11047 [ Links ]
58. Sundar S. Drug resistance in Indian visceral leishmaniasis. Trop Med Int Health 2001;6:849-54. [ Links ]
59. Sundar S, Thakur BB, Tandon AK, Agrawal NR, Mishra CP, Mahapatra TM et al. Clinicoepidemiological study of drug resistance in Indian kala-azar. BMJ 1994;308:307. [ Links ]
60. Oliveira CC, Lacerda HG, Martins DR, Barbosa JD, Monteiro GR, Queiroz JW et al. Changing epidemiology of American cutaneous leishmaniasis (ACL) in Brazil: a disease of the urban-rural interface. Acta Trop 2004;90:155-62. [ Links ]
61. Faraut-Gambarelli F, Piarroux R, Deniau M, Giusiano B, Marty P, Michel G et al. In vitro and in vivo resistance of Leishmania infantum to meglumine antimoniate: a study of 37 strains collected from patients with visceral leishmaniasis. Antimicrob Agents Chemother 1997;41:827-30. [ Links ]
62. Lira R, Sundar S, Makharia A, Kenney R, Gam A, Saraiva E et al. Evidence that the high incidence of treatment failure in kala-azar is due to the emergence of antimony resistant strains of Leishmania donovani. J Infect Dis 1999;180:564-7. [ Links ]
63. Yadon ZE, Rodrigues LC, Davies CR, Quigley MA. Indoor and peridomestic transmission of American cutaneous leishmaniasis in northwestern Argentina: a retrospective case-control study. Am J Trop Med Hyg 2003;68:519-26. [ Links ]
64. de Castro EA, Luz E, Telles FQ, Pandey A, Biseto A, Dinaiski M et al. Eco-epidemiological survey of Leishmania (Viannia) braziliensis American cutaneous and mucocutaneous leishmaniasis in Ribeira Valley River, Parana State, Brazil. Acta Trop 2005;93:141-9. [ Links ]
65. Campbell-Lendrum D, Dujardin JP, Martinez E, Feliciangeli MD, Perez JE, Silans LN et al. Domestic and peridomestic transmission of American cutaneous leishmaniasis: changing epidemiological patterns present new control opportunities. Mem Inst Oswaldo Cruz 2001;96:159-62. [ Links ]
66. Rabinovich JE, Feliciangeli MD. Parameters of Leishmania braziliensis transmission by indoor Lutzomyia ovallesi in Venezuela. Am J Trop Med Hyg 2004;70:373-82. [ Links ]
67. Vélez ID, Hendrickx E, Robledo SM, Agudelo S. Leishmaniosis cutánea en Colombia y género. Cad Saude Publica 2001;17:171-80. [ Links ]
68. Soto J, Toledo J, Soto P, Vega J, Casas L, Herrera R et al. Respuesta a antimoniales pentavalentes para el tratamiento de leishmaniasis cutánea en Colombia. Rev Asoc Col Dermat Cir Dermat 2005;13:39-44. [ Links ]
69. Davies CR, Reithinger R, Campbell-Lendrum D, Feliciangeli D, Borges R, et al. The epidemiology and control of leishmaniasis in Andean countries. Cad Saude Publica 2000;16:925-50. [ Links ]
70. Davies CR, Kaye P, Croft SL, Sundar S. Leishmaniasis: new approaches to disease control. BMJ 2003;326:377-82. [ Links ]
71. Jackson J, Tally J, Ellis W. Quantitative in vitro drug potency and drug susceptibility evaluation of Leishmania sp. from patients unresponsive to pentavalent antimony therapy. Am J Trop Med Hyg 1990;90:464-80. [ Links ]
72. Berhe N, Ali A, Hailu A, Yeneneh H. Relapse in Ethiopian visceral leishmaniasis (VL) patients after therapy with pentavalent antimonials: a ten year observation. Acta Trop 1994;57:83-90. [ Links ]
73. Croft SL, Sundar S, Fairlamb AH. Drug resistance in leishmaniasis. Clin Microbiol Rev 2006;19:111-26. [ Links ]
74. Andersson N. Los problemas con el muestreo probabilístico en la selección de sitios centinela. Centro de Investigaciones de Enfermedades Tropicales 1990;2:30-5. [ Links ]
75. East African Network for Monitoring Antimalarial Treatment (EANMAT). Monitoring antimalarial drug resistance within National malaria Control Programmes: the EANMAT experience. Trop Med Int Health 2001;6:891-8. [ Links ]
76. Organización Panamericana de la Salud. Red de Vigilancia de la Resistencia a las Drogas Antimaláricas en la Amazonía, en cooperación con la Iniciativa Amazónica contra la Malaria (IAM o AMIAmazon Malaria Initiative) de USAID. [Consultado: 9 de septiembre de 2005]. Disponible en: http://www.paho.org/spanish/AD/DPC/CD/ravreda-ami.htm [ Links ]
77. Terry B. Metodología de sitios centinela en la planificación de salud. Rev Cubana Aliment Nutr 1997;11:117-22. [ Links ]
78. Andersson N, Arostegui J, Lainez O, Irigoyen L, Amaris A, Martínez E et al. Sitios centinela: la experiencia de Centroamérica y Guerrero (México) en la descentralización de planificación. Prioridades de Salud: El Centro de Investigaciones de Enfermedades Tropicales Informa 1990;2:18-29. [ Links ]














