Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biomédica
versão impressa ISSN 0120-4157versão On-line ISSN 2590-7379
Biomédica v.27 n.1 Bogotá jan./mar. 2007
Evaluación de la eficacia de los medicamentos antimaláricos en Tarapacá, Amazonas colombiano
Lyda Osorio 1, Ligia del Pilar Pérez 2, Iveth J. González
1Centro Internacional de Entrenamiento e Investigaciones Médicas (CIDEIM), Cali, Colombia.2Programa de Control de Enfermedades Transmitidas por Vectores, Secretaría de Salud Departamentaldel Amazonas, Leticia, Colombia.
Recibido: 10/04/06; aceptado: 23/11/06
Introducción. La selección de los esquemas de tratamiento para malaria en Colombia se ha basado principalmente en estudios realizados en Antioquia y en la costa Pacífica, pero se desconoce la eficacia de los antimaláricos en la Orinoquia y Amazonia colombianas.
Objetivo. Evaluar la eficacia terapéutica de tres monoterapias: amodiaquina y sulfadoxina/pirimetamina para el tratamiento de malaria no complicada por Plasmodium falciparum y de cloroquina para el tratamiento de malaria por Plasmodium vivax en Tarapacá, departamento del Amazonas.
Materiales y métodos. Suministro de tratamiento supervisado y seguimiento clínico y parasitológico durante 28 días según protocolos estandarizados de sujetos con infección única por P. falciparum o P. vivax.
Resultados. No fue posible completar el tamaño de muestra por disminución marcada en la transmisión. En el grupo de P. falciparum, el tratamiento con amodiaquina fracasó en dos sujetos; se suspendió el grupo de sulfadoxina/pirimetamina por alto número de fracasos terapéuticos (7/8). En el grupo de P. vivax, la mayoría (18/20) presentó respuesta adecuada al tratamiento.
Conclusiones. Es necesario reconsiderar el uso de sulfadoxina/pirimetamina en Tarapacá y posiblemente en el Amazonas colombiano. Se requieren estudios de eficacia terapéutica en otras áreas endémicas, o la utilización de métodos in vitro o moleculares, para definir el esquema de tratamiento para malaria por P. falciparum en la Orinoquia y Amazonia colombianas.
Palabras clave: malaria falciparum/prevención y control, malaria vivax/prevención y control, quimioterapia, ecosistema amazónico, Colombia.
Assessment of the efficacy of antimalarial drugs in Tarapacá, in the Colombian Amazon basin
Introduction. The current antimalarial drug policy in Colombia has been based on studies conducted in Antioquia and the Pacific Coast. However, the efficacy of antimalarial drugs in other endemic regions is unknown.
Objective. The therapeutic efficacy of three monotherapies was assessed: amodiaquine and sulfadoxine/pyrimethamine for uncomplicated Plasmodium falciparum malaria, and chloroquine for Plasmodium vivax malaria in the municipality of Tarapacá, located in the Colombian province of Amazonas.
Materials and methods. Treatment was supervised and clinical/parasitological follow-up was undertaken through a 28-day period following to World Health Organization standard protocols for subjects with a single P. falciparum or P. vivax infection.
Results. Due to a decrease in malaria transmission at the time of the study, the sample size was very small. The treatment failed for two subjects who received amodiaquine, and treatment with sulfadoxine/pyrimethamine was discontinued due to a high frequency of therapeutic failures (7/8). Most subjects (18/20) with P. vivax infections showed an adequate therapeutic response.
Conclusions. The use of sulfadoxine/pyrimethamine in Tarapacá, and possibly in the Amazon region of Colombia, needs to be reviewed. Therapeutic efficacy studies in other endemic areas in the Amazon and Orinoco regions in Colombia are desirable but not feasible. Alternative methods such as in vitro assays or detection of molecular markers for resistance in the parasite can provide a basis for decisions concerning antimalarial drug policy for the Amazon and Orinoco regions in Colombia.
Key words: malaria, falciparum/prevention & control, malaria vivax/prevention & control, drug therapy, Amazonian ecosystem, Colombia.
La malaria sigue siendo uno de los principales problemas de salud pública en Colombia y el mundo. Los casos de malaria reportados al Ministerio de la Protección Social aumentaron en un 47% en la década de 1990 a 1999 con respecto a la década de 1980 a 1989 y la tendencia entre el 2000 y el 2005 continúa en aumento, reportándose para el año 2005 un total de 107.866 casos (1).
Uno de los factores que ha contribuido al aumento de casos de malaria es la aparición de parásitos resistentes a los antimaláricos. Colombia fue uno de los primeros países donde se reportaron casos de Plasmodium falciparum resistente a la cloroquina en 1961 (2), detectándose luego en la mayoría de las áreas endémicas del mundo. En 1999, luego de varios estudios realizados en la costa Pacífica y en el Bajo Cauca, en donde se encontraron niveles de fracaso terapéutico a cloroquina mayores al 40% (3-7), el entonces Ministerio de Salud recomendó el uso de amodiaquina en vez de cloroquina, en combinación con sulfadoxina/pirimetamina y primaquina (como gametocitocida) para el tratamiento de la malaria no complicada por P. falciparum (8). A pesar de que este esquema de tratamiento antimalárico se recomienda en todo el país, se conoce muy poco acerca de la resistencia a antimaláricos en la región amazónica colombiana fronteriza con Brasil y Perú, países en los cuales ya no se usan estos medicamentos por los altos niveles de fracaso terapéutico encontrados (9,10).
Además de P. falciparum, la malaria en Colombia es causada por Plasmodium vivax, especie responsable de alrededor del 60% del total de casos en el país. La resistencia de P. vivax a cloroquina ya ha sido descrita en Asia y en países de Suramérica como Guyana, Brasil y Colombia (11-13); sin embargo, la cloroquina sigue siendo utilizada en Colombia para el tratamiento de la malaria por P. vivax, lo cual hace necesario plantear estudios que permitan vigilar su eficacia aplicando protocolos recientemente estandarizados.
El presente estudio tuvo como objetivo determinar la eficacia de los medicamentos antimaláricos recomendados por el Ministerio de la Protección Social en el Amazonas colombiano tanto para P. falciparum como para P. vivax, con el fin de contribuir al establecimiento de políticas de medicamentos adecuadas como estrategia de control de malaria en esta región de frontera.
Materiales y métodos
El estudio se llevó a cabo entre julio del 2002 y octubre del 2003, en el municipio de Tarapacá, Amazonas, en la frontera con Brasil y Perú (figura 1), al cual se accede por vía fluvial y aérea. Tarapacá cuenta con 2.088 habitantes, en su mayoría colonos que se dedican especialmente a la explotación de la madera y al comercio; el 40% de ellos vive en el área urbana (Secretaría de Salud del Amazonas). La transmisión de malaria ocurre tanto en el área urbana como en la rural durante todo el año, con un pico de transmisión entre los meses de junio y septiembre. En el 2001 se reportaron 325 casos de malaria confirmados microscópicamente, de los cuales el 34% se debió a infección por P. falciparum (Informe técnico del Programa de Control de Enfermedades Transmitidas por Vectores, Secretaría Departa-mental de Salud del Amazonas). Esto corresponde a un índice parasitario anual de 155,6/1.000 habitantes/año.
El estudio incluyó sujetos con infección por P. falciparum o P. vivax que cumplían con los siguientes criterios: edad entre 6 meses y 65 años; infección única por P. falciparum o P. vivax; recuento de parasitemia mayor de 250 y menor de 50.000 formas asexuales/mL; disponibilidad de asistir a los seguimientos durante 28 días; aceptación de participar en el estudio con consentimiento informado firmado, y no cumplir con ningún criterio de exclusión como embarazo o lactancia (se realizaba prueba de embarazo [Babycheck, Veda Lab, Francia] a mujeres en edad fértil), signos de peligro o de malaria grave (14), enfermedad crónica subyacente (cardiaca, renal, hepática o malnutrición), antecedente de alergia a los medicamentos en estudio y presencia de enfermedad concomitante que requiriese tratamiento adicional con medicamentos de efecto antimalárico.
Los sujetos con malaria por P. falciparum fueron asignados aleatoriamente por bloques permutados usando sobres opacos sellados para recibir monoterapia con amodiaquina en dosis de 25 mg/kg divididas en tres días (10mg/kg los días 0 y 1, y 5mg/kg el día 2), o sulfadoxina/pirimetamina en dosis única de 25mg/kg de sulfadoxina/1,25mg/kg de pirimetamina. Los sujetos con malaria por P. vivax fueron tratados con cloroquina en dosis de 25mg/kg divididas en tres días (10 mg/kg los días 0 y 1, y 5mg/kg el día 2). La primaquina se administró al final del seguimiento como gametocitocida a los sujetos con malaria por P. falciparum en dosis única de 0,6 mg/kg y como cura radical (tratamiento de hipnozoitos) a los sujetos con P. vivax en dosis de 0,25 mg/kg/día durante 14 días. Se entregaron toldillos impreg-nados a todos los pacientes el día de la inclusión en el estudio. El tratamiento se administró a todos los pacientes en forma supervisada y se realizó el seguimiento clínico y parasitológico en los días 0, 1, 2, 3, 7, 14, 21 y 28. La respuesta terapéutica se clasificó en los pacientes que completaron el seguimiento utilizando las definiciones descritas en el protocolo estandarizado de la Organización Panamericana de la Salud (OPS)/Organización Mundial de la Salud para la "Evaluación de la eficacia terapéutica de los medicamentos para el tratamiento del paludismo sin complicaciones en las Américas" (15) así, a) fracaso terapéutico precoz: signos de peligro o malaria grave en los días 1, 2 o 3 con parasitemia, parasitemia en el día 2 mayor que en el día 0, parasitemia en el día 3 mayor al 25% de la parasitemia del día 0; b) fracaso terapéutico tardío: signos de peligro o malaria grave después del día 3 con parasitemia, regreso del paciente en día no programado debido a deterioro clínico con parasitemia, o parasitemia en alguno de los días de seguimiento después del día 3; c) respuesta terapéutica adecuada: no cumple con ninguno de los criterios de fracaso precoz o tardío y ausencia de parasitemia después del día 3 y hasta el día 28 de seguimiento.
Los casos de infección por P. falciparum clasificados como fracaso terapéutico recibieron quinina en dosis de 10 mg/kg cada 8 horas durante tres días más 20 mg/kg/día de clindamicina divididos en cuatro dosis durante cinco días. Los casos de P. vivax que presentaron fracaso con cloroquina recibieron amodiaquina más primaquina en las dosis descritas anteriormente. El estudio fue aprobado por el Comité de Ética de Investi-gación en Humanos del Centro Internacional de Entrenamiento e Investigaciones Médicas (CIDEIM). El cálculo de la parasitemia se realizó multiplicando el número de formas asexuales vistas al contar 200 leucocitos por 30 y asumiendo un recuento normal de leucocitos de 6.000/mL. La gota gruesa se consideró como negativa si no se observaban parásitos en 200 campos microscópicos.
Los datos se analizaron por medio de EpiInfo 6.04d (CDC 2001). El tamaño de la muestra se calculó con el método de muestreo de garantía de calidad por doble lote (DLQAS) recomendado para esa fecha en el protocolo estándar de la OPS (15). La tasa de curación con cualquiera de los esquemas de manejo de malaria por P. falciparum se consideró en el rango de 75 a 90% y para P. vivax entre 90 y 97%. Teniendo en cuenta un nivel de confianza del 95%, un poder estadístico de 80% y una estimación de 20% de pérdidas para el seguimiento se requerían 50 pacientes con P. falciparum por grupo de tratamiento y 100 con P. vivax.
Resultados
Durante los 15 meses de estudio se evaluaron 93 pacientes: 65 con malaria por P. vivax, 26 por P. falciparum y dos con infección mixta (P. falciparum más P. vivax). De los sujetos con infección por una sola especie de Plasmodium, 32 ingresaron al estudio: 22 tenían infección por P. vivax y recibieron tratamiento con cloroquina; 10 tenían infección por P. falciparum y de ellos ocho recibieron tratamiento con sulfadoxina/pirimetamina y dos con amodiaquina. Todos los pacientes, excepto dos en el grupo de P. vivax que no asistieron al control del día 14, completaron el seguimiento (
figura 2). De los dos pacientes que no completaron el seguimiento, uno se retiró voluntariamente y otro no regresó siendo imposible localizarlo.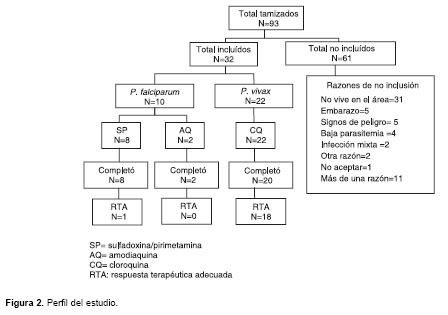
Los síntomas más frecuentes en el momento de la consulta fueron: fiebre (30/32), cefalea (29/32), escalofrío (30/32) y sudoración (27/32). El vómito y la diarrea fueron mencionados por 11/32 y 5/32 pacientes, respectivamente. Según los pacientes, las infecciones fueron adquiridas todas en el municipio de Tarapacá. Específicamente, las infecciones por P. falciparum fueron adquiridas en las localidades de Santa Lucía (5/10), Ventura (4/10) y en la cabecera de Tarapacá (1/10).
Los pacientes incluidos en el estudio tenían un rango de edad de 1,6 a 47 años; la mayoría eran hombres (18/32) e indígenas (27/32); todos negaron haber tomado antimaláricos para ese episodio de malaria (
cuadro 1). En el grupo que recibió sulfadoxina/pirimetamina, 7/8 pacientes presentaron fracaso terapéutico; por consideracio-nes éticas este grupo de tratamiento se suspendió. Los fracasos se clasificaron como precoces en dos pacientes (día 3) y tardíos en cinco pacientes (uno en el día 7 y cuatro en el día 21 de seguimiento). Los dos pacientes en el grupo de amodiaquina presentaron fracaso terapéutico, clasificándose uno como precoz (día 3) y otro como tardío (día 7). De los 20 pacientes con P. vivax que completaron el seguimiento, 18 presentaron respuesta terapéutica adecuada y dos fueron clasificados como fracaso terapéutico. Uno de los dos casos de P. vivax de fracaso con cloroquina se clasificó como precoz con base en un criterio eminentemente clínico, ya que después de recibir la primera dosis supervisada, el paciente regresó al día siguiente con vómito persistente que requirió manejo con antiemético. El otro caso de fracaso con cloroquina fue tardío y se clasificó con base en el criterio parasitológico al observarse gota gruesa positiva en el día 28 de seguimiento.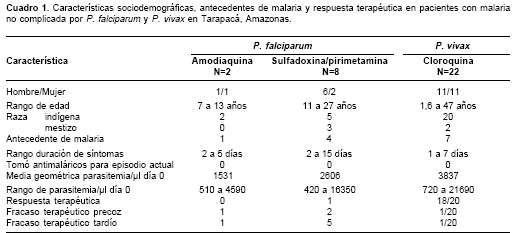
El estudio se debió suspender por una disminución marcada en la transmisión que se reflejó en un muy bajo número de pacientes. Se intentó reiniciar el estudio, pero entre enero y julio del 2005 se diagnosticaron 51 pacientes con malaria (todos por P. vivax) en Tarapacá, por lo cual se tomó la decisión de finalizar el estudio.
Discusión
El tratamiento actualmente recomendado por el Ministerio de la Protección Social para malaria no complicada por P. falciparum en todo el territorio colombiano incluye la combinación de amodiaquina y sulfadoxina/pirimetamina. Los resultados del presente estudio, a pesar del escaso número de pacientes, revelan un alto porcentaje (7/8) de fracaso terapéutico con la sulfadoxina/pirimetamina como monoterapia en Tarapacá, Amazonas. Este estudio, junto con reportes anteriores de fracaso terapéutico con sulfadoxina/pirimetamina en nueve pacientes procedentes de la Orinoquia y la Amazonia (16) sugieren que es necesario reconsiderar el uso de este antimalárico en Tarapacá y posiblemente en la región. Por el contrario, la cloroquina aparentemente continúa siendo eficaz para el tratamiento de malaria por P. vivax en esta zona. Debido al bajo número de pacientes no fue posible evaluar la eficacia terapéutica de amodiaquina como monoterapia, aunque los fracasos en los dos pacientes evalua-dos sugerirían una baja eficacia terapéutica también con este antimalárico.
Brasil no usa amodiaquina ni sulfadoxina/pirimetamina para el tratamiento de malaria por P. falciparum desde hace más de 20 años por presencia de resistencia. Recientemente, Perú reportó fracasos terapéuticos de P. falciparum a la sulfadoxina/pirimetamina superiores al 50% en la frontera con Colombia (10), y en el estado Amazonas de Venezuela se ha reportado resistencia in vitro tanto a amodiaquina como a sulfadoxina/pirimetamina (17). Todos estos países, con excepción de Colombia, han cambiado sus esquemas terapéuticos en la región amazónica por la combinación con un derivado de la artemisina (mefloquina más artesunato o artemeter más lumefantrina). Por el contrario, en la costa Pacífica colombiana y en Antioquia, la sulfadoxina/pirimetamina todavía continúa siendo útil, especialmente combinada con amodiaquina. Los niveles de fracaso terapéutico de P. falciparum a sulfadoxina/pirimetamina como monoterapia en la costa Pacífica varían entre 3 y 20%, y en Antioquia, entre 7 y 26%, mientras la combinación con amodiaquina presenta fracaso terapéutico entre el 0 y 2% (18,19) (CIDEIM, informes técnicos a la OPS, junio de 2004).
Si bien se requieren alternativas terapéuticas para malaria por P. falciparum en Tarapacá, y posible-mente en la región, los resultados obtenidos en el presente estudio no son necesariamente extrapolables a otras zonas de la Amazonia o de la Orinoquia colombianas, ya que estas regiones se encuentran aisladas geográficamente unas de otras. Para tomar decisiones acerca del esquema terapéutico para toda la Amazonia y Orinoquia colombianas sería ideal evaluar la eficacia de los antimaláricos en otras áreas endémicas diferentes a Tarapacá, pero estos estudios parecen poco viables en vista del escaso número de sitios con el suficiente número de pacientes y las condicio-nes logísticas que permitan cumplir con el seguimiento según está estandarizado en los protocolos. El Instituto Nacional de Salud ha intentado evaluar la eficacia de sulfadoxina/pirimetamina en el Guaviare, una de las zonas con más reportes de malaria por P. falciparum en el país, pero esto no ha sido posible por el escaso número de pacientes disponibles para seguimiento (Santiago Nicholls, comunicación personal), lo que también afectó la realización del presente estudio. De ser posible, la realización de estudios adicionales de eficacia terapéutica en la Amazonia y Orinoquia colombianas sería bienvenida. Mientras tanto, el empleo de métodos alternativos como la suscep-tibilidad in vitro de P. falciparum a sulfadoxina/pirimetamina y a otros antimaláricos como amodiaquina y mefloquina (20) y de marcadores moleculares para identificar mutaciones en los genes dhfr y dhps, que han sido asociadas con resistencia a sulfadoxina/pirimetamina (21,22), podrían servir para evaluar la resistencia a los antimaláricos en otras zonas endémicas de la Orinoquia y la Amazonia colombianas y para apoyar la toma de decisiones con respecto al uso de sulfadoxina/pirimetamina y otros antimaláricos utilizados en el tratamiento de P. falciparum en el oriente colombiano.
La vigilancia de la eficacia general de los antimalá-ricos en zonas de frontera resulta estratégico para Colombia, ya que existe la posibilidad de introducción de cepas resistentes procedentes de los países vecinos. Un sistema de vigilancia basado en estudios clínicos de eficacia terapéutica no parece ser la mejor estrategia por las razones expuestas anteriormente; por lo tanto, métodos alternativos como la evaluación de la susceptibilidad in vitro o estudios de biología molecular podrían implementarse. En la primera opción, podrían emplearse métodos basados en Elisa (20) en laboratorios regionales que cuenten con la infra-estructura necesaria, mientras que los métodos moleculares requieren la validación de marcadores que se correlacionen con la resistencia in vitro o con la eficacia terapéutica de los antimaláricos usados en Colombia y en los países vecinos.
Agradecimientos
Nuestros agradecimientos a los médicos Nicolás Martínez y Orietta Beltrán, a las bacteriólogas Karen Romero y Luz Mila Murcia y a la microbióloga Pamela Orjuela por la inclusión, seguimiento de los pacientes, control de calidad y apoyo para la realización del estudio. A Trenton K Ruebush II por la asesoría en la planeación del estudio y a la Secretaría de Salud del Amazonas por el apoyo logístico
Conflicto de intereses
Los autores declaran no haber incurrido, durante la realización de este estudio, en conflicto de interés alguno.
Financiación
Este estudio fue financiado por Colciencias: contrato No. 2229-04-12674
Correspondencia: Lyda Osorio, Avenida 1N # 3-03 Cali, Colombia.
Teléfono: (57 2) 668 2164, fax: (57 2 ) 667 2989. lydaosorio@cideim.org.co
Referencias
1. Zambrano P. Informe final de malaria, semanas 1 a 52 Colombia, 2005. Inf Quinc Epidemiol Nac 2006;11:49-53. [ Links ]
2. Moore DV, Lanier JE. Observations of two Plasmodium falciparum infections with an abnormal response to chloroquine. Am J Trop Med Hyg 1961;10:5-9. [ Links ]
3. López Y, Arroyave A, Salazar A. Evaluación de la resistencia in vivo a los medicamentos antimaláricos El Bagre, Antioquia, 1998. Rev Epidemiol Antioquia 1999;24:181-94. [ Links ]
4. Blair S, Lacharme L, Carmona J, Tobón A. Resistencia de Plasmodium falciparum a tres fármacos antimaláricos en Turbo (Antioquia, Colombia) 1998. Rev Panam Salud Pública 2001;9:23-9. [ Links ]
5. Blair S, Lacharme-Lora L, Carmona-Fonseca J. Resistance of Plasmodium falciparum to antimalarial drugs in Zaragoza (Antioquia, Colombia), 1998. Mem Inst Oswaldo Cruz 2002;97:401-6. [ Links ]
6. Castillo CM, Osorio LE, Palma GI. Assessment of the therapeutic response of Plasmodium vivax and Plasmodium falciparum to chloroquine in a malaria transmission free area in Colombia. Mem Inst Oswaldo Cruz 2002;97:559-62. [ Links ]
7. Osorio LE, Giraldo LE, Grajales LF, Arriaga AL, Andrade AL, Ruebush TK 2nd et al. Assessment of therapeutic response of Plasmodium falciparum to chloroquine and sulfadoxine/pyrimethamine in a low malaria transmission area in Colombia. Am J Trop Med Hyg 1999;61:968-72. [ Links ]
8. Ministerio de Salud de Colombia. Guía de atención clínica para el diagnóstico y tratamiento de la malaria. Bogotá: Ministerio de Salud; 1999. [ Links ]
9. Alecrim M das G, Alecrim WD, de Albuquerque BC, Dourado HV, Wanssa M do C. Resistance of Plasmodium falciparum in the Brazilian Amazonas to the combination of sulfadoxine and pyrimethamine. Rev Inst Med Trop Sao Paulo 1982;24 (6 suppl):44-7. [ Links ]
10. Magill AJ, Zegarra J, Garcia C, Marquino W, Ruebush TK 2nd. Efficacy of sulfadoxine-pyrimethamine and mefloquine for the treatment of uncomplicated Plasmodium falciparum malaria in the Amazon basin of Peru. Rev Soc Bras Med Trop 2004;37:279-81. [ Links ]
11. Alecrim M das G, Alecrim W, Macedo V. Plasmodium vivax resistance to chloroquine (R2) and mefloquine (R3) in Brazilian Amazon region. Rev Soc Bras Med Trop 1999;32:67-8. [ Links ]
12. Baird JK, Wiady I, Fryauff DJ, Sutanihardja MA, Leksana B, Widjaya H et al. In vivo resistance to chloroquine by Plasmodium vivax and Plasmodium falciparum at Nabire, Irian Jaya, Indonesia. Am J Trop Med Hyg 1997;56:627-31. [ Links ]
13. Soto J, Toledo J, Gutiérrez P, Luzz M, Llinas N, Cedeño N et al. Plasmodium vivax clinically resistant to chloroquine in Colombia. Am J Trop Med Hyg 2001;65:90-3. [ Links ]
14. World Health Organization. Assessment and monitoring of antimalarial drug efficacy for the treatment of of uncomplicated P. falciparum malaria. Report No.: WHO/HTM/RBM/2003.50. Geneva: WHO; 2003. [ Links ]
15. World Health Organization/Pan American Health Organization. Assessment of therapeutic efficacy of medicaments to treat uncomplicated P. falciparum malaria in the Americas. Report No.: PS/HCP/HCT/113/98. Washington: WHO, OPS; 1998. [ Links ]
16. Espinal CA, Cortes GT, Guerra P, Arias AE. Sensitivity of Plasmodium falciparum to antimalarial drugs in Colombia. Am J Trop Med Hyg 1985;34:675-80. [ Links ]
17. Magris M, Riggione F. Susceptibilidad del Plasmodium falciparum in vitro a la cloroquina, amodiaquina, quinina y pirimetamina-sulfadoxina en el estado Amazonas, Venezuela. Acta Científica Venezolana 1994;45 (Supl 1):250. [ Links ]
18. Blair S, Carmona-Fonseca J, Piñeros JG, Ríos A, Álvarez T, Álvarez G et al. Therapeutic efficacy test in malaria falciparum in Antioquia, Colombia. Malar J 2006;5:14. [ Links ]
19. Méndez F, Muñoz A, Carrasquilla G, Jurado D, Arevalo-Herrera M, Cortese J et al. Determinants of treatment response to sulfadoxine-pyrimethamine and subsequent transmission potential in falciparum malaria. Am J Epidemiol 2002;156:230-8. [ Links ]
20. Noedl H, Wongsrichanalai C, Wernsdorfer WH. Malaria drug-sensitivity testing: new assays, new perspectives. Trends Parasitol 2003;19:175-81. [ Links ]
21. Kublin J, Richard W, Shankar A, Quintana J, Gilman R, Aramburu J et al. Molecular assays for surveillance of antifolate-resistance malaria. Lancet 1998;351:1629. [ Links ]
22. Plowe CV, Cortese JF, Djimde A, Nwanyanwu OC, Watkins WM, Winstanley P et al. Mutations in Plasmodium falciparum dihydrofolate reductase and dihydropteroate synthase and epidemiologic patterns of pyrimethamine-sulfadoxine use and resistance. J Infect Dis 1997;176:1590-6. [ Links ]














