Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157On-line version ISSN 2590-7379
Biomédica vol.27 no.2 Bogotá Apr./June 2007
Haga usted el diagnóstico
Segunda parte
Carlos A. Álvarez 1, 2, Ángel Sánchez 2, Alexander Morales 3, Carlos A. Molina 4
1
Grupo de Infectología, Hospital Simón Bolívar E.S.E., Bogotá D. C., Colombia2
Facultad de Medicina, Universidad Nacional de Colombia, Bogotá D. C., Colombia3
Universidad de Caldas, Manizales, Caldas, Colombia4
Universidad de la Sabana, Chía, Cundinamarca, ColombiaInstitución donde se desarrolló el trabajo: Hospital Simón Bolívar de Bogotá
Recibido: 02/10/06; aceptado: 02/04/07
El diagnóstico de la paciente fue coccidioidomicosis pulmonar crónica, coccidioidomicosis extrapulmonar y meningoencefalitis por Coccidioides spp.
Comentario
La coccidioidomicosis es una infección micótica que afecta de forma primaria el parénquima pulmonar; en ocasiones, puede ser subclínica hasta convertirse en una enfermedad sistémica muy letal (1). En esta paciente con la sospecha diagnóstica clínica y los hallazgos en la biopsia del ganglio cervical se inició manejo con anfo-tericina B a dosis de 0,7-1 mg/kg al día; a pesar de recibir una dosis acumulada mayor a 1,5 g, no presentó mejoría, a excepción de la disminución de las lesiones en la lengua y las cervicales, y falleció a los 35 días de inicio de la terapia.
Hasta 70% de los 50 millones de personas que viajan cada año de países industrializados a países en vías de desarrollo, reportan alguna enfermedad relacionada con su viaje, pero en la mayoría ésta es leve y sólo entre el 1% y el 5% requieren atención médica, ya sea durante o inmediatamente después del viaje (2). La mención anterior se aplica a viajeros de países desarrollados hacia países en vías de desarrollo; sin embargo, es escasa la información de la incidencia o la prevalencia de enfermedades adquiridas en viajeros entre países con condiciones socio-económicas similares pero características epidemiológicas diferentes como son los que conforman Latinoamérica.
En el presente caso, inicialmente los colegas mexicanos en forma lógica pensaron que ante una paciente con sintomatología respiratoria procedente de un país suramericano, podría tratarse de una tuberculosis. Sin embargo, dado que la paciente vivió durante tres años en Hermosillo, Sonora, región endémica de coccidioidomicosis, esta última también era una opción diagnóstica.
La coccidioidomicosis es una infección causada por un hongo dimórfico del género Coccidioides (C. immitis y C. posadasii). Es endémica sólo en ciertos desiertos del hemisferio occidental que incluye el sur de Arizona, California central, el suroeste de Nuevo México y Texas en Estados Unidos. También se encuentra en regiones de México (áreas como Sonora, Nayarit, Michoacán, Durango y San Luis Potosí) (1). En Centroamérica se ha reportado en Guatemala, Honduras, Nicaragua y en Suramérica especialmente en Argentina, Brasil, Paraguay y Venezuela (3,4).
En Colombia esta enfermedad es infrecuente y hasta la fecha sólo se han reportado cinco casos, de los cuales tres se consideran autóctonos con predominio en los departamentos de Atlántico y Magdalena (5,6).
En Colombia se ha demostrado la existencia de zonas ecológicamente viables para el desarrollo del Coccidioides spp. principalmente en Cesar, La Guajira y Magdalena (7). Aunque en estudios epidemiológicos en población colombiana, mediante la prueba de intradermorreacción con esferulina y coccidioidina, se ha encontrado positividad entre 9% y 13% de personas sanas residentes en La Guajira, Cesar y el bajo Magdalena, llama la atención la ausencia de manifestaciones clínicas de enfermedad en estas regiones (7,8).
La enfermedad es ligeramente más frecuente en hombres que en mujeres. En las áreas endémicas, la enfermedad tiene picos estacionales. Está relacionada con la ocupación y, por ello, los agricultores, constructores, exploradores, arqueólogos, tropas en entrenamiento y personal de laboratorio, son los grupos que presentan mayor riesgo de infección (1,5,9).
C. immitis es un hongo muy infeccioso, el cual crece como un moho (forma saprofítica), a pocos centímetros del suelo del desierto. En condiciones secas los micelios se vuelven muy frágiles y se fracturan fácilmente (aun por una ligera corriente de aire) y dan origen a artroconidias infecciosas, las cuales pueden permanecer suspendidas en el aire por períodos prolongados. Para adquirir la infección sólo basta con la inhalación de unas pocas artroconidias, las cuales, pueden medir hasta 10 µm, tamaño suficiente para penetrar hasta los alvéolos (1,10). Allí empiezan a transfor-marse en esférulas, las cuales maduran entre cuatro y siete días, y después liberan abundantes endosporas. Cada endospora, forma parasitaria, es capaz de producir una nueva esférula (1).
Manifestaciones clínicas
Luego de la infección suele presentarse un amplio rango de manifestaciones, la mayoría leves, por lo cual se ha estimado que menos de la mitad de los pacientes primoinfectados buscan atención médica (11). Se cree que hay una relación directamente proporcional entre la exposición a grandes inóculos y las altas tasas de infección sintomática, especialmente en pacientes con riesgo ocupacional (12).
En las áreas endémicas se estima que el riesgo de infección es, aproximadamente, de 3% cada año (13). Posterior a la exposición hay un periodo de incubación de 7 a 21 días previo al inicio de la enfermedad.
En 60% de los pacientes con infección aguda primaria hay ausencia de síntomas clínicos evidentes. En el restante 40% de los pacientes, se presenta una enfermedad que frecuentemente mimetiza una infección del sistema respiratorio inferior con fiebre, diaforesis, disnea, dolor toráxico, producción de esputo, anorexia y debilidad (10), cuadro inespecífico similar a aquél con el cual empezó la paciente aquí informada. Cuando se presenta hemoptisis, se sugiere el desarrollo de cavidades pulmonares (10).
Se describen manifestaciones dermatológicas como eritema nodoso y eritema multiforme, especialmente en mujeres. La presencia de artromialgias la ha hecho conocer también como el "reumatismo del desierto" (13).
En la mayoría de los casos y sin terapia específica, la infección primaria se resuelve espontáneamente en varias semanas (14).
Los hallazgos de laboratorio suelen ser irrelevantes; en una cuarta parte de los pacientes se presenta eosinofilia y aumento de la velocidad de eritrosedimentación (15). Las radiografías de tórax son normales hasta en la mitad de los pacientes, mientras que otros presentan infiltrados unilaterales y adenopatía hiliar ipsilateral. En el caso informado, no se encontró alteración en la radiografía de tórax pero sí hallazgos en la TAC de tórax, lo que podría sugerir que ante la sospecha de coccidioido-micosis o de otras micosis endémicas y ante una radiografía negativa, es necesario completar la valoración imaginológica con una TAC de tórax.
No obstante, hasta 5% de los pacientes desa-rrollan lesiones pulmonares residuales mientras que menos del 1% progresan a enfermedad extrapulmonar como en este caso.
Diagnóstico
Se insiste en que, dado lo inespecífico del cuadro inicial, la mayoría de las infecciones primarias no son diagnosticadas. Para el diagnóstico temprano es indispensable obtener una historia de viaje o procedencia de áreas endémicas.
Las muestras de esputos y exudados de lesiones cutáneas son adecuadas para el diagnóstico y al examen es indispensable observar las esférulas que contienen las endosporas (9) (
figura 3).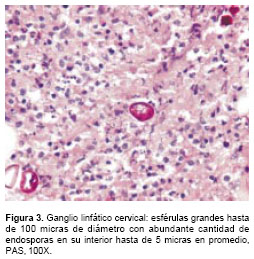
Las pruebas serológicas son muy útiles ya que cualquier resultado positivo es clínicamente relevante. Las reacciones cutáneas son de utilidad limitada.
El diagnóstico se establece cuando se observa el patógeno por biopsia o por exámenes directos, y se aísla el microorganismo en cultivo, en el cual se puede demostrar crecimiento de colonias incluso desde las 48 horas; sin embargo, el periodo promedio es, aproximadamente, de cinco días o más. Dado el peligro que representa el manejo de cultivos, es importante informar al laboratorio si se trata de un probable caso de coccidioidomicosis con el fin de minimizar el riesgo de transmisión ocupacional.
Cuando se observan esférulas maduras con endosporas el diagnóstico queda confirmado; éstas pueden observarse ya sea en biopsia, lavado broncoalveolar, estudios citológicos o muestras de esputos. Son útiles los extendidos teñidos con hematoxilina-eosina, ácido peryódico de Schiff o coloración con plata metenamina (16).
Complicaciones
La coccidioidomicosis ocasionalmente se disemina a través del torrente sanguíneo desde el sitio de la lesión pulmonar inicial a otras partes del cuerpo. El riesgo estimado varía de aproximadamente 4,7% de infecciones recono-cidas a 0,2% de todas las exposiciones respiratorias (Einstein HE, Catanzaro A, eds. Coccidioidomycosis. Proceedings of the 5th International Conference; August 24-27, 1994; Stanford University, Palo Alto, California. Washington, D.C.: National Foundation for Infectious Diseases; 1996. p.77-87).
Los factores de riesgo para complicación de la enfermedad incluyen infección por el VIH o sida (17), tratamiento inmunosupresor, esteroides, linfoma, terapia con factor de necrosis tumoral, quimioterapia, diabetes mellitus, embarazo y otros. En este caso no se encontró un claro factor inmunosupresor a excepción de un estado depresivo, probablemente, secundario a pérdida de su núcleo familiar y el estado caquéctico, probablemente, secundario a su enfermedad.
Dentro de los factores de riesgo para enfermedad diseminada se cita el origen étnico del paciente; la diseminación es más frecuente en filipinos, afroamericanos e hispánicos en comparación con la raza caucásica. Aunque se desconoce la causa de esta preferencia por razas de color, se cree que la afección obedece a un factor ocupacional (16).
La diseminación extrapulmonar se desarrolla en menos del 1% de los pacientes; puede ocurrir de manera aguda, subaguda o crónica, e incluso, sin evidencia de infiltrados en la radiografía de tórax; llega a afectar órganos, como la piel, hasta en 65%, tejido celular subcutáneo, hueso, meninges, ganglios linfáticos, hígado, bazo, riñón, pleura y cualquier órgano con excepción del tubo digestivo (18).
El sitio más común de diseminación es la piel. Las lesiones van desde máculo-pápulas superficiales hasta úlceras verrugosas y abscesos subcutáneos (16).
La coccidioidomicosis meníngea y la diseminación del patógeno al sistema nervioso central, provocan, en la actualidad, el mayor número de muertes por coccidioidomicosis estimadas en 200 casos al año, aproximadamente, en Estados Unidos; la hidrocefalia es la complicación con mayor frecuencia asociada a este compromiso como ocurrió en este caso (
figura 4) (19). Esta forma de presentación clínica se puede sospechar cuando el paciente presenta náuseas, vómito, cefalea intensa, alteración del estado mental, diplopía, signos meníngeos o neuropatía de pares craneanos; la historia natural de la coccidioido-micosis meníngea sin tratamiento ha demostrado tener una mortalidad alta. En el líquido cefalorraquídeo (LCR) puede observarse pleocitosis mononuclear a expensas de linfocitos. No es frecuente encontrar eosinófilos, pero cuando se reportan son altamente sugestivos de la enfermedad. Las pruebas bioquímicas del LCR usualmente muestran hipoglucorraquia e hiperproteinorraquia, semejante a los hallazgos del LCR en el presente caso (19).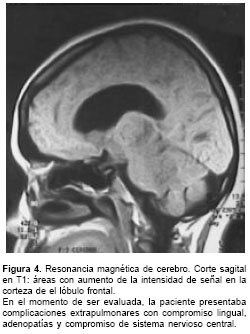
Tratamiento
Los pacientes sin evidencia de infección extensa o sin factores de riesgo para diseminación usual-mente no necesitan terapia antimicótica; sin embargo, es importante el seguimiento del paciente y estar pendiente de las complicaciones (9).
Se deben repetir las pruebas serológicas a intervalos de semanas a meses ya que un aumento en los títulos puede estar asociado con enfermedad diseminada (9).
Hay indicadores de gravedad para considerar el tratamiento, entre los que se mencionan pérdida de más de 10% del peso corporal, sudoración nocturna por más de tres meses, infiltrados que involucren más de la mitad de un pulmón, adenopatía hiliar prominente o persistente, incapacidad laboral y síntomas con una duración mayor de dos meses (1).
Los esquemas de tratamiento recomendados son fluconazol, 400 mg al día, o itraconazol, 200 mg al día. La duración del tratamiento para la enfermedad no complicada es de tres a seis meses (20).
Se debe considerar la anfotericina B sólo en los casos más graves de neumonía por coccidiodes o enfermedad extrapulmonar. En este caso y a pesar del manejo instaurado, el desenlace fue fatal; en este hecho influyeron múltiples factores, entre los que se destacan el diagnóstico tardío, el compromiso de varios sistemas y la invasión meníngea.
Conclusión
Al analizar el caso en retrospectiva, esta paciente tenía varios síntomas y signos que sugerían el cuadro de coccidioidomicosis; sin embargo, pasaron varios meses antes de que se hiciera el diagnóstico. La obtención de una historia completa en todos los pacientes y su interpretación correcta requieren tiempo y paciencia; pero es sólo haciendo lo anterior que el clínico es capaz de sospechar el diagnóstico correcto y lograr su confirmación con la ayuda del laboratorio (21).
Finalmente, se resalta el efecto que la migración, tanto interna como externa, ejerce sobre el perfil epidemiológico de nuestra población, especial-mente la exposición a enfermedades infecciosas; cada vez es más importante desarrollar programas locales sobre educación, prevención, inmunizaciones y riesgos de salud potenciales para la población viajera.
Conflicto de intereses
Los cuatro autores declaran no tener conflicto de intereses.
Financiación
No se recibió financiación externa.
Correspondencia:
Carlos A. Álvarez, calle 122A No. 14-71, apto. 412, teléfono: (571) 214 0939, fax: (571) 676 7940, extensión 212, Bogotá,D.C., Colombia
caalvarezmo@unal.edu.co
Referencias
1. Galgiani JN. Primary coccidioidal infection. En: Rose BD, editor. UpToDate. Waltham: UpToDate.Inc; 2006.
2. Steffen R, Rickenbach M, Wilhelm U, Hemilger A, Schar M. Health problems after travel to developing countries. J Infect Dis. 1987;156:84-91.
3. Wanke B, Lazera M, Monteiro PC, Lima FC, Leal MJ, Ferreira Filho PL, et al. Investigation of an outbreak of endemic coccidioidomycosis in Brazils northeastern state of Piaui with a review of the occurrence and distribution of Coccidioides immitis in three other Brazilian states. Mycopathologia. 1999;148:57-67.
4. Pappagianis D. Epidemiology of coccidioidomycosis. Curr Top Med Mycol. 1988;2:199-238.
5. Vélez A, Robledo M, Tobón AM, Builes M, Gómez CI, Restrepo A, et al. Coccidioidomicosis pulmonar. Informe de un caso autóctono. Medicina UPB. 1997;16:141-8.
6. Godoy J, Correa A, de Guevara E, de Salcedo M. Coccidioidomicosis sistémica: informe de un caso en Colombia. Acta Méd Colomb. 1990;15:208-10.
7. Robledo M, Restrepo A, Restrepo M, Ospina S, Gutiérrez F. Encuesta epidemiológica sobre coccidioidomicosis en algunas zonas áridas de Colombia. Antioquia Med. 1968;18:505-22.
8. Ajello L, Guzmán M, Aguilera A. Coccidioidomicosis. Estudio epidemiológico del área de influencia del proyecto carbonífero de El Cerrejón, Guajira. Informe I. Bogotá: INS; 1982. p.93-5.
9. Restrepo A. Neumología: micosis pulmonares. 6 edición. Medellín: CIB; 2003.
10. Chiller TM, Galgiani JN, Stevens DA. Coccidioidomycosis. Infect Dis Clin North Am. 2003;17:41-57.
11. Smith CE, Beard RR, Whiting EG, Rosember HG. Varieties of coccidioidal infection in relation to the epidemiology and control of the disease. Am J Public Health. 1946;36:1394-8.
12. Crum N, Lamb C, Utz G, Amundson D, Wallace M. Coccidioidomycosis outbreak among United States Navy SEALs training in a Coccidioides immitis-endemic area, Coalinga, California. J Infect Dis. 2002;186:865-8.
13. Dodge RR, Lebowitz MD, Barbee RA, Burrows B. Estimates of Coccidioides immitis infection by skin test reactivity in an endemic community. Am J Public Health. 1985;75:863-5.
14. Spivack S, Eugene JM. Case records of the Massachusetts General Hospital. N Engl J Med. 1999;341:182-90.
15. Yozwiak ML, Lundergan LL, Kerric SS, Galgiani JN. Symptoms and routine laboratory abnormalities associated with coccidioidomycosis. West J Med. 1988;149:419-21.
16. Galgiani JN. Coccidioides immitis. En: Mandell GL, Douglas RG, Bennett JE, editors. Principles & Practice of Infectious Diseases. 6ta ed. Philadelphia: Churchill Livingstone; 2005. p.3040-51.
17. Singh VR, Smith DK, Lawerence J, Kelly PC, Thomas AR, Spitz B, et al. Coccidioidomycosis in patients infected with human immunodeficiency virus: review of 91 cases at a single institution. Clin Infect Dis. 1996;23:563-8.
18. Stevens DA. Current concepts: Coccidioidomycosis. N Engl J Med. 1995;332:1077-82.
19. Johnson RH, Einstein HE. Coccidioidal meningitis. Clin Infect Dis. 2006;42:103-7.
20. Galgiani JN, Ampel NM, Blair JE, Catanzaro A, Johnson RH, Stevens DA, et al. Coccidioidomycosis. Clin Infec Dis. 2005; 41:1217-23.
21. Hampton JR, Harrison MJ, Mitchell JR, Prichard JS, Seymour C. Relative contributions of history-taking, physical examination, and laboratory investigation to diagnosis and management of medical outpatients. Br Med J.1 1975;2:486-9.














