Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biomédica
versão impressa ISSN 0120-4157versão On-line ISSN 2590-7379
Biomédica v.27 n.4 Bogotá out./dez. 2007
Comunicación breve
Citotoxicidad del glifosato en células mononucleares de sangre periférica humana
Adriano Martínez 1, Ismael Reyes 2, Niradiz Reyes 3
1 Corporación Universitaria Rafael Núñez, Cartagena, Colombia
2 Departamento de Microbiología e Inmunología, New York Medical College, Valhalla, New York, Estados Unidos
3 Grupo de Genética y Biología Molecular, Facultad de Medicina, Universidad de Cartagena, Cartagena, Colombia
Recibido: 01/12/06; aceptado: 16/07/07
Introducción. El glifosato es un herbicida de amplio espectro, no selectivo, utilizado comúnmente en agricultura para eliminar malezas. Los estudios que han evaluado la toxicidad del glifosato en animales y en ambiente muestran que las formulaciones comerciales son más tóxicas que el componente activo.
Objetivos. Evaluar la toxicidad del glifosato grado técnico y de la formulación comercial Roundup® en células mononucleares de sangre periférica humana.
Materiales y métodos. Células mononucleares de sangre periférica humana fueron expuestas a diferentes concentraciones de glifosato en grado técnico y en la forma de Roundup® por 24, 48, 72 y 96 horas. La citotoxicidad se evaluó mediante el método de exclusión con azul de tripano y reducción del reactivo sal sódica de (2,3-bis2-metoxi-4-nitro-5-sulfofenil-2Htetrazolio-5-carboxianilida) (XTT).
Resultados. Ambas presentaciones del glifosato (grado técnico y Roundup®) fueron tóxicas para las células mononucleares de sangre periférica humana. Roundup® fue más citotóxico que el glifosato grado técnico, ya que se encontró que la concentración letal 50 (LC50) analizada con el método de exclusión con azul de tripano a las 24 horas fue de 56,4 µg/ml de glifosato en la forma de Roundup® y de 1.640 mg/ml (1,64 µg/ml) para glifosato grado técnico.
Conclusiones. Los resultados de este estudio in vitro confirman el efecto tóxico para las células humanas observado para el glifosato y sus preparaciones comerciales, y que estas últimas son más citotóxicas que el compuesto activo, lo que apoya la idea de que los aditivos presentes en las formulaciones comerciales juegan un papel crucial en la toxicidad atribuida a los herbicidas que contienen glifosato.
Palabras clave: pruebas inmunológicas de citotoxicidad, herbicidas, células sanguíneas, supervivencia celular, azul de tripano, sales de tetrazolio.
Cytotoxicity of the herbicide glyphosate in human peripheral blood mononuclear cells
Introduction. Glyphosate is a broad-spectrum, non-selective herbicide and commonly used to eliminate weeds in agricultural and forest settings. Studies evaluating glyphosate toxicity in animals and environment show that commercial formulations of glyphosate are more toxic than the active component itself.
Objectives. Technical grade glyphosate was compared with the commercial formulation Roundup® in their respective toxicities on human peripheral blood mononuclear cells.
Materials and methods. Human peripheral blood mononuclear cells were exposed to different concentrations of glyphosate, either technical grade or in the form of Roundup for 24 h, 48 h, 72 h, and 96 h. Cytotoxicity was assayed by trypan blue dye exclusion method and reduction of (2,3-bis2-methoxy-4-nitro-5-sulfophenyl-2Htetrazolium-5-carboxyanilide inner salt)XTT reagent.
Results. Both technical grade glyphosate and Roundup® formulation were toxic to human peripheral blood mononuclear cells. Cytotoxicity of Roundup® was higher than cytotoxicity of glyphosate, since the LC50 (50% lethal concentration) determined by the trypan blue exclusion method at 24 h was the equivalent of 56.4 µg/ml of glyphosate in the form of Roundup® and 1,640 µg/ml (1.64 mg/ml) for technical grade glyphosate.
Conclusions. This in vitro study confirmed the toxic effects on human cells by glyphosate and its commercial preparations. Commercial formulations were more cytotoxic than the active component alone, supporting the concept that additives in commercial formulations play a role in the toxicity attributed to glyphosate-based herbicides.
Key words: cytotoxicity tests, immunologic, herbicides, blood cells, cell survival, trypan blue, tetrazolium salts.
El glifosato nombre químico según los parámetros de la International Union of Pure and Applied Chemistry, IUPAC): ácido 2-(fosfono-metil-amino) acético, C3H8NO5 es un herbicida de amplio espectro, no selectivo, utilizado en todo el mundo para eliminar malezas en ambientes agrícolas y forestales (1). Su acción herbicida se debe a la inhibición de la síntesis de aminoácidos aromáticos en plantas y microorganismos (2,3) por inactivación de la enzima 5-enolpiruvil-chiquimato-3-fosfato sintetasa (4,5). Debido a que esta vía es específica para plantas y microorganismos, el mecanismo no es considerado de riesgo para humanos y en el año 2000 un articulo de revisión concluyó que el herbicida Roundup® no constituía un riesgo para la salud humana (1). Por su parte, la Environmental Protection Agency de los Estados Unidos (EPA) lo clasifica en la categoría III de toxicidad y el grupo D de oncogenicidad por su relativa baja toxicidad aguda y por no existir indicios de carcinogenicidad en animales, respectivamente (6).
En cuanto a los efectos tóxicos directos en los humanos, se ha observado el desarrollo de diversas alteraciones clínicas y paraclínicas en los casos de exposición humana accidental o deliberada a herbicidas que contienen glifosato (7); en 131 sujetos intoxicados con glifosato en Taiwán se presentó leucocitosis, bicarbonato sérico bajo, acido-sis y una gama de complicaciones graves como dificultad respiratoria, edema pulmonar, choque, alteraciones de la conciencia y falla renal (8).
Existe preocupación respecto a los efectos adversos potenciales en la salud humana por exposición crónica ya que los humanos y otros animales pueden entrar en contacto con el glifosato y los aditivos presentes en las formulaciones comerciales a través de las prácticas rutinarias en agricultura (9), o a través de la cadena alimenticia (10), o a través de aguas contaminadas (11). Es así que tres estudios recientes de casos y controles han encontrado una asociación entre la exposición a herbicidas que contienen glifosato y el desarrollo de linfoma no Hodgkin (12,13). Sin embargo, a diferencia de estos resultados, un artículo basado en el Agricultural Health Study y publicado en el 2005 indica que hasta esa fecha no se había encontrado asociación significativa entre el uso del glifosato y la incidencia global de cáncer o con la mayoría de los subtipos de cáncer estudiados (14). El Agricultural Health Study es un estudio de cohortes iniciado en 1997 en los Estados Unidos, y que aún se encuentra en curso, el cual ha incluido más de 57.000 fumigadores de plaguicidas que cuentan con licencia. De acuerdo con el artículo en mención, el 75,5% de los participantes reportó haber usado glifosato.
Pese a esta información, la preocupación sobre los efectos adversos potenciales de los herbicidas basados en glifosato persiste ya que un número de estudios recientes in vivo en animales muestran que han causado efectos tóxicos en las diferentes especies que han sido expuestas experimentalmente al glifosato, a las formulaciones comerciales que lo contienen, y a uno de sus principales adyuvantes, el surfactante polioxietile-namina o tallow amina polietoxilada (15-23).
Entre los resultados obtenidos en estos estudios in vivo podemos mencionar cambios en la actividad de enzimas hepáticas en ratas gestantes y sus fetos (18); alteraciones histopatológicas y bioquímicas en peces (16) y ratas (22); anormalidades en el desarrollo de anfibios (17); y efectos teratogénicos en ratas (19), entre otros. Algunos de los estudios también indican que el surfactante polioxietilenamina o tallow amina polietoxilada fue más tóxico que el Roundup® y éste, a su vez, más tóxico que el glifosato grado técnico para diferentes organismos acuáticos (15); y que el surfactante polioxietilenamina o tallow amina polietoxilada fue extremadamente tóxico para los invertebrados acuáticos (20).
De igual forma, un número de estudios in vitro han demostrado que el glifosato y las prepara-ciones comerciales a base de él ejercen efectos tóxicos en todos los sistemas probados; así, se ha visto citoxicidad y genotoxicidad en células humanas (24), efectos en la expresión de genes (25), y mutagénesis (26), entre otros efectos.
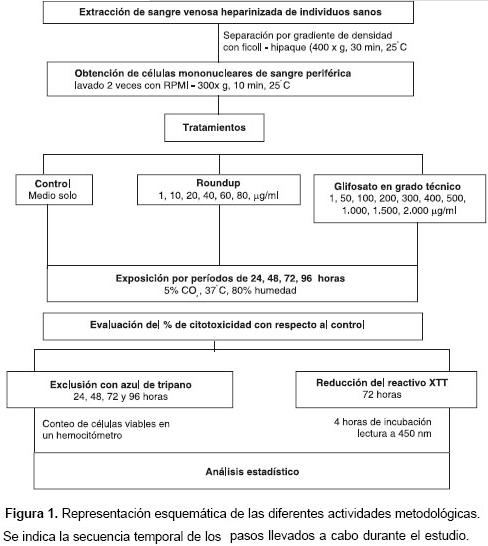
Si se toma en consideración el uso extenso de los herbicidas a base de glifosato, es claro que se necesitan más estudios que permitan estimar el verdadero riesgo en la salud humana. Dado que las células mononucleares de sangre periférica humana, por su fácil obtención y manipulación, constituyen un modelo útil en la realización de ensayos in vitro, y teniendo en cuenta que sus principales componentes, los linfocitos, son el blanco de enfermedades que se han asociado con la exposición a glifosato, nos propusimos examinar el efecto tóxico que tiene este herbicida sobre cultivos primarios de dichas células, para lo cual utilizamos la metodología descrita en la figura 1.
Materiales y métodos
Agentes químicos
Se adquirió glifosato grado técnico (N-fosfonometil-glicina) en la forma de sal isopropilamina de Sigma-Aldrich (St. Louis, MO, USA). El Roundup® se obtuvo de una fuente comercial (ingrediente activo: glifosato al 25% en la forma de sal isopropilamina; Monsanto, Columbus, OH, USA). Las concentraciones de trabajo para el glifosato en ambas presentaciones (grado técnico y en la formulación Roundup®) se prepararon en medio RPMI 1640 (Sigma) con suplemento de suero bovino fetal al 10% (Kraeber GMBH, Waldhofstrabe, Alemania) y 1% de penicilina-estreptomicina (Sigma). El colorante azul de tripano fue adquirido de Sigma-Aldrich (St. Louis, MO, USA) y la sal sódica de (2,3-bis 2-metoxi-4-nitro-5-sulfofenil-2Htetrazolio-5-carboxianilida) o XTT fue obtenida de Sigma-Aldrich (In vitro toxicology assay kit XTT-based, Tox-2; St. Louis, MO, USA).
Obtención de células mononucleares de sangre periférica
Con el debido consentimiento informado, se obtuvieron células mononucleares de sangre periférica de individuos sanos mediante gradientes de densidad con Ficoll-Hipaque (Histopaque 1077, Sigma, St Louis, MO USA) por centrifugación a 400g por 30 minutos a temperatura ambiente. Posteriormente, se lavaron dos veces con RPMI 1640 (Sigma) a 300g durante 10 minutos. La viabilidad inicial de las células mononucleares fue controlada mediante el método de exclusión con azul de tripano, y estuvo entre 95% y 98%. En el estudio participaron cinco donantes saludables, con edades entre 18 y 28 años.
Cultivos primarios de células mononucleares de sangre periférica y condiciones de tratamiento
Las células mononucleares de sangre periférica fueron utilizadas para los experimentos de citotoxicidad inmediatamente después de ser aisladas. Para las pruebas de citotoxicidad, 6x105 células por pozo, contenidas en un volumen total de 200 µl, se sembraron por triplicado, para cada concentración ensayada y para los controles, en platos de 96 pozos de fondo plano (Becton Dickinson, Franklin Lakes, NJ, USA). Los experimentos de citotoxicidad se realizaron a las 24, 48, 72 y 96 horas a 37 °C, en atmósfera húmeda con 5% CO2 con las diferentes concentraciones de glifosato grado técnico o de la formulación comercial Roundup® en RPMI 1640 con suplemento de 10% de suero bovino fetal y 1% de penicilina- estreptomicina (Sigma). La evaluación de la toxicidad se hizo con el método de exclusión con azul de tripano al cabo de cada tiempo de exposición (24, 48, 72 y 96 horas) y, además, con el ensayo de toxicidad in vitro Tox-2 a las 72 horas de exposición. Cada experimento de citotoxicidad fue replicado, al menos, tres veces a las mismas condiciones, y se obtuvieron resultados comparables.
Concentraciones de los agentes químicos
Para determinar el rango de concentraciones por utilizar en los ensayos de citotoxicidad, tanto para el glifosato grado técnico como para la formulación comercial, se hicieron ensayos preliminares usando un rango amplio de concentraciones, desde 1 ng/ml a 1 mg/ml, el cual se fue refinando de acuerdo con los resultados obtenidos. Para Roundup® se estableció que las concentraciones por usar serían en µg/ml: 1, 10, 20, 40, 60, 80 y 100; mientras que las concentraciones por usar en los experimentos con glifosato grado técnico serían en µg/ml: 1, 50, 100, 200, 300, 400, 500, 1.000, 1.500 y 2.000.
Evaluación de la citotoxicidad
La citotoxicidad se evaluó con dos métodos diferentes, el método de exclusión con azul de tripano (Sigma) y con el kit de toxicidad in vitro (TOX-2, Sigma-Aldrich), con el propósito de determinar su correspondencia y descartar que los resultados pudieran deberse a factores inherentes a alguno de los métodos y no al tratamiento en sí. La prueba de toxicidad in vitro con el XTT se basa en la degradación de la sal sódica 2,3-bis(2-metoxi-4-nitro-5-sulfonil)-2H-tetrazolio-5-carboxianilida (XTT) por deshidroge-nasas mitocondriales, lo cual puede ser monitoreado espectrofotométricamente.
Método de exclusión con el colorante azul de tripano
Se sembraron por triplicado 6x105 células por pozo, contenidas en un volumen total de 200 µl, para cada concentración ensayada y para los controles, en platos de 96 pozos de fondo plano (Becton Dickinson, Franklin Lakes, NJ, USA) y se expusieron a los tratamientos por 24, 48, 72 y 96 horas a 37 °C, en atmósfera húmeda con 5% CO2. Al finalizar los períodos de incubación, se agregaron 100 µl del colorante azul de tripano a 100 µl de suspension celular. Luego, se contaron las células viables para cada réplica de cada concentración y de los controles. Los ensayos de viabilidad celular se replicaron, al menos, tres veces y los conteos los hicieron, por lo menos, dos experimentadores para minimizar la subjetividad inherente al método.
Método de citotoxicidad in vitro basado en XTT (Tox-2, Sigma)
Una vez elaboradas las curvas dosis-respuesta derivadas de la evaluación de la citotoxicidad con el método de exclusión con azul de tripano (figura 2 y figura 3 ), se sembraron por triplicado 6x105 células por pozo, contenidas en un volumen total de 200 µl, para cada concentración ensayada y para los controles, en platos de 96 pozos de fondo plano (Becton Dickinson, Franklin Lakes, NJ, USA) y se expusieron a los tratamientos por 72 horas a 37 °C, 5% CO2. Al finalizar el período de incubación, se agregaron 40 µl del reactivo reconstituido XTT a cada pozo y los platos se incubaron a 37 °C, en atmósfera húmeda con 5% CO2 por 4 horas. Al cabo de las 4 horas de incubación, se leyó la absorbancia a 450 nm usando una longitud de onda de referencia de 690 nm en un lector de microplatos (Humareader Single, Human). Como controles se usaron las células cultivadas en medio solo (sin agentes químicos) y como blanco el medio completo sin células. Los ensayos de viabilidad celular fueron replicados, por lo menos, tres veces a las mismas condiciones.
Análisis estadístico
Se obtuvo el porcentaje de viablidad con respecto a los valores del control para cada concentración ensayada de glifosato grado técnico y Roundup® y se construyeron curvas dosis-respuesta. Los datos fueron analizados y graficados con el programa Graph Pad Prism versión 4.0. El cálculo de la concentración letal 50 (CL50) se hizo con el programa Trimmed Spearman-Karber (TSK), versión 1.5 de la EPA.
Consideraciones éticas
Este estudio fue aprobado por el Comité de Ética de la Corporación Universitaria Rafael Núñez, Cartagena, Colombia, y los participantes del estudio firmaron un consentimiento informado.
Resultados
Evaluación de la citotoxicidad mediante el método de exclusión con azul de tripano
El glifosato grado técnico y el Roundup® fueron citotóxicos para las células mononucleares de sangre periférica.
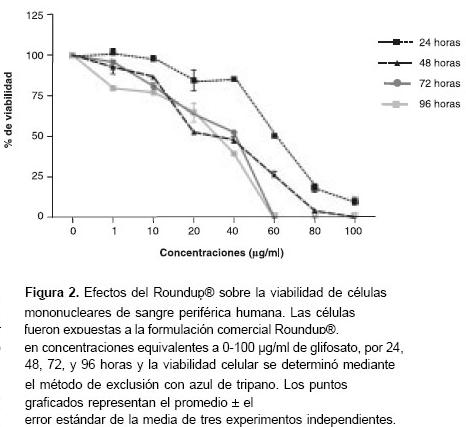
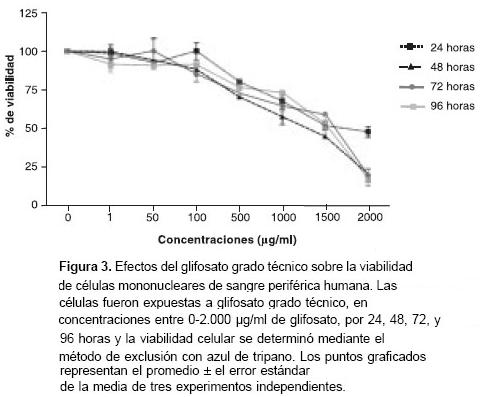
Las cinéticas de toxicidad del glifosato grado técnico y del Roundup® fueron determinadas a las 24, 48, 72 y 96 horas de exposición. Se encontró que ambas presentaciones eran tóxicas para las células mononucleares de sangre periférica humanas. Este efecto fue dependiente de la concentración tanto para Roundup® como para el glifosato grado técnico, pero sólo en la formulación comercial se notó que fue directamente proporcional al tiempo de exposición (figuras 2 y figura 3 ).
La actividad citotóxica de Roundup® fue significativamente mayor a la del glifosato grado técnico.
La evaluación de la citotoxicidad mediante el método de exclusión con azul de tripano mostró que la CL50 del Roundup® a las 24 horas de exposición fue de 56,4 µg/ml (IC95%: 53,96-58,96), mientras que la del glifosato grado técnico en el mismo período de tiempo fue de 1.630 µg/ml (1,63 mg/ml) (IC95%: 1, 0-2, 67). Esto revela que la concentración de Roundup® requerida para causar mortalidad al 50% de las células fue casi 30 veces más baja que la del glifosato grado técnico.
Evaluación de la citotoxicidad mediante la reducción del reactivo XTT
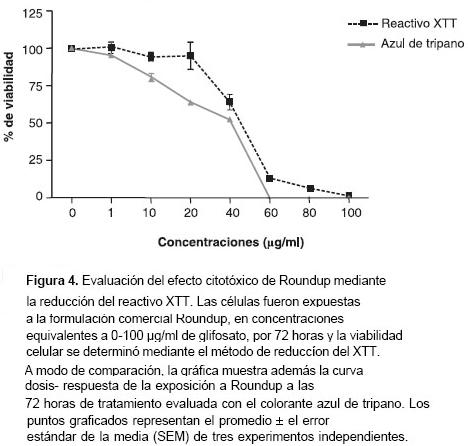
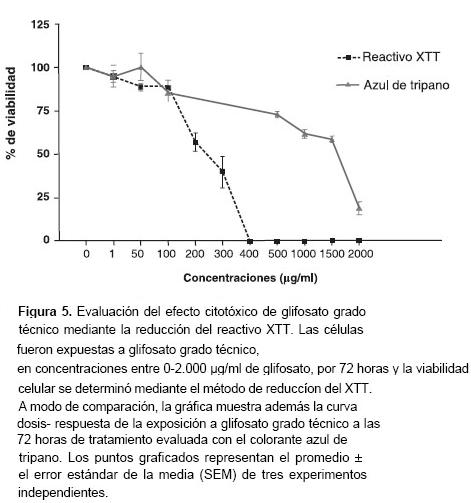
En las pruebas con Roundup®, los resultados de la evaluación de la citotoxicidad mediante el método de reducción del reactivo XTT a las 72 horas de cultivo fueron similares a los obtenidos en el mismo período de tiempo cuando se evaluó con el colorante de exclusión azul de tripano ( figura 4 ). Por el contrario, en las pruebas con el glifosato grado técnico no hubo coincidencia en los dos métodos de evaluación de la citotoxicidad, ya que con el método de reducción del reactivo XTT, se encontró que la concentración de 400 µg/ml de glifosato grado técnico produjo una mortalidad del 100%, mientras que el método de exclusión con azul de tripano mostró que la proporción de células que se colorearon (células muertas) no superó el 80%, aun usando concentraciones tan altas como 2 mg/ml de glifosato grado técnico ( figura 5 ).
Discusión
Diferentes estudios in vitro han mostrado que el glifosato es citotóxico para células tanto humanas como de otros animales (24,25,27). Aunque los mecanismos específicos de citotoxicidad se desconocen, éstos bien pudieran involucrar cambios en la permeabilidad de las membranas o en la actividad de enzimas mitocondriales que conducirían a la muerte celular (28). De otra parte, los estudios comparativos in vitro han demostrado que las formulaciones comerciales son más tóxicas que el compuesto activo y esto se ha atribuido a la presencia de adyuvantes en las formulaciones comerciales (15,17). Entre estos adyuvantes, los más comunes son los surfactantes, y en el caso de Roundup® el más ampliamente usado es la polioxietilenamina o tallow amina polietoxilada, un surfactante no iónico con el potencial de afectar adversamente los organismos acuáticos en áreas en las cuales es usado (20). Teniendo en cuenta el uso generalizado de herbicidas a base de glifosato, es prioritario generar conocimientos que permitan tomar decisiones acertadas desde una perspectiva de salud pública.
En este artículo presentamos el impacto en la viabilidad celular ocasionado por el glifosato grado técnico y la formulación comercial Roundup® sobre células mononucleares de sangre periférica humanas in vitro . Encontramos que tanto el glifosato grado técnico como la formulación Roundup® fueron tóxicos para estas células, un efecto dependiente de la dosis utilizada, y en el caso de Roundup®, proporcional al tiempo de exposición. Específicamente, encontramos que los efectos citóxicos de la formulación comercial Roundup® fueron mayores que los del glifosato grado técnico para todos los periodos de exposición ensayados.
Es posible que, en nuestro estudio, la mayor parte de la citotoxicidad causada por la formulación comercial Roundup® se deba directamente a la presencia del surfactante polioxietilenamina o tallow amina polietoxilada y a otros ingredientes menores, o a un efecto sinergístico de estos con el principio activo glifosato, como ha sido sugerido por otros (29-32). Aunque los mecanismos mediante los cuales el glifosato causa citotoxicidad no están definidos, es posible que los ingredientes en la formulación comercial pudieran favorecer la entrada del glifosato en las células mediante mecanismos que involucran interacciones directas entre la membrana celular y el surfactante (29,32).
De otra parte, aunque otros estudios in vitro han evaluado los efectos del glifosato en linfocitos bovinos (27,33) y en linfocitos humanos (34,35), no han comparado los efectos causados por el ingrediente activo con el de la formulación comercial. En este estudio, se ha evaluado en forma comparativa el efecto tóxico del glifosato grado técnico y la formulación comercial Roundup® en un cultivo primario de células mononucleares humanas. Estos resultados indican la necesidad de continuar las investigaciones en células humanas, y particularmente en células mononucleares de sangre periférica, que permitan elucidar los blancos bioquímicos del glifosato y de los diferentes componentes presentes en sus formulaciones comerciales en las células animales.
Los resultados presentados aquí son consistentes con otros estudios in vitro que han comparado los efectos tóxicos del glifosato grado técnico y de las formulaciones comerciales, los cuales han indicado que estas últimas resultan más tóxicas que el primero; por ejemplo, la adición de 0,1% de Roundup® al glifosato grado técnico redujo significativamente la viabilidad de las células placentarias humanas JEG3 (25).
En el presente trabajo, la actividad citotóxica de Roundup® sobre células mononucleares de sangre periférica fue casi 30 veces mayor que la de glifosato grado técnico, evaluado mediante el método de exclusión con azul de tripano. Este hecho se ha atribuido a aditivos como el surfactante polioxietilenamina y diversos detergentes presentes en las fórmulas comerciales que pueden ejercer un efecto citotóxico per se o potenciar los efectos tóxicos del glifosato (23).
Es interesante comentar que en el presente estudio cuando se usaron concentraciones de Roundup® superiores a 100 µg/ml se observó una desintegración total de las células, lo cual se evidenció por la ausencia de restos celulares en el medio de cultivo. Este fenómeno puede deberse a la presencia de detergentes y sugiere un mecanismo de muerte celular por necrosis (28). Estas observaciones están de acuerdo con lo observado por Sirisattha quien documentó que Roundup® afectó la estructura de la membrana plasmática y de las organelas celulares en levaduras (36).
Otro hallazgo que sugiere la vulnerabilidad de la membrana plasmática frente a los aditivos presentes en las fórmulas comerciales de glifosato fue la observación de que en las células tratadas con Roundup® coincide la pérdida de la actividad funcional, medida con la reducción del reactivo XTT, con la adquisición del color azul al ser examinadas mediante la tinción con azul de tripano. Este fenómeno no se observó de la misma manera en las células tratadas con glifosato grado técnico, en el que bajo determinadas concentraciones (iguales y superiores a 400 µg/ml), las células parecen conservar la integridad de la membrana lo que las hace aparecer viables en el hemocitómetro al evaluarlas con el azul de tripano, aunque hayan perdido totalmente su actividad metabólica revelada por la ausencia en la reducción del reactivo XTT. Aunque este efecto no ha sido mencionado previamente para el glifosato, no descartamos la posibilidad de que pudiera deberse a cambios en el pH o en la osmolaridad causados por las altas concen-traciones de glifosato a las cuales este efecto se observó (37,38). Sin embargo, para establecer con claridad el significado biológico de esta observación se necesitan estudios adicionales.
Los ensayos in vitro que han evaluado el efecto del glifosato sobre la viabilidad celular han mostrado que ejerce efectos diferenciales dependiendo del tipo celular probado, lo cual puede ayudar a explicar los resultados controvertidos que se han observado en relación a su toxicidad. De hecho, en un estudio se observó que la actividad citotóxica del glifosato grado técnico en la forma de sal isopropilamonio y una preparación comercial que contenía 48,6% de dicha sal fue diferente en cada una de las 3 líneas celulares ensayadas: 3T3, EBTr y DEC99 (39).
Finalmente, es necesario mencionar que debido al uso generalizado en agricultura y jardinería de los herbicidas que contienen glifosato, su exposi-ción ambiental representa riesgos potenciales para la salud humana, los cuales no están bien definidos y ameritan investigaciones adicionales.
En conclusión, los resultados in vitro mostrados aquí confirman el efecto citotóxico para las células humanas que se ha encontrado para el glifosato y las preparaciones comerciales a base de él, y que es posible que esta toxicidad pueda deberse en gran parte a los aditivos presentes en las formulaciones comerciales, como Roundup®. Es claro que se necesitan estudios in vivo que permitan esclarecer los mecanismos celulares implicados en la toxicidad celular causada por el glifosato y los adyuvantes presentes en las formulaciones comerciales, lo cual contribuiría a que se dé un uso racional a estos productos.
Agradecimientos
Expresamos nuestros agradecimientos a Ana Karina Gómez, Julia Gueto y Heber Meneses Gallo, estudiantes de Bacteriología de la Corporación Universitaria Rafael Núñez, por su valiosa colaboración en la realización de los cultivos celulares y los ensayos de citotoxicidad. De igual forma, agradecemos al personal del Instituto de Investigaciones Inmunológicas de la Universidad de Cartagena por el uso de sus equipos e instalaciones para la realización de algunos experimentos.
Conflicto de intereses
Los autores declaran que no existe conflicto de intereses para la publicación del presente manuscrito.
Financiación
Colciencias, Programa Nacional de Ciencia y Tecnología de la Salud, código del proyecto 1419-04-16299. Contrato No. 282-2004, Niradiz Reyes, Ph.D., investigadora principal, Corporación Universitaria Rafael Núñez, Cartagena, Colombia.
Correspondencia:
Niradiz Reyes, Departamento de Ciencias Básicas, Facultad de Medicina, Universidad de Cartagena, Cartagena, Colombia. Teléfono: 654 486, fax: 654 772 niradiz_reyes@nymc.edu
Referencias
1. Williams GM, Kroes R, Munro IC. Safety evaluation and risk assessment of the herbicide roundup and its active ingredient, glyphosate, for humans. Regul Toxicol Pharmacol. 2000;31:117-65. [ Links ]
2. Jaworski EG. Mode of action of n-phosphonomethylglycine:Inhibition of aromatic amino acid biosynthesis. J Agric Food Chem. 1972;20:1195-8. [ Links ]
3. Fischer RS, Berry A, Gaines CG, Jensen RA. Comparative action of glyphosate as a trigger of energy drain in eubacteria. J Bacteriol. 1986;168:1147-54. [ Links ]
4. Herrmann KM, Weaver LM. The shikimate pathway. Annu Rev Plant Physiol Plant Mol Biol. 1999;50:473-503. [ Links ]
5. Malik J, Barry G, Kishore G. The herbicide glyphosate. Biofactors. 1989;2:17-25. [ Links ]
6. U.S. Environmental Protection Agency. Glyphosate (CASRN 1071-83-6). Consultado: 8 de marzo de 2006. Disponible en: http://www.epa.gov/iris/subst/0057.htm . [ Links ]
7. Bradberry SM, Proudfoot AT, Vale JA. Glyphosate poisoning. Toxicol Rev. 2004;23:159-67. [ Links ]
8. Lee HL, Chen KW, Chi CH, Huang JJ, Tsai LM. Clinical presentations and prognostic factors of a glyphosate-surfactant herbicide intoxication: A review of 131 cases. Acad Emerg Med. 2000;7:906-10. [ Links ]
9. Acquavella JF, Alexander BH, Mandel JS, Gustin C, Baker B, Chapman P, et al. Glyphosate biomonitoring for farmers and their families: Results from the Farm Family Exposure Study. Environ Health Perspect. 2004;112:321-6. [ Links ]
10. Takahashi K, Horie M, Aoba N. Analysis of glyphosate and its metabolite, aminomethylphosphonic acid, in agricultural products by HPLC. Shokuhin Eiseigaku Zasshi. 2001;42:304-8. [ Links ]
11. Kolpin DW, Thurman EM, Lee EA, Meyer MT, Furlong ET, Glassmeyer ST. Urban contributions of glyphosate and its degradate AMPA to streams in the United States. Sci Total Environ. 2006;354:191-7. [ Links ]
12. Hardell L, Eriksson M, Nordstrom M. Exposure to pesticides as risk factor for non-hodgkin's lymphoma and hairy cell leukemia: Pooled analysis of two Swedish case-control studies. Leuk Lymphoma. 2002;43: 1043-9. [ Links ]
13. Hardell L, Eriksson M. A case-control study of non-Hodgkin lymphoma and exposure to pesticides. Cancer. 1999;85:1353-60. [ Links ]
14. De Roos AJ, Blair A, Rusiecki JA, Hoppin JA, Svec M, Dosemeci M, et al. Cancer incidence among glyphosate-exposed pesticide applicators in the Agricultural Health Study. Environ Health Perspect. 2005;113:49-54. [ Links ]
15. Tsui MT, Chu LM. Aquatic toxicity of glyphosate-based formulations: Comparison between different organisms and the effects of environmental factors. Chemosphere. 2003;52:1189-97. [ Links ]
16. Jiraungkoorskul W, Upatham ES, Kruatrachue M, Sahaphong S, Vichasri-Grams S, Pokethitiyook P. Biochemical and histopathological effects of glyphosate herbicide on Nile tilapia (Oreochromis niloticus). Environ Toxicol. 2003;18:260-7. [ Links ]
17. Howe CM, Berrill M, Pauli BD, Helbing CC, Werry K, Veldhoen N. Toxicity of glyphosate-based pesticides to four North American frog species. Environ Toxicol Chem. 2004;23:1928-38. [ Links ]
18. Daruich J, Zirulnik F, Gimenez MS. Effect of the herbicide glyphosate on enzymatic activity in pregnant rats and their fetuses. Environ Res. 2001;85:226-31. [ Links ]
19. Dallegrave E, Mantese FD, Coelho RS, Pereira JD, Dalsenter PR, Langeloh A. The teratogenic potential of the herbicide glyphosate-roundup in wistar rats. Toxicol Lett. 2003;142:45-52. [ Links ]
20. Brausch JM, Smith PN. Toxicity of three polyethoxylated tallowamine surfactant formulations to laboratory and field collected fairy shrimp, thamnocephalus platyurus. Arch Environ Contam Toxicol. 2007;52:217-21. [ Links ]
21. Beuret CJ, Zirulnik F, Gimenez MS. Effect of the herbicide glyphosate on liver lipoperoxidation in pregnant rats and their fetuses. Reprod Toxicol. 2005;19:501-4. [ Links ]
22. Benedetti AL, Vituri C de L, Trentin AG, Domingues MA, Alvarez-Silva M. The effects of sub-chronic exposure of wistar rats to the herbicide glyphosate-biocarb. Toxicology Letters 2004; 153:227-232 [ Links ]
23. Adam A, Marzuki A, Abdul Rahman H, Abdul Aziz M. The oral and intratracheal toxicities of roundup and its components to rats. Vet Hum Toxicol. 1997;39: 147-51. [ Links ]
24. Monroy CM, Cortes AC, Sicard DM, de Restrepo HG. Cytotoxicity and genotoxicity of human cells exposed in vitro to glyphosate. Biomedica. 2005;25: 335-45. [ Links ]
25. Richard S, Moslemi S, Sipahutar H, Benachour N, Seralini GE. Differential effects of glyphosate and roundup on human placental cells and aromatase. Environ Health Perspect. 2005;113:716-20. [ Links ]
26. Kale PG, Petty BT, Walker S, Ford JB, Dehkordi N, Tarasia S, et al. Mutagenicity testing of nine herbicides and pesticides currently used in agriculture. Environ Mol Mutagen. 1995;25:148-53. [ Links ]
27. Lioi MB, Scarfi MR, Santoro A, Barbieri R, Zeni O, Di Berardino D, et al. Genotoxicity and oxidative stress induced by pesticide exposure in bovine lymphocyte cultures in vitro. Mutat Res. 1998;403:13-20. [ Links ]
28. Eisenbrand G, Pool-Zobel B, Baker V, Balls M, Blaauboer BJ, Boobis A, et al. Methods of in vitrotoxicology. Food Chem Toxicol. 2002;40:193-236. [ Links ]
29. Gehin A, Guillaume YC, Millet J, Guyon C, Nicod L. Vitamins C and E reverse effect of herbicide-induced toxicity on human epidermal cells HaCaT: A biochemometric approach. Int J Pharm. 2005;288:219-26. [ Links ]
30. Martinez TT, Brown K. Oral and pulmonary toxicology of the surfactant used in roundup herbicide. Proc West Pharmacol Soc. 1991;34:43-6. [ Links ]
31. Martinez TT, Long WC, Hiller R. Comparison of the toxicology of the herbicide roundup by oral and pulmonary routes of exposure. Proc West Pharmacol Soc. 1990;33:193-7. [ Links ]
32. Wilheilm KP, Samblebe M, Siegers CP. Quantitative in vitro assessment of n-alkyl sulphate-induced cytotoxicity in human keratinocytes (HACAT). Comparison with in vivo human irritation tests. Br J Dermatol. 1994;130:18-23. [ Links ]
33. Sivikova K DJ. Cytogenetic effect of technical glyphosate on cultivated bovine peripheral lymphocytes. Int J Hyg Environ Health. 2006;209:15-20. [ Links ]
34. Lioi MB, Scarfi MR, Santoro A, Barbieri R, Zeni O, Salvemini F, et al. Cytogenetic damage and induction of pro-oxidant state in human lymphocytes exposed in vitro to gliphosate, vinclozolin, atrazine, and dpx-e9636. Environ Mol Mutagen. 1998;32:39-46. [ Links ]
35. Nakashima K, Yoshimura T, Mori H, Kawaguchi M, Adachi S, Nakao T, et al. Effects of pesticides on cytokines production by human peripheral blood mononuclear cells--fenitrothion and glyphosate. Chudoku Kenkyu. 2002;15:159-65. [ Links ]
36. Sirisattha S, Momose Y, Kitagawa E, Iwahashi H. Genomic profile of roundup treatment of yeast using DNA microarray analysis. Environ Sci. 2004;11:313-23. [ Links ]
37. Vistica DT Skehan P, Scudiero D, Monks A, Pittman A, Boyd MR. Tetrazolium-based assays for cellular viability: A critical examination of selected parameters affecting formazan production. Cancer Res. 1991;51:2515-20. [ Links ]
38. Roehm NW, Rodgers GH, Hatfield SM, Glasebrook AL. An improved colorimetric assay for cell proliferation and viability utilizing the tetrazolium salt xtt. J Immunol Methods. 1991;142:257-65. [ Links ]
39. Ivanov I, Halkova ZH, Tsolova S, Simeonov K, Sainova I, Tasheva M. Cytotoxicity induced by herbicides glyphosate and alachlor in vitro. Experim Pathol Parasitol. 2001;4:20-6. [ Links ]