Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157On-line version ISSN 2590-7379
Biomédica vol.28 no.1 Bogotá Jan./Mar. 2008
1 Grupo de Parasitología, Instituto Nacional de Salud, Bogotá, D.C., Colombia
2 Grupo de Bioquímica, Instituto Nacional de Salud, Bogotá, D.C., Colombia
3 Departamento de Microbiología, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá, D.C., Colombia
4 Programa de Control de Enfermedades Transmitidas por Vectores, Secretaría de Desarrollo de la Salud de Córdoba, Montería, Córdoba, Colombia
Recibido: 28/06/07; aceptado: 14/11/07
Introducción. La disminución de la eficacia de los medicamentos antipalúdicos en el mundo y en Colombia, dificulta el control de la enfermedad.
Objetivo. Evaluar la eficacia terapéutica in vivo de la combinación amodiaquina más sulfadoxina-pirimetamina para el tratamiento del paludismo no complicado por Plasmodium falciparum y de la cloroquina para el tratamiento del paludismo por P. vivax en Tierralta, Córdoba.
Materiales y métodos. Durante el período de mayo a noviembre de 2006, se realizaron estudios de eficacia in vivo siguiendo los protocolos estandarizados por la Organización Mundial de la Salud y la Organización Panamericana de la Salud, con algunas modificaciones. Se estudiaron pacientes mayores de dos años, con parasitemia entre 500 y 50.000 formas asexuales/µl, seleccionados conforme a los criterios de inclusión y exclusión previamente definidos. Se administró tratamiento supervisado y se realizó seguimiento clínico y parasitológico en los días 0 (inclusión), 1, 2, 3, 7, 14, 21 y 28. El desenlace se definió como respuesta clínica y parasitológica adecuada, fracaso terapéutico precoz o fracaso tardío al tratamiento.
Resultados. De los pacientes evaluados, 50/53 (94,3%) (IC95%: 70%-100%) presentaron respuesta clínica y parasitológica adecuada al tratamiento con amodiaquina más sulfadoxina-pirimetamina para paludismo no complicado por P. falciparum, un paciente presentó fracaso terapéutico precoz y dos presentaron fracaso terapéutico tardío. Los 50 pacientes evaluados (100%) (IC95%: 74%-100%) presentaron respuesta clínica y parasitológica adecuada al tratamiento con cloroquina para el paludismo por P. vivax.
Conclusiones. En Córdoba, la combinación amodiaquina más sulfadoxina-pirimetamina y la cloroquina son eficaces para el tratamiento del paludismo no complicado por P. falciparum y por P. vivax, respectivamente.
Palabras clave: paludismo/terapia, Plasmodium falciparum, Plasmodium vivax, antipalúdicos, amodiaquina, sulfadoxina, pirimetamina, cloroquina, eficacia, Colombia.
Efficacy of the amodiaquine+sulfadoxine-pyrimethamine combination and of chloroquine for the treatment of malaria in Córdoba, Colombia, 2006
Introduction. The decrease in the efficacy of antimalarial drugs in the world and in Colombia hampers its control.
Objective. The in vivo therapeutic efficacy of the amodiaquine+sulfadoxine-pyrimethamine combination was evaluated in the treatment of uncomplicated Plasmodium falciparum malaria and of chloroquine for P. vivax malaria.
Materials and methods. From May to November, in 2006, in vivo efficacy studies of malaria treatments were undertaken in Tierralta, Córdoba, northeastern Colombia. Standard protocols were followed as recommended by the World Health Organization/Panamerican Health Organization, with some modifications. Patients older than two years with single P. falciparum or P. vivax infection, with asexual parasitemia between 500 and 50,000 parasites/µl, were selected according to established inclusion and exclusion criteria. Supervised treatment was administered, and clinical and parasitological follow-up was carried out on days 0 (inclusion), 1, 2, 3, 7, 14, 21 and 28. The outcome was defined as adequate clinical and parasitological response, early therapeutic failure, or late therapeutic failure.
Results. Of 53 subjects selected, 50 (94.3%; CI 70%-100%) presented adequate clinical and parasitological response to the amodiaquine+sulfadoxine-pyrimethamine treatment for uncomplicated falciparum malaria. One patient presented early therapeutic failure, and two developed late therapeutic failure. All of the 50 patients (95%CI: 74%-100%) in the in vivo efficacy study of chloroquine for vivax malaria presented adequate clinical and parasitological response.
Conclusions. In Cordoba, the amodiaquine+sulfadoxine-pyrimethamine combination and chloroquine show a high efficacy for the treatment of uncomplicated falciparum and vivax malaria, respectively.
Key words: Malaria/therapy, Plasmodium falciparum, Plasmodium vivax, antimalarials, amodiaquine, sulfadoxine, pyrimethamine, chloroquine, efficacy, Colombia
Según la Organización Mundial de la Salud (OMS), cada año se presentan en el mundo entre 350 y 500 millones de nuevos casos clínicos y un poco más de un millón de muertes por paludismo (1). Aunque la mayoría de estas muertes ocurren en África, al sur del Sahara, la malaria ocasiona considerable morbilidad en las Américas, principalmente en los países de la cuenca amazónica (1). En Colombia, en 2006, se regis-traron 91.839 casos, de los cuales, 60.597 fueron por P. vivax y 30.229 por P. falciparum (2).
Colombia, como la mayoría de países en las Américas, ha adoptado la Estrategia Global para el Control de la Malaria de la OMS, la cual se basa en el diagnóstico y tratamiento antipalúdico oportuno y efectivo, como el mejor medio para reducir la morbilidad y mortalidad por la enfermedad (3).
Con el fin de conocer la respuesta in vivo a los medicamentos, la OMS y la Organización Panamericana de la Salud (OPS) desarrollaron protocolos para la evaluación de la eficacia terapéutica de los medicamentos para el tratamiento del paludismo sin complicaciones por P. falciparum y P. vivax, en las Américas (4-6).
Los estudios in vivo son considerados como el método de elección para orientar cambios en la política de tratamiento del paludismo, debido a que sus resultados reflejan la respuesta clínica de los pacientes a estos medicamentos (4). En Suramérica, la mayoría de los cambios en la política de medicamentos durante los últimos tres a cuatro años se hicieron con base en los resultados de los estudios in vivo (1).
En Colombia, los altos porcentajes (44% a 97%) de fallas terapéuticas encontrados en los estudios de eficacia de la cloroquina como monoterapia o en combinación con sulfadoxina-pirimetamina para el tratamiento del paludismo no complicado por P. falciparum, realizados entre 1997 y 2000 en la costa del Pacífico y en Antioquia (7-11), llevaron al Ministerio de Salud a cambiar, a partir del año 2000, el esquema de tratamiento de primera línea para P. falciparum por la combinación amodiaquina más sulfadoxina-pirimetamina (12), esquema actualmente vigente.
La eficacia de los componentes individuales de esta combinación fue evaluada en diversos estudios realizados desde finales de la década de 1990. En Zaragoza, Antioquia, en 1998, con seguimiento de siete días, se encontró 3% de fallas en pacientes tratados con amodiaquina y 9% con sulfadoxina-pirimetamina, mientras que en Turbo, en 1998, se encontraron fallas terapéuticas con amodiaquina en 7% y con sulfadoxina-pirimetamina en 13%, con seguimiento de 14 días (9). En El Bagre, Antioquia, en 1998, con segui-miento de 14 días, se encontraron fallas terapéuticas de 12% con amodiaquina y de 15% con sulfadoxina-pirimetamina (7). En Nariño, de
Las eficacias promedio de la amodiaquina y de la sulfadoxina-pirimetamina para el tratamiento del paludismo por P. falciparum en Colombia se calcularon recientemente en 80,1% y 85,4%, respectivamente (16).
En contraste con los numerosos estudios que han evaluado la eficacia de sus componentes individuales, existen pocos estudios publicados en los cuales se haya evaluado la eficacia de la combinación amodiaquina más sulfadoxina-pirimetamina para el tratamiento de la malaria no complicada por P. falciparum. En 2006, Blair et al. informaron que la eficacia de la combinación en 90 pacientes evaluados, con seguimiento a 21 días, entre los años 2000 a 2004, fue de 97,8% en la zona de Urabá-Bajo Cauca, Antioquia (16).
Por otra parte, la disminución de la eficacia terapéutica de la cloroquina para el tratamiento del paludismo no complicado por P. vivax fue informada por primera vez en Papua, Nueva Guinea, en 1989 (17) y, posteriormente, en Indonesia en 1991 (18). En las Américas, se han informado casos de fallas terapéuticas en Guyana (19) y Brasil (20). En un estudio realizado en Perú entre 1998 y 2001, con seguimiento de 28 días, se reportaron fallas en 4 de 177 pacientes (2,26%) con paludismo por P. vivax tratados con cloroquina en la región amazónica y ninguna falla en 59 pacientes evaluados al norte de la costa del Pacífico peruano (21).
En contraste con P. falciparum, y a pesar de ser P. vivax la especie que mayor número de casos de paludismo ocasiona cada año, son escasos los estudios realizados en Colombia que evalúan la eficacia de la cloroquina para el tratamiento del paludismo no complicado por P. vivax. En Antioquia en 1998, se encontró 100% de respuesta terapéutica a los 16 días de seguimiento en 96 pacientes de Zaragoza y Turbo (22). En Cali, en un estudio rea-lizado entre 1998 y 1999, con seguimiento de 28 días, 100% de 44 pacientes evaluados presentaron una respuesta clínica adecuada (11), mientras que, en 2001, Soto et al. reportaron tres casos (11%) de fallas terapéuticas al tratamiento con cloroquina del paludismo por P. vivax en un grupo de pacientes con seguimiento de 28 días (23).
En la amazonia colombiana, en 2002 y 2003, se informó una eficacia de 90% (15) y en 2006 se informó 100% de curación clínica y parasitológica a 28 días en 210 pacientes que recibieron cloroquina para el tratamiento del paludismo no complicado por P. vivax en Turbo y El Bagre, Antioquia (24,25).
A pesar de que Córdoba ocupa uno de los primeros lugares en morbilidad e incidencia de paludismo en Colombia (2), no se conocen hasta la fecha publicaciones de estudios de eficacia de los antipalúdicos realizados en este departamento. El presente estudio tuvo como objetivo evaluar la eficacia del tratamiento con la combinación amodiaquina más sulfadoxina-pirimetamina de pacientes con paludismo no complicado por P. falciparum así como la de la cloroquina para el tratamiento de pacientes con paludismo por P. vivax en Tierralta, Córdoba.
Materiales y métodos
Sitio de estudio
El estudio se llevó a cabo en Tierralta, Córdoba, de mayo a noviembre de 2006. Este municipio está ubicado sobre la margen oriental del río Sinú, al suroeste del departamento de Córdoba, a de distancia por carretera desde Montería. Sus coordenadas geográficas son: 76° 03 46 longitud oeste; 8° 10 34, latitud norte; su altura es de 5 msnm, su temperatura media 27 °C y su precipita-ción media anual 1.120 mm3; la extensión del municipio es de 4.728 km2 (26) y, de acuerdo con los resultados del censo realizado en 2005, cuenta con 78.972 habitantes, de los cuales, 33.084 viven en la cabecera municipal y 45.888 en la zona rural (27). Las actividades económicas principales son la agricultura, la ganadería y el comercio (26).
En Córdoba en 2005, se informaron 29.872 casos con un índice parasitario anual (IPA) de 43,5/1.000, índice vivax anual de 34,6/1.000 e índice falciparum anual de 8,4/1.000 (2). En 2006 se informaron 17.456 casos de paludismo por P. vivax y 4.163 de paludismo por P. falciparum (28). El IPA es el cuociente resultante de la división del número de casos de malaria en un año por el número de habitantes expuestos, multiplicado por 1.000; el índice vivax anual y el índice falciparum anual se calculan de manera similar, pero teniendo en cuenta solamente los casos de paludismo por P. vivax o P. falciparum.
Se escogió el municipio de Tierralta por su alta incidencia y transmisión de paludismo (IPA>10/1.000) (2) y porque, en este municipio, existe automedicación y venta sin fórmula médica de medicamentos antipalúdicos, según se pudo constatar por observación directa de los investigadores. En 2004, se reportaron en Tierralta 4.196 (25,4%) casos de paludismo por P. falciparum, 12.090 (73,3%) casos por P. vivax y 208 (1,3%) casos de infección mixta, para un total de 14.385 casos. Para el año 2.005, se informaron 13.949 casos de paludismo, 4.866 (34,9%) de P. falciparum, 8.790 de P. vivax (63,1%) y 284 (2%) de infección mixta (Martha Lucía Peña, Secretaría Municipal de Salud de Tierralta, Córdoba, 2006, comunicación personal). De acuerdo con el número de habitantes de la zona rural de Tierralta, los índices palúdicos en este municipio, en 2005, fueron: IPA, 304/1.000; índice vivax anual, 192/1.000, e índice falciparum anual, 106/1.000.
El comportamiento del paludismo en este municipio, en los tres primeros períodos epidemiológicos del 2006, mostró 1.193 casos de paludismo por P. vivax (35,9%), 694 casos de P. falciparum (61,8%) y 42 casos de infección mixta (2,2%) (Martha Lucía Peña, Secretaría Municipal de Salud de Tierralta, Córdoba, 2006, comunicación personal).
Diseño
Se siguieron los protocolos estandarizados por la OMS (4) y por la OPS para la evaluación de la eficacia terapéutica de los medicamentos para el tratamiento del paludismo sin complicaciones (5,6).
Tamaño de la muestra
Si se considera una proporción de fracasos al tratamiento de 5% con la combinación amodiaquina más sulfadoxina-pirimetamina para el tratamiento del paludismo no complicado por P. falciparum y con cloroquina para el tratamiento del paludismo por P. vivax en una población de tamaño infinito, un nivel de significación de 5%, con una precisión de +10%, sería necesario incluir en cada uno de los estudios de eficacia un mínimo de 35 pacientes (5,6,29). Para compensar la posible pérdida de pacientes que pudiera presentarse durante el seguimiento, se decidió incluir como mínimo 50 pacientes en cada uno de los grupos de estudio.
Selección de los pacientes
La población de estudio correspondió a los pacientes positivos para paludismo por P. falciparum y P. vivax que asistieron al puesto de diagnóstico de malaria de la zona urbana del municipio de Tierralta, Córdoba, a quienes se les aplicó una encuesta que permitió realizar una selección de acuerdo con los criterios de inclusión y exclusión establecidos en los protocolos de OMS y OPS (4-6), con modificaciones en dos de los criterios de inclusión, así: edad mayor de dos años e infección única por P. falciparum o P. vivax, con parasitemia inicial entre 500 y 50.000 parásitos por µl.
Para la definición de signos o síntomas de peligro o paludismo grave, considerado como uno de los criterios de exclusión, se siguieron las definiciones establecidas por la OMS (5,6,30).
Tratamiento y seguimiento de pacientes
A los pacientes con infección por P. falciparum incluidos se les administró amodiaquina y sulfadoxina-pirimetamina de manera supervisada, así:
- Día 0: amodiaquina, 10 mg/kg, en una sola toma, más sulfadoxina-pirimetamina, 25 mg/kg de sulfadoxina y 1 mg/kg de pirimetamina, en dosis única;
- Día 1: amodiaquina, 7,5 mg/kg, en una sola toma;
- Día 2: amodiaquina, 7,5 mg/kg, en una sola toma.
Además, los pacientes que llegaron al día 28 con criterios de respuesta clínica y parasitológica adecuada recibieron primaquina en dosis única de 0,75 mg/kg como droga gametocida, una vez terminado el tratamiento esquizonticida.
A todos los pacientes se les hizo un registro de datos clínicos de ingreso y se les hizo seguimiento en los días 1, 2, 3, 7, 14, 21 y 28, en los cuales se realizó evaluación clínica y parasitológica (salvo en el día 1).
A los pacientes con infección por P. vivax incluidos se les administró cloroquina de manera supervisada en dosis total de 25 mg/kg, así:
- Día 0: 10 mg/kg, en una sola toma;
- Día 1: 7,5 mg/kg en una sola toma;
- Día 2: 7,5 mg/kg, en una sola toma.
Como una modificación a la metodología propuesta en los protocolos estandarizados por OMS/OPS, el día siete de seguimiento se administró la primera dosis supervisada de primaquina de 0,3 mg/kg y se le entregaron las 13 dosis restantes, con la correspondiente fórmula. En los días 14 y 21 de seguimiento se le preguntó al paciente sobre el cumplimiento del tratamiento con primaquina. El registro de las variables en el día de ingreso y en los días de seguimiento clínico y parasitológico se realizó de la misma forma ya explicada para los pacientes con paludismo por P. falciparum.
Evaluación parasitológica
La toma, preparación y coloración de las muestras de sangre (gota gruesa) se realizaron según los procedimientos estandarizados por el Grupo de Parasitología del Instituto Nacional de Salud (31). Se consideró como negativa la gota gruesa cuando no se observaron parásitos al examinar 200 campos microscópicos. El recuento parasitario se realizó contando el número de parásitos presentes al contar 200 leucocitos y estimando la parasitemia de acuerdo con un promedio de 8.000 leucocitos/µl; en el caso de P. falciparum, se registraron independientemente las parasitemias asexual y la sexual (gametocitemia). Las gotas gruesas fueron leídas por microscopistas experimentados, contratados para realizar el diagnóstico de paludismo por la Secretaría Municipal de Salud de Tierralta, y a quienes antes de iniciar la inclusión de pacientes se les dictó un taller para unificar criterios y procedimientos para el diagnóstico y seguimiento parasitológico de los pacientes.
Control de calidad del diagnóstico parasitológico
Todas las láminas (extendidos y gotas gruesas) del día de inclusión y de los días de seguimiento de 40 pacientes, 20 con paludismo por P. falciparum y 20 con P. vivax, escogidos aleatoriamente, se sometieron a una segunda lectura realizada en forma ciega (sin conocimiento del resultado de la primera lectura) por una bacterióloga experta, funcionaria del Grupo de Parasitología de la Subdirección Red Nacional de Laboratorios del Instituto Nacional de Salud, y se estableció el índice kappa de concordancia entre las dos lecturas.
Desenlace
Las definiciones del desenlace fueron las establecidas en los protocolos de la OMS (4) y la OPS (5,6): fracaso terapéutico precoz, fracaso tardío al tratamiento, el cual a su vez se clasificó, según el caso, como fracaso clínico tardío o fracaso parasitológico tardío, y respuesta clínica y parasitológica adecuada. También se tuvieron en cuenta las definiciones de pérdida del seguimiento (deserción) y retiro del estudio (exclusión) acordes con estos protocolos.
Tratamiento de rescate
Los pacientes del grupo de P. falciparum que presentaron falla terapéutica durante el seguimiento, recibieron como tratamiento de rescate artesunato, 4 mg/kg, dosis diaria por tres días; mefloquina, 15 mg/kg, el primer día y 10 mg/kg el segundo día, y primaquina, 0,75 mg/kg, dosis total como dosis única el día tres del tratamiento de rescate. Los pacientes del grupo de P. vivax que presentaran falla terapéutica recibirían amodiaquina, 25 mg/kg dosis total, divididos en tres dosis más sulfadoxina-pirimetamina –25 mg/kg de sulfadoxina y 1 mg/kg de pirimetamina dosis única el día 0– y primaquina, 0,3 mg/kg dosis diaria por 14 días. A estos pacientes se les hizo seguimiento en los días 4 y 7, en lo posible.
Análisis estadístico
Se utilizó el programa Microsoft Office Excel 2003® para la creación de la base de datos y a partir de ella se obtuvieron datos de frecuencia de las variables cualitativas y medias, medianas y desviaciones estándar de las variables cuantita-tivas en cada uno de los dos grupos de estudio. Con el programa Stata 8® se calculó el porcentaje de falla y la proporción del tipo de falla en cada uno de los dos grupos de estudio, con sus intervalos de confianza de 95%. Con el programa Epi-Info 6.04 b se calculó el índice kappa de concordancia.
Aspectos éticos
Para todos los procedimientos se tuvieron en cuenta las consideraciones éticas y los principios de la declaración de Helsinki (32), las normas del Ministerio de Salud, Resolución 008430 de 1993 (33), y el Decreto 2737 de 1989, Artículo 13 (34). Se elaboró, de acuerdo con lo estipulado en la Resolución 008430 de 1993, un documento que fue entregado, previa lectura y explicación de la naturaleza, beneficios y riesgos de la participación en el estudio, a cada uno de los pacientes elegibles o a sus padres en caso de ser menores de edad, y un formato en el que el paciente elegible o su padre o adulto confirmó, mediante su firma, su disposición de participar en el estudio. A los pacientes elegibles cuya edad estaba entre 7 y 18 años se les solicitó, además, su asentimiento. De acuerdo con la Resolución 008430, este estudio se consideró como de riesgo mínimo (33). El proyecto fue sometido a estudio y aprobado en todas sus partes por el Comité de Ética del Instituto Nacional de Salud.
El protocolo fue presentado, discutido y aprobado previamente por las autoridades departamentales de salud de Córdoba, al igual que por la Secretaría Municipal de Salud de Tierralta.
Resultados
En el grupo de pacientes con infección por P. falciparum, se evaluaron 59 pacientes, 46 de ellos hombres (78%). Se evaluaron 53 pacientes en el grupo de infección por P. vivax, 34 de ellos hombres (57,6%). En los dos grupos, la mayoría de los pacientes (44,1% en las infecciones por P. falciparum y 51% en las infecciones por P. vivax) se encontraban en un rango de edad entre 11 y 20 años de edad. La frecuencia de las manifesta-ciones clínicas presentes en el día 0 en los pacientes que terminaron el seguimiento se muestra en el cuadro 1.
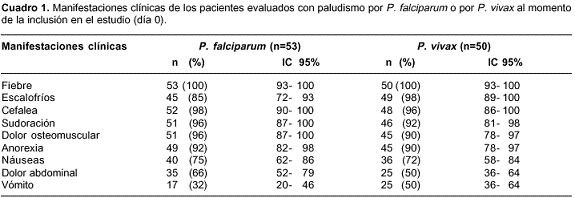
En el grupo de infección por P. falciparum, la parasitemia en el día 0 se encontró en un rango entre 677 y 35.508 trofozoítos/µl de sangre, con un promedio de 6.962, una desviación estándar de 7.066 y una mediana de 4.629.
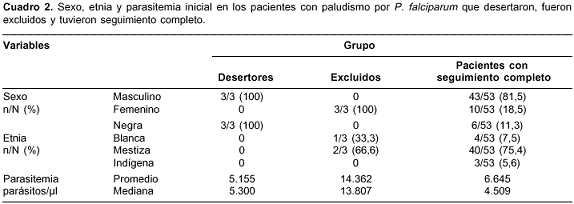
De los 59 pacientes con malaria por P. falciparum, tres fueron retirados del estudio por intolerancia al medicamento oral, que requirió hospitalización para tratamiento con quinina parenteral, tres desertaron durante el seguimiento y 53 tuvieron seguimiento completo a 28 días. Las características de sexo, etnia y la parasitemia inicial entre los pacientes que culminaron el estudio, los excluidos y los desertores se muestran en el cuadro 2.
De los 53 pacientes con malaria por P. falciparum, 50 (94,3%) (IC95%: 70%-100%) tuvieron respuesta clínica y parasitológica adecuada; un paciente (1,9%) (IC95%:0%-10,5%) presentó fracaso terapéutico precoz porque su parasitemia asexual en el día 2 fue mayor que en el día 0, y 2 pacientes (3,8%) (IC95%: 0-13,6%) presentaron fracaso tardío al tratamiento, en ambos casos por reaparición de parasitemia asexual al día 28 de seguimiento, en ausencia de manifestaciones clínicas (fracaso parasitológico tardío). A los tres pacientes que presentaron fracasos terapéuticos se les administró tratamiento de rescate.
La parasitemia asexual en el día 2 osciló entre 0 y 4.768 parásitos/µl, con un promedio de 182, una desviación estándar de 651 y una mediana de 39. La reducción promedio de la parasitemia asexual antes de recibir la última dosis de amodiaquina fue de 97,4%. En el día 2, 19 de los 53 pacientes estudiados (35,8%) (IC95%: 23,1%-50,2%) presentaron negativización de su parasitemia asexual y en el día 3, 46 (87%) (IC95%: 74,7%-94,5%) se habían negativizado. La evolución de la concentración de gametocitos en sangre periférica (gametocitemia) y de la proporción de pacientes con gametocitos circulantes durante el seguimiento se muestra en el cuadro 3. La gametocitemia alcanzó su valor promedio máximo el día 7 y luego presentó una disminución gradual hasta el día 28. La máxima proporción de pacientes con gametocitemia, 59,6%, se encontró en el día 14, pero en el día 28, antes de recibir la única dosis de primaquina de 0,75 mg/kg como gametocida, 44,2% de los pacientes aún presentaban gametocitos circulantes.
<

Un paciente que presentó respuesta clínica y parasitológica adecuada consultó tres meses después con sintomatología febril y gota gruesa positiva para P. falciparum, y fue incluido nuevamente en el estudio.
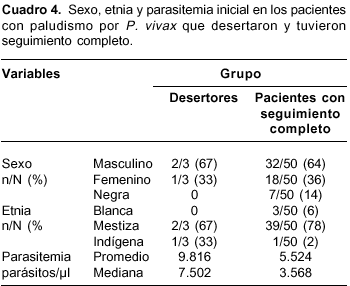
En el grupo de pacientes con paludismo por P. vivax, tres de ellos se perdieron durante el seguimiento y 50 lo completaron. Las características de sexo, etnia y la parasitemia inicial entre los pacientes que culminaron el estudio, los excluidos y los desertores se muestran en el cuadro 4.
Todos los 50 pacientes (100%) (IC95%: 74%-100%) presentaron respuesta clínica y parasitológica adecuada al tratamiento con cloroquina. En este grupo la parasitemia en el día 0 se encontró en un rango entre 618 y 15.756 parásitos/µl de sangre, con un promedio de 5.767, una desviación estándar de 3.894 y una mediana de 4.554. La parasitemia en el día 2 osciló entre 0 y 446 parásitos/ìl, con un promedio de 47, una desviación estándar de 88 y una mediana de 0. Por ende, la reducción promedio de la parasitemia antes de recibir la última dosis de cloroquina fue de 99,2%. Al día 2 de seguimiento, 27 de los 50 pacientes estudiados (54%) (IC95%: 39,3%-68,2%) presentaban negativización de la parasitemia y al día 3, 43 pacientes (86%) (IC95%: 73%-94,2%) se habían negativizado. El promedio ± desviación estándar de parasitemia en los siete pacientes que aún presentaban parasitemia el día 3 fue de 56,6±21, con un rango entre 39 y 80 parásitos/µl. No se encontró ningún paciente con parasitemia al día 7 antes de inicia la administración de primaquina.
Para el control de calidad del diagnóstico parasitológico, se examinaron 262 láminas. El total de láminas positivas para P. falciparum observadas por los dos lectores fue de 87 por el primero y 88 por el segundo; para P. vivax, ambos lectores encontraron 34 láminas positivas. El número de láminas negativas fue de 141 por el primer lector y de 140 por el segundo. De acuerdo con estos resultados, el índice kappa de concordancia entre las dos lecturas fue de 0,99 (IC95%: 0,93-1,00). El resultado discordante correspondió a una gota gruesa de seguimiento del día 21 que fue diagnosticada como negativa por el primer lector y como positiva para P. falciparum por el segundo, con la observación de 16 gametocitos/µl. Este resultado no modificó el desenlace observado en este paciente.
Discusión
Los hallazgos obtenidos demuestran la eficacia de la combinación amodiaquina más sulfadoxina-pirimetamina para el tratamiento del paludismo no complicado por P. falciparum, lo cual ratifica los resultados de estudios similares realizados en otras áreas endémicas de paludismo en Colombia (16) y confirma, también, la eficacia de la cloroquina para el tratamiento del paludismo por P. vivax, lo cual es consistente con los resultados de eficacia de este medicamento realizados en Colombia desde finales de la década de 1990 y hasta 2004 (11,15,22,24,25).
A pesar de que en los pacientes con P. falciparum se encontró una diferencia en la distribución de las variables de sexo y etnia entre los desertores comparados con los pacientes que culminaron el seguimiento, es poco probable que estas variables puedan determinar el desenlace terapéutico, por lo cual se minimiza la influencia del sesgo de selección por pérdida de seguimiento. La parasitemia inicial no fue significativamente diferente en estos dos grupos. En contraste, el promedio y la mediana de la parasitemia inicial fueron mayores en las tres pacientes excluidas en comparación con los pacientes que terminaron el seguimiento. Sin embargo, puesto que en los pacientes con falla terapéutica las parasitemias iniciales fueron inferiores, estos resultados sugieren que la parasitemia asexual inicial, dentro de los rangos encontrados en este estudio, no determina por sí sola una mayor probabilidad de falla. Los resultados permiten hacer una afirmación similar con respecto a los casos de paludismo por P. vivax.
Si, como se ha informado, el porcentaje promedio de fallas terapéuticas a la amodiaquina como monoterapia para el tratamiento del paludismo por P. falciparum en Colombia es 19,9% y el de la sulfadoxina-pirimetamina es 14,6% (16), se esperaría que el porcentaje de fallas a la combinación fuera de 2,9%, es decir, que la eficacia promedio de la combinación fuese de 97,1%. La eficacia encontrada en este estudio, 94,3%, es inferior a la eficacia esperada y también inferior a la de 97,8% informada por Blair et al. en 2006 (16). Una posible explicación de la diferencia encontrada entre el presente estudio y el de Blair et al. (16) es que, en este último, el seguimiento se hizo a 21 días, mientras en el presente estudio el seguimiento se hizo a 28 días y dos de los tres pacientes presentaron fracaso tardío al tratamiento, por reaparición de parasitemia asexual, al día 28 de seguimiento.
La terapia antipalúdica combinada, junto con el fomento del uso adecuado de los medicamentos, que incluye su óptima formulación y el asegurar el adecuado cumplimiento terapéutico y la vigilancia del surgimiento y la dispersión de la resistencia, constituyen estrategias para el control de la resistencia (35). En el presente estudio se verificó el cumplimiento terapéutico mediante la administración de tratamiento supervisado. Los hallazgos enfatizan la importancia de diseñar estrategias para asegurar y vigilar el cumplimiento terapéutico, con el fin de garantizar la eficacia del tratamiento antipalúdico, cuando el medicamento se entrega a los pacientes con paludismo en los puestos de diagnóstico y tratamiento que son atendidos en su mayoría por microscopistas.
El comportamiento de la gametocitemia fue similar al informado por Arango et al., en un estudio realizado en 2002 en el que se evaluó el comportamiento de la gametocitemia de P. falciparum según la respuesta terapéutica a sulfadoxina-pirimetamina y cloroquina en Turbo y Zaragoza, Antioquia (36). En ambos casos, las mayores gametocitemias se encontraron en el día 7 de seguimiento, aunque las cifras encontradas en Tierralta fueron menores, en cada uno de los días de seguimiento, a las encontradas en Antioquia (36), y la proporción de pacientes con gametocitemia en Tierralta fue menor en cada uno de los días de seguimiento en comparación con lo observado en Turbo, pero mayor que en Zaragoza (36).
No se encontró ninguna falla terapéutica a la cloroquina para el tratamiento del paludismo por P. vivax, lo cual afortunadamente permite continuar utilizando este medicamento para el manejo de la infección única por esta especie. Aunque la primaquina, además de su actividad contra hipnozoítos y gametocitos, tiene cierta actividad esquizonticida sanguínea, consideramos que la reducción de la parasitemia en este estudio se debió exclusivamente al efecto esquizonticida de la cloroquina, por cuanto la administración de la primaquina se inició en el día 7, cuando ninguno de los pacientes tenía parasitemia detectable en gota gruesa, y además, los siete pacientes que presentaron parasitemia detectable en el día 3 tenían una parasitemia baja, entre 39 y 80 parásitos/µl.
El porcentaje de eficacia encontrado, 100%, es igual a los obtenidos en estudios similares realizados en Cali (11) y en Zaragoza y Turbo, Antioquia (22). En un estudio realizado en 27 soldados, 11 procedentes de Urabá, zona geográficamente cercana a Tierralta, y 16 de los Llanos Orientales, con seguimiento a 28 días, se encontraron tres pacientes (11%) con falla terapéutica (23). Sin embargo, estos tres pacientes recibieron un segundo tratamiento con cloroquina en dosis iguales al primero, con seguimiento a 28 días, presentando respuesta clínica adecuada, lo cual sugiere que las fallas terapéuticas presentadas no se debieron a resistencia del parásito a cloroquina sino posiblemente a otros factores que determinaron la presencia de concentraciones subterapéuticas del medicamento en sangre (23). Recientemente, se informaron dos casos de fallas terapéuticas, una precoz y otra tardía, en 20 pacientes (10%) con paludismo por P. vivax, en Tarapacá, Amazonas, en 2002 y 2003 (15).
A pesar de algunos informes de fallas terapéuticas en Guyana y Brasil (19,20), los resultados de los estudios de eficacia in vivo realizados hasta la fecha en Perú y Colombia (11,21,22,24,25) demuestran, en general, la eficacia de la cloroquina para el tratamiento del paludismo por P. vivax, a diferencia de lo informado en Papua, Nueva Guinea (17), y en Indonesia (18). De acuerdo con estos hallazgos, la resistencia de P. vivax a la cloroquina no constituye aún un serio problema en las Américas, aunque sí parece ser un problema emergente en la cuenca amazónica (15,19,20), mas no en las demás áreas endémicas de transmisión de paludismo en Colombia.
En consecuencia, no se requiere evaluar alternativas terapéuticas al tratamiento actual del paludismo por P. vivax en Colombia, pero se recomienda continuar con la evaluación periódica, mediante estudios in vivo de la eficacia del esquema de tratamiento actual, con el fin de supervisar su eficacia.
En 2006, el Ministerio de la Protección Social de Colombia decidió cambiar el esquema de primera línea para el tratamiento del paludismo por P. falciparum no complicado, por el uso de combinaciones terapéuticas con derivados de artemisinina (37), con base en la eficacia de estas combinaciones y el efecto que ellas tienen en la reducción de la gametocitemia y, por ende, potencialmente, en la reducción de la transmisión. Además, para sustentar esta decisión, el Ministerio argumentó que en los años recientes todos los demás países endémicos de paludismo de la región amazónica, región en la cual se concentra más del 90% del paludismo de América (1), han adoptado el uso de combinaciones terapéuticas con derivados de artemisinina como primera línea para el tratamiento del paludismo por P. falciparum no complicado.
Los resultados del presente estudio y del realizado por Blair et al. (16) permiten controvertir esta decisión, puesto que demuestran la eficacia de la combinación amodiaquina más sulfadoxina-pirimetamina para el tratamiento del paludismo no complicado por P. falciparum en los departamentos de Antioquia y Córdoba, aunque podría argumentarse que este cambio no se justificó por la disminución de la eficacia de la combinación amodiaquina más sulfadoxina-pirimetamina, sino en razón del efecto gametocitocida de las combinaciones terapéuticas con derivados de artemisinina, que podría contribuir a reducir la transmisión y así la incidencia de paludismo en las zonas de alta transmisión de esta enfermedad en Colombia.
Sin embargo, los altos porcentajes de eficacia de la combinación amodiaquina más sulfadoxina-pirimetamina permiten garantizar un tratamiento efectivo mientras se realiza el cambio, el cual debe hacerse con adecuada planificación y en forma gradual, con la debida capacitación de todos los actores del sistema de salud involucrados en la atención de pacientes con malaria, con amplia difusión en las comunidades afectadas y teniendo en cuenta todas las recomendaciones que al respecto ha formulado la OMS (38).
Agradecimientos
Los autores agradecemos la valiosa colaboración recibida de parte de Martha Lucía Peña y de todo el personal administrativo de la Secretaría Municipal de Salud de Tierralta, así como de Eziquio Díaz, director del Hospital San José de Tierralta. Muy especialmente, agradecemos la dedicación y el trabajo de Ender Hernández, David Vargas y José Luis Sierra, microscopistas encargados del diagnóstico en la sede de la Secretaría Municipal de Salud de Tierralta, sin cuyo interés y activa participación hubiera sido imposible realizar este trabajo.
Se agradece especialmente a Zulma Milena Cucunubá y a Julián Alfredo Fernández por sus aportes críticos al manuscrito.
Conflictos de intereses
Los autores manifestamos expresamente que durante la realización del presente trabajo no incurrimos en conflicto de interés alguno que pudiera haber afectado los resultados obtenidos.
Financiación
Este estudio fue cofinanciado con recursos del Fondo de Investigaciones en Salud, Ministerio de la Protección Social-Colciencias, proyecto código 2104-04-16338, contrato No. RC 363-2004, del Instituto Nacional de Salud y de la Secretaría Departamental de Desarrollo de la Salud de Córdoba.
Correspondencia:
Rubén Santiago Nicholls, Grupo de Parasitología, Instituto Nacional de Salud, Avenida Calle 26 N° 51-20, Bogotá, D.C., Colombia Teléfono: (1) 220 7700, extensión 423; fax: 220 7700, extensión 457.
Referencias
1. World Health Organization, UNICEF, Roll Back Malaria. World Malaria Report 2005. Consultado: 16 de abril de 2007. Disponible en: http://www.rbm.who.int/wmr2005/index.html [ Links ]
2. Ministerio de la Protección Social, Instituto Nacional de Salud, Subdirección de Vigilancia y Control en Salud Pública. Sistema de Vigilancia en Salud Pública (SIVIGILA). Informe final de malaria. Semanas 1-52. Bogotá: Ministerio de la Protección Social, INS; 2006. [ Links ]
3. World Health Organization. Global strategy for malaria control. Bull Pan Am Health Organ. 1993;27:280-3. [ Links ]
4. World Health Organization. Asssessment and monitoring of antimalarial drug efficacy for the treatment of uncomplicated falciparum malaria. WHO/HTM/RBM/2003.50. Geneva: WHO; 2003. [ Links ]
5. Organización Panamericana de la Salud, USAID, Red Amazónica de Vigilancia de la Resistencia a los Antimaláricos (RAVREDA). Protocolo genérico para estudios in vivo de eficacia de los medicamentos antimaláricos en las Américas. Eficacia de la terapia con cloroquina y sulfadoxina-pirimetamina para el tratamiento de la malaria no complicada por Plasmodium falciparum. 2003.[Consultado: 20 de octubre de 2005. Disponible en:http://www.paho.org/Spanish/AD/DPC/CD/mal-genericPf_CQ-SP_esp.doc. [ Links ]
6. Organización Panamericana de la Salud, USAID, Red Amazónica de Vigilancia de la Resistencia a los Antimaláricos (RAVREDA). Protocolo genérico para estudios in vivo de eficacia de los medicamentos antimaláricos en las Américas. Eficacia de la cloroquina para el tratamiento de la malaria porPlasmodium vivax. 2003.Consultado: 20 de octubre de 2005. Disponible en:http://www.paho.org/Spanish/AD/DPC/CD/mal-genericPv_CQ_Esp.doc [ Links ]
7. López YL, Arroyave A, Salazar A. Evaluación de la resistencia in vivo a medicamentos antimaláricos. El Bagre, Antioquia, 1998. Revista Epidemiológica de Antioquia. 1999;24:181-93. [ Links ]
8. Osorio LE, Giraldo LE, Grajales LF, Arriaga AL, Andrade AL, Ruebush TK, et al. Assessment of therapeutic response of Plasmodium falciparum to chloroquine and sulfadoxine-pyrimethamine in an area of low malaria transmission in Colombia. Am J Trop Med Hyg. 1999;61:968-72. [ Links ]
9. Blair S, Lacharme-Lora L, Carmona-Fonseca J. Resistance of Plasmodium falciparum to antimalarial drugs in Zaragoza (Antioquia, Colombia). 1998. Mem Inst Oswaldo Cruz. 2002;97:401-6. [ Links ]
10. Blair S, Lacharme LL, Carmona J, Tobón A. Resistencia de Plasmodum falciparum a tres fármacos antimaláricos en Turbo (Antioquia, Colombia), 1998. Rev Panam Salud Pública. 2001;9:23-9. [ Links ]
11. Castillo CM, Osorio LE, Palma GI. Assessment of therapeutic response of Plasmodium vivax and Plasmodium falciparum to chloroquine in a malaria transmission free area in Colombia. Mem Inst Oswaldo Cruz. 2002;97:559-62. [ Links ]
12. Ministerio de Salud, Dirección General de Promoción y Prevención. Guía de atención para la malaria. Resolución No. 0412 de febrero de 2000. Bogotá, D.C.: Ministerio de Salud; 2000. [ Links ]
13. González IJ, Padilla JC, Giraldo LE, Saravia NG. Eficacia de la amodiaquina y la sulfadoxina/pirimetamina en el tratamiento de malaria no complicada por Plasmodium falciparum en Nariño, Colombia, 1999-2002. Biomédica. 2003;23:38-46. [ Links ]
14. Mendez F, Muñoz A, Carrasquilla G, Jurado D, Arévalo–Herrera M, Cortese JF, et al. Determinants of treatment response to sulfadoxine-pyrimethamine and subsequent transmission potential in falciparum malaria. Am J Epidemiol. 2002;156:230-8. [ Links ]
15. Osorio L, Pérez LP, González IJ. Evaluación de la eficacia de los medicamentos antimaláricos en Tarapacá, Amazonas colombiano. Biomédica. 2007;27:133-40. [ Links ]
16. Blair S, Carmona-Fonseca J, Piñeros JG, Ríos A, Álvarez T, Álvarez G, et al. Therapeutic efficacy test in malaria falciparum in Antioquia, Colombia. Malar J. 2006;5:14-22. [ Links ]
17. Rieckmann KH, Davis DR, Hutton DC. Plasmodium vivax resistance to chloroquine? Lancet. 1989;2:1183-4. [ Links ]
18. Baird JK, Basri H, Purnomo Y, Bangs MJ, Subianto B, Patchen LC, et al. Resistance to chloroquine by Plasmodium vivax in Irian Jaya, Indonesia. Am J Trop Med Hyg. 1991;44:547-52. [ Links ]
19. Phillips EJ, Keystone JS, Kain KC. Failure of combined chloroquine and high dose primaquine therapy for Plasmodium vivax malaria acquired in Guyana, South America. Clin Infect Dis. 1996;23:1171-3. [ Links ]
20. Alecrim M das C, Alecrim W, Macedo V. Plasmodium vivax resistance to chloroquine (R2) and mefloquine (R3) in Brazilian Amazon region. Rev Soc Bras Med Trop. 1999;32:67-8. [ Links ]
21. Ruebush TK 2nd, Zegarra J, Cairo J, Andersen EM, Green M, Pillai DR, et al. Chloroquine-resistant Plasmodium vivax malaria in Perú. Am J Trop Med Hyg. 2003;69:548-52. [ Links ]
22. Lacharme-Lora L, Carmona-Fonseca J, Tobón A, Blair-Trujillo S. Respuesta de P. vivax al esquema terapéutico cloroquina-primaquina en Zaragoza y Turbo, Colombia, 1998. Infectio. 1998;2:90-4. [ Links ]
23. Soto J, Toledo P, Gutiérrez P, Luzz M, Llinas N, Cedeño N, et al. Plasmodium vivax clinically resistant to chloroquine in Colombia. Am J Trop Med Hyg. 2001;65:90-3. [ Links ]
24. Álvarez G, Piñeros JG, Tobón A, Ríos A, Maestre A, Blair S, et al. Efficacy of three chloroquine-primaquine treatment regimens for treatment of Plasmodium vivax malaria in Colombia. Am J Trop Med Hyg. 2006;75:606-9. [ Links ]
25. Carmona-Fonseca J, Álvarez G, Blair S. Malaria por Plasmodium vivax: curación del ataque agudo con tres dosis diferentes de primaquina y dosis fija de cloroquina. Antioquia, Colombia, 2003-2004. Biomédica. 2006;26:353-65. [ Links ]
26. Gobernación de Córdoba Tierralta. Consultado: 7 de abril de 2007. Disponible en: http://tierralta-cordoba.gov.co/sitio.shtml. [ Links ]
27. Departamento Administrativo Nacional de Estadística. Censo 2005. Consultado: 7 de abril de 2007. Disponible en: http://200.21.49.233/Tot_censo05/Index.asp. [ Links ]
28. Instituto Nacional de Salud. [Consultado: 7 de abril de 2007]. Disponible en: http://www.ins.gov.co/pdf/vcsp/Tablas/2006/2006_semana_52.pdf.
29. Organización Panamericana de la Salud. Guía práctica para estudios in vivo de la eficacia de los medicamentos antimaláricos en las Américas. OPS/DCP/CD/240/03. Washington: Organización Panamericana de la Salud; 2003. [ Links ]
30. World Health Organization. Severe falciparum malaria. Trans R Soc Trop Med Hyg. 2000;94 (Suppl. 1):1-90. [ Links ]
31. Mendoza NM, Nicholls RS, Olano VA, Cortés LJ, Raad J. Manejo Integral de Malaria. Bogotá D.C.: Instituto Nacional de Salud; 2000. p.16-30. [ Links ]
32. World Medical Association. Declaration of Helsinki. Ethical principles for medical research involving human subjects. Last revision. 52nd WMA General Assembly. Edinburgh: World Medical Association; 2000. [ Links ]
33. Dirección de Desarrollo Científico y Tecnológico, Ministerio de Salud. Normas científicas, técnicas y administrativas para la investigación en salud. Resolución No 008430 de 1993. Santafé de Bogotá: Imprenta Nacional; 1993. [ Links ]
34. República de Colombia. Código del menor. Derechos del niño. Decreto 2737, artículo13. Bogotá D.C; República de Colombia: 1989. [ Links ]
35. Orjuela P, González I, Osorio L. Terapia combinada como estrategia en la prevención de la resistencia a los antimaláricos. Biomédica. 2004;24:423-37. [ Links ]
36. Arango E, Álvarez T, Carmona J, Blair S. Gametocitemia de Plasmodium falciparum según la respuesta terapéutica a sulfadoxina-pirimetamina y cloroquina en dos municipios de Antioquia, Colombia. Biomédica. 2004;24:79-88. [ Links ]
37. Grupo de Enfermedades Transmitidas por Vectores, Dirección General de Salud Pública, Ministerio de la Protección Social. Plan de implementación de la terapia combinada con derivados de artemisinina (TCDA) para el tratamiento de la malaria no complicada por Plasmodium falciparum en áreas de alta transmisión en Colombia. Bogotá, D.C.: Ministerio de la Protección Social; 2006. [ Links ]
38. World Health Organization. The use of antimalarial drugs. Report of an informal consultation. WHO/CDS/RBM/2001.33 Geneva: WHO; 2001. p.38-40. [ Links ]














